-
Medical journals
- Career
Minimalizace krevních ztrát v jaterní chirurgii
Authors: J. Mendl; M. Oliverius; Valsamis A. Krak M. *
Authors‘ workplace: Klinika transplantační chirurgie IKEM, přednosta: prof. MUDr. Miloš Adamec, CSc. ; Klinika anesteziologie, resuscitace a intenzivní péče IKEM, přednostka: MUDr. Eva Kieslichová *
Published in: Rozhl. Chir., 2009, roč. 88, č. 7, s. 373-376.
Category: Monothematic special - Original
Overview
Úvod:
Operace jater mohou být spojená se značnou krevní ztrátou vyžadující podání krevních derivátů. Závažnější krvácení prodlužuje dobu resekce a zhoršuje pooperační morbiditu a mortalitu. Každá technika, která sníží krevní ztráty při resekci je výhodná jak pro pacienta, tak i pro operatéra.Materiál a metodika:
Literární přehled nejčastěji používaných resekčních technik a peroperační péče zaměřené na minimalizaci krevních ztrát. Zhodnocení vlastního souboru 183 pacientů odoperovaných v období 2004–2008.Výsledky a závěr:
Ve sledovaném období bylo provedeno 217 jaterních resekci u 183 pacientů. Mortalita činila 2,7 %, morbidita 24,6 %. Pro pooperační krvácení nebyl revidován ani jeden pacient. Průměrná krevní ztráta činila 820 ml. Při použití šetrné operační techniky, moderních přístrojů a kvalitní peroperační a pooperační péče lze provádět jaterní resekce s minimální krevní ztrátou, která zajišťuje rychlou rekonvalescenci a minimum komplikací.Klíčová slova:
jaterní resekce – krevní ztrátyÚVOD
Jaterní resekce se provádějí nejčastěji pro nádorové onemocnění, primární (hepatocelulární, cholangiocelulární) nebo sekundární – metastázy, nejčastěji kolorektálního karcinomu. Vzhledem k vysoké incidenci maligních nádorů v naší populaci, zejména kolorektálního karcinomu, roste i počet pacientů s metastatickým postižením jater. Pro tyto pacienty je pouze radikální chirurgické řešení předpokladem dlouhodobého přežívání nebo i vyléčení. Pokud by dobře fungoval screening onkologických pacientů bylo by možno zachytit metastatická ložiska relativně malých rozměrů a tudíž i rozsah jaterní resekce by nemusel být rozsáhlý (segmentectomie). Bohužel často dochází k diagnostice nádorového bujení v játrech v dosti pokročilém stadiu. Cílem operace je odstranění patologického ložiska ve zdravé tkáni s minimálním poškozením ponechané části jater, vzdálenost resekční plochy by měla být min. 5–10 mm od nádoru – R0 resekce [1].
MATERIÁL A METODA
Z dostupné literatury a vlastních zkušeností předkládáme přehled nejčastěji používaných technik ke snížení peroperačních krevních ztrát při resekci jater.
V základě lze faktory ovlivňující krevní ztráty rozdělit na nechirurgické a chirurgické.
Nechirugické metody jsou: udržování nízké hladiny centrálního žilního tlaku (CVP) a izovolemická hemodiluce.
V mnoha studiích bylo prokázáno, že udržování nízkého CVP v průběhu jaterní resekce vede k výraznému snížení peroperačních krevních ztrát a zkrácení doby samotné resekce. Vzhledem k tomu, že tlak v jaterních sinusoidech je přímo úměrný tlaku v jaterních žilách a potažmo i tlaku v centrálním žilním řečišti, tak vysoké hodnoty CVP vedou ke zvýšení krvácení z resekční plochy. Bylo prokázáno, že hodnoty CVP 2–5 mm Hg nejefektivněji napomáhají snížení krevních ztrát v průběhu resekce jater [2–6]. Je proto velice důležitá úzká spolupráce s anesteziologem, který může v tomto ohledu být velice nápomocen. Možné způsoby snižování CVP jsou:
- farmakologické (Furosemid, Nitroglycerin),
- restrikce tekutin (1 ml/kg/hod, v preresekční fázi max. 75 ml/hod, event. bolusově k udržení diurézy 25 ml/hod a TK > 90 mm/Hg) a
- operační poloha pacienta (Trendelenberg 15°), jako prevence vzniku vzduchové embolie.
K dosažení normovolemie se po dokončení resekce doplňují tekutiny podle potřeby a krevní převody podle hladiny Hb (80–100 mg/dl) event. podání odebrané autotransfuze. Použití cellsaveru je výhodné, ale u operací pro maligní onemocnění nevhodný pro možný rozsev maligních buněk. U transplantací je jeho použití velice výhodné, protože tyto výkony bývají spojeny s větší krevní ztrátou z důvodů hemokoagulačních poruch spojených se základním jaterním onemocněním a zahájením imunosupresivní terapie po reperfuzi štěpu.
Chirurgické metody
Ovlivnění krevních ztrát u jaterních resekci je prioritní a za tímto účelem bylo vyvinuto mnoho operačních technik. Nejzákladnější a nejstarší je Pringleho manévr omezující krevní přítok do jater kompresí struktur hepatoduodenálního ligamenta [7]. Tento manévr je lehce proveditelný, relativně bezpečný a široce užívaný. Další technikou je totální vaskulární exkluze jater – okluze dolní duté žíly nad a pod játry. Tato technika je však spojena s vyššími riziky a komplikacemi, nejzávažnější je snížení srdečního výdeje a následná hypotenze. Použití žilního bypassu může odstranit četnost těchto komplikací, ale prodlužuje operační čas a náročnost výkonu [3].
Samotnou resekci jater lze provést několika způsoby drcením jaterní tkáně prsty (finger fracture) nebo peánem (Kelly fracture), ultrazvukovým disektorem – cavitron ultrasonic surgical aspirator (CUSA), harmonickým skalpelem, Water jetem, Liga-sure.
VÝSLEDKY
Na našem pracovišti standardně měříme celkové krevní ztráty vážením břišních roušek a měřením odsáté krve z operačního pole a pravidelné kontroly hladiny KO. Za období 2004–2008 bylo na našem pracovišti provedeno 217 jaterních resekci u 183 pacientů (Tab. 1). Průměrná peroperační krevní ztráta činila 820 ml, což je hemodynamicky dobře tolerované a navíc při navrácení předoperačně odebrané krve plně postačuje k sanaci krevního obrazu. Ve sledovaném období došlo k úmrtí u 5 pacientů, mortalita 2,7 %. Pro krvácení nebyl revidován ani jeden pacient. Komplikace jsme pozorovali u 45 pacientů, 24,6% morbidita (Tab. 2).
Table 1. Základní diagnóza a typ resekce Tab. 1. Primary diagnosis and resection type 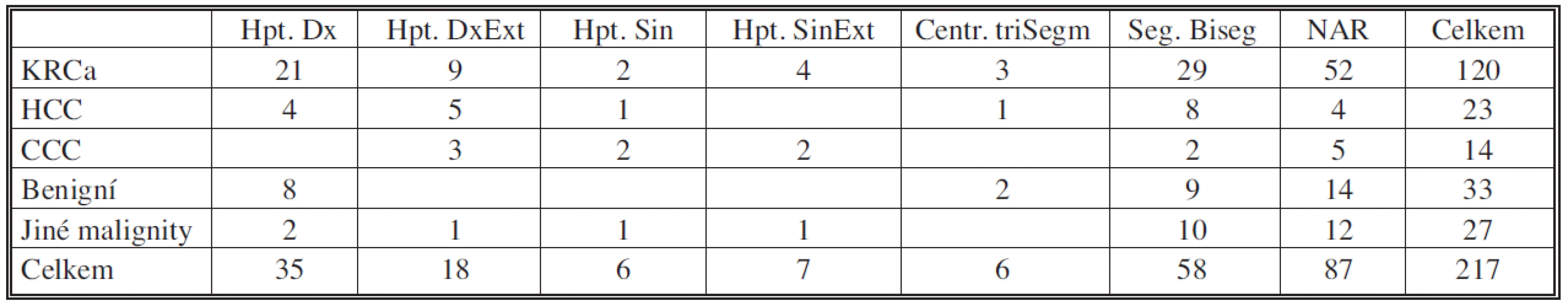
KRCa – metastáza kolorektálního karcinomu HCC – hepatocelulární karcinom CCC – cholangiocelulární karcinom Hpt. Dx – Pravá hepatektomie Hpt. DxExt – Pravá extenzivní hepatektomie Hpt. Sin – Levá hepatektomie Hpt. SinExt – Levá extenzivní hepatektomie Centr. triSeg – Centrální trisegmentektomie Seg. Biseg – Seg./bisegmentektomie NAR – Neanatomická resekce Table 2. Komplikace Tab. 2. Complications 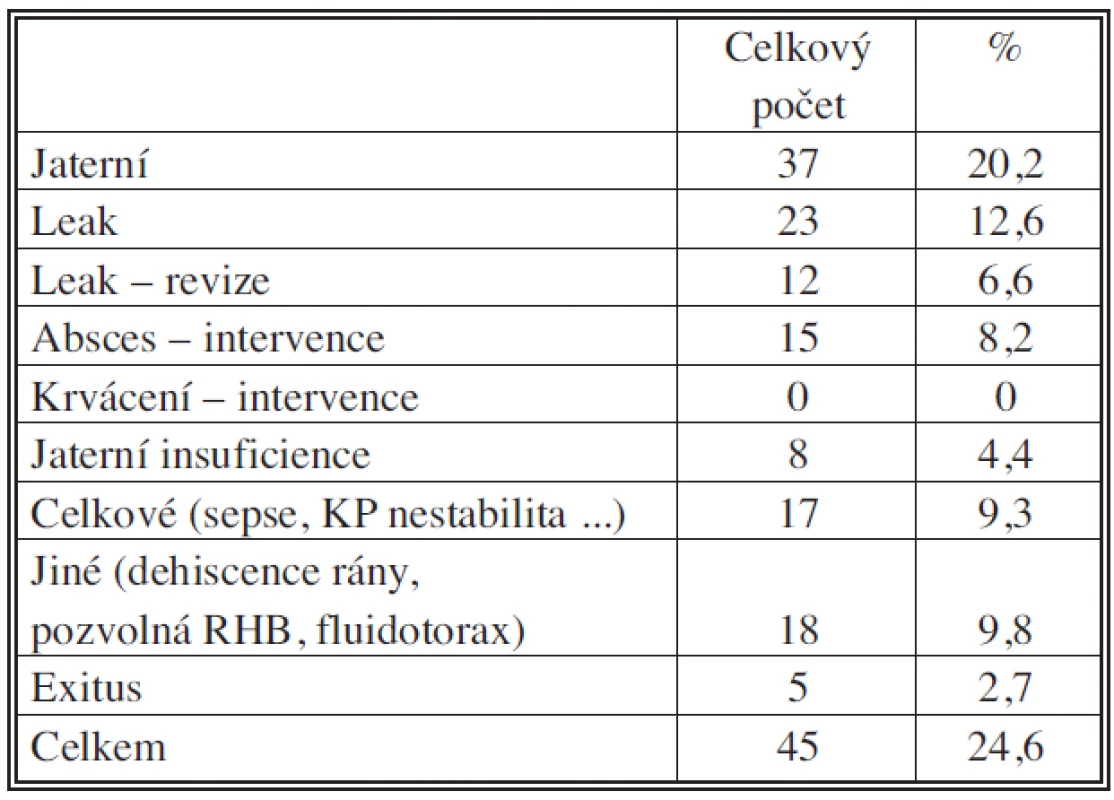
DISKUSE
Díky zkvalitnění intenzivní pooperační péče došlo k výraznému snížení pooperační mortality na literárně uváděných 0–10 % u pacientů po resekci jater [8–11]. Morbidita se uvádí v rozmezí 16,2–22,6 % [10, 12]. Zásadní vliv na pooperační průběh má objem peroperačních krevních ztrát. Při dobré operační strategii a technice lze krevní ztráty minimalizovat tak, že v perioperačním a pooperačním období není nutné podávat krevní převody a tím výrazně snížit možná rizika s nimi spojená. Rizika krevních převodů jsou hemolytické reakce (bezprostřední – AB0 inkompatibilita, pozdní hemolýza v důsledku izoimunizace), pyretická reakce, alergická reakce, přetížení kardiovaskulárního oběhu (při příliš rychlém podání) a tromboembolické komplikace. Z dlouhodobých rizik je virová hepatitida získaná od dárce nejběžnější letální komplikací po transfuzích. Stupeň rizika nakažení hepatitidou není přesně znám, ale odhaduje se na 1 % při každém krevním převodu [3]. Bylo prokázáno, že podání krevních derivátů u pacientů s maligním onemocněním zvyšuje pooperační mortalitu a morbiditu, zároveň vede i ke zkrácení doby přežívání. Riziko pooperační mortality je přímo úměrné množství podaných jednotek krevních derivátů. Míra rizika je 11% po podání dvou a více jednotek oproti 1,2 % u pacientů nevyžadující transfuzi. Taktéž dochází i ke zkrácení mediánu doby přežívání u pacientů po resekci jater vyžadující v perioperačním období aplikaci 2 a více krevních převodů oproti žádné nebo 1–2 TRF jednotek, 34 vs. 50 měsíců [14–17]. Podání transfuzi v perioperačním období podporuje rekurenci maligního bujení až v 74,3 % pacientů po resekci jater pro HCC a to i při podání 1–2 TRF jednotek [18]. V tomto ohleduje výhodná metoda izovolemické hemodiluce, kdy je bezprostředně před operací pacientovi odebrána autotransfuze, objem nahrazen krystaloidními roztoky a peroperačně event. pooperačně je krev podána zpět pacientovi.
Nejdůležitějším faktorem snižujícím peroperační ztráty je precizní a šetrná operační technika. Jak již bylo výše zmíněno nejzákladnější technikou v jaterní chirurgii je Pringleho manévr. Nevýhodou je riziko ischemického poškození jater, proto se tento manévr aplikuje intermitentně po 15 min. s 5 min. reperfuzí jater, takto ho lze aplikovat téměř neomezenou dobu. Někteří autoři užívají Pringleho manévr po celou dobu resekce bez vážnějšího ischemického poškození jater, protože během pauz na reperfuzi může docházet ke zvýšeným krevním ztrátám [19]. Toto riziko lze eliminovat podvazem cév jak na resekční ploše, tak na straně preparátu. Při portální hypertenzi a kolaterálním oběhu může paradoxně docházet při Pringleho manévru k většímu krvácení retrográdně z jaterních žil [5]. V závislosti na operační technice a použití moderních přístrojů se lze vyhnout použití tohoto manévru a provést resekci bez kompromitace zbylého parenchymu. Taktéž udržení nízkého CVP během resekce jater může být na tolik dostatečné, že se Pringleho manévr nemusí vůbec použít. Ischemické poškození jater je detekovatelné po 30 minutové teplé ischemii [20]. Tolerance vůči ischemii klesá s mírou poškození jater chronickým onemocněním, (steatóza, fibróza), s rozsahem resekce a s věkem pacienta. Technika využívající preischemii jater popsaná Clavienem a spol. měla protektivní účinek na ischemické poškození jater u pacientů se steatózou i při ischemii v délce 30–60 min. [21, 22]. Použití Pringleho manévru závisí na preferenci operatéra a použité resekční technice.
ZÁVĚR
Jaterní chirurgie v posledních 20–30 letech zaznamenala výrazný nárůst díky snížení pooperační mortality z 5–20 % na nynějších méně než 5 %. Tento pokrok je dán nejen zkvalitněním pooperační péče, ale i vylepšením operační techniky podporované moderními přístroji. Hlavním cílem resekce jater je nejenom odstranění patologického ložiska, ale i dosažení rychlé rekonvalescence s minimem komplikací a zároveň v případě malignit i dlouhodobé remise nebo vyléčení.
Hlavním prediktorem nekomplikovaného pooperačního průběhu je množství peroperačních krevních ztrát. Nejen že závažnější krvácení komplikuje a prodlužuje samotný výkon, ale má i negativní vliv na pooperační průběh. V případě onkologického onemocnění i na délku event. rekurence onemocnění. Tento negativní jev je spojen dokonce i s minimálním počtem podaných krevních převodů v perioperačním období.
S využitím těchto poznatků, operačních technik a přístrojovému vybavení lze provádět jaterní resekce s minimální krevní ztrátou a to i v případě velkých jaterních resekcí. Na naší klinice používáme v indikovaných případech isovolemickou hemodiluci, selektivní venózní exkluzi (v případě hemi či extenzivní hepatektomie) a obejití hepatoduodenálního ligamenta pro případ Pringleho manévru. Samotnou resekci jater provádíme CUSA doplněnou o bipolární koagulaci, větší cévy ligujeme nebo klipujeme. Samozřejmostí je i udržování nízkého CVP v průběhu resekce. Takto dosahujeme v průměru 820 ml krevní ztrátu, která je hemodynamicky dobře tolerována. V tomto ohledu se můžeme srovnávat s výsledky zahraničních pracovišť.
MUDr. Jiří Mendl
Štichova 645/34
149 00 Praha 4
e-mail: jiri.mendl@ikem.cz
Sources
1. Nuzzo, G., Giuliante, F., Ardito, F., Vellone, M., Giovannini, I., Federico, B., Vecchio Influence of surgical margin on type of recurrence after liver resection for colorectal metastases: a single-center experience. Surgery, 2008; 143(3): 384–393.
2. Chen, et al. Hepatic Resection Using Intermittent Vascular Inflow Occlusion and Low Central Venouš Pressure Anesthesia Improves Morbidity and Mortality. Journal of Gastrointestinal Surgery, Vol. 4, No. 2, 2000.
3. Jones, R. Mc L., Molton, C. E., Hardy, K. J. Central venous pressure and its effect on blood loss during liver resection. British Journal of Surgery, 1998, 85, 1058–1060.
4. Melendez, et al. Perioperative Outcomes of Major Hepatic Resections under Low Central Venous Pressure Anesthesia: Blood Loss, Blood Transfusion, and the Risk of Postoperative Renal Dysfunction. J. Am. Coll. Surg., 1998; 187 : 620–625.
5. Smyrniotis, V., et al. The role of central venous pressure and type of vascular control in blood loss during major liver resections. The American Journal of Surgery, 187 (2004), 398–402.
6. Wang, W. D., Liang, L. J., Huang, X. Q., Yin, X. Y. Low central venous pressure reduces blood loss in hepatectomy. World J. Gastroenterol., 2006; 12(6): 935–939.
7. Pringle, J. H. Notes on the arrest of hepatic haemorrhage due to trauma. Ann. Surg., 1909; 48 : 541–549.
8. Adson, M. A., VanHeerden, J. A. Major hepatic resections for metastatic colorectal cancer. Ann. Surg., 1980; 191 : 576–583.
9. Iwatsuki, S., Shaw, B. W., Starzl, T. E. Experience with 150 liver resections. Ann. Surg., 1983; 197 : 247–253.
10. Sitzmann, J. V., Greene, P. S. Perioperative predictors of morbidity following hepatic resection for neoplasm: a multivariate analysis of a single surgeon experience with 105 patients. Ann. Surg., 1994; 219 : 13–17.
11. Belghiti, J., Hiramatsu, K., Benoist, S., et al. Seven hundred forty-seven hepatectomies in the 1990s: an update to evaluate the actual risk of liver resection. J. Am. Coll. Surg., 2000; 191 : 38–46.
12. Sophia Virani, B. S., et al. Morbidity and Mortality after Liver Resection: Results of the Patient Safety in Surgery Study. J. Am. Coll. Surg., 2007; 204 : 1284–1292.
13. Way, L. W. Současná chirurgická diagnostika a léčba. str. 109–110.
14. Kooby, D. A., et al. Influence of Transfusions on Perioperative and Long-Term Outcome in Patients Following Hepatic Resection for Colorectal Metastases. Ann. Surg., Vol. 237, No. 6, 860–870.
15. Stephenson, K. R., Steinberg, S. M., Hughes, K. S., et al. Perioperative blood transfusions are associated with decreased time to recurrence and decreased survival after resection of colorectal liver metastases. Ann. Surg., 1988; 208 : 679–687.
16. Younes, R. N., Rogatko, A., Brennan, M. F. The influence of intraoperative hypotension and perioperative blood transfusion on disease-free survival in patients with complete resection of colorectal liver metastases. Ann. Surg., 1991; 214 : 107–113.
17. Rosen, C. B., Nagorney, D. M., Taswell, H. F., et al. Perioperative blood transfusion and determinants of survival after liver resection for metastatic colorectal carcinoma. Ann. Surg., 1992; 216 : 493–504.
18. Yamamoto, J., Kosuge, T., Takayama, T., et al. Perioperative blood transfusion promotes recurrence of hepatocellular carcinoma after hepatectomy. Surgery, 1994; 115 : 303–309.
19. Lesurtel, M., et al. How Should Transection of the Liver Be Performed? A Prospective Randomized Study in 100 Consecutive Patients: Comparing Four Different Transection Strategies. Ann. Surg., 2005; 242(6): 814–822.
20. Belghiti, J., Noun, R., Malafosse, R., et al. Continuous versus intermittent portal triad clamping for liver resection. A controlled study. Ann. Surg., 1999; 229 : 369–375.
21. Clavien, P. A., Selzner, M., Rudiger, H. A., et al. A prospective randomized study in 100 consecutive patients undergoing major liver resection with versus without ischemic preconditioning. Ann. Surg., 2003; 238 : 843–850; discussion 851–852.
22. Clavien, P. A., Yadav, S., Sindram, D., et al. Protective effects of ischemic preconditioning for liver resection performed under inflow occlusion in humans. Ann. Surg., 2000; 232 : 155–162.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2009 Issue 7-
All articles in this issue
- Úloha klasickej chirurgie pri liečbe náhlych príhod brušných u onkologických pacientov
- Nekrotizující infekční komplikace u syndromu diabetické nohy a jejich řešení
- Moderní radioterapie v komplexní léčbě sarkomů měkkých tkání a kostí u dospělých – aktuální přehled a vlastní zkušenosti
- Komplikace IPOM plastiky – naše zkušenosti
- Septický šok u pacienta s Fourniérovou gangrénou s fatálním koncem
- Komplikace periproktálního abscesu – Fourniérova gangréna nebo nekrotizující fasciitida? Kazuistika
- Nutriční intervence v chirurgii
- Infekce náhrad abdominální aorty
- Perioperační metabolická péče u diabetického pacienta – doporučení
- Antibiotická profylaxe v urologii
- Levostranné resekce pankreatu: indikace, chirurgická technika a komplikace
- Experimentální terapie nádoru pomocí intratumorózní aplikace dendritických buněk
- Minimalizace krevních ztrát v jaterní chirurgii
- The Occurrence of Gallbladder Carcinoma in Yemeni Patients Undergoing Cholecystectomy in Two Hospitals
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Septický šok u pacienta s Fourniérovou gangrénou s fatálním koncem
- Komplikace IPOM plastiky – naše zkušenosti
- Komplikace periproktálního abscesu – Fourniérova gangréna nebo nekrotizující fasciitida? Kazuistika
- Antibiotická profylaxe v urologii
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

