-
Medical journals
- Career
Využití lokálních hemostyptik při jaterních resekcích
Authors: R. Šefr; J. Silák; M. Ondrák; L. Fiala
Authors‘ workplace: Chirurgické oddělení, Masarykův onkologický ústav Brno, primář MUDr. Vojtech Chrenko, CSc.
Published in: Rozhl. Chir., 2009, roč. 88, č. 6, s. 337-341.
Category: Monothematic special - Original
Overview
Úvod:
Peroperační stavění krvácení během nebo po jaterní resekci je stále předmětem klinického zájmu a potenciálním zdrojem morbidity. Lokální hemostatika jsou obvykle používána tam, kde konvenční metody hemostázy nejsou zcela dostatečné, ať již z důvodu místa nebo stupně krvácení. K dispozici je mnoho preparátů různého mechanismu účinku.Cíl:
Ověřit efektivitu a bezpečnost použití lokálního hemostyptika na bázi oxidované celulózy při jaterních resekcích.Metoda:
V 67 případech (77 %) po jaterní resekci byla řezná plocha nebo sutura parenchymu překryta hemostatickou síťkou Traumacel TAF nebo Traumacel TAF light.Výsledky:
Ve sledovaném souboru nedošlo k signifikantnímu pooperačnímu krvácení ani v jednom případě.Závěr:
Použití Traumacelu TAF ke stavění krvácení při jaterních resekcích je účinné, rychlé a bezpečné.Klíčová slova:
hemostáza – resekce jater – lokální hemostatikaÚVOD
Resekční výkony na játrech jsou základním pilířem chirurgické léčby při postižení jater solidním zhoubným nádorem, a to jak primárním jaterním karcinomem, tak zejména u jaterních metastáz různého origa, nejčastěji však karcinomu kolon a rekta. Jedná se o náročné zákroky, které i přes pokroky v perioperační péči zůstávají zatíženy vyšší morbiditou a mortalitou, nejčastěji v důsledku selhání jater, krvácení a sepse [1].
Navzdory novým postupům v technice jaterních resekcí a moderním technologiím, které jsou dnes celkem běžně k dispozici, je peroperační nebo pooperační krvácení stále významnou a obávanou komplikací a jednou z možných příčin morbidity v pooperačním období. V širších souvislostech pak mohou větší krevní ztráty nepříznivě ovlivňovat i prognózu zhoubného onemocnění, mají i negativní ekonomické dopady včetně prodloužení hospitalizace.
Jednou ze základních příčin je predispozice tohoto orgánu k difuznímu krvácení, která je dána jeho extrémní vaskularizací a dále jaterní sinusoidální strukturou bez hladkého svalstva umožňujícího účinnou kontrakci a tím i vazokonstrikci. Rozsáhlejší resekční plochy s mnohočetnými zdroji krvácení jsou pak obtížně ošetřitelné podvazem, opichem nebo suturou a neexistuje ideální technika k dokonalému zamezení krvácení nebo žlučových úniků z řezné plochy. Na většině pracovišť, zabývajících se uvedenou problematikou, jsou proto používány kombinace technik, přístrojů i dalších pomůcek k dosažení co nejlepší hemostázy a minimalizaci krevních ztrát, ať již během operace nebo v bezprostředním pooperačním období [2, 3].
Jednoznačná shoda je v pohledu na šetrnou disekci parenchymu a dosažení rychlé a účinné zástavy krvácejících cév a plošných difuzních krvácení. Samozřejmostí v této souvislosti je použití moderního přístrojového vybavení (harmonický skalpel, radiofrekvenční ablace, CUSA, Hydro-jet, argonová koagulace, Tissuelink aj.), a to jak k resekcím anatomickým tak i extraanatomickým nebo při jejich kombinacích. Základem však nesporně zůstává jemná a přesná operační technika a správná taktika těchto zpravidla elektivních výkonů. Důležitou roli hraje také anestezie a stav jaterního parenchymu, situaci významně ztěžují některá jeho přidružená onemocnění jako je steatóza a zvláště cirhóza.
Jedním z pomocných prostředků vhodným pro terapeu-tické stavění plošného, „parenchymatózního“ krvácení, ale i profylakticky, jsou lokálně působící hemostyptika [4, 5, 6]. Obecně lze říct, že jsou používána v situacích, kdy konvenční metody zástavy krvácení jsou nedostatečné, ať již se jedná o místo krvácení nebo jeho stupeň. Dnes je k dispozici celé spektrum těchto preparátů působících různými mechanismy [7]. Podle toho je lze rozdělovat na aktivní a pasivní. Aktivní hemostyptika se zapojují do koagulační kaskády a lépe tak splňují požadavky na ideální preparát v případech kapilárního a mírného žilního krvácení. Velmi časté je také jejich rozdělení podle účinné látky. Různá je také ekonomická náročnost jejich použití včetně úhrad zdravotními pojišťovnami.
Definitivní rozhodnutí o použití a výběru preparátu by mělo být v rukou operatéra, jenž na základě svých zkušeností a preferencí určí typ lokálního hemostyptika, které považuje v dané situaci za optimální.
Vstřebatelné preparáty na bázi oxidované celulózy mají dlouholetou tradici založenou již v bývalém Československu. Traumacel ve formě sterilního prášku byl používán ve všeobecné, úrazové a břišní chirurgii v celé řadě indikací od drobných povrchních poranění až po aplikaci v břišní dutině, ale také například v neurochirugii, ústní chirurgii a dalších oborech [8]. Uplatnil se také ve válečné chirurgii při kyperském konfliktu [9]. Využití preparátu v práškové formě má však některá významná omezení a nevýhody, proto byla vyvinuta, mimo jiné, forma hemostatické síťky, která významně rozšiřuje spektrum indikací a možností použití.
Precizní chemická struktura preparátů z oxidované celulózy kolísá podle metody a stupně oxidace. Celulóza je 100% polymer glukózy, ekvivalentní chemický název pro Traumacel TAF je polyanhydroglukuronová kyselina. V těle je biologicky odbouratelný během 48–72 hodin a z organismu zcela vymizí v rozmezí 10–21 dnů. Traumacel TAF podporuje reparační tkáňové procesy, je hypoalergenní a má antibakteriální efekt.
Mechanismus účinku: hemostatický účinek preparátů z oxidované celulózy bývá připisován několika mechanismům. Jsou to především absorpční schopnosti, povrchové interakce s proteiny a krevními destičkami, aktivace intrinsických i extrinsických cest [7]. Nižší pH těchto preparátů také přispívá k hemostáze a je zodpovědné za jejich bakteriostatické účinky [7].
MATERIÁL A METODA
V letech 2007–2008 bylo na chirurgickém oddělení MOÚ Brno provedeno celkem 87 resekčních výkonů na játrech. Nejčastější indikací byly metastázy kolorektálního karcinomu (CRC), dále primární karcinom jater, jaterní metastázy karcinomu prsu, maligního melanomu, karcinomu ledviny, karcinomu žaludku, gastrointestinálního stromálního nádoru (GIST) nebo neuroendokrinních nádorů.
Bližší členění resekčních výkonů zobrazují tabulky 1 a 2. Chirurgický výkon je většinou součástí léčebného algoritmu v rámci klinických standardů léčby nebo stanoveného indikační komisí pro digestivní problematiku v Masarykově onkologickém ústavu (Komise digestivní onkologie). Radikálně resekabilní extrahepatální nádorovu infiltraci nepokládáme za kontraindikaci jaterní resekce podobně jako vícečetné jaterní postižení. V uvedených případech je však nutno postupovat individuálně.
Table 1. Indikace a počty resekčních výkonů Tab. 1. Indications and numbers of resection procedures 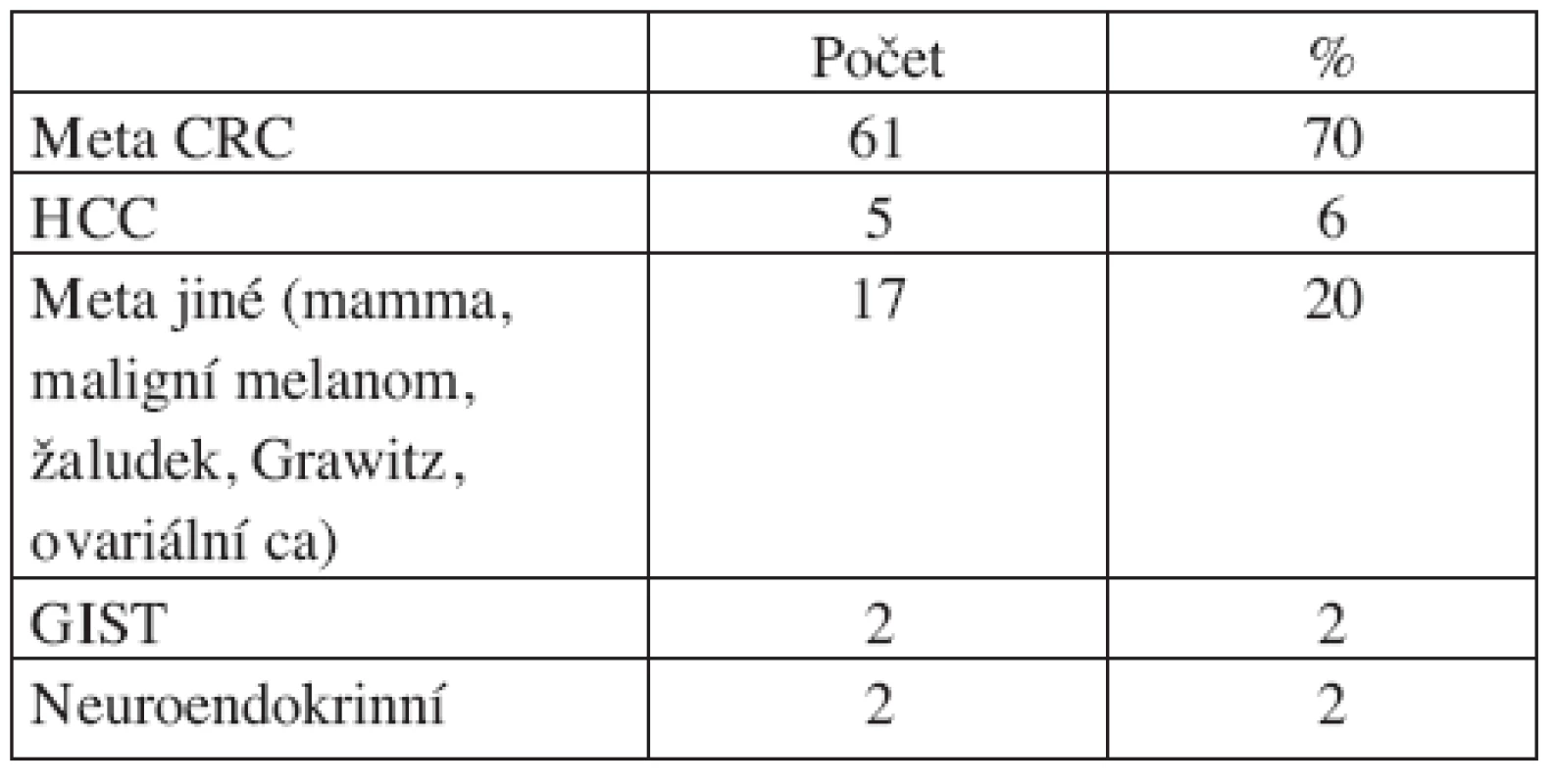
Table 2. Typy a rozsah výkonů Tab 2. Types and extents of the procedures 
Předoperační zobrazení zahrnují CT nebo MR jater, základem funkčních vyšetření zůstává Childova-Pughova klasifikace. Před velkými resekcemi provádíme klasickou nebo MR angiografii jaterní tepny a výjimečně i CT volumetrii, hepatobiliární scintigrafii.
Peroperačně je k dispozici ultrazvukové vyšetření, které však není používáno paušálně. Při resekci užíváme nejčastěji harmonický skalpel v kombinaci s klasickou technikou hmoždění parenchymu peanem s ligací struktur klipy a podvazy. Větší struktury jsou propichově ligovány nebo ošetřeny EndoGIA staplerem, který standardně používáme k protětí jaterních žil nebo pravé či levé portální větve. V několika případech byla použita technika radiofrekvenční ablace tkáně podle Habiba, tato však nenalezla širší obliby. Dobré zkušenosti máme i s přístroji CUSA a Hydro-jet, které ale v současné době nemáme pravidelně k dispozici.
K ošetření ranné plochy používáme podle situace také argonovou koagulaci nebo lokální hemostyptikum Traumacel TAF, později nový Traumacel TAF light (Bioster a.s., Veverská Bítýška) – ve formě sítí různých rozměrů, které ponecháváme in situ i po zástavě krvácení (Obr. 1–3). Samozřejmostí je adekvátní drenáž po operačním výkonu.
Image 1. Resekční plocha jater Obr. 1. Raw surface of the transected liver 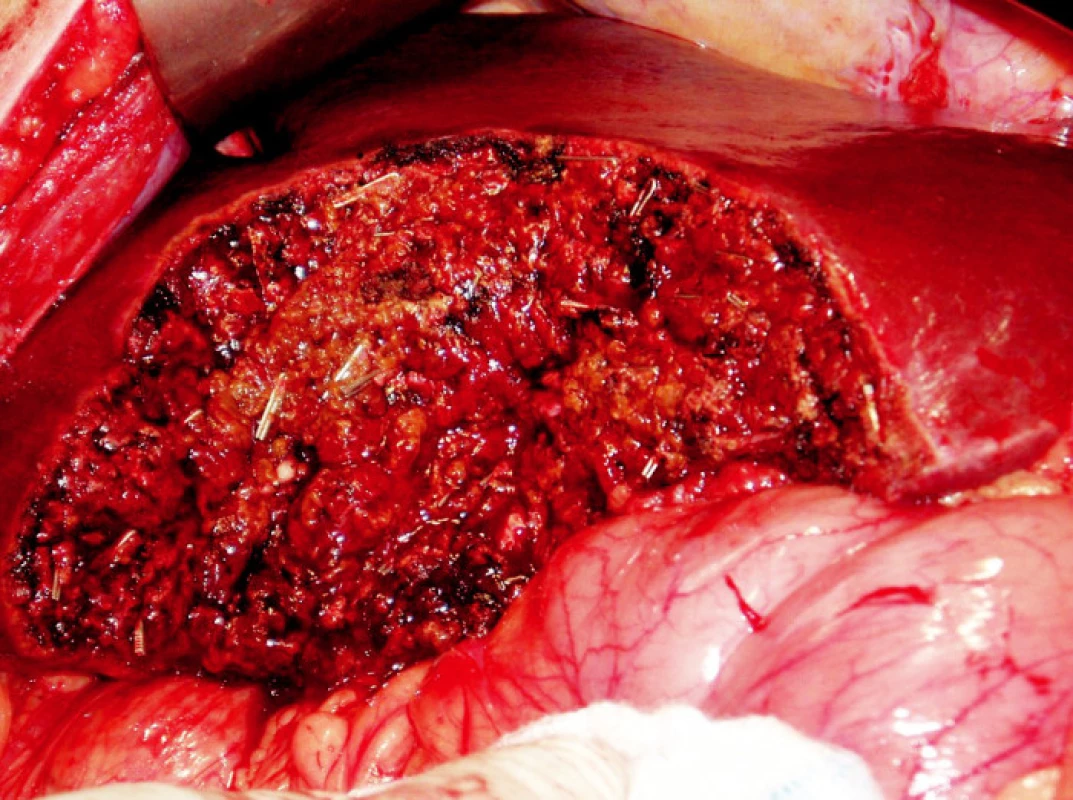
Image 2. Resekční plocha překrytá Traumacel TAF sítí Obr. 2. Raw surface covered with Traumacel TAF 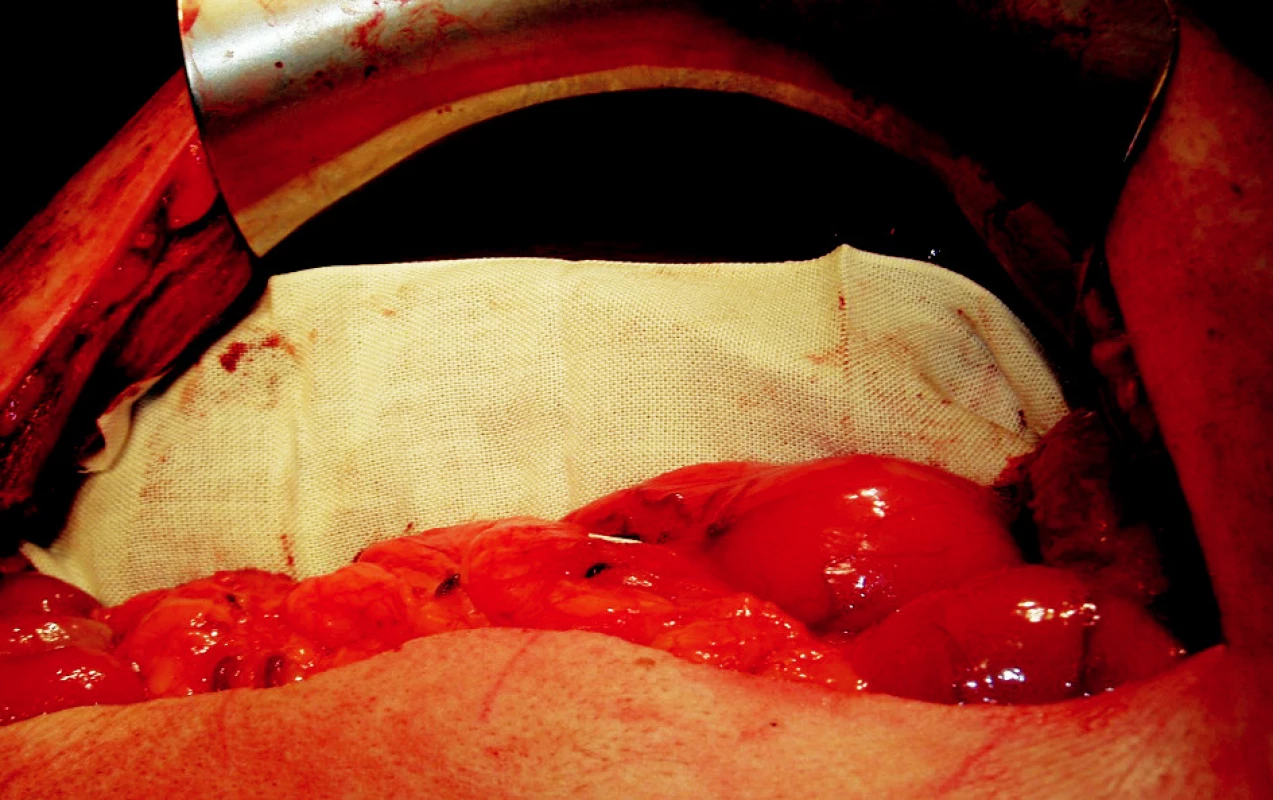
Image 3. Extraanatomická resekce jater s překrytím resekčních ploch Obr. 3. Extraanatomic resection, surfaces covered with Traumacel TAF 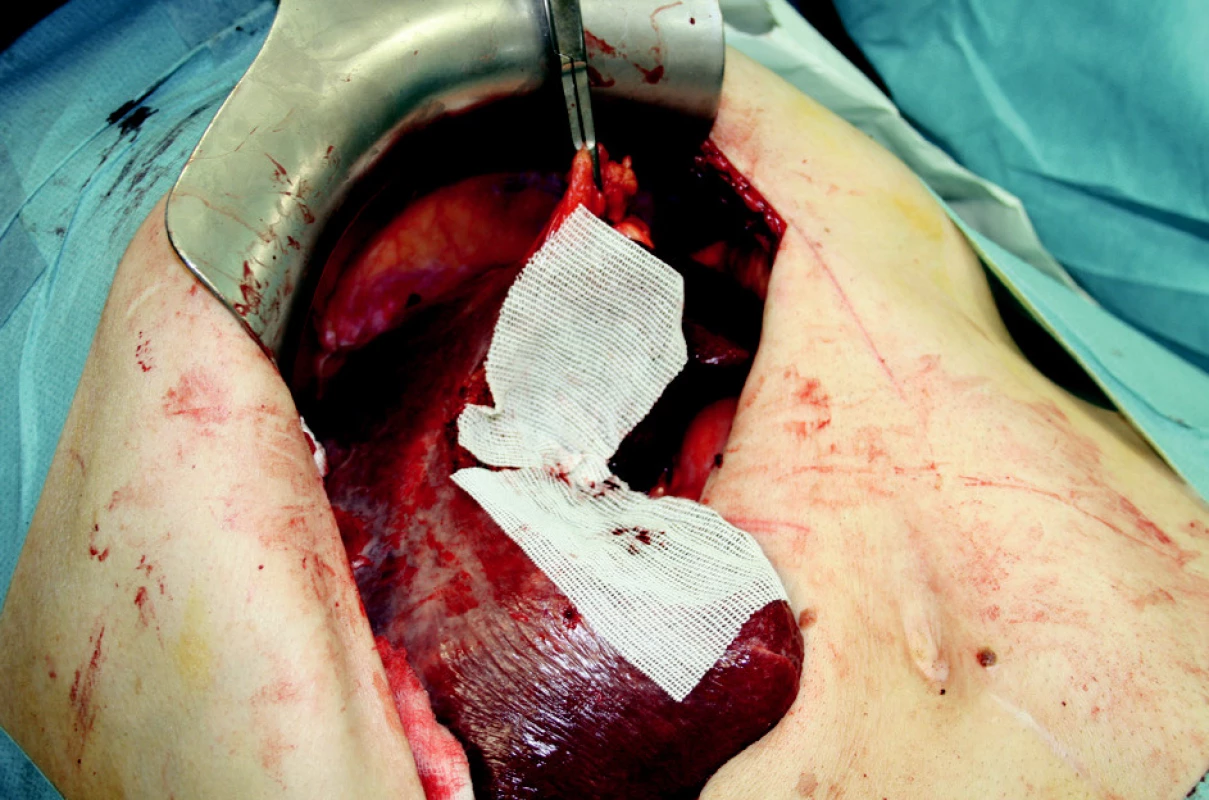
VÝSLEDKY
Počty resekčních výkonů u jednotlivých indikací zobrazuje tabulka 1. Jednoznačně nejčastější indikací k resekci jsou metastázy kolorektálního karcinomu, což je samozřejmě dáno vysokou incidencí CRC v České republice, pozdním záchytem v pokročilejších stadiích onemocnění a jeho následným klinickým průběhem. Z pohledu sledované problematiky nehraje roli rozdíl zda se jedná o metastázy synchronní či metachronní.
Tabulka číslo 2 zobrazuje typy a rozsah výkonů, převažují extraanatomické resekce, což je dáno počtem metastáz a jejich lokací nezřídka v obou jaterních lalocích. Většinou je snaha řešit situaci jednorázovým výkonem.
V uvedeném souboru pacientů nebyla ani v jednom případě indikována operační revize či jiný typ intervence pro pooperační krvácení. Žádný z pacientů nezemřel do 30 dnů po operaci.
Z komplikací jsme zaznamenali 2x abscesovou formaci (bez aplikace Traumacelu, po Habibově technice), která byla řešena perkutánní drenážní intervencí. V souboru nebyla prokázána biliární píštěl ani krvácení, které by si vynutilo reoperaci. Krevní převody indikuje pouze v nezbytných případech peroperačně anesteziolog po domluvě s chirurgem. Traumacel TAF byl použit u 67 pacientů (77 %).
DISKUSE
Spolu s rozšiřujícími se indikacemi k jaterním resekčním výkonům a pokroky v technickém vybavení v posledních létech byla vyvinuta i klinicky aplikována řada lokálně působících prostředků zejména za účelem zástavy a prevence krvácení z větších resekčních ploch, ale také k zamezení biliárních úniků a akumulace tekutiny intraperitoneálně.
Zejména v zahraničním písemnictví existuje celá řada prací, zabývající se touto problematikou v podstatně širším spektru aplikací od neurochirurgie, ORL, torakochirurgie, cévní chirurgie, urologie, gynekologie a v jiných operačních oborech [6, 7, 8, 10]. Komerčně vyráběných prostředků je celosvětově celá řada, průkazů o jejich účinnosti a především efektivitě podání je prozatím málo [2]. Některé mohou navíc přinášet rizika přenosu virových onemocnění, formací protilátek nebo alergických reakcí [7, 11].
Dosud však nedošlo ke zjištění nejúčinnější a nejefektivnější skupiny těchto látek. Je to dáno především tím, že provádění randomizovaných klinických studií na lidech je vzhledem k počtu dostupných preparátů logisticky nesmírně obtížné, ale i eticky sporné. V této souvislosti se slibně jeví nová skupina tzv. polymerních hemostatik, zatím převážně ve stadiu klinických testů. Jejich použití však bude nepochybně finančně náročné [7].
V Masarykově onkologickém ústavu se v poslední dekádě provádí kolem 40 jaterních resekcí ročně. Od roku 2007 jsme na základě spolupráce s výrobcem a za podpory grantu z EU přistoupili k pravidelnější aplikaci hemostatických sítěk Traumacelu TAF na krvácející ranné plochy a to nejen u jaterních resekcí, ale i po dalších rozsáhlých zákrocích v dutině břišní a retroperitoneu, podobně naši kolegové z gynekologie pak ve vybraných operačních situacích. Výsledky této studie byly více než uspokojivé, žádný z pacientů nebyl reoperován pro krvácení, v případě jaterních resekcí nebyl zaznamenán biliární leak. Podobně také v řadě pacientů, kde byl Traumacel TAF použit k zástavě kapilárního krvácení například po odstranění rozsáhlých liposarkomů retroperitonea nebo při krvácení ze sleziny se jeho použití osvědčilo natolik, že nebylo nutné hledat alternativní řešení. Přínos použití tkáňových lepidel vidíme spíše v jejich aplikaci u vysoce rizikových anastomóz například na žlučových cestách nebo pankreatu zvláště při reoperacích, ale nikoliv při zástavě krvácení z větších ranných ploch.
Hemostatické sítě nepoužíváme při každé jaterní resekci, zejména v situacích, kdy se daří „ideálně“ zastavit krvácení běžnými prostředky tak, že nedochází ani k ronění krve z resekční plochy nebo sutury parenchymu. Na druhé straně neváháme je použít nejen k vlastní zástavě krvácení, ale i „profylakticky“ tam, kde k tomuto jevu dochází nebo bylo drobné krvácení zastavováno opakovaně a/nebo v terénu steatotických či cirhotických jater. Nehrozí zde nebezpečí komprese v ohraničeném prostoru popisované při použití podobných preparátů po neurochirurgických operacích, nesetkali jsme se ani v literatuře s popsanou tvorbou granulomů [12]. Při pooperačních kontrolách CT nebo MR vyšetřením s odstupem v řádu několika měsíců nebývá přítomnost sítě zřetelná.
V této práci jsme se nezaměřili na pečlivé sledování časového intervalu zástavy krvácení po aplikaci sítě, ve sledovaných studiích bývá tento čas udáván do 10 minut [13], v některých dokonce měřen v sekundách, zejména při použití fibrinových preparátů [14, 15]. K zástavě krvácení při použití Traumacelu TAF dochází obvykle v řádu desítek vteřin až několika málo minut. Během několikahodinových operací však zkrácení nebo prodloužení o několik desítek vteřin nebo v řádu jednotlivých minut podle našeho názoru nehraje žádnou zásadní roli. Navíc bývá v literatuře správně poukazováno na nedostatek randomizovaných kontrolovaných studií včetně použití placeba zabývajících se touto složitou problematikou, jak již bylo shora zmíněno, takže operační týmy spíše používají vlastními zkušenostmi ověřené osvědčené postupy a preparáty [16].
Hemostatika založená na účinku oxidované celulózy jsou zmíněna výše, nejčastěji popisovaným nežádoucím účinkem je tvorba granulomů, při správném použití je toto riziko minimalizováno [7, 8].
Další, poměrně velkou skupinu lokálně působících prostředků tvoří přípravky na bázi fibrinu, které se v chirurgii používají od 70. let minulého století. Mají hemostatické i adhezivní vlastnosti a široké spektrum použití. Naproti tomu existuje řada pochyb o bezpečnosti jejich použití zejména z hlediska přenosu některých patogenů krevní cestou, možné senzibilizace a anafylaktické reakce i koagulopatie spouštěné bovinním trombinem. Nejnovější preparáty této skupiny uvedená rizika minimalizují. Poslední literární prameny však neprokazují efektivitu preparátů na bázi fibrinu použitých při jaterních resekcích v prospektivní studii na 300 pacientech [17].
Rozšířenou skupinu představují hemostatika na bázi kolagenu, která byla zavedena také v 70. letech 19. století. Jejich struktura podporuje formaci trombu, často jsou užívána v kombinaci s prokoagulační substancí – trombinem, za účelem posílení efektu hemostázy. Nežádoucí účinky u této skupiny nejsou časté, byla zaznamenána tvorba adhezí, alergické reakce [11]. Přidáním bovinního trombinu však roste riziko přenosu bovinní spongiformní encefalopatie a podobných nežádoucích reakcí jako u přípravků fibrinových.
Významnou skupinu hemostatik tvoří gelatinové preparáty. Jejich účinek je založen spíše na povrchovém efektu materiálu než aktivitě v koagulační kaskádě, jsou k dispozici v různých provedeních (prášek, houbička, gel). Preparáty byly úspěšně aplikovány také u jaterních resekcí [18]. V experimentu byla u přípravků této skupiny zaznamenána granulomatózní zánětlivá reakce nebo tromboza po aplikaci na cévní suturu v experimentu [19].
K nejnovějším skupinám preparátů patří hemostatika na bázi polysacharidů, anorganická hemostatika a tzv. polymerní hemostatika [7]. Některé z nich budou v blízké době pravděpodobně určeny k zástavě masivnějších krvácení v bojových podmínkách [7].
ZÁVĚR
Závěrem lze konstatovat, že použití Traumacelu TAF i TAF light se osvědčilo při zástavě i profylaxi krvácení z jaterního parenchymu po resekčních výkonech z různých indikací. Jeho aplikace je snadná a rychlá, hemostatikum je účinné, efektivní i bezpečné a ve srovnání s ostatními preparáty stejné skupiny ekonomicky úsporné.
Doc. MUDr. R. Šefr, Ph.D.
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: sefr@mou.cz
Sources
1. Grundmann, R. T., Hermanek, P., Merkel, S., et al. Diagnostik und Therapie von Lebermetastasen kolorektaler Karzinome – Workflow. Zentralbl. Chir., 2008; 133 : 267–284.
2. Berrevoet, F., Hemptinne, B. Use of topical hemostatic agents during liver resection. Dig. Surg., 2007; 24 : 288–293.
3. Delis, S. G., Madariaga, J., Bakoyannis, A., Dervenis, C. Current role of bloodless liver resection. World J. Gastroenterol., 2007; 13 : 826–829.
4. Erdogan, D., Busch, O. R. C., Gouma, D. J., Gulik, T. M.: Prevention of biliary leakage after partial liver resection using topical hemostatic agents. Dig. Surg., 2007; 24 : 294–299.
5. Spotnitz, W.D., Bursk, S.: Hemostats, sealants, and adhesives: components of the surgical toolbox. Transfusion, 2008; 48 : 1502–1516.
6. Gabay, M. Absorbable hemostatic agents. Am. J. Health Syst. Pharm., 2006; 63 : 1244–1253.
7. Seyednejad, H., Imani, M., Jamieson, T., Seifalian, A. M. Topical haemostatic agents. Brit. J. Surg., 2008; 95 : 1197–1225.
8. Smrčka, M. Použití oxicelulózy v neurochirurgii – technické poznámky. Rozhl. Chir., 2001; 80 : 112–115.
9. Hofman, D., Wilson, J., Poore, S., et al. Can Traumacel be used in the treatment of chronic wounds? J. Wound Care, 2000, 9 : 393–396.
10. Palm, M. D., Altman, J. S.: Topical hemostatic agents: a review. Dermatol. Surg., 2008; 34 : 431–445.
11. Kitamura, K., Yasuoka, R., Ohara, M., et al. How safe are xenogeneic hemostats – report of a case of severe systemic allergic reaction. Surg. Today, 1995; 25 : 433–435.
12. Brodbelt, A. R., Miles, J. B., Foy, P. M., Broome, J. C. Intra - spinal oxidised cellulose (Surgicel®) causing delayed paraplegia after thoracotomy – a report of three cases. Ann. R. Coll. Surg. Engl., 2002; 84 : 97–99.
13. Cheng, C. M., Meyer-Massetti, C., Kayser, S. R.: A review of three stand-alone topical thrombins for surgical hemostasis. Clin. Ther., 2009; 31 : 32–41.
14. Frilling, A., Stavrou, G. A., Mischinger, H. J., et al. Effectiveness of a new carrier-bound fibrin sealant versus argon beamer as a haemostatic agent during liver resection: a randomised prospective trial. Langenbecks Arch. Surg., 2005; 390 : 114–120.
15. Schwartz, M., Madagriaga, J., Hirose, R., et al. Comparison of a new fibrin sealant with standard topical hemostatic agents. Arch. Surg., 2004; 139 : 1148–1154.
16. Izzo, F., Giacomo, R., Falco, P., et al. Efficacy of a haemostatic matrix for the management of bleeding in patients undergoing liver resections: results from 237 cases. Curr. Med. Res. Opin., 2008; 24 : 1011–1015.
17. Figueras, J., Llado, J., Miro, M., et al. Application of fibrin glue sealant after hepatectomy does not seem justified: results of a randomized study in 300 patients. Ann. Surg., 2007; 245 : 536–542.
18. Chapman, W. C., Clavien, P. A., Fung, J., et al. Effective control of hepatic bleeding with a novel collagen-based composite with autologous plasma:results of a randomized controlled trial. Arch. Surg., 2000; 129 : 445–450.
19. Kheirabadi, B.S., Field-Riley, A., Pearson, R., et al.: Comparative study of the efficacy of the common topical hemostatic agents with fibrin sealant in a rabbit aortic anastomosis model. J. Surg. Res., 2002; 106 : 99–107.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2009 Issue 6-
All articles in this issue
- 100 let operace podle Milese – W. Ernest Miles 1869–1947
- Epidemiologie a léčba kolorektálního karcinomu v českých populačních datech
- Chemoterapie a biologická léčba v komplexní léčbě karcinomu tlustého střeva a konečníku. Kdy, proč, jak?
- Endoskopická diagnostika a léčba plochých nádorových lézí střevních
- Uzávěr defektu perinea po abdominoperineální resekci rekta pomocí Vertical Rectus Abdominis Flap
- Lymfom rekta – diagnóza k operaci?
- Sexuální dysfunkce u mužů po operacích kolorektálního karcinomu. Novinky v prevenci a terapii
- Výskyt a prognostický význam extranodálních nádorových depozit v mezorektu u pacientů s karcinomem rekta po neoadjuvantní terapii
- Antibiotická profylaxe v kolorektální chirurgii
- Enterální píštěl jako pooperační komplikace – kazuistika
- Využití lokálních hemostyptik při jaterních resekcích
- Complications after Colorectal Surgery
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Endoskopická diagnostika a léčba plochých nádorových lézí střevních
- Chemoterapie a biologická léčba v komplexní léčbě karcinomu tlustého střeva a konečníku. Kdy, proč, jak?
- Antibiotická profylaxe v kolorektální chirurgii
- Enterální píštěl jako pooperační komplikace – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

