-
Medical journals
- Career
Chemoterapie a biologická léčba v komplexní léčbě karcinomu tlustého střeva a konečníku. Kdy, proč, jak?
Authors: E. Kubala; L. Petruželka; E. Sedláčková
Authors‘ workplace: Onkologická klinika VFN a UK 1. LF, Praha, přednosta: prof. MUDr. L. Petruželka, CSc.
Published in: Rozhl. Chir., 2009, roč. 88, č. 6, s. 303-307.
Category: Monothematic special - Original
Overview
Léčba kolorektálního karcinomu doznala za poslední roky významných změn. Zařazením nových molekul do léčby (oxaliplatina, irinotecan, kapecitabin) vedlo k výraznému zlepšení přežití pacientů s tímto onemocněním. Výzkum biologického chování a genetických změn kolorektálního karcinomu vedly k rozvoji biologické léčby.
V současné době jsou používány standardně tři preparáty:
bevacizumab (anti - VEGF protilátka), cetuximab a panitumumab (protilátky proti EGFR).
Biologická léčba se používá v kombinaci s chemoterapií a bez genetického vyšetření by neměla být podána (vyšetření K ras mutace).
V adjuvantní léčbě se dnes používá kombinace FOLFOX (oxaliplatina, 5-fluorouracil a leukovorin). Její zavedení do léčby výrazně snížilo riziko úmrtí na toto onemocnění u stadia III. Otevřená je otázka adjuvantní léčby u stadia IIB, u kterého je nutné stanovit další rizikové faktory, které určí zařazení pacienta do adjuvantní léčby.
V paliativní léčbě kolorektálního karcinomu se používá celá řada chemoterapeutických kombinací (FUFA, FOLFOX, FOLFIRI, XELOX, XELIRI) v kombinaci s biologickou léčbou. Mezinárodně je doporučený systém postupného podávání jednotlivých kombinací chemoterapie s biologickou léčbou – v první linii bevacizumab, v druhé linii cetuximab nebo panitumumab.
Nové poznatky v biologii kolorektálního karcinomu ukazují na nutnost individualizovat léčebný postup pro každého pacienta.Klíčová slova:
adjuvantní léčba – paliativní léčba – biologické léčba – genetické vyšetřeníÚVOD
Kolorektální karcinom patří v současné době k nejčastěji se vyskytujícím tumorům. Roční incidence je 10,1 % ze všech nádorů a postihuje obě pohlaví stejným dílem. Má na svědomí pět set tisíc úmrtí ročně podle statistiky Světové zdravotnické organizace. Až 40 % pacientů je diagnostikováno v pozdním IV. stadiu, kdy možnost záchrany pacienta je nulová. Nejvíce je postižena populace nad 50 let věku, v ekonomicky bohatých státech především Evropy a Ameriky. Hlavní příčinou je excesivní kalorický příjem, tučná strava s nízkým obsahem vlákniny. Za rizikový faktor je považován výskyt kolorektálního karcinomu (CRC) v rodinné anamnéze, přítomnost polypů v tlustém střevě, ulcerózní kolitida, Crohnova nemoc a některá vrozená onemocnění.
Podle dostupných statistických údajů ze 100 pacientů s diagnostikovaným CRC je 30 s pokročilým onemocnění, z nich 25 má metastazující kolorektální karcinom a 5 lokálně pokročilý neresekabilní nádor. 70 pacientů podstoupí chirurgickou onkologickou léčbu, z nich se podaří zachránit 45 pacientů a u 25 dojde přes veškerou léčbu včetně adjuvantní k recidivě onemocnění. Vedle chirurgické léčby můžeme pacientovi nabídnout chemoterapii a biologickou léčbu, které jsou nedílnou součástí komplexní léčby karcinomů tlustého střeva a konečníku. Nadále zůstává otevřená otázka, proč ji aplikovat, kdy a jakým způsobem, aby byla použita s maximální efektivitou a nejlepším výsledkem, tedy záchranou pacienta a jeho vyléčením. Podle cíle léčby ji dělíme na adjuvantní léčbu, u které předpokládáme vyléčení, a paliativní léčbu u pokročilého metastazujícího CRC, kde je cílem dosáhnout dlouhodobého přežití.
ADJUVANTNÍ LÉČBA CRC
Proč máme podávat adjuvantní léčbu? Progrese nádoru je způsobena nerozpoznanými vzdálenými metastázami. Penetrace celou stěnou tlustého střeva tumorem stadium IIb a postižení regionálních uzlin ve stadiu III. zvyšují riziko vzniku metastáz, proto je u nich adjuvantní léčba doporučována. Za důležité prognostické faktory jsou považovány angioinvaze, lymfangioinvaze, histopatologický grading, počet metastáz v regionálních uzlinách, penetrace nebo perforace nádorů stěnou střevní. Přežití pacienta je plně závislé na kvalitě chirurgické léčby, radikalitě výkonu a počtu odebraných a vyšetřených uzlin. Studie INT -089 1 [1] ukázala, že přežití pacientů je plně závislé na počtu vyšetřených uzlin. Pouze 59 % pacientů s maximálně 10 vyšetřenými uzlinami dosáhlo čtyřletého přežití na rozdíl od 79 % u pacientů s 20 a více vyšetřenými uzlinami (Obr. 1).
Image 1. Adjuvantní léčba kolorektálního karcinomu Fig. 1. Adjuvant treatment of colorectal carcinoma 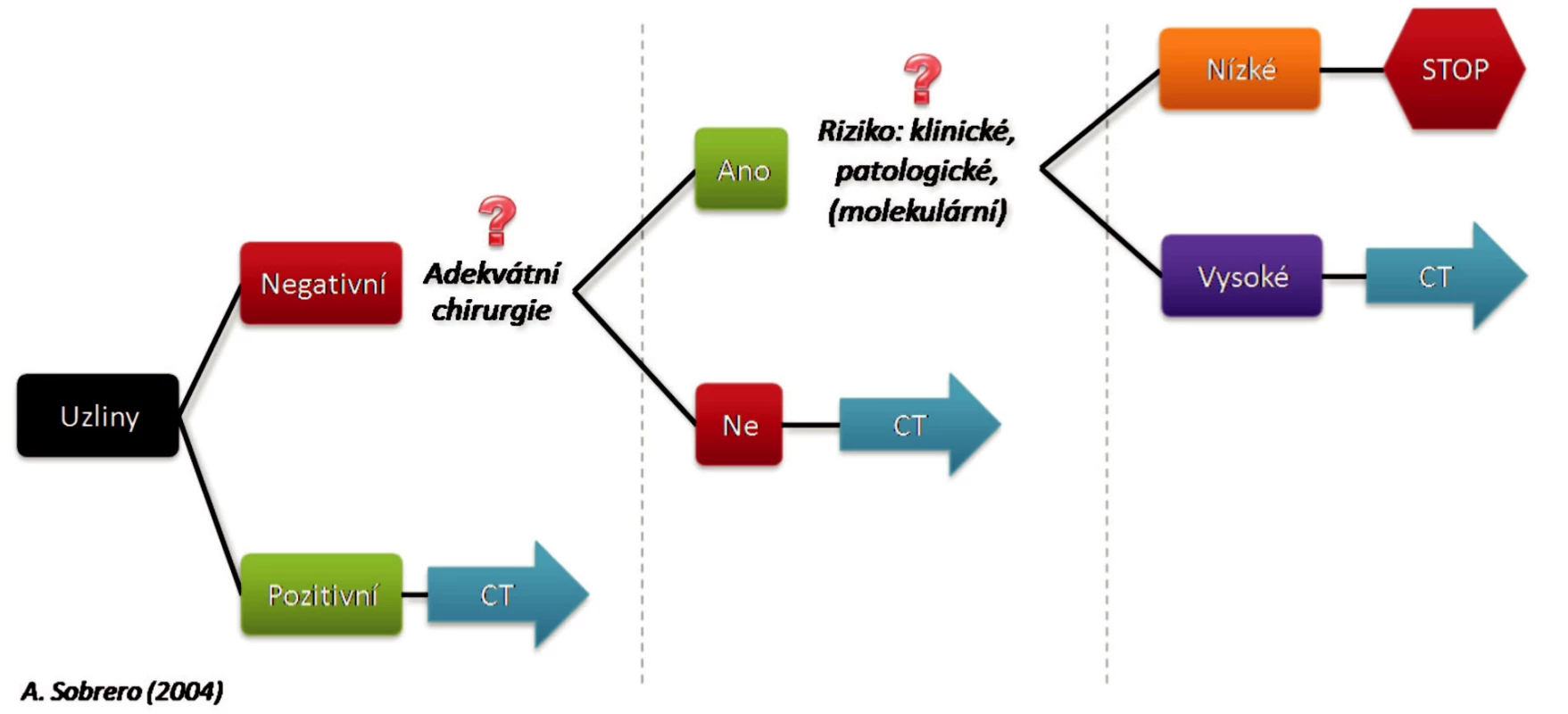
Klasifikace nádoru stanovení stadia onemocnění (TNM klasifikace) je rozhodujícím faktorem k zahájení adjuvantní léčby. Sama o sobě však klasifikace nestačí. Analýza statistických dat pětiletého přežití karcinomu tlustého střeva podle stadií TNM systému ukázala velmi závažný problém [2].Stadium II v 5. revizi klasifikace AJCC mělo pětileté přežití 83 % pacientů, ale podle 6. revize, kdy došlo k rozdělení II stadia na IIA T3N0M0 a IIB T4N0M0, se objevilo paradoxní zhoršení pětiletého přežití stadia IIB u 72 % pacientů proti 83 % u III stadia s metastázami do regionálních uzlin. Tento nález byl statisticky významný p < 0,001. U stadia II. nebyla adjuvantní léčba doporučena a tito pacienti byli pouze sledováni, tím došlo k zhoršení jejich přežití (Obr. 2).
Image 2. Adjuvantní léčba kolorektálního karcinomu Fig. 2. Adjuvant treatment of colorectal carcinoma 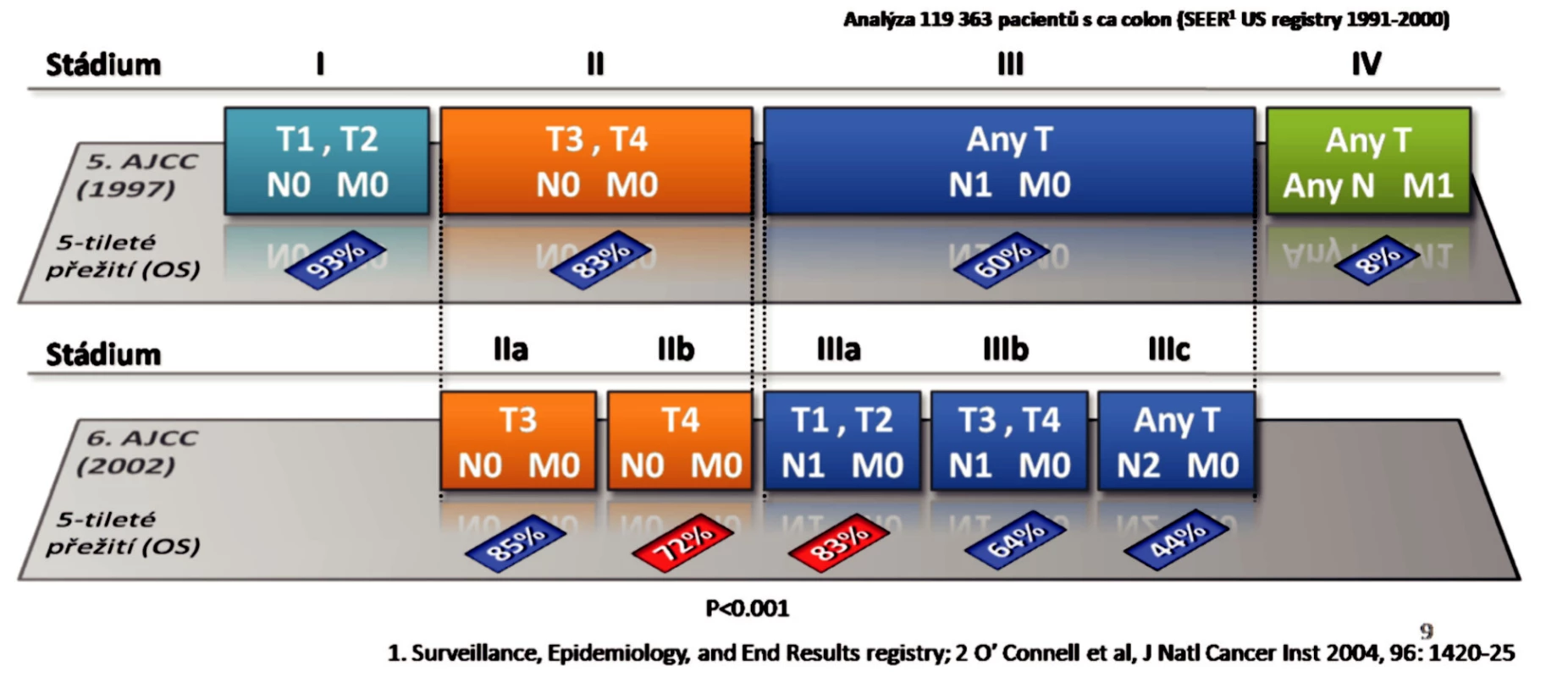
Další analýza ukázala, že nedostatečné vyšetření spádových uzlin vede k mylnému stanovení NO, ačkoliv onemocnění je N1. Také byly přehlédnuty další rizikové faktory u stadia pT4pN0M0, jako je perforace střeva, obstrukce vyžadující akutní operaci, lymfangioinvaze, angioinvaze, patologický grading nádoru, chromozomální a genetické abnormality tumorózních buněk a nízká odezva v poklesu karcinoembryonálního antigenu (CEA) na primární chirurgickou onkologickou léčbu. Také menší radikalita chirurgické léčby u stadia IIB vedla k zhoršení prognózy nemocných. U stadia IIb je proto nutné přesně individualizovat riziko pacienta a podle toho jej zařadit do adjuvantní léčby [2].
Po rozhodnutí, zda podat adjuvantní léčbu, vyvstává otázka, zda máme dostatečně účinnou adjuvantní léčbu kolorektálního karcinomu, účinné léky nebo jejich kombinace a zda je nadále 5-fluorouracil hlavním lékem v adjuvantní léčbě a pokud ano, jaká forma podání je nejúčinnější.
Již v 80. letech minulého století bylo prokázáno, že adjuvantní léčba s 5FU je lepší než pouhé sledování. Studie IMPACT (3) a NSABP CO1 - CO4 [4] prokázaly, že adjuvantní léčba kombinace 5FU a leukovorinu (FUFA) je vhodná pro pacienta se stadiem III, ale neprokázaly prospěch pro pacienty se stadiem II.
Zavedením nové molekuly oxaliplatiny do kombinace s FUFA a vznik nové kombinace FOLFOX ve studii MOSAIC [5] přineslo pokrok adjuvantní léčbě karcinomu tlustého střeva. Tato studie prokázala 18% redukci rizika relapsu onemocnění u pacientů zařazených do ramene s kombinací FOLFOX (oxaliplatina + 5FU + FA) a šestiletá analýza tohoto projektu ukázala 7% rozdíl v době do progrese onemocnění. V současné době je tato léčba považována za standardní léčbu u stadií III a u vybraných rizikových stadií IIB. Kombinace FUFA zůstává základem léčby, 5FU může být nahrazen perorálním capecitabinem se stejnými léčebnými výsledky [6]. Na zařazení biologické léčby nejsou v současné době dostatečná data.
Závěrem lze říci, že máme účinnou kombinovanou chemoterapii v adjuvantní léčbě FOLFOX4, 5FU zůstává standardním lékem těchto kombinací a může být nahrazován perorálním capecitabinem. Jako účinný se ukázal pouze v dlouhodobém infuzním podání. Kombinace FUFA v krátkodobém podání (FUFA Mayo režim) se ukázaly jako nedostatečně účinné.
PALIATIVNÍ LÉČBA
Od paliativní léčby nelze očekávat úplné vyléčení pacienta, hlavním úkolem je prodloužení života, zmírnění symptomů nemoci a komplexním výsledkem musí být zlepšení kvality života. Léčba je založena na velmi úzké mezioborové týmové spolupráci gastroenterologa, radiologa, chirurga, onkologa a patologa. Bez této spolupráce nelze stanovit strategii léčby, která bude pro jednotlivého pacienta optimální. Individualizací léčby, takzvané „šití na míru“ (tailoring), je předpokladem úspěšné léčby a dosažení dlouhodobého přežití. Tento předpoklad je potvrzován povzbudivými výsledky dosažených kompletních remisí ve 2–6 % případů a na nárůstu sekundární operability na 22–50 % v případech primární inoperability kolorektálního karcinomu [7].
V 80. letech minulého století bylo prokázáno, že pa-liativní chemoterapie je lepší než kvalitní podpůrná léčba. Prodloužila život z 6 na 10 až 12 měsíců, důležité je její včasné zahájení, kombinace FUFA je účinnější než samotný 5FU. Dále se prokázalo, že infuzní dlouhodobé podání je více aktivní než jednorázové podání v bolusu. V 90. letech se objevily nové preparáty oxaliplatina a irinotekan. V kombinacích s oxaliplatinou [8] a s irinotekanem [9] došlo k prodloužení mediánu přežití o 14–16 měsíců. Fluoropirimidiny, oxaliplatina a irinotekan v kombinacích nebo sekvenčním podání prodloužily medián přežití nad 20 měsíců [10].
Rozvoj molekulární biologie a genetiky odhalil biologii chování nádorových buněk, pomohl odhalit některé klíčové molekuly, které ovlivňují chování nádorových buněk. Pomocí nových léčiv se zaměřením na tyto molekuly byla zahájena tzv. cílená terapie, která ovlivňuje jen nádorové buňky. Působí společně s cytostatickou léčbou a zvyšuje efektivitu léčby. V současné době jsou schváleny 3 molekuly v léčbě metastatického kolorektálního karcinomu bevacizumab, cetuximab a panitumimab. Bevacizumab je monoklonální protilátka proti všem variantám vaskulárního endoteliálního růstového faktoru VEGF A, který hraje důležitou roli při regule angiogeneze [11]. Cetuximab je protilátka proti epidermálnímu růstovému faktoru EGFR, který hraje důležitou úlohu při buněčné proliferaci, adhezi, diferenciaci, angiogenezi a apoptóze. Jeho blokádu lze zajistit inhibicí extracelulární domény pomocí cetuximabu nebo inhibicí tirosinkinázové kaskády [12]. Panitumimab je další protilátkou s jiným působením na EGFR receptor. U obou je nezbytné vyšetřit K ras. Pokud došlo k jeho mutaci, nedoporučuje se podávat inhibitory EGFR. K ras mutace hraje klíčovou úlohu v biologické léčbě MCRC, ve studii 2107 byl prokázán jako prediktor klinického benefitu v celkovém přežití i v celkovém počtu odpovědí [13].
Vyšetření K ras mutace by mělo být provedeno u každého nově zjištěného kolorektálního karcinomu.
Do první linie chemoterapie metastázujícího kolorektálního karcinomu lze zařadit kombinace FOLFOX4, XELOX, FOLFIRI, FUFA nebo jen capecitabin (Obr. 3). K cytostastické léčbě je přiřazena biologická léčba. Jako nejvhodnější se ukázal bevacizumab. Po selhání kombinace s oxaliplatinou je doporučena 2. linie v podobě kombinace FOLFIRI a pokračování biologické léčby s bevacizumabem. Třetí linií po selhání FOLFIRI + bevacizumab je léčba irinotecan + cetuximab.
Image 3. Současný doporučený způsob léčby u metastazujícího CRC Fig. 3. Current guidance for the management of metastazing CRCs 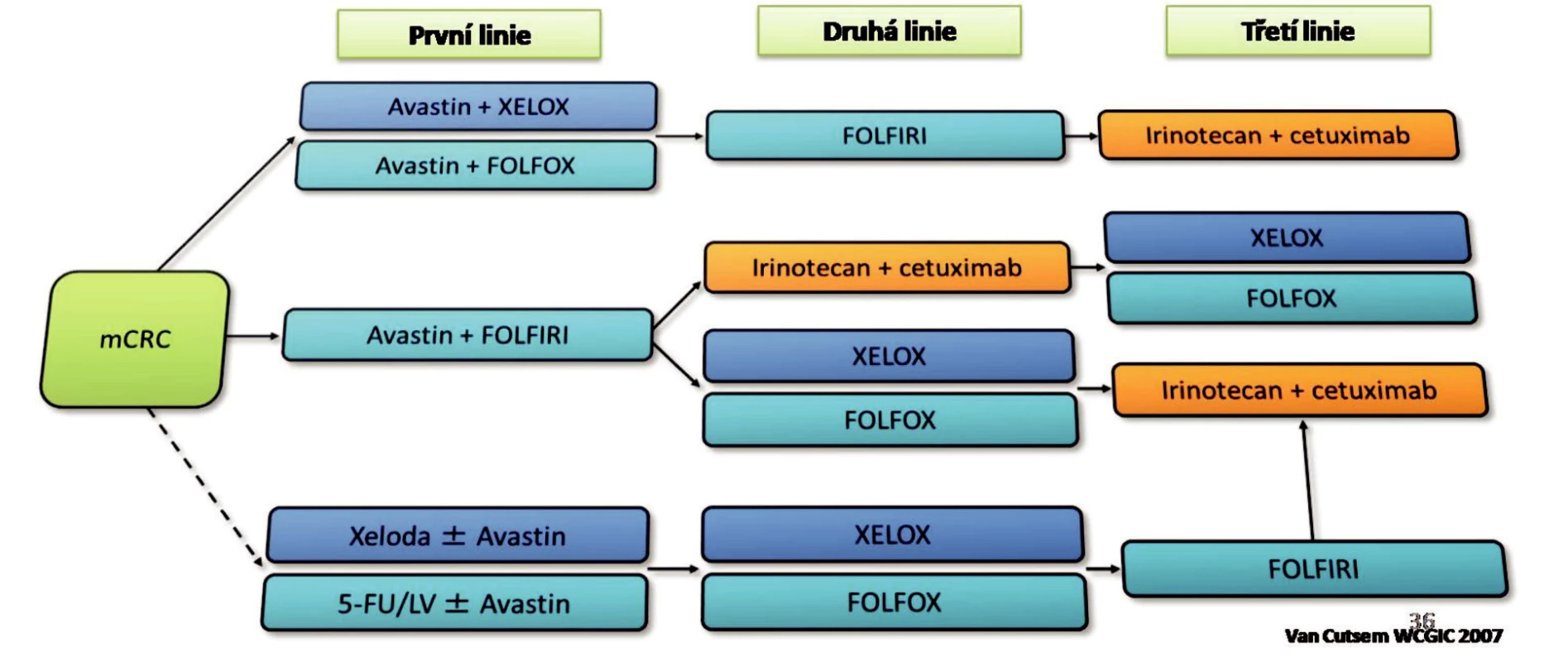
Po selhání 1. linie FOLFIRI je doporučeno podávat kombinace FOLFOX nebo XELOX a pokračování bevacizumabu. Pokud bychom zvolili pouze irinotecan, doporučuje se podat cetuximab, který potencuje účinek irinotecanu po selhání kombinace FOLFIRI. Jako 3. linie léčby se doporučuje kombinace XELOX nebo FOLFOX. Pokud byla podána jako 2. linie kombinace XELOX nebo FOLFOX, jako 3. linie je doporučena kombinace irinotecan + cetuximab.
Druhou linií po selhání capecitabinu nebo FUFA je kombinace XELOX nebo FOLFOX s pokračováním bevacizumabu. Jako 3. linie je doporučována kombinace FOLFIRI.
Dvojkombinace biologické léčby bevacizumabu + panitumumabu v kombinacích s chemoterapií (kombinace s irinotecanem nebo oxaliplatinou) se zatím ukázala neúspěšnou ve studii fáze III PACCE, jejíž výsledky nepotvrdily předpoklad zvýšené efektivity léčby [14]. Při používání biologické léčby je ale důležité, že po selhání 1. linie chemoterapie je vhodné pokračovat v bevacizumabu i v 2. linii léčby. Studie fáze III 2107 prokázala prodloužení průměrného přežití o 30 % (z 15,6 měsíců na 20,3 měsíců) [13]. Při použití v 2. linii se zvýšilo celkové přežití o 20 % (z 10,8 měsíců na 13 měsíců). Výsledky studie fáze III E3200 (15) byly potvrzeny studií BRiTE (16), která sledovala efektivitu kontinuální léčby bevacizumabem po selhání 1. linie chemoterapie. Bylo dosaženo až 25,1 měsíců průměrného přežití u pokročilého metastazujícího kolorektálního karcinomu.
Výrazná efektivita paliativní léčby otvírá možnosti stanovení nové strategie léčby jaterních operabilních metastáz. EORTC studie prokázala vysokou efektivitu předoperačního podání chemoterapie FOLFOX 6 cyklů s následnou resekcí jaterních metastáz a adjuvantní léčbou po resekci primárního tumoru a metastáz [17]. Bylo prokázáno, že tato léčba vedla ke zvýšení počtu pacientů s tříletým přežitím o 9,2 %. Zařazení biologické léčby, především bevacuzimabu, ještě zlepšuje odpovědi a ukazuje se, že snižuje toxicitu oxaliplatiny u sinusoidálního postižení jater po léčbě kombinací FOLFOX [18].
Paliativní léčba metastázujícího kolorektálního karcinomu dosáhla výrazného pokroku. Zařazením biologické léčby po roce 2000 vedla k výraznému prodloužení života. Také vhodnou kombinací s chirurgickou léčbou, se zařazováním resekcí jaterních a plicních metastáz, umožnila efektivně prodloužit život pacientů na několik let. Dosažení takového úspěchu vyžaduje týmovou práci všech zainteresovaných odborníků a stanovení optimálního léčebného postupu pro jednotlivé pacienty.
Zkratky:
5FU 5 fluorouracil
FA leucovorin
FUFA 5 fluorouracil + leucovorin
FOLFOX oxaliplatina + 5 fluorouracil + leucovorin
FOLFIRI irinotecan + 5 fluorouracil + leucovorin
XELOX oxaliplatina + capecitabin
MUDr. E. Kubala
Onkologická klinika VFN a 1. LF UK
U Nemocnice 2
128 08 Praha 2
Sources
1. Le Foyer,T. E., et al. INT - 089. J. Clin. Oncol., 2003, 21, s. 2912–2919.
2. O’Connel, et al. Surveillance, Epidemiology and Results registry J. Natl. Cancer Indy., 2004, 96, s. 1420–1425.
3. International Multicentre Pooled Analysis of Colon Cancer Trial (IMPACT) Investigators: Efficacy of adjuvant fluorouracil and folinic acid in colon cancer. Lancet 345, 1995, s. 939–944.
4. Mamounas, E., Weinard, S., Walmark, N., et al. Comparative efficacy of adjuvant chemotherapy in patiens with Dukes’B versus Dukes’C colon cancer: Results from national surgical adjuvant brest and bowel project adjuvant studies (C-01, C-02, C-03, and C-04). J. Clin. Oncol., 1999, 17, s. 1349–1355.
5. Andre, T., Boni, C., Mounedji-Boudiaf, L., et al. Oxaliplatin, fluorouracil and leucovorin as adjuvant treatment for colon cancer. N. Engl. J. Med., 2004, 350, s. 2343–2351.
6. Cassidy, J., Scheithauer, W., McKendrick, J., et al. Capecitabine (X) vs bolus 5-FU/leucovorin (LV) as adjuvant therapy for colon cancer (the X-ACT study): positive efficacy results of phase III trial. Proc. Am. Soc. Clin. Oncol., 2004, 23, s. 2475, (abstr 3509).
7. Nordlinger, H., Skrbte, L., Collette, B., et al. Final results of the EORTC Intergroup randomized phase III study 40983 (EPOC) evaluating the benefit of perioperative FOLFOX 4 Chemotherapy for patiens with potentially resectable cororectal cancer liver metastases. J. Clin. Oncol., 2007; ASCO Annual Meeting Proceedings (Post-Meeting Edition), 25, 18S (June 20 Supplement), 2007; abstract LBA5.
8. De Gramont, A., Cervantes, A., Andre, T., et al. OPTIMOX study: FOLFOX 7/LV5FU2 compared to FOLFOX 4 in patiens with advanced colorectal cancer. J. Clin. Oncol., 2004, 22, s. 251, (suppl; abstr 3525).
9. Saltz, L. B., Cox, J. V., Blanke, C., et al. Irinotecan plus fluorouracil and leucovorin for metastatic colorectal cancer. N. Engl. J. Med., 2000, 343, s. 905–914.
10. Tournigand, C., Andre, T., Achille, E., et al. FOLFIRI followed by FOLFOX6 or the reverse sequence in advaced colorectal cancer: A Randomized GERCOR study. J. Clin. Oncol., 2004, 2, s. 229–237.
11. Ferrana, N., Hillan, K. J., Gerber, H. P., et al. Dicsovery and development of bevacizumab, an anti-VEGF antipody for treating cancer. Nat. Rev. Drug Discov., 2004, 350, s. 2335–2342.
12. Kiss, I., Tomášek, J., Halámková, J. Biologická léčba kolorektálního karcinomu. Remedia, 2008, 18, s. 28–34.
13. Hurwitz, H., Fehrenbacher, I., et al. Bevacizumab plus Irinotecan, Fluorourail and Leucovorin for Metastatic Coleorectal Cancer. N. Engl. J. Med., 2004, 350, s. 2335–2342 (study 2107).
14. Hecht, J., Chidiac, T., Mitchell, E., et al. An interim analysis of efficacy and safety from randomized controlled trial of panitumumab with chemotherapy plus bevacizumab for metastatic colorectal cancer. Ann. Oncol., 2007, 18, vii 21, abstact 0–0033.
15. Giantonio, B. J., Catalano, P. J., et al. Bevacizumab in combination with oxaliplatin fluorouracil and leucovorin (FOLFOX4) for previously treated metastatic colorectal cancer; results from ECOG study E3200. J. Clin. Oncol., 2007, 25, s. 1539–1544.
16. Grothey, A., et al. Beacizumab beyone first progression is associated with prolonged overall survival in metastatic colorectal cancer: results from large observatinnal kohort study (BRiTE). J. Clin. Oncol., doi: 10.1200/JCO 2008, 16.3212.
17. van Cutsen, E., Nordinger, B., Adam, R., et al. Towards a pan-European konsensus on the treatment of patients with colorectal liver metastase: Eur. J. Cancer 2006, 42, s. 2212–2221.
18. Zorzi, D., Kishi, Z., Maru, D. M., et al. Effect of extended preoperative chemotherapy on pathologic response and postoperative liver insufficiency after hepatic resection for colorectal liver metastase. ASCO GIT Cancer Symposium 2009, abstrakt 295, s. 207.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2009 Issue 6-
All articles in this issue
- 100 let operace podle Milese – W. Ernest Miles 1869–1947
- Epidemiologie a léčba kolorektálního karcinomu v českých populačních datech
- Chemoterapie a biologická léčba v komplexní léčbě karcinomu tlustého střeva a konečníku. Kdy, proč, jak?
- Endoskopická diagnostika a léčba plochých nádorových lézí střevních
- Uzávěr defektu perinea po abdominoperineální resekci rekta pomocí Vertical Rectus Abdominis Flap
- Lymfom rekta – diagnóza k operaci?
- Sexuální dysfunkce u mužů po operacích kolorektálního karcinomu. Novinky v prevenci a terapii
- Výskyt a prognostický význam extranodálních nádorových depozit v mezorektu u pacientů s karcinomem rekta po neoadjuvantní terapii
- Antibiotická profylaxe v kolorektální chirurgii
- Enterální píštěl jako pooperační komplikace – kazuistika
- Využití lokálních hemostyptik při jaterních resekcích
- Complications after Colorectal Surgery
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Endoskopická diagnostika a léčba plochých nádorových lézí střevních
- Chemoterapie a biologická léčba v komplexní léčbě karcinomu tlustého střeva a konečníku. Kdy, proč, jak?
- Antibiotická profylaxe v kolorektální chirurgii
- Enterální píštěl jako pooperační komplikace – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

