-
Medical journals
- Career
Embolizace portální žíly – zvýšení resekability jater pro maligní onemocnění
Authors: V. Liška 1; V. Třeška 1; H. Mírka 2; M. Novák 2; F. Šlauf 2; T. Skalický 1; A. Sutnar 1; S. Kormunda 1
Authors‘ workplace: Chirurgická klinika, FN Plzeň-Lochotín, LF UK v Plzni, přednosta: prof. MUDr. V. Třeška, DrSc. 1; Radiodiagnostická klinika, FN Plzeň-Lochotín, LF UK v Plzni, přednosta: doc. MUDr. B. Kreuzberg, CSs. 2
Published in: Rozhl. Chir., 2007, roč. 86, č. 2, s. 97-101.
Category: Monothematic special - Original
Overview
Úvod:
Resekce jater pro maligní onemocnění nejsou v současné době limitovány technickými možnostmi, ale fyziologickými rezervami zbytkového jaterního parenchymu. Embolizace portální žíly (PVE – portal vein embolization) umožňuje zvýšit zbytkový parenchym jater po jaterní resekci (FLRV – future liver remnant volume) a tím rozšířit možnosti jaterní chirurgie. Autoři hodnotí skupinu pacientů, kteří podstoupili PVE a srovnávají ji se skupinou pacientů, kteří podstoupili resekci jater bez provedení předchozí PVE.Metodika:
Na Chirurgické klinice a Radiodiagnostické klinice FN Plzeň-Lochotín a LF UK Plzeň byla v období 1/2001 až 8/2006 provedena úspěšně PVE u 24 pacientů. Nárůst FLRV byl dostatečný u 17 pacientů. Průměrná doba mezi provedením PVE a CT volumetrie jater byla 29 dní. Průměrná doba mezi provedením PVE a chirurgickým výkonem byla 54 dní. Osm pacientů podstoupilo radikální chirurgický výkon (pravostranná hepatektomie, rozšířená pravostranná hepatektomie, kombinace pravostranné hepatektomie s radiofrekvenční ablací v levém laloku), u 3 pacientů byla provedena radiofrekvenční ablace. U zbývajících pacientů byla provedena jen explorativní laparotomie s nálezem progrese maligního onemocnění v játrech. K porovnání byl použit soubor 107 pacientů, kteří podstoupili jednostupňovou operaci jater pro malignitu.Výsledky:
Jednoleté celkové přežití po provedení jaterní operace s předchozí PVE bylo 85,7 %, tříleté pak 42,9 %. Bezpříznakové přežití (DFI – disease free interval) bylo statisticky hodnoceno jen pro skupinu radikálně operovaných pacientů. Jednoleté DFI bylo 40 %, dvouleté DFI pak 20 %. Ve skupině pacientů bez provedení PVE bylo jednoleté celkové přežití 78,9 %, tříleté pak 34,0 %, jednoleté DFI 60,2 %, dvouleté DFI pak 36,6 %. Počet ošetřených lézí nebyl prokázán jako statisticky významný faktor, který by ovlivňoval DFI či celkové přežití.Diskuse:
Celkové přežití bylo vyšší ve skupině pacientů s provedenou PVE, zatímco DFI bylo zkráceno v téže skupině. PVE rozšiřuje možnosti jaterních resekcí u pacientů s malým FLRV před resekcí a umožňuje provedení radikálního resekčního výkonu u pacientů, kteří byli dříve ponecháni paliativní chirurgické léčbě či onkologické terapii.Klíčová slova:
nádory jater – embolizace portální žíly – resekce jater – RFA jater – DFI – přežívání nemocnýchÚVOD
Resekce jater pro maligní onemocnění nejsou v současné době limitovány technickými možnostmi, ale fyziologickými rezervami zbytkového jaterního parenchymu (FLRV – future liver remnant volume). Od některých resekčních výkonů se upouští z důvodu příliš malého FLRV, který vystavuje pacienta riziku pooperačního akutního jaterního selhání s častými fatálními následky. Embolizace portální žíly (PVE – portal vein embolization) umožňuje zvýšit tento zbytkový parenchym jater a tím rozšířit možnosti jaterní chirurgie.
Tato metoda je založena na pozorování, které provedl v roce 1920 Rous, který po ligaci jedné větve portální žíly psa pozoroval ipsilaterální atrofii a kontralaterální hypertrofii jaterního parenchymu [1]. Vysvětlení tohoto efektu bylo objasněno až v roce 1973 Starzlem [2], který předpokládal v portální krvi výskyt stimulujících hepatotrofických faktorů nezbytných pro udržení trofiky jaterního parenchymu a to ať už se jedná o výživné látky (lipidy, glycidy…) či látky hormonální či cytokinové povahy. Atrofie jaterního laloku ipsilaterálního s PVE je realizována apoptózou a nikoliv nekrózou, což má velký význam pro snížení zátěže organismu případnou zánětlivou reakcí [3, 4]. První klinické použití tohoto efektu publikoval Makuuchi teprve v roce 1984 [5, 6]. Tato metoda se během devadesátých let stala nedílnou součástí jaterní chirurgie a umožňuje provádět rozsáhlé resekční výkony na jaterním parenchymu a to nejen při embolizaci laloku s maligním procesem, ale i v kombinaci s předchozím operačním ošetřením (metastazektomie, radiofrekvenční ablace – RFA) maligních ložisek v kontralaterálním laloku jater [7].
Její provedení je indikováno pokud je FLRV menší než 25–30 % [8, 9] u zdravého parenchymu, u postiženého např. jaterní steatózou či v terénu jaterní cirhózy je třeba počítat s minimálně 40% FLRV [10]. Podobně je třeba se zachovat i v případě operace následující časně po chemoterapii [11]. Průměrný nárůst objemu je 10–14 % z celkového objemu jater (TLV – total liver volume) v prvních 2–4 týdnech [11, 12, 13, 14, 15]. Současně probíhající atrofie embolizovaného laloku odpovídá poklesu objemu o 10 % [3, 11, 13]. Pro vypočtení ideálního TLV v případě rozsáhlého ipsilaterálního postižení jaterního parenchymu maligním procesem před provedením PVE, kdy je těžké zhodnotit skutečně funkční odstraňovaný parenchym, je možné použít rovnici TLV = 706,2 x BSA (m2) + 2,4 (cm3) (BSA – body surface area, povrch těla) [16].
PVE se provádí buďto perkutánně transhepatální sondáží větve portální žíly nebo je možno provést kanylaci portálního kmene operačně přes ileokolickou žílu, kdy je předpokládaná větev (nejčastěji pravá) portální žíly vyplněna embolizujícím materiálem (Histoacryl, Gelfoam, Lipiodol, Cyanoacrylate, Urografin, fibrinové lepidlo, titanové spirálky, mikrosféry) [17]. Modifikací je taktéž ligace předpokládané větve portální žíly peroperačně, která ovšem nemá podle některých autorů takovou úspěšnost hypertrofie kontralaterálního jaterního laloku [18]. Vysvětlením může být rekanalizace řečiště z portálních kolaterál či částečně proplnění portálního řečiště z arteriovenózních spojek. Navíc tato metoda zatěžuje nemocného celkovou anestezií a komplikuje definitivní výkon na játrech pooperačními změnami v podjaterní krajině. Maximum regenerace je dosaženo v prvním týdnu, 70–80 % celkového nárůstu hypertrofie je dosaženo v prvních 4 týdnech, fakticky je hypertrofie dokončena po 4–5 týdnech [19].
Autoři hodnotí skupinu pacientů, kteří podstoupili PVE a srovnávají ji se skupinou pacientů, u kterých byla provedena resekce jater bez předchozí PVE.
SOUBOR PACIENTŮ A POUŽITÉ METODY
Na Chirurgické a Radiodiagnostické klinice FN a LF UK Plzeň-Lochotín byla v období 1/2001 až 8/2006 provedena úspěšně PVE u 24 pacientů. U 21 pacientů byla PVE provedena transhepatální cestou a u 3 pacientů přes v. ileocolica při laparotomii či ze střídavého řezu v pravém podbřišku a to pokud byla předchozí transhepatální cesta neúspěšná. Vždy byl použit Histoacryl k vyplnění embolizované větve portální žíly (Obr. 1, 2). Nikdy nebyl výkon provázen fatální nebo významnou komplikací. U 20 pacientů se jednalo o jaterní metastázy kolorektálního karcinomu, u 2 pacientů o hepatocelulární karcinom. Jedenkrát se jednalo o metastázu karcinomu žaludku a metastázu nejasného origa vzhledem k pokročilosti karcinomu při radikální operaci základního onemocnění, kdy nebylo možné rozhodnout (z klinického a histopatologického nálezu) blíže o lokalizaci primární malignity (metastáza karcinomu ovaria či kolorektálního karcinomu). Při rozdělení pacientů podle pohlaví převažovali muži (14 pacientů) proti 10 ženám (58,3 % : 41,7 %). Průměrný věk pacientů při PVE byl 62,4 roku (29–76 let). V jednom případě byla PVE a následná resekce jater provedena i přes přítomnost extrahepatálního ložiska malignity. Plicní metastáza pak byla úspěšně ošetřena ve druhé době. V období mezi provedením PVE a operací nebyla podávána ani lokální ani systémová chemoterapie.
Image 1. DSA snímek po úspěšném provedení pravostrannéPVE Histoacrylem Pic. 1. A DSA view following successful completion of the right-sided PVE using Histoacryl 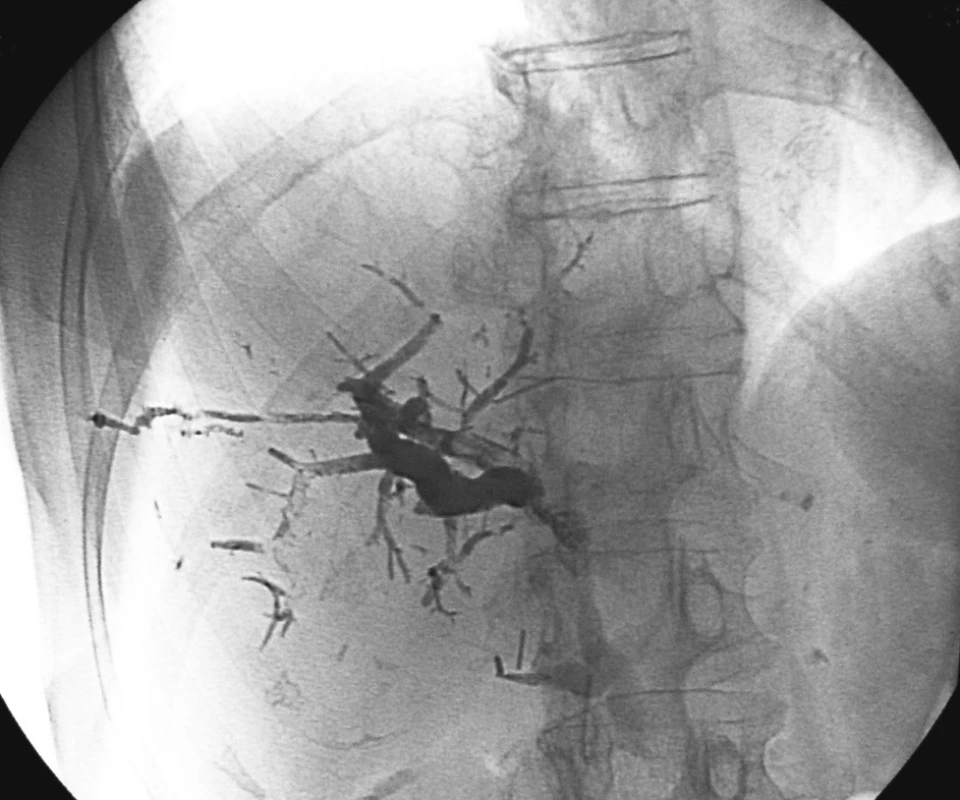
Image 2. CT-portogram po úspěšném provedení pravostranné PVE Histoacrylem Pic. 2. CT-portogram following successful completion of the right-sided PVE using Histoacryl 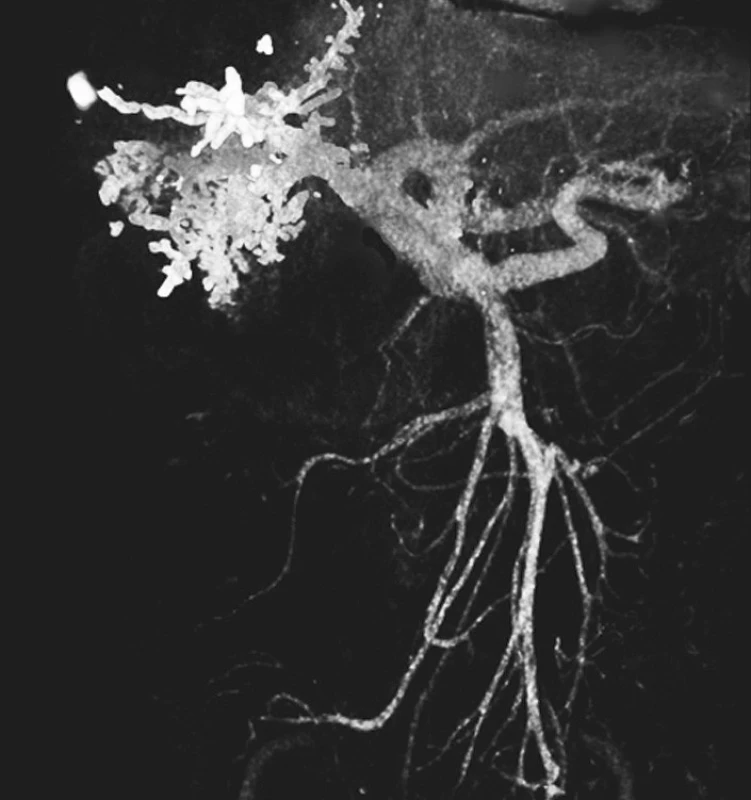
Nárůst FLRV byl dostatečný u 17 pacientů dle prováděné CT volumetrie (Obr. 3). Průměrná doba mezi provedením PVE a CT volumetrie jater byla 29 dní. Průměrná doba mezi provedením PVE a chirurgickým výkonem byla 54 dní. Jako hranici pro resekci jsme předpokládali FLRV min. 30% TLV po odečtení objemu masy maligního ložiska. U 7 pacientů (29,2 %) nedošlo buďto k žádné nebo nedostatečné hypetrofii kontralaterálního jaterního laloku a bylo tedy pro malou FLRV odstoupeno od resekčního výkonu a pacienti byli předání k další onkologické léčbě. Osm pacientů (33,3 %) podstoupilo radikální chirurgický výkon (pravostranná hepatektomie, rozšířená pravostranná hepatektomie, kombinace pravostranné hepatektomie s radiofrekvenční ablací v levém laloku), u 3 pacientů (12,5 %) byla provedena radiofrekvenční ablace. U zbývajících pacientů výkon skončil vzhledem k progresi maligního onemocnění v játrech jen explorativní laparotomií (25 %). Bylo ošetřeno 1 až 8 jaterních lézí. K porovnání byla použita starší zatím nepublikovaná data [20], týkající se souboru 107 pacientů, kteří podstoupili jednostupňovou radikální operaci jater pro metastatický proces KRCa etilogie v identickém období.
Image 3. CT volumetrie po PVE Pic. 3. CT volumetry following PVE 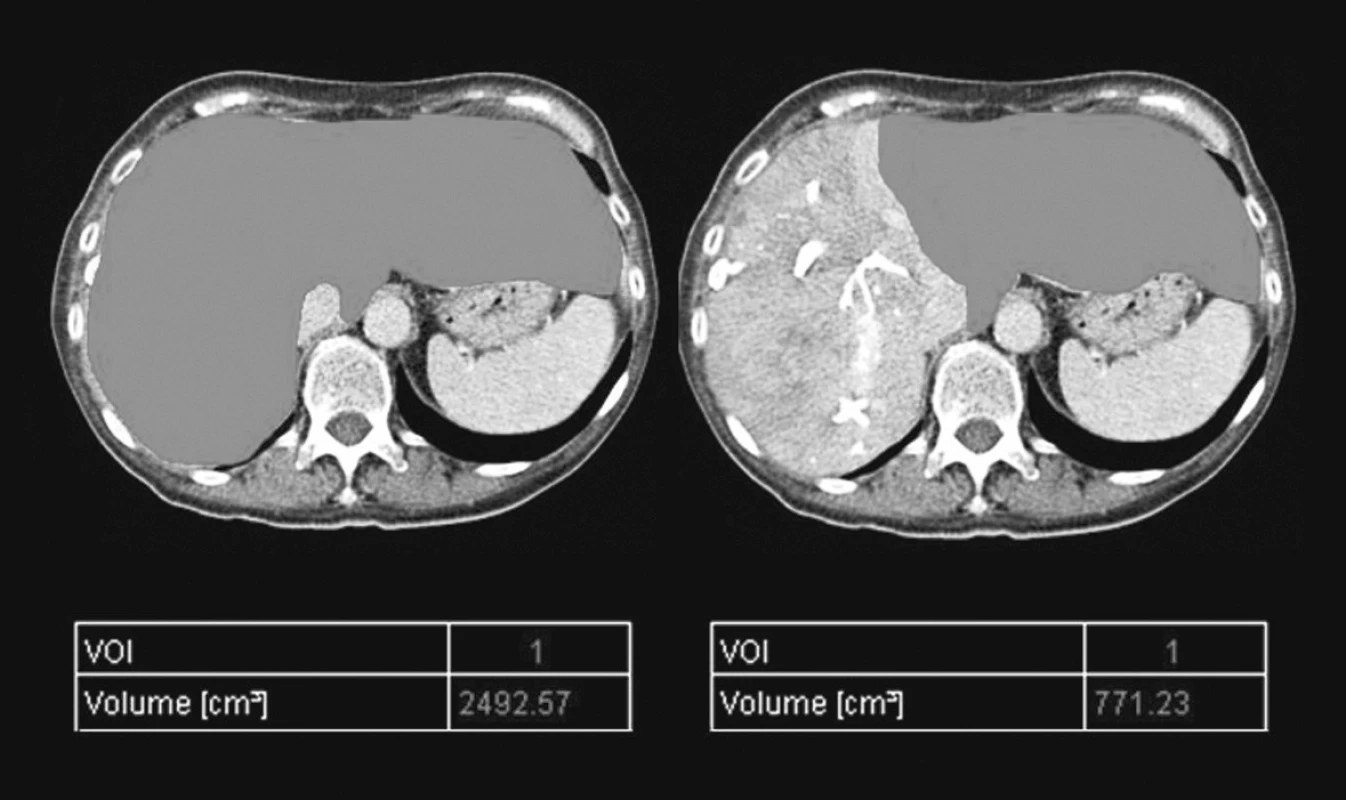
Pro zhodnocení celkového přežití a DFI (disease free interval) byla použita Kaplanova-Meierové metoda. Zhodnocení statistické významnosti sledovaných parametrů bylo provedeno Log-rank testem a Wilcoxonovým testem. K statistické analýze dat byl použit program S.A.S. version 6.12 (Statistical Analysis Software, Inc.).
VÝSLEDKY
Bezpříznakové přežití (DFI – disease free interval) bylo statisticky hodnoceno jen pro skupinu radikálně operovaných pacientů. Jednoleté DFI bylo 40 %, dvouleté DFI pak 20 % (Obr. 4). Počet ošetřených lézí nebyl prokázán jako statisticky významný faktor, který by ovlivňoval DFI či celkové přežití. Ve skupině pacientů bez provedení PVE bylo jednoleté celkové přežití 78,9 %, tříleté pak 34,0 %, jednoleté DFI 60,2 %, dvouleté DFI pak 36,6 %. Jednoleté celkové přežití po provedení jaterní operace s předchozí PVE bylo 85,7 %, tříleté pak 42,9 % (Obr. 5).
Image 4. Srovnání DFI u pacientů po provedení jen radikální resekce jaterní malignity a v kombinaci po předchozí PVE Pic. 4. Comparison of DFIs in patients following radical resection of the liver malignancy and its combination with preceding PVE 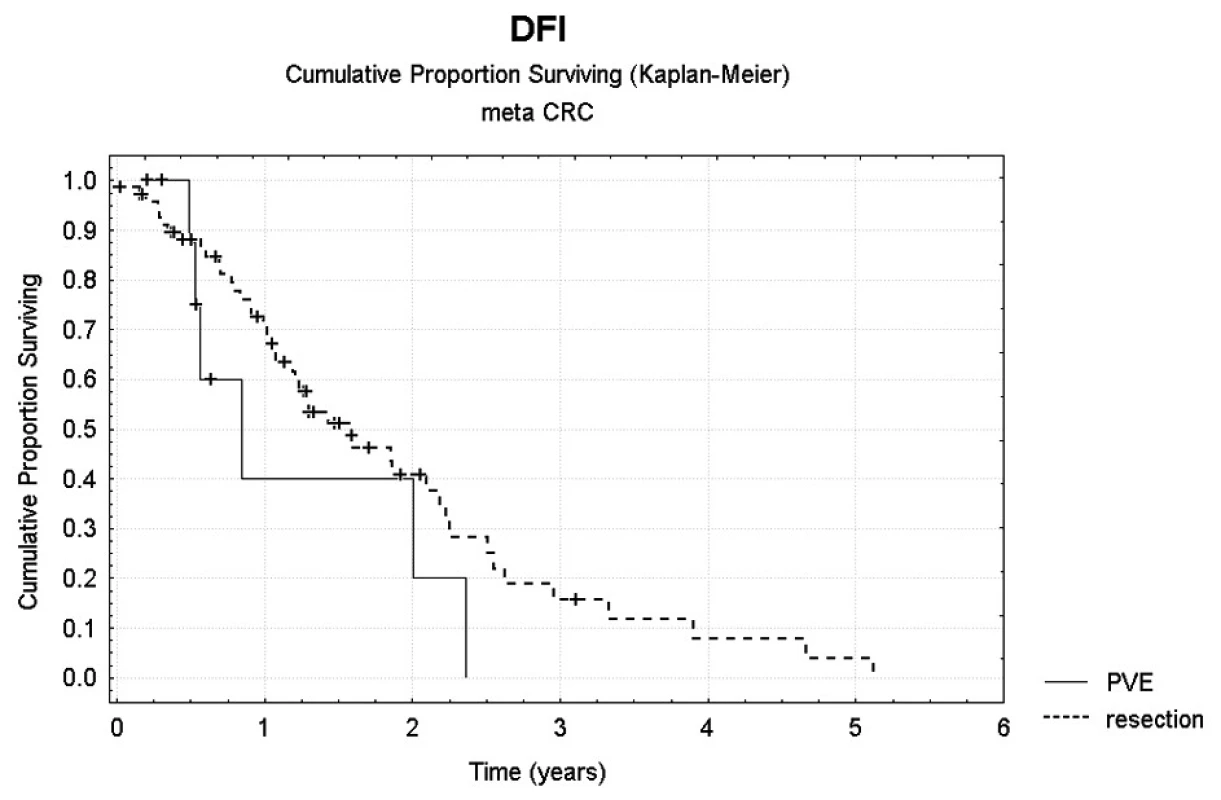
Image 5. Srovnání celkového přežití u pacientů po provedení jen radikální operace jater a v kombinaci po předchozí PVE Pic. 5. Comparison of overall survival rates in patients who underwent radical liver surgery and its combination with preceding PVE 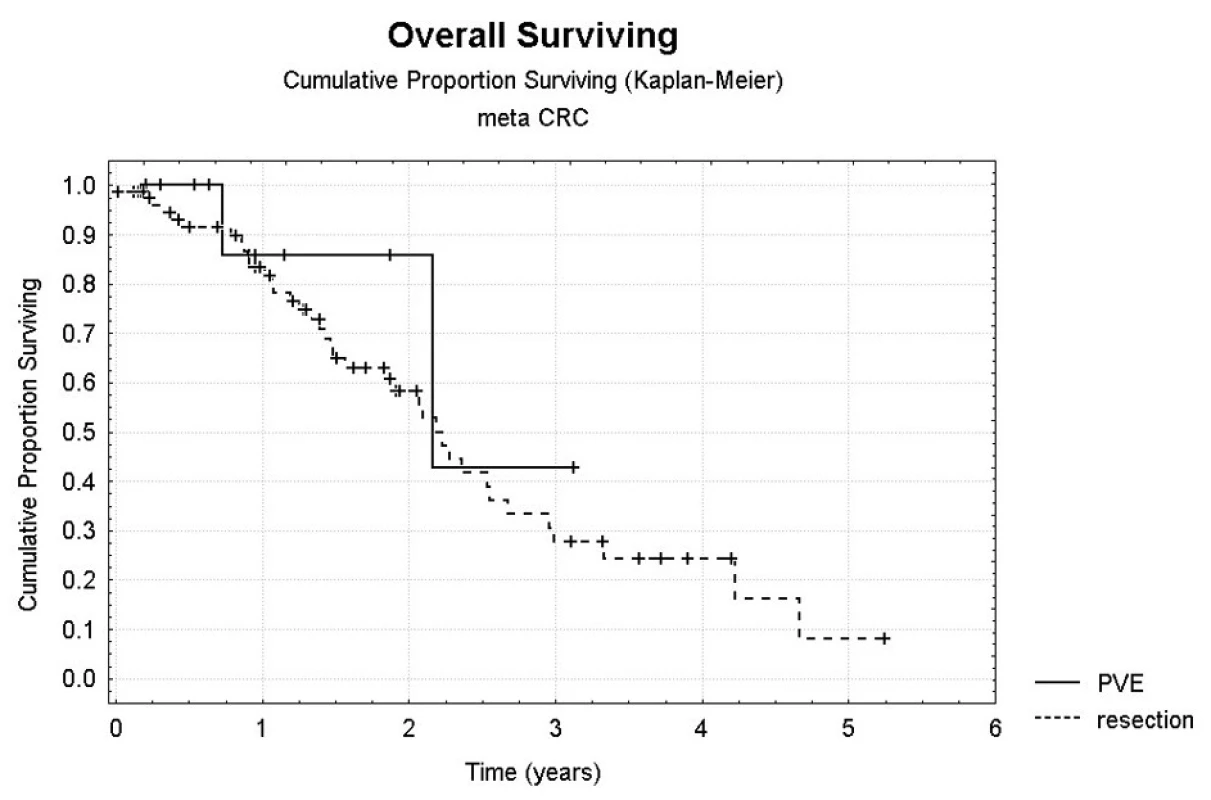
DISKUSE
V našem souboru bylo celkové přežití vyšší ve skupině pacientů s provedenou PVE, zatímco DFI bylo sníženo v téže skupině v porovnání se skupinou pacientů po provedení radikální operace jater pro metastatický proces KRCa etiologie.
Načasování CT volumetrie a následné operace je udáváno v rozmezí 3–9 týdnů [12, 14]. Provedení PVE není určující podmínkou pro provedení následné resekce, jelikož během období mezi provedením PVE a resekcí dochází často k progresi onemocnění a taktéž je nutno brát v úvahu chybu zobrazovacích metod při diagnostice rozsahu onemocnění. V obdobných souborech se udává úspěšnost operace po provedení PVE v rozmezí 36–96 % [12, 14, 21]. Vysvětlením je buď nedostatečná hypetrofie FLRV nebo progrese maligního procesu jater. Harada provedl multivariační analýzu, z které vyplývají diabetes melitus (nedostatek hepatotropního inzulinu), zvýšený sérový bilirubin a mužské pohlaví jako nezávislé faktory asociované se sníženou kontralaterální hypertrofií jaterního parenchymu po PVE [22]. Nanashima uvádí negativní korelaci sérové hladiny alkalické fosfatázy s atrofií embolizovaného laloku a pozitivní korelaci hodnoty trombocytů s hypetrofií kontralaterálního laloku [23]. Rychlost portálního toku a také hladina transforming growth faktoru alfa (TGF alpha) je satisticky signifikantně korelovatelná s hypertrofií [24].
Vedlejší symptomatologiíí po provedení PVE jsou obvykle teplotní špičky, nauzea, bolesti v pravém podžebří. Taktéž je zaznamenána elevace jaterních testů a sérového bilirubínu [11, 12, 14]. Normalizace jaterních testů a sérové hladiny bilirubínu je zpravidla dosaženo před provedením CT volumometrie v úplné shodě s předpokládaným ukončením hypetrofie jater a tedy i regenerace funkční kapacity jaterního parenchymu. Komplikace ve smyslu mortality a významnější morbidity (hemobilie, sepse, trombóza kmene či kontralaterální větve portální žíly, přechodné jaterní selhání, hemoperitoneum, subkapsulární hematom…) je popisována u 5–24 % pacientů [8, 21].
Někteří autoři kombinují ligaci větve portální žíly pro pravý lalok s konkomitantní selektivní intra-arteriální chemoterapií při downstagingu inoperabilního metastatického procesu kolorektální etiologie [18] a u 36,4 % pacientů docilují regrese nálezu dostatečné k radikální resekci. Tento postup je však stále předmětem diskusí z hlediska jeho skutečného efektu.
Gruttadauria předkládá studii kombinující PVE s ipsilaterální embolizací větve hepatální arterie, která sice přináší nevýhody spojené s nekrózou v embolizovaném jaterním parenchymu, ale fakticky zastavuje růst malignity v období mezi PVE a operací [25], kdy je předpokládána významná indukovaná proliferační aktivita nejen v hypertrofujícím laloku jater, ale i maligním ložisku, které je právě zásobeno arteriální krví [7]. Tyto závěry vyvrací Vetelainen, který na zvířecím modelu neprokazuje význam doplnění ligatury větve portální žíly ještě uzávěrem ipsilaterální větve hepatální arterie pro hypertrofii kontralaterálního jaterního laloku. Naopak poukazuje na nebezpečí vyplývající z důsledků vzniklé nekrózy [26]. Goere doplňuje PVE v období do operace systémovou chemoterapií a neprokazuje zde negativní vliv na hypertrofii, naopak tento postup zastavuje předpokládanou akceleraci růstu malignity po PVE [27].
Ogata kombinuje PVE se selektivní transarteriální chemoebolizací (TACE) u nemocných s hepatocelulárním karcinomem při jaterní cirhóze. Zaznamenává signifikantně zvýšený nejen nárůst FLRV, ale i celkového přežití a DFI u těchto nemocných ve srovnání s provedením jen PVE [28]. Tímto downstagingem maligních procesů jater lze docílit až dvojnásobný nárůst resekability [29].
U experimentálního modelu imitujícího PVE u prasat dosáhla replikace hepatocytů vrcholu 7. den, kdy byla proliferační aktivita zachycena u 14 % hepatocytů a návrat do klidového stadia, tedy dokončení hypertrofie, bylo zaznamenáno 12. den [30]. Ve srovnání s regenerací jater po resekci, která dosahovala 70 % jater u psa a mitotický index kulminoval 3.-4. den, je restituce objemu jater po PVE pomalejší [31].
ZÁVĚR
PVE rozšiřuje možnosti jaterních resekcí u pacientů s nedostatečným FLRV před resekcí a umožňuje provedení radikálního resekčního výkonu u pacientů, kteří byli dříve ponecháni paliativní chirurgické léčbě či onkologické terapii. Tím prodlužuje celkové přežití a DFI těchto pacientů.
Je důležitou součástí etapových chirurgických výkonů.
Práce byla podpořena granty IGA MZ CR 8860/1-3 a IGA MZ CR 8301-3 a výzkumným záměrem MSM 0021620819.
MUDr. V. Liška
Chirurgická klinika LF UK a FN
Alej Svobody 80
304 00 Plzeň
e-mail.: liska@fnplzen.cz
Sources
1. Rous, P., Larimore, L. D. Relation of the portal flow to liver maintenance. A demonstration of liver atrophy conditional on compensation. J. Exp. Med., 1920, 31 : 609–632.
2. Starzl, T., Francavilla, A., Halgrimson, C. The origin, hormonal nature, and action of hepatotrophic substances in portal venous blood. Surg. Gynecol. Obstet, 1973, 137 : 179–199.
3. Imamura, H., Shimada, R., Kubota, M. Preoperative portal vein embolization: An audit of 84 patients. Hepatology, 1999, 29 : 1099–1105.
4. Komori, K., Nagino, M., Nimura, Y. Hepatocyte morphology and kinetics after portalvein embolization. Br. J. Surg., 2006, 93 : 745–751.
5. Makuuchi, M., Thai, B.L., Takayasu, K., Takayama, T., Kosuge, T., Gunven, P. Preoperative portal embolization to increase safety of major hepatectomy for hilar bile duct carcinoma: A preliminary report. Surgery, 1990, 107 : 521–527.
6. Makuuchi, M., Takayasu, K., Takayama, T. Preoperative transcatheter embolization of portal venous branch for patient receiving extended lobectomy du to the bile duct carcinoma. J. Jpn. Soc. Clin. Surg., 1984, 45 : 14–20.
7. Elias, D., de Baere, T., Roche, A., Ducreux, M., Leclere, J., Lasser, P. During liver regenration following righ portal embolization the growth rate of liver metastases is more rapod than that of the liver parenchyma. Br. J. Surg., 1999, 86 : 784–788.
8. Abdalla, E. K., Hicks, M. E., Vauthey, J. N. Portal vein embolization: Rationale, technique and future prospects. Br. J. Surg., 2001, 88 : 165–175.
9. Hemming, A. W., Reed, A. I., Howard, R. J. Preoperative portal vein embolization for extended hepatectomy. Ann. Surg., 2004, 237 : 686–693.
10. Kubota, K, Makuuchi, M, Kusaka, K. Measurement of liver volume and hepatic functional rserve as a guide to decision-making in resectional surgery for hepatic tumors. Hepatology, 1997, 26 : 1176–1181.
11. de Baere, T., Roche, A., Elias, D., Lasser, P., Lagrange, C., Bousson, V. Preoperative portal vein embolization for extension of hepatectomy indications. Hepatology, 1996, 24 : 1386–1391.
12. Azoulay, D., Castaing, D., Smail, A., Adam, R., Cailliez, V., Laurent, A., Lemoine, A., Bismuth, H. Resection of non-resectable liver metastases from colorectal cancer after percutaneus portal vein embolization. Ann. Surg., 2000, 4 : 480–486.
13. Elias, D., Ouellet, J. F., de Baere, T., Lasser, P., Roche, A. Preoperative selective portal vein embolization before hepatectomy for liver metastases: long term results and impact on survival. Surgery, 2002, 131 : 294–299.
14. Kokudo, N., Tda, K., Seki, M., Ohta, H., Azekura, K, Ueno, M., Ohta, K., Yamaguchi, T., Matsubara, T., Nakajima, T., Muto, T., Ikari, T., Yanagisawa, A., Kato, Y. Proliferative activity of intrahepatic colorectal metastases after preoperative hemihepatic portal vein embolization. Hepatology, 2001, 34 : 267–272.
15. Tarazov, P. G., Granov, D. A., Sergeev, V. I., Polikarpov, A. A., Polysalov, V. N., Rozengauz, E. V. Preoperative portal vein embolization for liver malignancies. Hepatogastroenterology, 2006, 53 : 566–570.
16. Urata, K., Kawasaki, S., Matsunami, H., Hashikura, Y., Ikegami, T., Ishizone, S. Calculation of child and adult standard liver volume for liver transplantation. Hepatology, 1995, 21 : 317–321.
17. Fusai, G., Davidson, B. R. Strategies to increase the resectability of liver metastases from colorectal cancer. Dig. Surg., 2003, 20 : 481–496.
18. Selzner, N., Pestalozzi, B. C., Kadry, Z., Selzner, M., Wildermuth, S., Clavien, P. A. Downstaging colorectal liver metastases by concomitant unilateral portal vein ligation and selective intra-arterial chemotherapy. Br. J. Surg., 2006, 93, 587–592.
19. Joyeux, H., Collet, H., Saint-Aubert, B., Faurous, P., Peraldi, D., Liu, Y, Domergue, J., Foucou, B., Solassol, C. Mise au point par gammatographie computerisée d@un index pondéral hépatique au cours de la régénération du foie. Gastroénterol. Clin. Biol., 1984, 8 : 507–511.
20. Třeška, V. 2006 – zatím nepublikovaná data
21. Stefano, D., de Baere, T., Denys, A., Gorin, G., Gillet, M. Preoperative percutaneus portal vein embolization: evaluation of adverse events in 188 patients. Radiology, 2005, 234 : 625–630.
22. Harada, H., Imamura, H., Miyagawa, S., Kawasaki, S. Fate of human liver after hemihepatic portal vein embolization: Cell kinetic and morphometric study. Hepatology, 1997, 26 : 1162–1170.
23. Nanashima, A., Sumida, Y, Shibasaki, S., Takeshita, H., Hidaka, S. Parameters associated with changes in liver volume in patients undergoing portal vein embolization. J. Surg. Res., 2006, 133 : 95–101.
24. Kusaka, K, Imamura, H., Tomiya, T., Makuuchi, M. Factors affecting regeneration after portal vein embolization. Hepatogastroenterology, 2004, 51 : 532–535.
25. Gruttadauria, S., Luca, A., Mandala, L., Miraglia, R., Gridelli, B. Sequential preoperative ipsilateral portal and arterial embolization in patients with colorectal liver metastases. World J. Surg., 2006, 30 : 576–578.
26. Vetelainen, R., Dinant, S., van Vliet, A., van Gulik, T. M. Portal vein ligation is as effective as sequential portal vein and hepatic artery ligation in inducing contralateral liver hypertrophy in rat model. J. Vasc. Interv. Radiol., 2006, 17 : 1181–1188.
27. Goere, D., Farges, O., Leporrier, J., Sauvanet, A., Vilgrain, V., Belghiti, J. Chemotherapy does not impair hyertrophy of the left liver after right portal vein obstruction. Gastrointest. Surg., 2006, 10 : 365–370.
28. Ogata, S., Belghiti, J., Farges, O., Varma, D., Sibert, A., Vilgrain, V. Sequential arterial and portal vein embolization before right hepatectomy in patients with cirhosis and hepatocellular carcinoma. Br. J. Surg., 2006, 93 : 1091–1098.
29. Bismuth, H., Adam, R., Levi, F., Farabos, C., Waechter, F., Castaing, D. Resection of nonresectable liver metastases from colorectal cancer after neoadjuvant chemotherapy. Ann. Surg., 1996, 224 : 509–522.
30. Duncan, J. R., Hicks, M. E., Cai, S. R., Brunt, E. M., Ponder, K. P. Embolization of portal vein branches induces hepatocyte replication in swine: a potential step in gene therapy. Radiology, 1999, 210 : 467–477.
31. Sigel, B., Pechet, G., Que, M. Y., MacDonald, R. A. Trittiated thymidine autoradiography in the regenerating liver of the dog. J. Surg. Res., 1965, 45 : 72–78.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2007 Issue 2-
All articles in this issue
- Interhemisferický subdurální hematom
- Izolované aneuryzmy arteria iliaca interna
- Embolická komplikace léčby poskatetrizačního pseudoaneuryzmatu arteria femoralis perkutánní trombotizací. Kazuistika
- Endovenózní laserová fotokoagulace insuficientní safény v experimentu
- Metastazektomie vícečetných plicních metastáz nízce diferencovaného synoviálního sarkomu
- Laparoskopická resekce jater
- Apendektómia – porovnanie výsledkov laparoskopickej a otvorenej techniky operácie
- Embolizace portální žíly – zvýšení resekability jater pro maligní onemocnění
- Biliární ileus – opomíjená příčina střevní obstrukce
- Laparoskopická diagnostika akutní ischemie střeva – první experimentální zkušenosti
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Biliární ileus – opomíjená příčina střevní obstrukce
- Apendektómia – porovnanie výsledkov laparoskopickej a otvorenej techniky operácie
- Metastazektomie vícečetných plicních metastáz nízce diferencovaného synoviálního sarkomu
- Izolované aneuryzmy arteria iliaca interna
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

