-
Medical journals
- Career
Laparoskopická diagnostika akutní ischemie střeva – první experimentální zkušenosti
Authors: J. Páral; A. Ferko; M. Plodr; P. Lochman; Z. Šubrt
Authors‘ workplace: Katedra chirurgie, Fakulta vojenského zdravotnictví Univerzity obrany, Hradec Králové, vedoucí katedry doc. MUDr. A. Ferko, CSc.
Published in: Rozhl. Chir., 2007, roč. 86, č. 2, s. 106-111.
Category: Monothematic special - Original
Overview
Cíl:
Cílem experimentální studie bylo ověřit možnosti laparoskopické diagnostiky akutní ischemie střeva za pomocí barviva fluoresceinu a ultrafialového (UV) světla.Metodika:
Do studie bylo v roce 2005 zařazeno pět experimentálních zvířat (prase domácí). V endotracheální anestezii byla vazograficky provedena embolizace periferní větve horní mezenterické tepny. Do laparoskopické sestavy byly zařazeny optické filtry generující UV světlo a umožňující snímat obraz v UV světle. Po intravenózním podání fluoresceinu byla provedena revize střeva. Hranice mezi vitálním a ischemickým střevem vymezená fluoresceinovou luminiscencí byla označena klipy.Výsledky:
Podařilo se prokázat, že laparoskopie v UV světle, po intravenózním podání fluoresceinu, dokáže spolehlivě odlišit vitální střevo od střeva ischemického.Závěr:
Kombinace UV světla a fluoresceinu dokáže spolehlivě odlišit vitální, prokrvené úseky střeva od úseků ischemických.Klíčová slova:
ischemie střeva – laparoskopie – fluorescein – ultrafialové světloÚVOD
Akutní ischemie střeva zůstává onemocněním s vysokou mortalitou. Ta se v současné době stále pohybuje v rozmezí 60 až 90 % [1, 2, 3]. Opožděná diagnostika je považována za hlavní faktor léčebných neúspěchů. Včasné rozpoznání a zhodnocení rozsahu ischemie je nejvýznamnějším aspektem úspěšné léčby [1, 2, 3, 4].
Laparoskopická diagnostika akutních břišních stavů, tedy i akutní ischemie střeva, nalézá stále častější uplatnění. Rovněž je akceptována jako bezpečná a úspěšná metoda pro „second look” kontrolu [5, 6, 7, 8, 9]. V časných stadiích ischemie nemusí být, při běžné laparoskopii, ischemické změny střevní stěny makroskopicky patrné. Tento nedostatek prosté laparoskopie může odstranit laparoskopie v ultrafialovém světle (UV) po podání barviva fluoresceinu, ta dokáže ischemické změny zobrazit již v nejčasnějším stadiu [10, 11].
CÍLE STUDIE
- Vypracovat model akutní střevní ischemie na podkladě selektivní endoluminální embolizace periferní větve horní mezenterické tepny.
- Ověřit možnosti laparoskopické diagnostiky akutní střevní ischemie za pomocí barviva fluoresceinu a dlouhovlnného ultrafialového světla generovaného optickými filtry.
- Připravit výchozí podklady k využití metody v klinické praxi.
METODIKA
Do studie bylo v roce 2005 zařazeno šest experimentálních zvířat – prase domácí, samice, průměrná hmotnost 52,7 kg. Experimenty byly prováděny ve shodě se Zákonem na ochranu zvířat proti týrání č. 246/92 Sbírky v platném znění. Experimenty byly schváleny Oborovou komisí Fakulty vojenského zdravotnictví UO a Lékařské fakulty UK v Hradci Králové.
V den operačního výkonu byla pokusným jedincům vysazena potrava. Po premedikaci ketamínem 15 mg/kg i.m. (Narkamon, Zentiva, Praha, ČR), azaperonem 1,0 mg/kg i.m. (Stresnil, Janssen, Beerse, Belgie) a atropinem 0,02 mg/kg i.m. (Atropin, Hoechst-Biotika, Martin, Slovensko), byla do periferní žíly zavedena kanyla k zajištění žilního vstupu. Za použití Müllerova laryngoskopu s dlouho lžící byla provedena orotracheální intubace. Po zajištění dýchacích cest bylo zvíře relaxováno pipecuroniem 40 Ķg/kg i.v. (Arduan, Budapešť, Gedeon Richter, Maďarsko) a po připojení k ventilačnímu přístroji ventilováno řízenou objemovou ventilací.
Celková sedace byla udržována titračně, podle efektu, kombinací midazolamu 0,05–0,1 mg/kg/h i.v. (Dormicum, Roche, Praha, ČR) a propofolu v (Diprivan, Astra Zeneca, Cheshire, Velká Británie) 2–4 mg/kg/hod. Analgezie byla zajištěna metamizolem (Novalgin, Aventis Pharma, Frankfurt n. M, Německo), kontinuálním podáváním 5 mg/kg/hod. Relaxace v průběhu operačního výkonu byla udržována pipecuroniem. Kombinací krystaloidů (Infusio Hartmanni, Medicamenta, Vysoké Mýto, ČR) 300 ml/h i.v. a koloidů (Hemohes 6%, Braun, Melsungen, Německo) byla zajištěna volumoterapie.
Po intubaci zvířete byla orogastricky zavedena žaludeční sonda. Krevní tlak byl monitorován invazivně, kanylací axilární tepny. Po celou dobu výkonu bylo monitorována saturace O2, EKG a ETCO2.
Do chirurgicky vypreparované femorální tepny byl z arteriotomie zaveden sheat 5 F s hemostatickou chlopní. Touto cestou byl do břišní aorty koaxiálně umístěn vodič a pomocí zahnutého katétru (DAV-catheter, Cook Medical, Bloomington, USA) a terumo vodiče 5 F (Terumo-Europe, Leuven, Belgie) byl za RTG kontroly nasondován kmen horní mezenterické tepny. Cestou DAV katétru byl do periferní větve horní mezenterické tepny, přes vodič (0,018 inch), umístěn mikrokatétr (Obr. 1). Vlastní embolizace byla provedena polyvinil-alkoholovými částicemi velikosti 180–300 ∝m (PVA-200, Cook Medical, Bloomington, USA) cestou mikrokatétru (Obr 2).
Image 1. Angiografie periferní větve horní mezenterické tepny Fig. 1. Angiography of peripheral branch of superior mesenteric artery 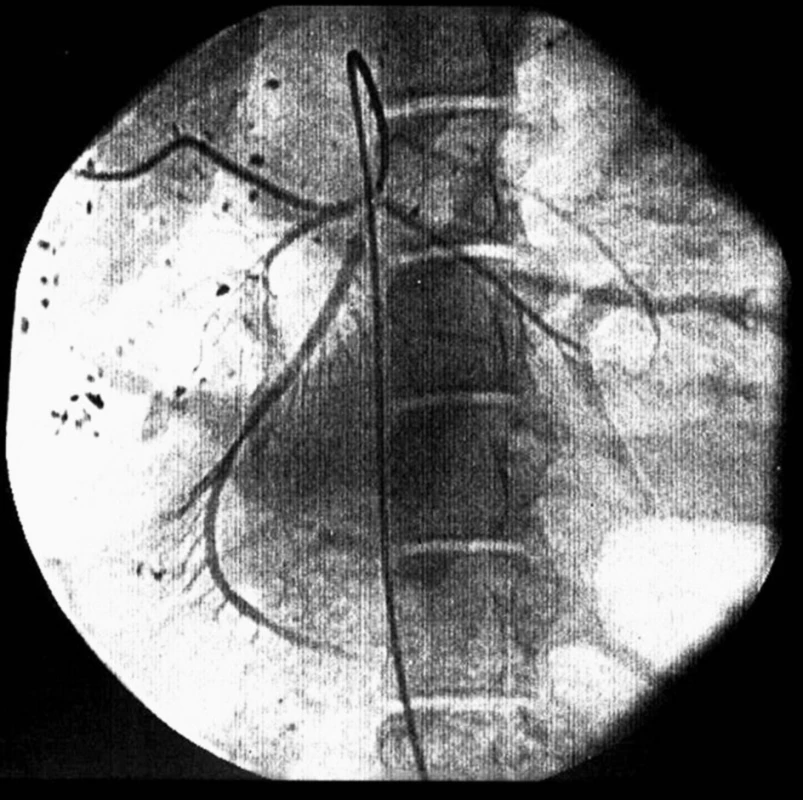
Image 2. Periferní větve horní mezenterické tepny po embolizaci polyvinil-alkoholovými částicemi Fig. 2. Peripheral branch of superior mesenteric artery after embolisation of polyvinyl alcohol particles 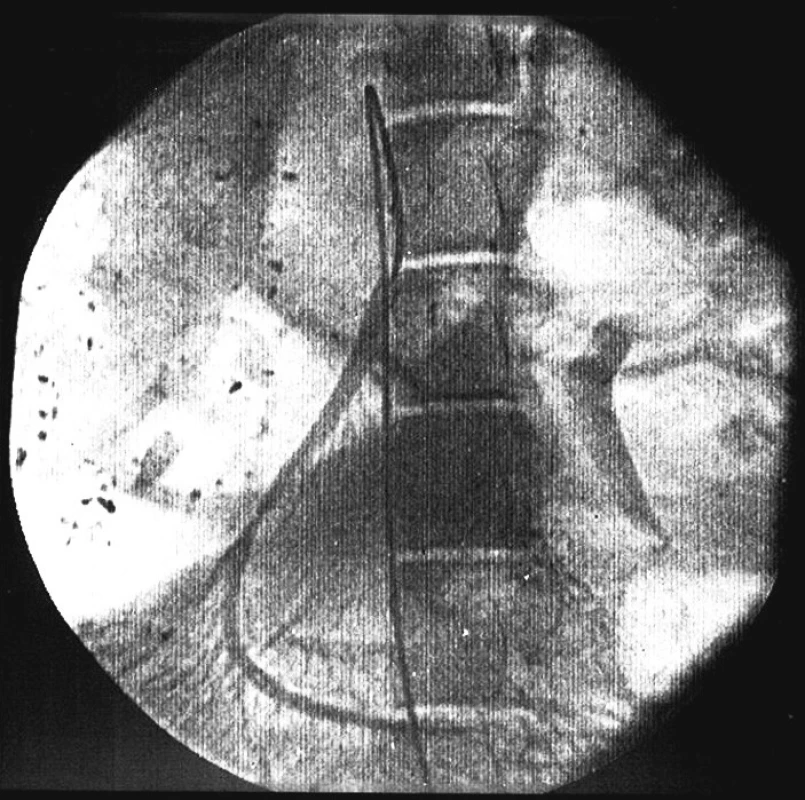
Následovala laparoskopická část experimentu. Řezem nad pupkem byla zavedena insuflační jehla a založeno kapnoperitoneum. Tímto řezem byl zaveden port 10 mm pro kameru a kamera. Dva pracovní porty 5 mm byly umístěny do levého mezogastria a středního hypogastria. Intraabdominální tlak CO2 byl udržován na 14 mm sloupce Hg.
Střevo bylo revidováno za pomocí Babcockových klíštěk od duodenojejunálního přechodu po ileocékální přechod. Tračník byl rovněž revidován v celém rozsahu. Pokud byla při prosté laparoskopii patrná hranice ischemie byla označena klipy. Následně byly do laparoskopické sestavy (Richard Wolf, Knittlingen, Německo) zařazeny dva optické filtry (Karl Storz – Endoskope, Tuttlingen, Německo) (Obr. 3) . Filtr generující UV světlo byl vložen mezi zdroj světla laparoskopické sestavy a světlovodný kabel, filtr umožňující snímat obraz v UV světle byl vložen mezi laparoskopickou optiku a hlavici laparoskopické kamery. Po intravenózním podání fluoresceinu (Fluorescite, Alcon-Courver, Puurs, Belgie) v dávce 15 mg/kg hmotnosti zvířete, byla provedena nová revize střeva v UV světle. Hranice mezi vitálním a ischemickým střevem byla na obou koncích označena klipy.
Image 3. Optické filtry (Karl Storz – Endoskope, Tuttlingen, Německo) Fig. 3. Optical filters (Karl Storz – Endoskope, Tuttlingen, Germany) 
Cestou laparotomie byla provedena resekce střeva ve zdravé vitální části 5 cm od hranice ischemie patrné po podání fluoresceinu. Z důvodu následující manipulace se střevem při histologickém vyšetření byly klipy nahrazeny stehy na mezenteriální straně střeva. Operační výkon byl ukončen utracením zvířete i. v. podáním preparátu T61 (Hoechst, Frankfurt n. M., Německo).
Resekované části střeva odebrané k histologickému vyšetření byly fixovány v 10% roztoku formalinu, zpracovány standardní parafinovou technikou a obarveny hematoxylinem-eozinem. Vyhotovená sklíčka byla prohlížená světelným mikroskopem.
VÝSLEDKY
Ve všech případech byl úspěšně vytvořen model akutní střevní ischemie na podkladě endoluminální embolizace periferní větve horní mezenterické tepny polyvinil-alkoholovými částicemi. Podařilo se prokázat, že laparoskopie v ultrafialovém světle, po intravenózním podání fluoresceinu, dokáže spolehlivě odlišit vitální střevo od střeva ischemického.
Zařazení optických filtrů do laparoskopické sestavy je technicky jednoduché a rychlé. Hranice ischemie byly při použití fluoresceinu a UV světla jasně a zřetelně patrné, vitální úseky střeva zářily zelenožlutou luminiscencí, ischemická část střeva měla v UV světle temnou, červenofialovou barvu (Obr. 4). Přechodová zóna mezi vitálním a ischemickým střevem byla ve všech případech krátkým úsekem v délce 1–2 cm, ve kterém došlo k barevnému přechodu od žlutozelené luminiscence do temné barvy nevitálního střeva (Obr. 5).
Image 4. Laparoskopický obraz v UV světle po podání fluoresceinu. Vitální segmenty střeva emitují žlutozelenou luminiscenci, ischemické segmenty mají barvu tmavě fialovou Fig. 4. Laparoscopic image under UV light after intravenous administering of fluorescien dye. Vital segments of bowel emit yellow green luminescence; ischemic segments have dark violet color 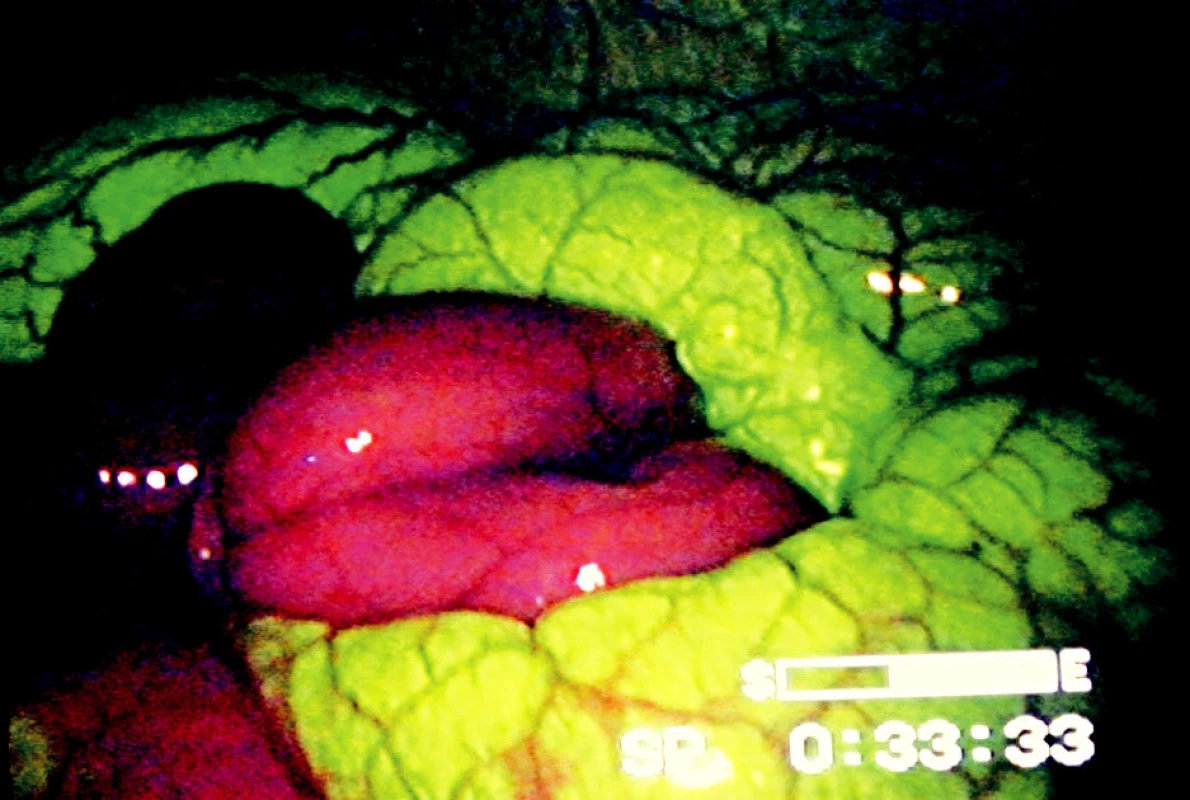
Image 5. Hranice ischemie střeva vymezená fluoresceinem a UV světlem Fig. 5. The border of intestinal ischemia marked by fluorescein dye and ultraviolet light 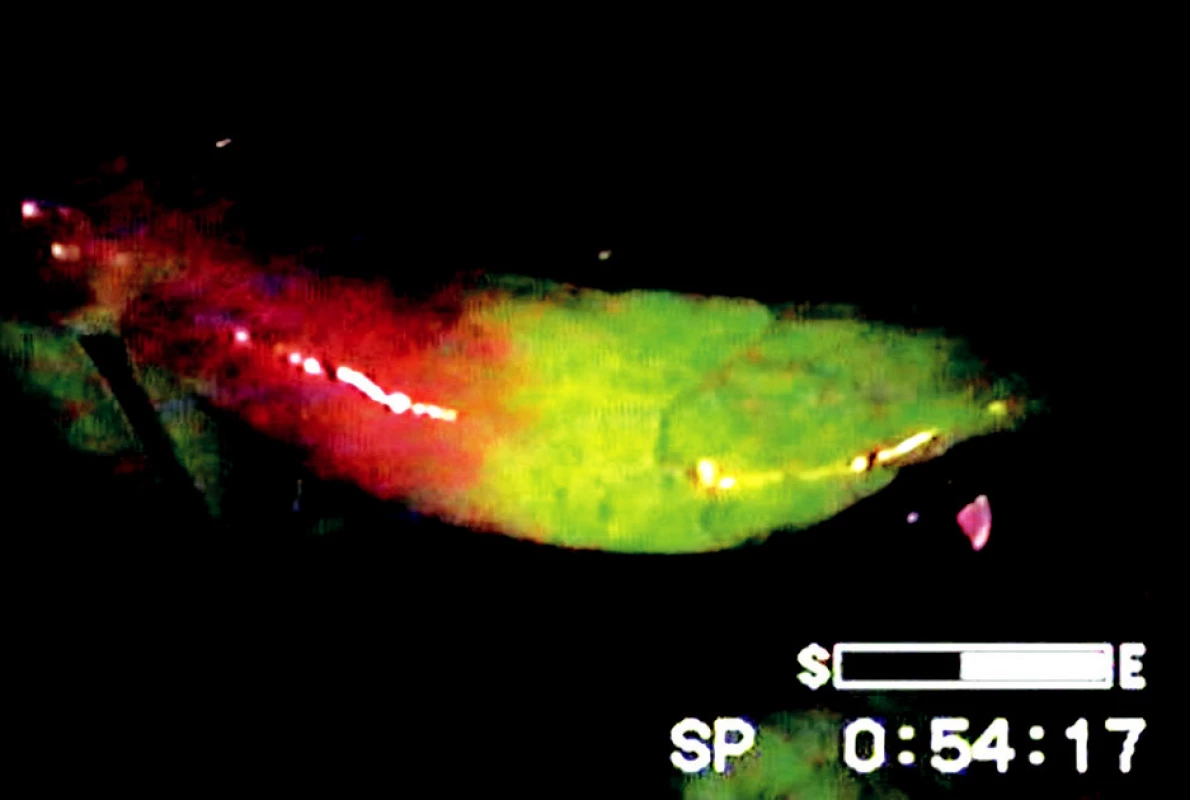
Fluorescein byl podán 55–75 min. (prům. 62 min.) po provedení embolizace periferní větve horní mezenterické tepny. V tomto krátkém časovém úseku byly hranice ischemie při prosté laparoskopii málo nebo téměř vůbec patrné (Obr. 6). Ke stanovení hranice ischemie při prosté laparoskopii musela být provedena postupná a velmi pečlivá revize celého střeva. Při laparoskopii v UV světle byly ischemické úseky jasně patrné do dvou minut po podání fluoresceinu.
Image 6. Hranice ischemie střeva v bílém světle při prosté laparoskopii Fig. 6. The border of intestinal ischemia during laparoscopy in white light 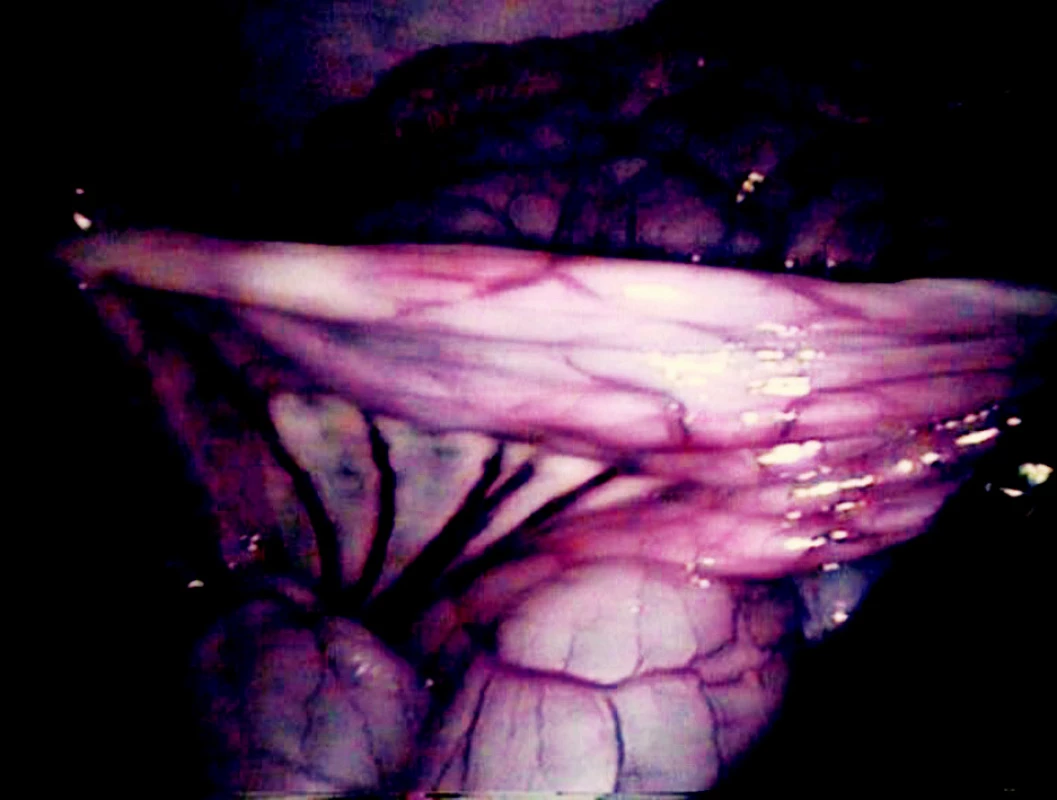
Mikroskopické hodnocení histologických preparátů ukázalo, že metoda dokáže odhalit rozvíjející se ischemii střeva ještě předtím, něž dojde k ischemickému poškození tkání střevní stěny. V preparátech střevní stěny nebyly světelnou mikroskopii zastiženy nekrózy a ischemické změny. Zánětlivé změny sliznice tenkého střeva rovněž nebyly zaznamenány. V některých vzorcích byla pozorována dilatace submukózních cév a slizničních kapilár (venostáza) různého stupně. V ischemizované části střeva, byly nalezeny zmnožené submukózní lymfatické agregáty.
Původní hypotéza předpokládala, že histologické vyšetření přispěje k potvrzení hranice ischemie označené klipy při laparoskopii v UV světle po podání fluoresceinu. Výsledky však ukázaly, že za dobu ischemie střeva, která byla v provedených experimentech průměrně 118 minut, nedošlo ve tkáních stěny střeva k histologicky markantním změnám. To však na druhou stranu dokazuje, že kombinace UV světla a fluoresceinu dokáže ischemii odhalit již v jejím nejčasnějším stádiu.
DISKUSE
Vaskulární příčinou akutní ischemie střeva je ve většině případů okluze horní mezenterické tepny (HMT). Více než 50 % případů uzávěru této tepny způsobuje embolie s následnou úplnou nebo částečnou okluzí, 30–40 % uzávěru zapříčiňuje její trombóza. Postižení žilního systému akutní trombózou se pohybuje v rozmezí 10–15 % [3, 4]. Méně často je akutní ischemie střeva zapříčiněna nevaskulárními onemocněními typu strangulace, uskřinutí, volvulu a podobně.
Okluze tepny má za následek rozvoj slizniční infarzace přecházející v transmurální gangrénu střeva která vyústí v perforaci střevní stěny. Nejcitlivěji na ischemii reaguje slizniční výstelka, svalová vrstva je rezistentnější. Ke změnám patrným na seróze dochází v pozdním stadiu ischemie střeva, což zvyšuje riziko nesprávné diagnózy při peroperačním hodnocení. Při úplném přerušení dodávky kyslíku krví dochází za 3 hodiny k nekróze střevní sliznice, po 6 hodinách se rozvíjí nekróza stěny [2, 3].
Rychlá a spolehlivá diagnostika je tedy zásadním krokem, na němž závisí úspěšnost léčby. Důležité je nejen správné rozpoznání onemocnění, ale i co možná nejpřesnější stanovení rozsahu postižení střeva. Rozsáhlé resekce jsou příčinou syndromu krátkého střeva s malnutricí a alimentární invaliditou pacienta, naopak nerozpoznání ischemie má ve vysokém procentu za následek smrt postiženého [1, 2, 3, 4].
Klinické stanovení diagnózy je většinou obtížné. Anamnestická data zpravidla nemají specifickou povahu. K těžkostem při rozhodování přispívá i to, že pacientem popisované abdominální bolesti jsou často v rozporu s relativně chudým klinickým nálezem.
Selektivní mezenterická angiografie je v současné době nejspolehlivější metodou sloužící k diagnostice tohoto onemocnění, nicméně má i svá omezení [3, 12]. Vyšetření je prováděno specializovanými centry a zpravidla vyžaduje časově náročný transport pacienta. To prodlužuje dobu potřebnou ke stanovení diagnózy.
Počítačová tomografie a ultrazvukové vyšetření nedokáží, především v časných stadiích, mezenterickou ischemii spolehlivě rozpoznat. Užitečné informace, směřující k podezření na ischemii střeva, přináší počítačová tomografie v 50 % případů u sonografického vyšetření je to 25 % [2, 3].
Laboratorní vyšetření (stanovení hladiny amyláz, CK-BB izoenzymu kreatinkinázy laktatdehydrogenázy nebo transamináz) nemají specifickou diagnostickou hodnotu [13].
Slibně se vyvíjející výzkum zaměřený na sledování dynamiky hladin D-dimerů zatím zůstává v rovině experimentálních studií [14, 15, 16].
Definitivní odpověď dá ve většině případů až laparotomie nebo laparoskopie. Peroperační vizuální a palpační posouzeni stavu střeva (zbarvení, pulzace, edém, motilita) není považováno za spolehlivou metodu. Jde o hodnocení subjektivní a vždy tedy zatížené určitou chybou [4, 17, 18, 19].
Pro techniku peroperačního hodnocení vitality střeva chirurgem vypracovali Horgan a Gorey [19] pět základních požadavků:
- Vybavení potřebné k provedení metody musí být kdykoliv k dispozici na operačním sále, na kterém je prováděna akutní břišní chirurgie.
- Technické vybavení nesmí být složité nebo vyžadovat specializovaný personál.
- Metoda musí být přesná, s minimem falešně pozitivních či falešně negativních výsledků.
- Metoda a technika provedení musí být objektivní a reprodukovatelná.
- Nesmí jít o metodu nákladnou.
Těmto požadavkům v současné době vyhovují flouresceinová luminiscence v ultrafialovém světle a peroperační Dopplerovská sonografie.
Metoda fluorescence v UV světle k peroperační diagnostice vitality střeva byla při klasické laparotomii poprvé použita Herrlinem et al. [20]. Postupně byla metoda zavedena do klinické praxe na pracovištích především v USA [17, 21, 22, 23, 24, 25].
Látka fluorescein (fluoresceinum natricum, 10% vodný roztok) je organické barvivo, které v ultrafialovém spektru světla emituje jasnou žluto-zelenou luminiscenci. Je levným a při intravenózním podání bezpečným farmakem. Riziko nežádoucích účinků (alergická reakce, bolesti hlavy, nauzea, zvracení, hypotenze) je při intravenózním podání nižší než 1%. Fluorescein podaný intravenózně má v kombinaci s dlouhovlnným ultrafialovým světlem za následek světelnou luminiscenci prokrvených tkání. Luminiscence výrazně opticky odliší tkáně prokrvené, tedy vitální, od tkání neprokrvených, ischemických. Prokrvené úseky střeva září jasnou žlutozelenou barvou, neprokrvené úseky zůstávají temné. Zdrojem ultrafialového světla je při klasické laparotomii tzv. Woodova lampa produkující UV světlo o vlnové délce 540–550 nm.
V uplynulém desetiletí se v souvislosti s rychlým rozvojem laparoskopické přístrojové techniky objevila celá řada prací a studií zaměřených na využití diagnostické laparoskopie [7, 11, 26, 27]. U závažně nemocných nebo netransportabilních pacientů lze diagnostickou laparoskopii provést na lůžku JIP a to i v kombinaci lokální anestezie a analgosedace [5, 6, 7, 26, 27, 28]. V porovnání s diagnostickou laparotomií je laparoskopie zatížena nižší pooperační morbiditou. Široké uplatnění rovněž nalézá při „second look” výkonech.
Určitou nevýhodou diagnostické laparoskopie může být to, že v časném stadiu ischemie má seróza střeva (zpravidla) makroskopicky normální vzhled a onemocnění tedy nemusí být rozpoznáno. Toto riziko může odstranit použití laparoskopie v UV světle po podání fluoresceinu. Jako první použili v experimentu (na psím modelu) kombinaci laparoskopie a fluoresceinové luminiscence v UV světle k diagnostice akutní střevní ischemie Kam a Sheeres [10]. Při experimentálně navozené ischemii, podvazem větve HMT, dokázali touto metodou spolehlivě identifikovat postižené střevní úseky. Nevýhodou jejich metody bylo to, že jako zdroj UV světla použily argonový laser. Mc Ginty jr. et al. experimentálně na prasečím modelu ověřil možnosti diagnostiky časné ischemie střeva navozené zaklipováním větví HMT pomocí optických filtrů zařazených do laparoskopické sestavy [11]. Ve své práci navíc prokázal, že kapnoperitoneum, při standardně používaném tlaku do 14 mm Hg, má minimální nebo žádný vliv na fluoresceinovou luminiscenci a že tedy nedochází ke snížení pronikání barviva do kapilárního řečiště vitálního střeva.
V uvedených pracích chirurg provádějící experiment vždy, vzhledem k metodě uzávěru mezenteriálního řečiště (podvaz, klip), mohl dopředu odhadnout rozsah postižení střeva. V námi překládané studii však nebylo možné, vzhledem k endoluminální embolizaci části tepenného řečiště, předem odhadnout rozsah postižení střeva. Ischemii se však vždy podařilo rychle a spolehlivě prokázat a její rozsah spolehlivě vymezit.
ZÁVĚR
- Při nejasném chirurgickém nálezu a podezření na akutní ischemii střeva je diagnostická laparoskopie metodou volby.
- Laparoskopie nemusí v časných stadiích jednoznačně odhalit ischemické úseky střeva nebo vymezit rozsah ischemie.
- Kombinace ultrafialového světla a fluoresceinového barviva dokáže spolehlivě odlišit vitální úseky střeva od úseků ischemických a to již v době, kdy při prosté laparoskopii je ischemie střeva málo nebo vůbec patrná.
- Metodu je možné využít bez zvláštních nároků na nové technické vybavení.
- Metoda dává chirurgovi větší samostatnost při stanovení diagnózy a posouzení rozsahu postižení střeva bez nutnosti spolupráce s dalšími specialisty.
Studie je podpořena Interní grantovou agenturou Ministerstva zdravotnictví ČR Grant č. 8460-03 (2005-2007).
MUDr. J. Páral
Chirurgická klinika FN
Sokolská 581
500 05 Hradec Králové
Sources
1. Kaleya, R. N., Sammartano, R. J., Boley, S. J. Aggressive approach to acute mesenteric ischemia. Surgical Clinics of North America, 1992, vol. 72, no. 1, p. 157–182.
2. Kurland, B., Brandt, L., Delany, H. Diagnostic tests for intestinal ischemia. Surgical Clinics of North America, 1992, vol. 72, p. 85–101
3. Shelton, A. A., Schrock, T. R., Welton, M. L. Acute mesenteric vascular oclusion. In: Way, L. W. Current surgical diagnosis and treatment. New York: McGraw-Hill Companies, 2003, p. 698–700.
4. Zelenock, G. B. Visceral oclusive disease. In: Zelenock, G. B. Surgery. Philadelphia: Lippincott Williams&Wilkins, 2001, p. 1691–1707.
5. Agresta, F., Michelet, I., Coluci, G., et al. Emergency laparoscopy: a community hospital experience. Surgical Endoscopy, 2000, vol. 14, no. 5, p. 484–487.
6. Gagne, D. J., Malay, M. B., Hogle, N. J., et al. Bedside diagnostic minilaparoscopy in the intensive care patient. Surgery, 2002, vol. 131, no. 5, p. 491–496.
7. Pecoraro, A. P., Cacchione, R. N., Sayad, P., et al. The routine use of diagnostic laparoscopy in the intensive care unit. Surgical Endoscopy, 2001, vol. 15, no. 7, p. 638–641.
8. Seshadri, P. A., Poulin, E. C., Mamazza, J., et al. Simplified laparoscopic approach to „second-look“ laparotomy: a review. Surgical Laparoscopy Endoscopy and Percutaneous Techniques, 1999, vol. 9, no. 4, p. 286–289.
9. Slutzki, S., Halpern, Z., Negri, M., et al. The laparoscopic second look for ischemic bowel disease. Surgical Endoscopy, 1996, vol. 10, no. 7, p. 729–731.
10. Kam, D., Scheeres D. Fluorescein-assisted laparoscopy in the identification of arterial mesenteric ishemia. Surgical Endoscopy, 1993, vol. 7, p. 75–78.
11. McGinty, J. J., Jr., Hogle, N., Fowler, D. L. Laparoscopic evaluation of intestinal ischemia using fluorescein and ultraviolet light in a porcine model. Surgical Endoscopy, 2003, vol. 17, p.1140–1143.
12. Eldrup-Jorgensen, J., Hawkins, R., Brendenberg, C. Abdominal vascular catastrophes. Surgical Clinics of North America, 1997, vol. 77, p. 1305–1320.
13. Sternbach, Y., Perler, B. A. Acute mesenteric ischemia. In Shackelford’s Surgery of the alimentary tract. Philadelphia: W. B. Saunders company, 2002, p. 17–31.
14. Acosta, S., Nilsson, T. K., Bjorck, M. Preliminary study of D-dimer as a possible marker of acute bowel ischemia. British Journal of Surgery, 2001, vol. 88, no. 3, p. 385–388.
15. Acosta, S., Nilsson, TK., Bjorck, M. D-dimer testing in patients with suspected acute thromboembolic occlusion of the superior mesenteric artery. British Journal of Surgery, 2004, vol. 91, no. 8, p. 991–994.
16. Kurt, Y., Akin, M. L., Demirbas, S., Uluutku, A. H., Gulderen, M., et al. D-dimer in the early diagnosis of acute mesenteric ischemia secondary to arterial occlusion in rats. European Surgical Research, 2005, vol. 37, no. 4, p. 216–219.
17. Bulkley, G., Zuidema, G., Hamilton, S., et al. Intraoperative determination of small intestinal viability following ischemic injury. Annals of Surgery, 1981, vol. 193, p. 628–637.
18. Gorey, T. F. The recovery of intestine after ischaemic injury. British Journal of Surgery, 1980, vol. 67, no. 10, p. 699–702.
19. Horgan, P., Gorey, T. Operative assessment of intestinal viability. Surgical Clinics of North America, 1992, vol. 72, p. 143–154.
20. Herrlin, J. O., Glasser, S. T., Lange, K. New methods for determing the viability of bowel. Archives of Surgery, 1942, vol. 45, p. 785.
21. Dyess, D., Bruner, B., Donnell, C., et al. Intraoperative evaluation of intestinal ischemia: a comparison of methods. Southern Medical Journal, 1991, vol. 84, p. 966–974.
22. Pearce, W., Jones, D., Warren, G., et al. The use of infrared photoplethysmography in identifying early intestinal ischemia. Archives of Surgery, 1987, vol. 122, p. 308–310.
23. Peas, E., Vollmar, J., Hütschenreiter, S., et al. Mesenteric infarct: new aspects of diagnosis and therapy. Chirurg, 1988, vol. 59, p. 828–835.
24. Carter, M. S., Fantini, G. A., Sammartano, R. J., et al. Qualitative and quantitative fluorescein fluorescence in determining intestinal viability. American Journal of Surgery, 1984, vol. 147, no. 1, p. 117–123.
25. Lynch, T. G., Hobson, R. W., Kerr, J. C., et al. Doppler ultrasound, laser Doppler, and perfusion fluorometry in bowel ischemia. Archives of Surgery, 1988, vol. 123, no. 4, p. 483–486.
26. Wullstein, C., Gross, E. Laparoscopic compared with conventional treatment of acute adhesive small bowel obstruction. British Journal of Surgery, 2003, vol. 90, no. 9, p. 1147–1151.
27. Zamir, G., Reissmann, P. Diagnostic laparoscopy in mesenteric ischemia. Surgical Endoscopy, 1998, vol. 12, p. 390–393.
28. Orlando, R., Crowell, K. Laparoscopy in the critically ill. Surgical Endoscopy, 1997, vol. 11, p. 1072–1074.
29. Ehrmantraut, W., Sardi, A. Laparoscopy-assisted small bowel resection. American Surgeon, 1997, vol. 63, no. 11, p. 996–1001.
30. Duh, Q. Y. Laparoscopic procedures for small bowel disease. Baillieres Clinical Gastroenterology, 1993, vol. 7, no. 4, p. 833–850.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2007 Issue 2-
All articles in this issue
- Interhemisferický subdurální hematom
- Izolované aneuryzmy arteria iliaca interna
- Embolická komplikace léčby poskatetrizačního pseudoaneuryzmatu arteria femoralis perkutánní trombotizací. Kazuistika
- Endovenózní laserová fotokoagulace insuficientní safény v experimentu
- Metastazektomie vícečetných plicních metastáz nízce diferencovaného synoviálního sarkomu
- Laparoskopická resekce jater
- Apendektómia – porovnanie výsledkov laparoskopickej a otvorenej techniky operácie
- Embolizace portální žíly – zvýšení resekability jater pro maligní onemocnění
- Biliární ileus – opomíjená příčina střevní obstrukce
- Laparoskopická diagnostika akutní ischemie střeva – první experimentální zkušenosti
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Biliární ileus – opomíjená příčina střevní obstrukce
- Apendektómia – porovnanie výsledkov laparoskopickej a otvorenej techniky operácie
- Metastazektomie vícečetných plicních metastáz nízce diferencovaného synoviálního sarkomu
- Izolované aneuryzmy arteria iliaca interna
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

