-
Medical journals
- Career
Význam exprese C kit a MYB genu pro diagnostiku, prognózu a léčbu adenoidně cystických karcinomů slinných žláz – současná úroveň výzkumu a jeho aplikace v praxi
Authors: M. Brož; I. Stárek; Richard Salzman
Authors‘ workplace: Klinika otorinolaryngologie a chirurgie hlavy a krku LF UP a Fakultní nemocnice Olomouc
Published in: Otorinolaryngol Foniatr, 65, 2016, No. 1, pp. 53-57.
Category: Review Article
Overview
Adenoidně cystický karcinom je druhým až třetím nejčastějším maligním neoplazmatem velkých a převládající nádorovou jednotkou tumorů malých slinných žláz. Podobně jako některé další nádory této onkologické skupiny jej charakterizuje obtížná předpověď klinického průběhu. To je důvodem pro intenzivní hledání nových prognostických a prediktivních molekulárně biologických markerů. Jde především o identifikaci genů, resp. jejich produktů, odpovědných za iniciaci, progresi a metastázování nádorů. Kromě toho se přepokládá, že jejich cílenou biologickou blokádou by bylo možno zlepšit křivky přežití u prognosticky závažných salivárních nádorů vysokého stupně malignity.
Práce podává přehled poznatků o dvou v posledních letech intenzivně zkoumaných genetických alterací, týkajících se C-kit a MYB genu a jejich významu pro diagnostiku, prognózu a cílenou terapii adenoidně cystického karcinomu slinných žláz.Klíčová slova:
C kit, MYB, adenoidně cystický karcinom, slinné žlázy, prognóza, cílená terapieÚVOD
V současnosti jsme svědky mohutného nárůstu poznatků, týkajících se chromozomálních a molekulárně-genetických aspektů celé řady onemocnění. U nádorů jsou tak vedle příslušných genů identifikovány i jednotlivé signální dráhy a molekuly odpovědné za jejich vznik, progresi, jakož i lokální a vzdálené šíření. Některé chromozomální a genové abnormality, resp. exprese příslušných onkoproteinů, mají současně i význam prognostický anebo diferenciálně diagnostický. Blokáda relevantních molekul je obecným principem cílené léčby malignit, která byla již jako standard vedle hematoonkologických afekcí zavedena i u některých solidních nádorů, především nemalobuněčných karcinomů plic, karcinomu kolorekta, mammy, gastrointestinální stromálního tumoru, maligního melanomu, jakož i spinaliomu horních dýchacích a polykacích cest aj. (16). Uvedený trend se nemohl vyhnout ani tumorům slinných žláz. V poslední době přibývá důkazů, že v tumorigenezi těchto, podobně jako u jiných neoplazmat, se uplatňují alterace nádorových, jakož i supresorových genů. Některé jednotky jsou charakterizovány chromozomálními translokacemi, vedoucími ke vzniku fúzních genů. Podobně pleomorfní adenom je asociován s genem PLAG1, karcinom v pleomorfním adenomu s HMGA2 a karcinom mukoepidermoidní s MECT1/MAML2 (6). Těmito geny kódované, abnormálně exprimované a alterované onkoproteiny vedou k aktivaci různých signálních drah, jež vedle vlastní iniciace nádoru determinují i jeho další progresi a šíření. Tak například exprese výše zmíněného MECT1/MAML2 genu má pozitivní prognostický význam u mukoepidermoidního karcinomu. Průkaz genové fúze ETV6-NTRK3 umožnil identifikaci nové histopatologické jednotky, kterou je mammary analogue secretory carcinoma (MASC), dříve často mylně diagnostikovaný jako karcinom z acinárních buněk s výrazně lepší prognózou. (31).
Pro adenoidně cystický karcinom (ACC) jsou typické chromozomální translokace mezi geny pro transkripční faktory MYB a NFIB a exprese c-kit genu (6).
Salivární karcinomy jsou charakterizovány velkou morfologickou i biologickou rozmanitostí, a to i rámci jedné a téže histopatologické jednotky. To je příčinou obtížné předpovědi jejich klinického průběhu. Proto se hledají nové prognostické a prediktivní molekulárně biologické markery. Jde především o identifikaci genů, resp. relevantních produktů, odpovědných za iniciaci, progresi a metastazování jednotlivých typů nádorů. Kromě toho se přepokládá, že jejich cílenou biologickou blokádou by bylo možno zlepšit křivky přežití u prognosticky závažných salivárních nádorů vysokého stupně malignity.
V práci podáváme současný přehled poznatků o dvou v posledních letech intenzivně zkoumaných genetických alteracích, týkajících se C-kit a MYB genu a jejich významu pro diagnostiku, prognózu a cílenou terapii ACC.
Tento obtížně predikovatelný nádor je častým karcinomem velkých a převládajícím maligním tumorem malých slinných žláz (20). Postihuje pacienty každého věku, ponejvíce však 5. a 6. decénia (11). Časté je perineurální šíření, nezřídka prakticky znemožňující úplné chirurgické odstranění tumoru, který tak vykazuje výraznou tendenci k lokoregionálním recidivám. Typický je dále vleklý průběh s pozdním výskytem hematogenních metastáz, postihujících zejména plíce, játra a skelet, které jsou schopné zahubit pacienta i za několik desetiletí (34). Patomorfologicky tento nádor charakterizuje přítomnost tubulárních, kribriformních a solidních struktur. Relativní zastoupení posledně uvedené složky se stalo základem později modifikovaného histopatologického gradingu (35, 37). Seethala (29) však poukazuje na to, že jeho prognostický význam nebyl jednoznačně prokázán a v tomto směru rozhodujícím činitelem u ACC je (podobně jako u dalších karcinomů slinných žláz) klinické stadium. Velmi rychlým fatálním průběhem se vyznačují ACC, u nichž došlo k high-grade transformaci. Pro tuto histopatologickou jednotku, vyčleněnou z ACC Seethalou v r. 2007, je charakteristická dediferenciace nádorových, duktálních a myoepiteliálních buněk, jejich vysoká mitotická aktivita a nepravidelnosti jader (30).
Exprese C-kit genu u ACC
C-kit je protoonkogen, lokalizovaný v pozici 4 (q 11-12). Jeho produkt patří mezi receptorové tyrosinkinázy (RTK), což jsou transmembránové proteiny, převádějící signál po vazbě ligandu růstových faktorů přes buněčnou membránu. Tím spouštějí intracelulární kaskádu, kterou se předává signál do jádra. Zde po aktivaci transkripčních faktorů dojde k expresi genů nutných pro aktivaci mitózy (obr. 1).
Image 1. Schematické znázornění C kit signální dráhy. 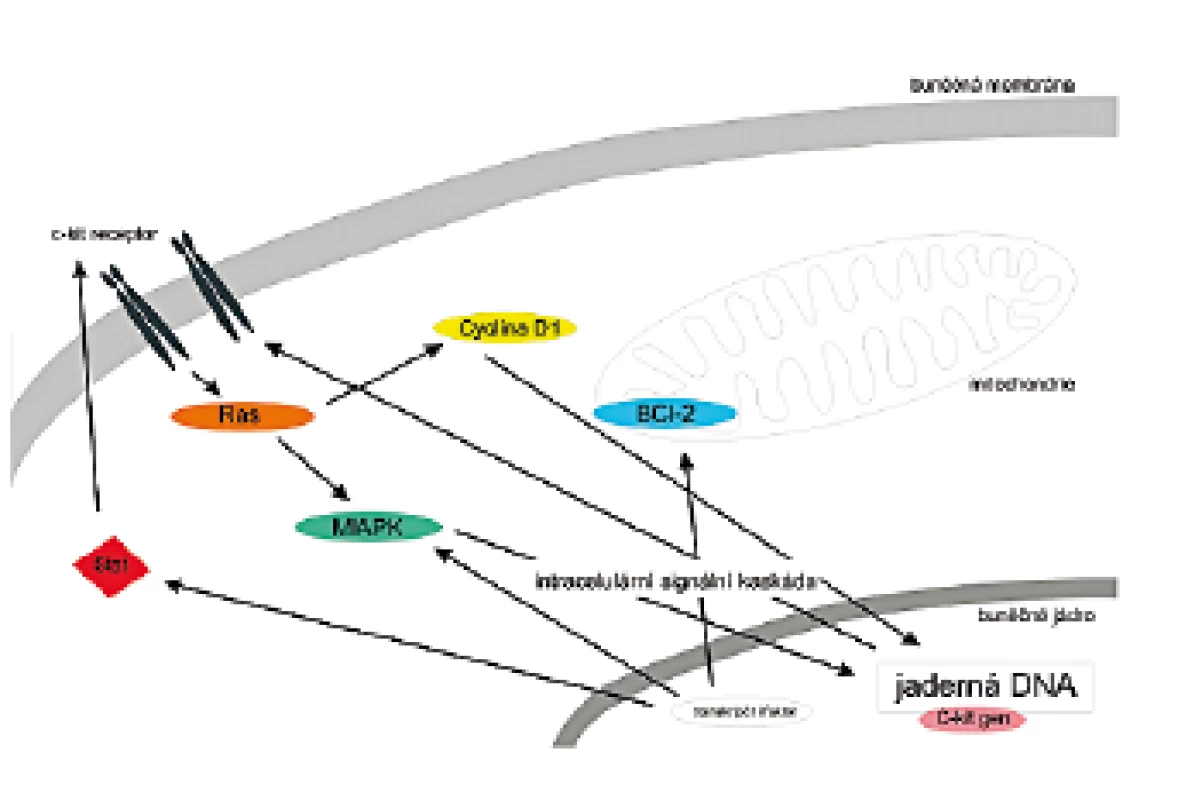
C-kit hraje významnou úlohu ve vývoji mastocytů, melanocytů, kmenových buněk bílé i červené krevní řady, jakož i germinálních a intersticiálních buněk Cajalových GITu. Jeho výrazná exprese, prokázaná u myeloidní leukémie, melanomu, karcinomu prsu, plic, štítné žlázy, seminomu a zejména pak u GISTu, je u nádorů slinných žláz značně variabilní. Výjimku však představuje právě ACC, který vykazuje pozitivní c-kit reakci (obr. 2) v 80–100 % případů (2, 33). Její přítomnost může sloužit jako pomocný diferenciálně diagnostický znak k odlišení velmi podobného, avšak prognosticky daleko příznivějšího polymorfního low-grade adenokarcinomu slinných žláz a benigního pleomorfního adenomu s absencí „stromální“ komponenty (21).
Image 2. C-kit pozitivní imunohistochemická reakce v buňkách tubulárních struktur ACC. 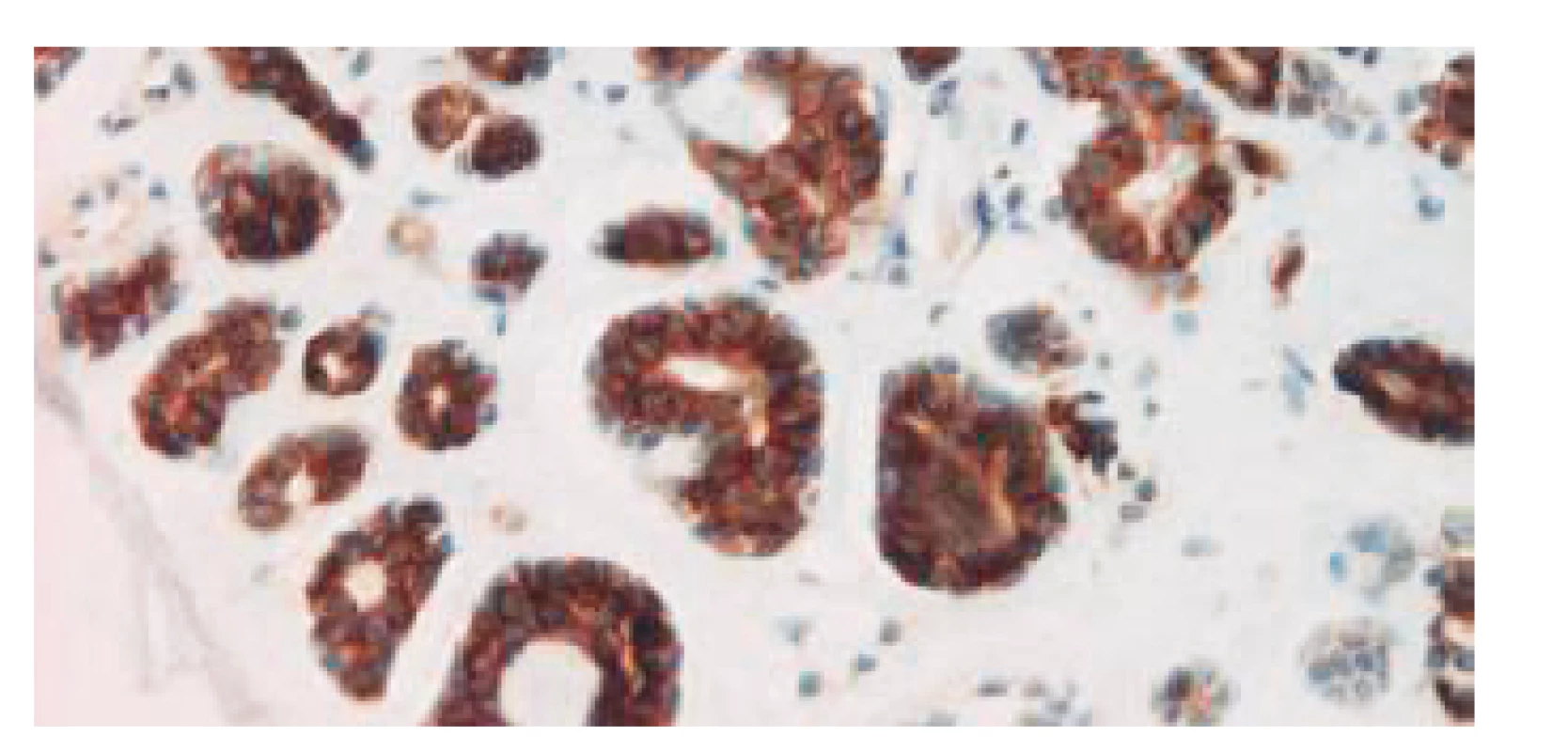
Prognostický význam C-kit genu
Sorensenová ve skupině 73 karcinomů, pozůstávající z 10 nejčastějších histopatologických subtypů, včetně ACC, neprokázala žádný prognostický význam exprese c-kit (33). K analogickým závěrům dospěl i Stárek (36), v jehož souboru, čítajícím 33 karcinomů širokého histopatologického spektra, nebyl potvrzen rozdíl v celkovém nádorově specifickém přežívání mezi pacienty s c-kit negativními a c-kit pozitivními karcinomy. To je v kontrastu s prognostickým významem c-kit genu u GISTu, kde byla zjištěna souvislost mezi jeho expresí a délkou přežití (19, 38).
Biologické principy a význam léčby c-kitpozitivních ACC
Protože naprostá většina ACC vykazuje silnou c-kit imunoreakci, vkládaly se do blokády c-kit signální cesty tyrozinkinázovými inhibitory (TKI) velké naděje.
Určitý entuziasmus byl vyvolán výsledky prvních aplikací imatinibu (Glivec), protože Alcedo (1) v r. 2004 referoval o dvou pacientech s ACC, úspěšně léčených tímto preparátem. V roce 2005 Faivrová (10) publikovala výsledky u jen málo většího souboru 8 pacientů s ACC. K pozitivní odpovědi na léčbu došlo u jednoho z nich. Podobně ani Hotte (14) nezaznamenal výraznější efekt působení imatinibu u 16 nemocných s tímto nádorem. Kritický pohled potvrdily i další, rozsáhlejší studie (13, 26). Linem byl po uvedené terapii dokonce popsán akcelerovaný růst metastáz (17). Ghosal ve studii, publikované v roce 2010, podával imatinib v kombinaci s cisplatinou v léčbě tohoto nádoru s částečným efektem, kdy u 3 z 28 pacientů došlo k dočasnému zastavení jeho progrese (12). Nověji byly syntetizovány TKI nové generace (sunitinib, nilotinib,dasatinib a jiné), které se od imatinibu liší tím, že kromě c-kit působí i na další receptory s tyrozinkinázovou aktivitou. V současnosti probíhá intenzívní výzkum léčby salivárního ACC těmito novými preparáty, dosavadní zprávy však jsou zdrženlivé. Chau (15) nezaznamenal reakci u 14 nemocných, léčených sunitinibem. Podobně nedošlo k pozitivní odpovědi na léčbu dasatinibem v kombinaci s cetuximabem (3). Recentní studie, která má za úkol sledovat odpověď na léčbu Dasatinibem, dosud nebyla ukončena (9). Dosavadní negativní zkušeností s uvedenou terapií je ovšem nutno hodnotit ve světle skutečnosti, že do studií byli zahrnuti jen pacienti s generalizovanými progredujícími, nikoliv s primárními tumory. Dalším možným důvodem neúčinnosti léčby imatinibem je dle Bellové (5) skutečnost, že c-kit je exprimován toliko v nádorových duktálních, a nikoli myoepiteliálních buňkách. Posledně uvedené elementy exprimují MYB gen, který není cílovou molekulou pro léčbu TKI.
Exprese MYB genu u ACC
MYB gen je lokalizován v oblasti q22-q23 chromozomu 6. Jeho proteinový produkt je klíčový transkripční faktor pro správnou diferenciaci buněk hematopoetického systému, nervových a kožních buněk a střevních krypt (33). Jeho deregulace a aberantní funkce vede k iniciaci různých nádorů. Vysoká exprese MYB genu je spojená se špatnou prognózou T buněčné leukémie, akutní myelogenní leukémie (32) a kolorektálního karcinomu (40).
Alteraci MYB genu (obr. 3) u ACC popsala jako první Perssonová (25) u 6 pacientů s nádory vycházejícími z velkých a malých slinných žláz, ze slzné žlázy a z prsu. Ve všech těchto případech šlo o fúzní translokaci, na níž se jako partner podílel NFIB gen, lokalizovaný na chromozomu 9. Autorka se proto domnívala, že tato alterace, zvyšující MYB transkripční aktivitu nádorových buněk, je jediným mechanismem vzniku této histopatologické jednotky. Výsledky dalších studií (7, 23, 36) však prokázaly, že overexprese MYB proteinu není vždy spojená s MYB-NFIB fúzí. Mitani se proto spekulativně domnívá, že MYB gen je aktivován ještě dalšími, ne zcela objasněnými mechanismy (23).
Image 3. FISH MYB průkaz zlomu MYB genu u ACC. 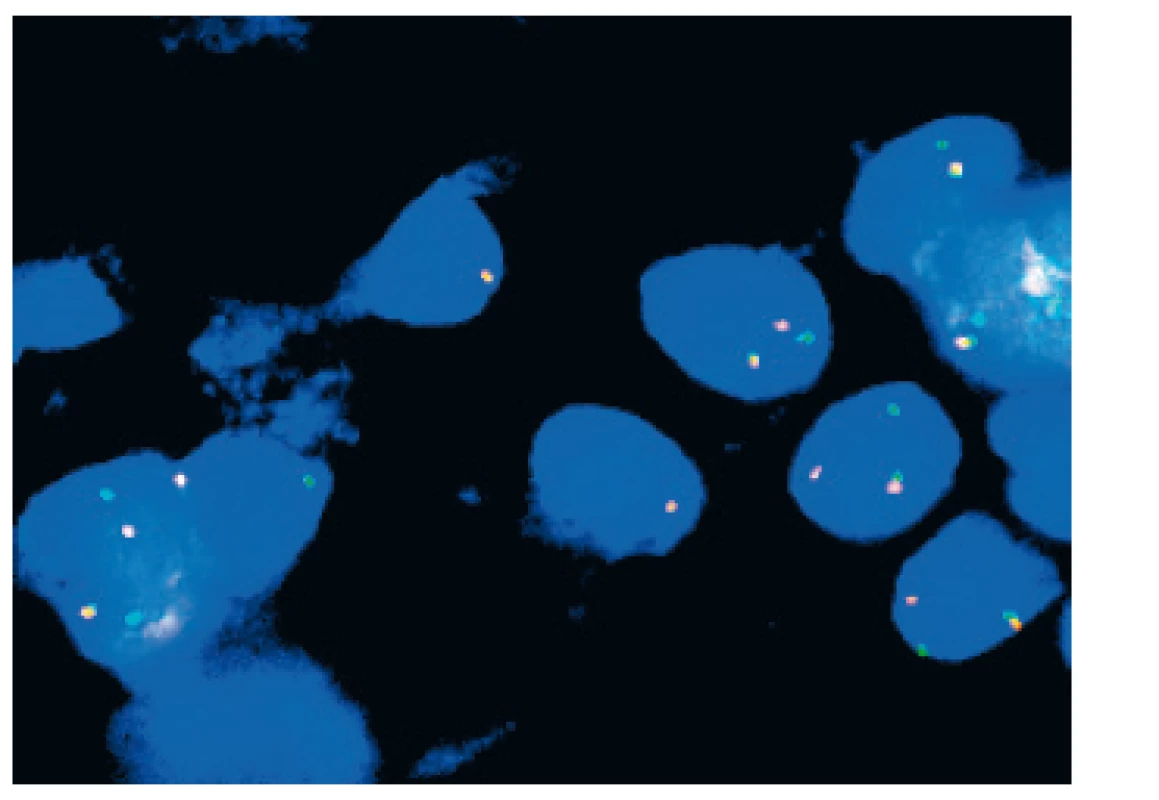
Diferenciálně diagnostický významMYB genu
ACC je jediným ze salivárních tumorů, který vykazuje alterace MYB genu. Ten může být více poškozen dosud ne zcela přesně identifikovanými mechanismy (23), mezi něž patří i translokační fúze s genem NFIB. Ta je přítomna v 28-49 % případů (23, 39). Oproti tomu samotná alterace MYB genu byla nalezena i u karcinomu prsu a kolorekta (40). Její průkaz tak má význam v histopatologické diferenciální diagnostice karcinomů slinných žláz, především v odlišení ACC od nejčastěji se vyskytujícího benigního pleomorfního adenomu (27).
Prognostický význam MYB genu
Několik recentních studií zkoumalo prognostický potenciál exprese MYB genu u ACC. Mitani (22) v klinickopatologické analýze vzorků 102 pacientů prokázal signifikantní asociaci zvýšené MYB exprese s horší prognózou. Oproti tomu West (39) u 37 a Bellová (4) u 156 pacientů s těmito tumory nezjistili statisticky významnou souvislost mezi MYB expresí a délkou přežití. Závěry dosavadních studií, hodnotících prognostický význam MYB genu u ACC, se tedy různí. V tomto směru však probíhá v současnosti intenzívní výzkum. Dosavadní výsledky naznačují, že některé z jeho alterací jeví prognostickou relevanci (23).
Terapeutický význam MYB genu
Terapeutický potenciál blokády MYB genu u malignit byl zkoumán zatím pouze experimentálně, protože transkripční faktory, mezi něž tento patří, jsou obecně považovány za velmi obtížné terapeutické cíle (24). Na zvířatech bylo zjištěno, že MYB gen lze u hematologických malignit zablokovat buď přímo na transkripční či nižší signální úrovni (28). Další studie prokázala, že jinak imunitnímu dohledu unikající MYB pozitivní buňky murinního kolorektálního karcinomu jsou po navázání MYB protilátky imunokompetentními mechanismy rozpoznány a následně zničeny (8). Výsledky uvedených experimentálních studií se jeví terapeutickým příslibem nejen u zmíněných nádorů, ale i u ACC.
ZÁVĚR
ACC je nádor, asociovaný jak s C-kit tak i MYB genem. Zatímco expresi prvního z nich nacházíme i u jiných salivárních karcinomů, exprese MYB je pro ACC zcela specifická a mohla by být využívána v histopatologické diferenciální diagnostice patomorfologicky podobných nádorů. Exprese C - kit genu nemá žádnou prognostickou relevanci, u MYB genu se názory v tomto směru zatím rozcházejí. Recentní klinické zkušenosti s cílenou blokádou C-kit genu jsou neuspokojivé, zkoumání efektu na MYB gen zaměřené biologické léčby zatím nepřekročilo experimentální stadium. K vyřešení těchto dosud sporných otázek prognózy a terapie ACC bude zapotřebí dalších studií.
Seznam zkratek:
RTK – receptorové tyrozinkinázy
ACC – adenoidně cystický karcinom
KIT – kinase inhibitor tyrozin
GIST – gastrointestinální stromální tumor
EGFR – epidermal growth factor receptor
Grantová podpora: Tato práce byla podpořena grantem MZ ČR č. 1RVO-FNOL2016, RVO: 61989592
Adresa ke korespondenci:
MUDr. Martin Brož
Klinika ORL a chirurgie hlavy a krku
LF UP a FN Olomouc
I. P. Pavlova 6
772 00 Olomouc
e-mail: martin.broz@fnol.cz
Sources
1 Alcedo, J. C., Fabrega, J. M., Arosemena, J. R. et al.: Imatinib mesylate as treatment for adenoid cystic carcinoma of the salivary glands: report of two successfully treated cases. Head Neck, 26, 2004, s. 829-831.
2. Andreadis, D., Epivatianos, A. et al.: Detection of C-KIT (CD117) molecule in benign and malignant salivary gland tumours. Oral Oncology, 42, 2006, s. 57-65.
3. Argiris, A., Feinstein, T. M., Wang, L.: Phase I and pharmacokinetic study of dasatinib and cetuximab in patients with advanced solid malignancies. Investigational new drugs, 30, 2012, 4, s. 1575-1584.
4. Bell, D., Roberts, D. et al.: Cell type dependent biomarker expression in adenoid cystic carcinoma. Cancer, 116, 2010, s. 5749-5056.
5. Bell, D., Roberts, D., Karpowicz, M., Hanna et al.: Clinical significance of Myb protein and downstream target genes in salivary adenoid cystic carcinoma. Cancer biology & Therapy, 12, 2011, 7, s. 569-573.
6. Bradley, P. J., Orlando, G. L.: Salivary gland disorders and diseases: diagnosis and management. Georg. Thieme Verlag, 2011, s. 256.
7. Brill, L., Kanner, W.: Analysis of MYB expression and MYB-NFIB gene fusion in adenoid cystic carcinoma and other salivary neoplasms. Modern Pathology, 24, 2011, s. 1169-1176.
8. Cross, R. S., Malaterre, J., Davenport, A. J. et al.: Therapeutic DNA vaccination against colorectal cancer by targeting the MYB oncoprotein. Clinical & Translational Immunology, 4, 2015, 1, e30.
9. Dasatinib in Treating Patients With Recurrent or Metastatic Malignant Salivary Gland Tumors. www.clinicaltrials.gov.
10. Faivre, S., Raymond, E., Casiraghi et al.: Imatinib mesylate can induce objective response in progressing, highly expressing KIT adenoid cystic carcinoma of the salivary glands. Journal of Clinical Oncology, 23, 2005, s. 6271-6273.
11. Gondivkar, S. M. Gadbail, A. R., Chole, R., Parikh, R. V.: Adenoid cystic carcinoma: a rare clinical entity and literature review. Oral Oncology, 47, 2011, 4, s. 231-236.
12. Ghosal, N., Mais, K., Shenjere, P. et al.: Phase II study of cisplatin and imatinib in advanced salivary adenoid cystic carcinoma. British Journal of Oral and Maxillofacial Surgery, 49, 2011, 7, s. 510-515.
13. Heinrich, M., Joensuu, H., Demetri. G. et al.: Phase II, Open-label study evaluating the activity of imatinib in treating Life-threatening malignancies known to be associated with Imatinib-sensitive tyrosine kinases .Clin. Cancer, 14, 2008, s. 2717-2725.
14. Hotte, S. J., Winquist, E. W., Lamont, E. et al.: Imatinib mesylate in patients with adenoid cystic cancers of the salivary glands expressing c-kit: a Princess Margaret Hospital phase II consortium study. J. Clin. Oncol., 23, 2005, s. 585-590.
15. Chau, N. G., Hotte, S. J., Chen, E. X. et al.: A phase II study of sunitinib in recurrent and/or metastatic adenoid cystic carcinoma (ACC) of the salivary glands: current progress and challenges in evaluating molecularly targeted agents in ACC. Annals of Oncology, 23, 2005, s. 1562-1570.
16. Klener, P., Klener, P. jr.: Nová protinádorová léčiva a léčebné strategie v onkologii. Grada Publishing, Praha, I. vydání, 2010.
17. Lin, H., Yen, F. et al.: Unexpected rapid progression of metastatic adenoid cystic carcinoma during treatment with imatinib mesylate. Head & Neck, 12, 2005, s. 1022.
18. Marchiò, C., Weigelt, B., Reis-Filho, J.: Adenoid cystic carcinomas of the breast and salivary glands (or ‘The strange case of Dr Jekyll and Mr Hyde’ of exocrine gland carcinomas). J. Clin. Pathol., 63, 2010, s. 220-228.
19. Miettinen, M., Lasota, J.: Gastrointestinal stromal tumors: review on morphology, molecular pathology, prognosis, and differential diagnosis. Archives of Pathology & Laboratory Medicíně, 130, 2006, 10, s. 1466-1478.
20. Milano, A., Longo, F., Basile, M. et al.: Recent advances in the treatment of salivary gland cancers: Emphasis on molecular targeted therapy .Oral Oncology, 43, 2007, s. 729-734.
21. Mino, M., Pilch, B. Z., Faquin, W. C.: Expression of KIT (CD117) in neoplasms of the head and neck: an ancillary marker for adenoid cystic carcinoma. Modern Pathology, 16, s. 1224-1231.
22. Mitani, Y., Rao, P. H., Futreal, A. et al.: Novel chromosomal rearrangements and bvreak points at the t(6;9) in salivary adenoid cystic carcinoma: Association with MYB-NFIB chimeric fusion, MYB expression, and clinical outcome. Clinical Cancer Research, 17, 2011, s. 7003-7014.
23. Mitani, Y., Li, J., Rao H. et al.: Comprehensive analysis of the MYB-NFIB gene fusion in salivary adenoid cystic carcinoma : incidence ,variability and clinicopathological significance. Clin. Cancer Res., 16, 2010, s. 4722-4731.
24. Pattabiraman, D. R., Gonda, T. J.: Role and potential for therapeutic targeting of MYB in leukemia. [Review] Leukemia, 27, 2013, 2, s. 269-277.
25. Persson, M., Andrén, Y., Mark, J. et al.: Recurrent fusion of MYB and NFIB transcription factor genes in carcinomas of the breast and head and neck. Proceedings of the National Academy of Sciences, 106, 2009, 44, s. 18740-18744.
26. Pfeffer, M. R., Talmi, Y., Catane, R. et al.: A phase II study of imatinib for advanced adenoid cystic carcinoma of head and neck salivary glands. Oral Oncol., 43, 2007, s. 33-36.
27. Pusztaszeri, M. P., Sadow, P. M., Ushiku, A. et al.: MYB immunostaining is a useful ancillary test for distinguishing adenoid cystic carcinoma from pleomorphic adenoma in fine-needle aspiration biopsy specimens. Cancer Cytopathology, 122, 2014, 4, s. 257-265.
28. Ramsay, R. G., Barton, A. L., Gonda, T. J.: Targeting c-Myb expression in human disease. Expert Opinion on Therapeutic Targets, 7, 2003, 2, s. 235-248.
29. Seethala, R. R.: An update on grading of salivary gland carcinomas. Head and Neck Pathology, 2009, 3, s .69-77.
30. Seethala, R. R, Hunt, J. L., Baloch, Z. W., LiVolsi, V. A., Barnes, E. L.: Adenoid cystisc carcinoma with high-grade transformation. A report of 11 cases and review of the literature. Am. J. Surg. Pathol., 31, 2007, 11, s. 1683-1694.
31. Skalova, A.,Vanecek, T., Sima, R. et al.: Mammary analogue secretory carcinoma of salivary glands, containing the ETV6-NTRK3 fusion gene: a hitherto undescribed salivary gland tumor entity. Am. J. Surg. Pathol., 34, 2010, s. 599-608.
32. Slamon, D. J., Boone, T. C., Murdock, D. C. et al.: Studies of the human c-myb gene and its product in human acute leukemias. Science, 233, 1986, s. 347-351.
33. Sørensen, K., Godballe, Ch., Stricker, K. et al.: Parotid carcinoma: expression of kit protein and epidermal growth factor receptor. Journal of Oral Pathology & Medicine, 35, 2006, s. 286-291.
34. Speight, P. M., Baret, A. W.: Salivary gland tumours. Oral Diseases, 2002, 8, s. 229-240.
35. Stapiro, R. H, Huvos, G. A.: Stage means more than grade in adenoid cystic carcinoma. The American Journal of Surgery, 164, 1992, 6, s. 623-628.
36. Stárek, I., Kučerová, L., Skálová, A.: Imunohistochemická exprese C-kit onkoproteinu u karcinomů slinných žláz (pilotní studie) .Otorinolaryngologie a foniatrie, 2010, 3, s. 129-135.
37. Szanto, P. A., Luna, M. A., Tortoledo, M. E. et al.: Histologic grading of adenoid cystic carcinoma of the salivary glands. Cancor, 54, 1984, 6, s. 1062-1069.
38. Taniguchi, M., Nishida, T., Sirota, S., Isozak, K. et al.: Effect of c-kit mutation on prognosis of gastrointestinal stromal tumors. Cancer Research, 59, 1999, s. 4297-4300.
39. West, R. B., Kong, C., Clarke, N., Gilks, T.: MYB expression and translocation in adenoid cystic carcinomas and other salivary gland tumors with clinicopathologic correlation. The American Journal of Surgical Pathology, 35, 2011, 1, s. 92-99.
40. Wilkins, H. R., Doucet, K., Duke, V., Morra, A., Johnson, N.: Estrogen prevents sustained COLO-205 human colon cancer cell growth by inducing apoptosis, decreasing c-myb protein and decreasing transcription of the antiapoptotic protein bcl-2. Tumour Biol., 31, 2010, s. 16-22.
Labels
Audiology Paediatric ENT ENT (Otorhinolaryngology)
Article was published inOtorhinolaryngology and Phoniatrics

2016 Issue 1-
All articles in this issue
- Flexibilní endoskopie horních dýchacích cest v léky navozeném spánku
- Nosní tamponády – přehled materiálů
- Vizuálně podporovaná audiometrie Behaviorální metoda vyšetřování sluchu malých dětí
- Klinické využití nové audiometrické metody – vizuálně podporovaná audiometrie
- Význam exprese C kit a MYB genu pro diagnostiku, prognózu a léčbu adenoidně cystických karcinomů slinných žláz – současná úroveň výzkumu a jeho aplikace v praxi
- Slizničný malígny melanóm nosnej dutiny
- Diagnostika Menierovej choroby pomocou objektívnych vyšetrovacích metód
- Kvalita života nemocných s rakovinou hlavy a krku ve tříletém sledování nutriční ambulancí
- Mikrobiologické nálezy u dětí s adeno-tonzilární hypertrofií
- Peritonzilární komplikace akutních zánětů patrových tonzil (retrospektivní studie)
- Otorhinolaryngology and Phoniatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nosní tamponády – přehled materiálů
- Peritonzilární komplikace akutních zánětů patrových tonzil (retrospektivní studie)
- Diagnostika Menierovej choroby pomocou objektívnych vyšetrovacích metód
- Flexibilní endoskopie horních dýchacích cest v léky navozeném spánku
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

