-
Medical journals
- Career
Kvalita života nemocných s rakovinou hlavy a krku ve tříletém sledování nutriční ambulancí
Authors: E. Malá 1; E. Vejražková 2; M. Vošmik 3; J. Novosad 4; L. Sobotka 5
Authors‘ workplace: Ústav klinické imunologie a alergologie, Fakultní nemocnice Hradec Králové 1; IV. Interní hematologická klinika, Fakultní nemocnice Hradec Králové 2; Klinika onkologie a radioterapie, Fakultní nemocnice Hradec Králové 3; Ústav klinické imunologie a alergologie, Fakultní nemocnice Hradec Králové 4; III. interní gerontometabolická klinika, Fakultní nemocnice Hradec Králové 5
Published in: Otorinolaryngol Foniatr, 65, 2016, No. 1, pp. 9-16.
Category: Original Article
Overview
Cíl sledování:
Provedli jsme tříleté sledování nemocných s rakovinou hlavy a krku, kteří byli nutričně intervenováni. Sledovali jsme vývoj kvality života v čase u onkologických nemocných v kontextu udržení fyzické zdatnosti versus trendu vývoje závislosti na dopomoci nebo péči druhé osoby a podle sledovaných parametrů malnutrice.Soubor a metodika:
Provedli jsme sledování souboru 726 nemocných s rakovinou hlavy a krku. Nemocní byli zajištěni výživou, kterou jsme podávali cestou zavedené perkutánní endoskopické gastrostomie (skupina A). Druhá skupina (B) byla intervenována formou sippingu. Sledování kvality života bylo provedeno formou dotazníků v modulech obecné kvality života a kvality života u nemocných s rakovinou hlavy a krku. Souběžně jsme prováděli srovnání výsledků s demografickými údaji pacientů, Karfnosky Performance Status Score, vždy v obou skupinách a dále se zohledněním pohlaví. Skupina A a B jsou srovnatelné ve smyslu zastoupení nádorových onemocnění i modality léčby.Výsledky:
Nutriční intervence je kauzálním faktorem ovlivňujícím vývoj nutričních parametrů i komplikací, kvalitu života, bolesti, závislosti na druhé osobě i přežití nemocných. Nemocní s nutriční intervencí formou perkutánní endoskopické gastrostomie vykázali lepší toleranci onkologické léčby (p < 0,02), menší počet komplikací, významně nižší výskyt závislosti na péči druhé osoby (p < 0,04), lepší kvalitu života (p < 0,04). Lze říci, že ženy tolerovaly onkologické onemocnění i léčebný proces lépe než muži, i přes větší vstupní hmotnostní úbytek.Závěr:
Sledování kvality života považujeme za jeden z klíčových faktorů komplexní péče v rámci onkologické léčby. Prokázalo, že zavedení perkutánní endoskopické gastrostomie nevede ke zhoršení kvality života v žádném ze sledovaných parametrů, naopak – nemocní takto léčení významně profitují z klinické výživy a mají lepší kvalitu života.Klíčová slova:
rakovina hlavy a krku, malnutrice, perkutánní endoskopická gastrostomie, kvalita života, výživa, hmotnostní úbytekÚVOD
Nádory hlavy a krku (HNC) celosvětově zaujímají 6. místo. V Evropě je HNC na čtvrtém místě u mužů (5, 34, 35). V ČR se incidence pohybuje u mužů kolem 2,6 % a u žen kolem 0,7 % a vykazuje nejvyšší mortalitu v Evropě (34, 35). Lokalizace nádoru má přímou souvislost s konkrétním histologickým typem a molekulárně-biologickými vlastnostmi nádoru (34, 35). Negativní prognostické faktory jsou vyšší věk a mužské pohlaví. Kvalita života (QOL) dle pracovní skupiny při WHO (1, 3, 6-8, 11, 12) v roce 1995 definovala kvalitu života jako: jedincem vnímanou vlastní pozici v životě, v kontextu své kultury a hodnotového systému, ve vztahu k jeho cílům, očekáváním, normám a obavám. Medicína pohlíží na hodnocení QOL z hlediska zdraví a nemoci (6-8, 11, 12).
SOUBOR PACIENTŮ A METODY
Do sledování jsme zahrnuli 726 nemocných s diagnózou rakoviny hlavy a krku, kteří byli odesláni k zavedení nutriční intervence. Každého z nemocných s rakovinou hlavy a krku (HNC) jsme sledovali po dobu tří let. Soubor pacientů jsme, vzhledem k podstatě nutriční ambulance (44, 45, 53-58) rozdělili (nerandomizovali) do dvou skupin. Skupina A představovala nemocné, kteří akceptovali zavedení PEG (45-47) (perkutánní endoskopická gastrostomie) a měli plnou sondovou výživu. Do druhé skupiny (B) patřili nemocní, kteří zavedení PEG neakceptovali. Jejich nutriční podpora byla zajištěna formou sippingu. Všichni účastníci podepsali informovaný souhlas. Pacienti byli po dobu trvání projektu v trvalé péči nutriční ambulance a docházeli na kontroly v pravidelných intervalech. Obě skupiny nemocných jsou srovnatelné podle zastoupení nemocných dle typu a stadia nemoci, dále i podle modality léčby.
Naše sledované parametry: Demografické údaje (pohlaví, věk, vzdělání), onkologická data (TNM klasifikace, modalita onkologické léčby). Subjektivní klinické symptomy (CSS): 1. dysfagie, 2. ztráta chuti k jídlu, 3. pocity plnosti, 4. nevolnost, 5. zvracení, 6. obtíže se žvýkáním, 7. obtíže při polykání, 8. změna chuti, 9. změny čichu, 10. sucho v ústech, 11. vazké/husté sliny, 12. bolesti v ústech, 13. úbytek energie, 14. úzkosti, 15. bolest, 16. nespavost. Komorbidity nemocného byly skórovány podle CCI (30, 31) (Charlson Comorbidity Index), které hodnotí nemoci, provázející aktuální léčené onemocnění. Každé onemocnění (anamneza infarktu myokardu, městnavého srdečního selhání, onemocnění periferních cév, demence, cerebrovaskulárního onemocnění apod.) má stanovený počet bodů, které se sčítají a podle výsledku se určuje celkové skore. K hodnocení aktuální fyzické zdatnosti (nebo závislosti na dopomoci druhé osoby) jsme použili KPS (41, 42) (Karnofsky Performance Status Score), které procentem postihuje míru funkčního postižení nemocného. Hodnoty jsou od 0 (smrt) do 100 % (plná zdatnost). Z nutričních markerů jsme hodnotili: hmotnost (měření bylo provedeno na váze zn. Lindeltronic 8000 m při všech měřeních), BMI (53, 54) (Body Mass Index byl vypočten jako hmotnost v kg/výška v metrech5
2), úbytek hmotnosti (v %) vyjadřuje neočekávaný pokles hmotnosti z obvyklé tělesné hmotnosti v posledních 6 měsících (15, 20, 28, 29, 50-52). Metodologie nutričního screeningu byla realizována podle doporučení ESPEN (European Society for Parenteral and Enteral Nutrition) (18, 19, 21-27, 32, 33, 36, 37, 39, 40, 43, 48, 55-58).
Měření kvality života (1, 3, 4, 6, 9, 10, 13, 14, 17, 20, 38, 49-52) pomocí standardizovaných dotazníků EORTC QOL (European Organisation for Research and Treatment of Cancer, Evropská organizace pro výzkum a léčbu rakoviny, QOL= kvalita života) (1-4, 6, 9, 10, 13, 14, 16, 17, 20, 38, 49-52) byly použity 2 moduly: QOL C-30 (1-4, 9, 10, 13, 20) a QOL HN-35 (Head&Neck modul) (1, 3, 4, 9, 13, 17, 20, 50). Pro přehlednost dále budeme užívat mezinárodně užívané zkratky QOL (Quality of Life) s označením příslušného užitého modulu (C-30 nebo HN-35), tzn. QOL C-30 nebo QOL HN-35. Výpočet výsledků obou dotazníků QOL byl proveden podle manuálu. Soubor sledovaných proměnných – viz tabulka 1.
Table 1. Demogranická data pacientů a vstupní proměnné v T0. 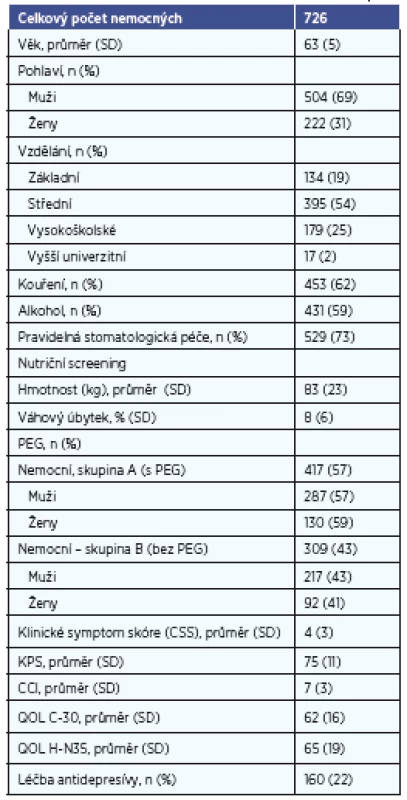
Graph 1. Grafické znázornění zastoupení jednotlivých nádorových onemocnění. 
Sledování jsme provedli ve schématu: T0 = vstup pacienta, T6 = kontrola za 6, měsíců, T12 = kontrola za 12 měsíců, T24 = kontrola za 24 měsíců, T36 = kontrola za 36 měsíců od vstupu nemocného do sledování.
Statistika: Statistické analytické metody byly: 1. smíšená faktoriální ANOVA, 2. multivariátní analýza rozptylu (MANOVA), 3. smíšený model (mixed model) s odhadem parametrů metodou maximální věrohodnosti (maximum likelihood), 4. analýza přežití Kaplan-Meierovým algoritmem, 5. Coxova regrese. Opakovaná opatření byla ošetřena pomocí smíšené faktoriální ANOVY (GLM = obecný lineární model pro opakovaná měření) s příslušnými korekcemi dle Greenhouse a Geissera. U nezávislých měření byly aplikovány post hoc testy dle Bonferroniho a Games-Howella. Analýzu přežití jsme hodnotili podle sledovaných parametrů. Všechny výsledky testů považujeme za statisticky významné při p ≤ 0,05. Statistické analýzy byly provedeny s použitím produktu IBM SPSS Statistics software (verze 22).
Celkový počet nemocných je 726, s průměrným věkem 62 ± 7 let. Muži měli průměrný věk 62 let, ženy 64 let. Poměr mužů a žen ve sledování je 3 : 2. Nejčastější rakovinou v našem souboru byl hypofaryngeální karcinom (26 %). Nejvyšší průměrný věk měli nemocní s rakovinou mandlí (66 let), nejnižší věk měli nemocní s karcinomem jazyka (55 let). Nejčastějším stadiem tumoru u nemocných bylo stadium II (344 pacientů, 48 %). Celkem 190 nemocných (26 %) mělo pokročilé stadium III a IV. Zastoupení nádorových stadií onemocnění a změny zastoupení v čase (od vstupu do sledování v T0 do konce sledování v T36) znázorňuje tabulka 2.
Table 2. Přehled zastoupení stadií v čase T0-T36. 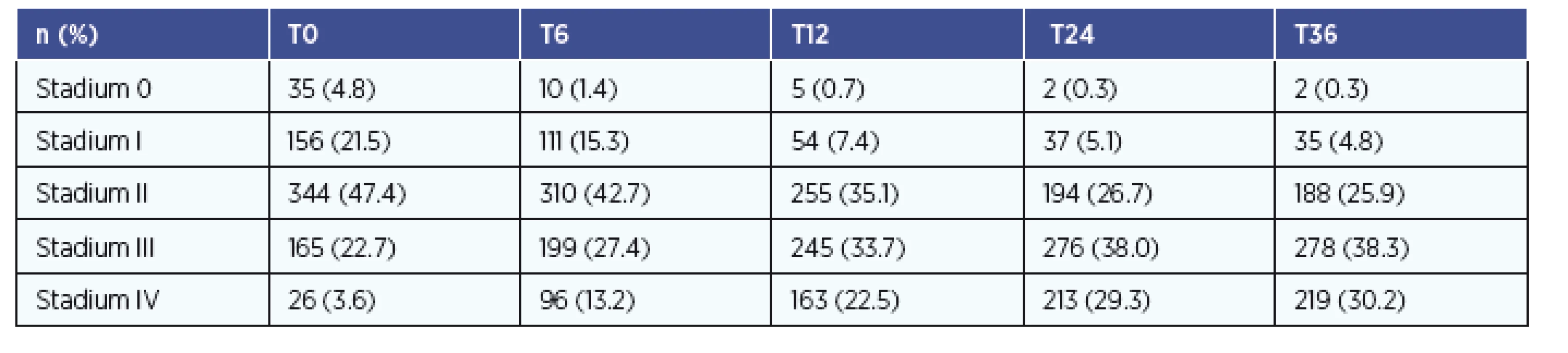
Vzhledem k primárnímu zájmu nutriční ambulance jsme kvalitu života sledovali ve dvou skupinách – ve skupině A (s PEG) a B (bez PEG). Lze konstatovat, že malnutrice významně ovlivňuje kvalitu života nemocných. Jako kritérium malnutrice jsme zvolili neočekávaný úbytek hmotnosti > 10 % za posledních 6 měsíců. Signifikantní rozdíly v QOL mezi pacienty ve skupině A (s PEG) a B (bez PEG) jsou markantní od počátku sledování, avšak s maximem změn od T6. Průměrné hodnoty v T6 ve skupině A pro QOL C-30 byly 58 a QOL HN-35 byly 66, (p < 0,01).
U pacientů ve skupině A (s PEG) od T6 trvá celkově lepší profil psychického ladění, udávají méně úzkosti, nespavosti a menší výskyt sociální izolace. Nemocní udávají významně lepší sociální kontakt. Naopak u nemocných ve skupině B (bez PEG) je významně vyšší počet nemocných s úzkostí a nespavosti. Muži kuřáci ve skupině B mají současně nejvyšší frekvenci udávané bolesti a současně nejvyšší spotřebu analgetik.
Ženy v obou skupinách vykazují setrvale lepší QOL (C-30 i HN-35) od T6 než muži. Vstupní podíl žen léčených antidepresivy byl v T0 50 %. Setrvale lepší hodnoty QOL u žen odpovídá i údaj o lepší toleranci onkologické léčby, menší spotřebě analgetik a nižším podílu závislosti na pečovateli (dle KPS). Výsledky mají ženy lepší i přes fakt, že do sledování vstupovaly s nižší vstupní hmotností, měly nižší BMI a vyšší neočekávaný pokles hmotnosti. Ženy ve skupině A (s PEG) měly významně nižší frekvenci rehospitalizací. Naše obavy z nárůstu psychického handikepu po zavedení PEG se neprokázaly. Zavedení PEG naopak odpovídá významnému zlepšení kvality života C-30 (v obecné kvalitě života) i kvalitě života postihující nádorové onemocnění. Celkově klesá výskyt nespavosti, anxiety a zlepšuje se schopnost života v sociálním prostředí, včetně schopnosti stolovat s rodinou a přáteli. Kvalita života sledovaná ve vztahu k nádorovému onemocnění (QOL HN-35) má také trend ke zlepšování, přestože zlepšování nastupuje později než C-30. Tuto skutečnost lze vysvětlit jistě persistujícími obtížemi vlastního nádorového onemocnění a léčeného nádoru s následky onkologické léčby (mukositida). Od T12-24 nejčastěji přetrvává pocit sucha v ústech, potíže s polykáním, změny čichu a chuti, vazkost slin v obou skupinách srovnatelně (tab. 3).
Table 3. Vývoj sledovaných proměnných v čase T0-T36. 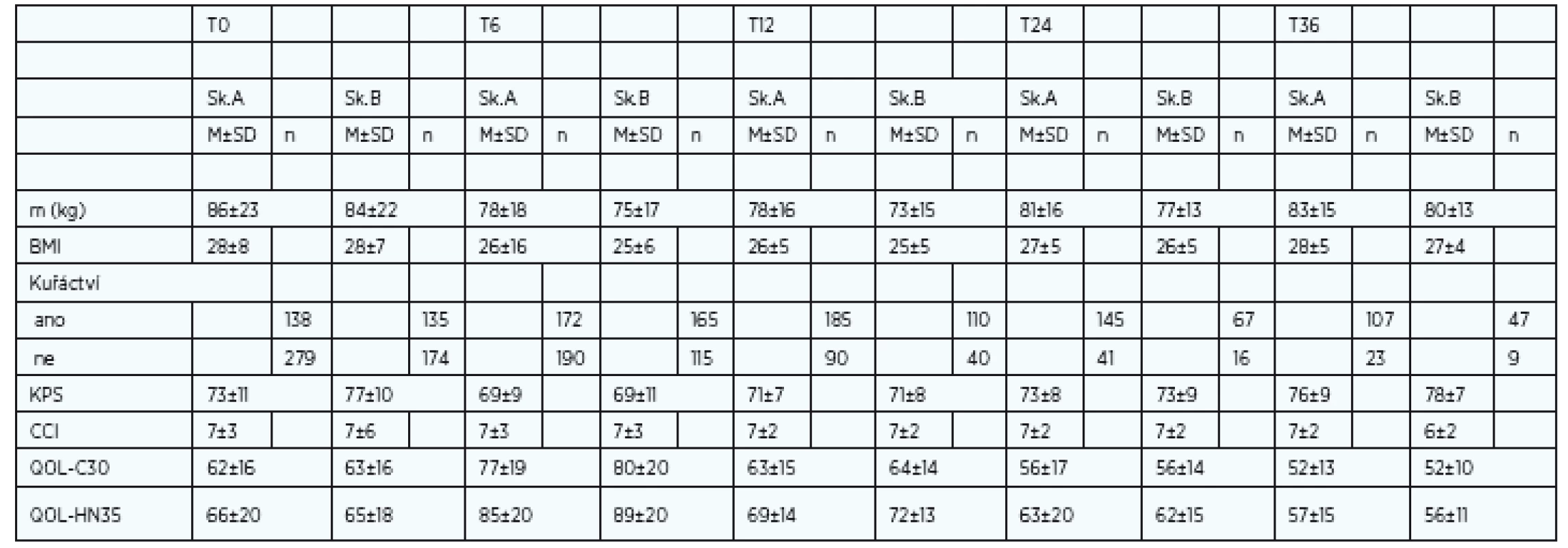
Vysvělivky: m = hmotnost, BMI = Body Mass Index, KPS = Karfnofsky Performance Status, CCI = Charleson Comorbidity Index,QOL C-30 = obecná kvalita života, QOL HN-35=Kvalita života nemocného s rakovinou hlavy a krku, skupina A = skupina s PEG, skupina B = bez PEG,M±SD =střední hodnota±směrodatná odchylka Nejvýznamnější symptomy v dotazníku QOL C-30 jsou následující:
Potíže při vykonávání namáhavějších činností
V čase T0 tento údaj udalo celkem 11 % respondentů. Mezi T6-T12 výskyt totohoto symptomu prudce narůstá (36 % nemocných, z toho 57 % mužů). Pokud šlo o kuřáky, udávali zhoršení námahy v téměř 84 % (na rozdíl od žen kuřaček). Tato obtíž regreduje od T24 setrvale až do konce našeho sledování. Zachytili významnou závislost s KPS (hodnocení fyzické výkonnosti). Nemocní, kteří udali odpověď „nikdy“ nebo „někdy“ měli vždy hodnoty QOL lepší a současně i KPS > 80 s nižší spotřebou analgetik. Statisticky významná je korelace s významností malnutrice. Hmotnostní úbytek ≥ 15 % za posledních 6 měsíců a BMI ≤ 22 je spojeno se zhoršením výsledků (p < 0,03). Tito nemocní udávali nejčastěji odpověď „často“ a „velmi často“. Zhoršení QOL odpovídá zhoršení fyzické výkonnosti dle KPS (60 < a > 80). Nejvýznamnější zhoršení QOL jsme zaznamenali v čase kontroly T6, která odpovídá i nejvyššímu zhoršení celkových výsledků hodnocení QOL a nejvyššímu výskytu i klicikých obtíží (CSS – klinické symptom skóre). Nemocní ve skupině A (s PEG) mají celkově lepší výsledky QOL i KPS a nižší hodnoty problémů dle CSS. Léčbu podle kvalty života v období T0-T6 nejlépe tolerovaly ženy nekuřačky ve skupině A. Nejhorší výsledky naopak měli muži kuřáci ve skupině B (bez PEG). Tato skupina vykázala současně nejvyšší potřebu rehospitalizací z důvodu komplikací zdravotního stavu. Délka jejich pobytu v nemocnici během prvního roku sledování (období mezi kontrolou T0-T12) byla nad 21 dnů za rok a je nejvyšší ze všech sledovaných skupin. Velice zajímavým nálezem je dále korelace horší kvality života u nemocných, kteří měli vyšší počet komorbidit dle Charleson Comorbidity Index (CCI ≥ 5). Šlo nejčastěji o kombinaci diagnóz preexistující ICHS, diabetu, hypercholesterolemie, anamnezy CMP nebo ischemické choroby tepen dolních končetin. Pokud byli pacienti malnutriční (vstupní neočekávaný pokles hmotnosti byl ≥ 10%) a současně se nacházeli v prozánětlivém stavu (infekce dle dokumentace), zvyšuje se současně i jejich kardiovaskulární morbidita a mortalita. Typickou skupinou pro tento model zhoršení jsou muži kuřáci ve skupině B (bez PEG). Pokud jsme porovnali mužské pohlaví ve skupině A a muže kuřáky, nenašli jsme žádnou obdobnou závislost.
Potíže s dechem
V čase T0 tento údaj udalo minimum nemocných (6 %). Nejvýznamnější nárůst jsme zachytili v období T6-T12 a poté následuje regrese potíží. Nejvyšší výskyt tohoto problému udávají muži kuřáci ve skupině B (bez PEG). Opět je zřejmá korelace s výkonností nemocného (KPS). Pokud poklesla pod 70, dochází k prudkému vzestupu výskytu frekvence výskytu problému. Respondenti, kteří udali odpověď „nikdy“ nebo „někdy“, měli nejlepší šanci na přežití - za předpokladu úbytku hmotnosti ≤ 10 % a současném BMI ≥ 22. Pokud nemocní udávali nejčastěji odpověď „často“ a „velmi často“, jednalo se nejčastěji o nemocné, kteří mají v anamneze komorbidity typu chronické ischemické srdeční choroby či městnavého srdečního selhání nebo chronické obstrukční nemoci. Výskyt je nejvyšší u polymorbidních nemocných, kteří mají CCI > 5 (stejně jako u předchozího problému s námahou). Tito nemocní měli nejvyšší kardiovaskulární mortalitu. V období T6-T24 bylo zhoršení tohoto problému s kladnou anamnézou zánětlivé komplikace (pneumonie) a byla udávána nemocnými s hypalbuminemií ≤ 30 g/l.
Pomoc při běžných činnostech
Toto je velmi závažný faktor ve zdravotním i sociálním kontextu. Většina pacientů nepotřebovala pomoc při běžných denních činnostech před zahájením léčby. V T0 udalo negativní odpověď 86 % dotázaných. V období T6-12 naopak pomoc druhé osoby či asistenci pečovatelské služby vyžadovalo skoro 73 % nemocných. Nejčastěji se jednalo o nemocné muže, kuřáky, ve skupině B se středoškolským a vysokoškolským vzděláním. Naopak ženy středoškolačky, nekuřačky, ve skupině A neudaly žádnou závislost na druhé osobě. Tento údaj koreluje s jejich lepší fyzickou zdatností dle KPS ≥ 70 ve všech obdobích T0-T36. Potřeba pomoci v běžných činnostech začíná klesat až od T24. Trvalá závislost na pomoci je ve skupině mužů, kteří žijí sami a jsou kuřáci. Tito byli nejčastěji hospitalizováni v LDN na dobu delší než 3 měsíce a jejich KPS bylo mezi 30-60 v období T6-T24. Poté následuje trend mírného zlepšení, včetně poklesu potřeby pobytu v LDN.
Máte bolesti?
V tomto parametru jsme nalezli zásadní rozdíl mezi muži a ženami (p < 0,02). Muži obecně významně častěji udávají bolesti. Lze říci, že bolest ženy tolerují lépe. V době nejvyššího vzestupu frekvence odpovědí „často“ u žen, který byl v období T0-T12, udalo tento problém pouze 29 % žen, ale 76 % mužů v T6 (p < 0,001), v T12 74 % mužů (vs. 33 % žen, p < 0,02), v T24 – 69 % mužů (vs. 32 % žen, p < 0,004). Kladná odpověď v této kategorii koreluje s poklesem kvality života, zhoršením fyzické zdatnosti a vzestupu CSS (klinické symptom skóre). Je zajímavé, že přestože chirurgické řešení onkologických onemocnění mezi T0 a T6 bylo obdobné z pohledu skupiny A a B i z pohledu údajů mezi pohlavími. Přesto jsme ani v této analýze nenalezli významné zhoršení u žen, zatímco u mužů je statisticky významné.
Vnímání bolesti je jedním je zásadních faktorů, ovlivňujících kvalitu života. Má souvislost i se zhoršením psychického stavu, anxietou a nespavostí. Negativní údaj o bolesti měly pouze 4 ženy nekuřačky ve skupině A v T0 a tři z nich bolest negovaly po celou dobu sledování. Údaj o bolesti nám nekoreluje s KPS. Zatímco muži udávají vyšší četnost bolesti, nedochází k současnému poklesu KPS, ale souběžně významně roste závislost na pomoci druhé osoby. Tento trend přetrvává až do T24. Přestože tento výstup navozuje dojem účelového jednání, takto bych tuto situaci nepopsala, vzhledem k závažnosti onemocnění. Naopak jako nesmírně příznivé vnímám právě to, že i přes nárůst bolesti a závislosti na dopomoci, přesto neklesá v parametrech QOL HN-35 komunikace s přáteli a schopnost stolovat s rodinou. V těchto konsekvencích snad lze „spekulovat“ o zlepšení vztahů v rámci rodiny a zlepšení vzájemné komunikace a pomoci nemocnému, včetně zájmu přátel, což považuji za nesmírně pozitivní.
Jako nejvýznamnější jsme vyhodnotili z dotazníku QOL HN-35 následující symptomy:
Bolesti v ústech
Od první návštěvy v ambulanci udalo tento symptom 72 % nemocných. Míra obtíží (často, velmi často) korelovala se stadiem onemocnění. Bolesti v ústech dále korelují i s bolestmi dle QOL C-30. V tomto parametru jsme nalezli obdobné rozdíly mezi muži a ženami (p < 0,03). Muži bolest v ústech i v krku udávají častěji. Je významná korelace s vyšší spotřebou analgetik a vyšší spotřebou tramadolových analgetik. Údaj o vnímání obecné bolesti (dle QOL C-30), bolesti v ústech a v krku (níže) je prakticky konstantní po celou dobu sledování. I tentokrát lze říci, že bolest ženy tolerují lépe než muži. V době nejvyššího vzestupu frekvence odpovědí „často“ u žen, který byl v období T0-T12, udalo tento problém pouze 33 % žen, zatímco 81 % mužů v T6 (p < 0,002), v T12 33 % žen vs. 79 % mužů (p < 0,02) a 69 % mužů (vs. 32 % žen, p < 0,006) v T24. Kladná odpověď v této kategorii koreluje s poklesem kvality života, zhoršením fyzické zdatnosti a vzestupu CSS (klinické symptom skóre). V čase sledování tento symptom společně s dysfagickými obtížemi persistuje a jeho pokles je nejméně častý. Nejčastěji ho udávají nemocní s karcinomem tonzil. Nemocní s hypofaryngeálním karcinomem tento symptom negují.
Bolest v krku
Tento symptom provázelo 52 % nemocných od počátku sledování. Jeho vzestup odpovídá souvislosti s projevem mukositidy. Anamnéza trvající bolesti nevykazuje rozdíl mezi nemocnými, kteří byli léčeni radioterapií nebo chemoterapií. Je častěji udávána u nemocných, kteří byli léčeni chirurgicky.
Nejčastěji tento symptom udávají nemocní – muži nekuřáci, kteří v době stanovení diagnózy měli již pokročilé nádorové onemocnění ve stadiu III a IV. U těchto nemocných byla bolest v krku, současně s vysokým CSS, častým znakem. Nejlepší efekt na potlačení bolesti v krku měla modalita radioterapie, protože od T12 dochází k prudkému poklesu kladných odpovědí.
Při srovnání skupiny A a B udávají nemocní ve skupině A (s PEG) více údajů (méně často) a nemocní ve skupině B „často“ (p < 0,02).
Je rozdíl i mezi pohlavími, který byl popsán opakovaně. Muži udávají vjemy bolesti obecně mnohem častěji a déle než ženy, včetně údajů o frekvenci jejího výskytu (p < 0,007). Údaj o bolesti je spojen s poklesem kvality života v C-30 i HN-35, se zhoršením fyzické zdatnosti (pokles KPS) a vzestupem CSS (klinické symptom skóre).
Problém s polykáním
Společně s bolestí v ústech je tento symptom udáván většinou mužů (86 % nemocných). Potíž v tomto parametru zcela výjimečně udává signifikantně vyšší počet žen, 82 % (p < 0,02). Při srovnání pohlaví a anamnézy kuřáctví, muži kuřáci vnímají tento problém méně častěji než muži nekuřáci (p < 0,02). Potíž s polykáním u žen ale nekoreluje s bolestí, zatímco u mužů jednoznačně (p < 0,03). Polykací obtíže, kde je současně vyšší i CSS ≥ 5 (klinické symptom skóre) persistuje až do T12. Dalším zajímavým nálezem je, že muži s VŠ vzděláním udali tento problém již při stadiu I, zatímco ostatní nemocní tuto potíž vnímají až od vyšších stadií. Nejčastěji problém udávají nemocní s rakovinou hypofaryngu. Signifikantně méně často opět problém s polykáním udávají respondenti ze skupiny A (s PEG) – 35 % vs. 64 % ve skupině B (p < 0,03). Problém s polykáním souvisí s pocitem celkového zdraví. Vývoj této potíže neodpovídá vývoji kvality života. Neprokázali jsme žádnou korelaci s laboratorními, ani jinými parametry, které jsme sledovali.
Problém se zuby
Je markantní zejména u kuřáků bez odpovídající stomatologické péče (p < 0,007). Významný je zejména v populaci se středním a základním vzděláním. U VŠ tento jsme tento problém nenalezli. Častěji zanedbaný chrup měli muži ve skupině B (p < 0,03). Problém s infekčními stomatologickými fokusy byl nejčastější příčinou nutnosti odložení onkologické léčby. V této skupině nemocných jsme nalezli současně nejvýznamnější hmotnostní úbytek > 15 % a BMI < 25. Nejvyšší frekvence problémů s chrupem udali pacienti v T0 (46 %) a od T6 nastává permanentní pokles až do T36 (12 %). Při srovnání skupiny A a B, tyto problémy byly častější ve skupině B až do T24. Problémy se zuby nekorelují s vývojem kvality života ani v jedné z modalit. Souvisí spíše s dílčími problémy (celkové zdraví, bolesti v ústech). Bohužel ale tento problém považujeme za závažný, protože souvisí s frekvencí přerušení onkologické léčby a s trendem poklesu fyzické výkonnosti, stejně jako se vzestupem potřeby dopomoci druhou osobou.
Problém jíst společně s rodinou
Je častěji udáván u nemocných v pokročilých stadiích (stadium III a IV). Zdá se, že významně koreluje s poklesem fyzické kondice (dle KPS) a nárůstem závislosti na pomoci při různých činnostech (vit QOL C-30) a pocitech celkového zdraví (viz tamtéž). Nemocní s významným poklesem KPS < 50 současně mají významný pocit poklesu celkového zdraví. Dostávají se zpravidla do sociální izolace s významným poklesem QOL v obou modulech, přestože dochází ke stabilizaci celkového zdravotního stavu. Tito nemocní, kteří vykazují vyšší závislost, jsou nejčastěji v LDN a tento pobyt patrně vysvětluje nedostupnost možnosti jíst společně s rodinou (p < 0,04). Při analýze nemocných, kteří zůstali v domácím léčebném režimu – pak nemocní ve skupině A (s PEG) zpočátku udávali odpověď spíše „často“ až ve 36 % (avšak bez významného, odpovídajícího poklesu kvality života v QOL C-30) a od T6 začíná příznivý trend trvalého poklesu negativních odpovědí ve prospěch příznivých odpovědí „nikdy“ a „někdy“ (p < 0,03). Nemocní ve skupině B (bez PEG) mají významné zvýšení odpovědí „často“ a „velmi často“, přestože jsou závislí na perorálním příjmu. Tato odpověď koreluje s vysokou frekvencí potíží s chrupem – zejména u mužů kuřáků, kteří nepřestali kouřit (p < 0,008).
ZÁVĚR
Kvalitu života považujeme za jeden klíčových faktorů života nemocných s nádorovým onemocněním, protože jsou denně konfrontováni se závažnou a život ohrožující chorobou. Sledování kvality života je důležitým nástrojem pro vybudování vzájemné důvěry a pro udržení dlouhodobé vynikající spolupráce. Vzhledem k primárnímu významu nutriční ambulance jsme kvalitu života sledovali cíleně ve dvou skupinách – z pohledu nemocného, který akceptoval zavedení PEG, a těch, kteří PEG nepřijali. Toto rozdělení poskytlo další možnosti srovnání z pohledu preexistující malnutrice, vývoje nutričního stavu a dalších klinických aspektů ve sledování 3letého horizontu. Výsledky viz tabulka 2. Různé způsoby léčby nádorových onemocnění ovlivňují život nemocného ve všech jeho aspektech (40–43). Nicméně výsledky ukazují na přínos nutriční péče, včetně výhodnosti zavedení PEG. Nepopiratelný je fakt, že onkologicky nemocný člověk zůstává nemocným i po úspěšně ukončené onkologické léčbě. Prokázali jsme, že negativní vliv na průběh léčby onkologického nemocného mají následující znaky: věk > 63 let, mužské pohlaví, hypofaryngeální karcinom ve stadiu III nebo IV, základní vzdělání, trvalé kouření, úbytek hmotnosti > 5 % z obvyklé hmotnosti, BMI ≥ 30 nebo BMI < 21 v čase T0 a skupina B (bez PEG).
Adresa ke korespondenci:
MUDr. Eva Malá
ÚKIA
Fakultní nemocnice Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: eva.taita@seznam.cz
Sources
1. Study protocol for the World Health Organization project to develop a Quality of Life assessment instrument (WHOQOL). Qual Life Res 2, 1993, s. 153-159.
2. The World Health Organization Quality of Life assessment (WHOQOL): position paper from the World Health Organization. Soc Sci Med 41, 1995, s. 1403-1409.
3. What quality of life? The WHOQOL Group. World Health Organization Quality of Life Assessment. World Health Forum 17, 1996 s. 354-356.
4. The World Health Organization Quality of Life Assessment (WHOQOL): development and general psychometric properties. Soc. Sci. Med., 46, 1998, s. 1569-1585.
5. www.svod.cz 2015. Ref Type: Online Source.
6. Aaronson, N. K. et al.: Quality of life: what is it? How should it be measured? Oncology (Williston Park), 64, 1988, s. 69-76
7. Aaronson, N. K. et al.: Quality of life assessment in clinical trials: methodologic issues. Kontrol. Clin. Trials, 10, 1989, s. 195-208.
8. Aaronson, N. K. et al.: Quality of life research in cancer clinical trials: a need for common rules and language. Oncology (Williston Park), 4, 1990, s. 59-66.
9. Aaronson, N. K. et al.: Methodologic issues in assessing the quality of life of cancer patients. Cancer, 67, 1991, s. 844-850.
10. Aaronson, N. K., Ahmedzai, S., Bergman, B. et al.: The European Organization for Research and Treatment of Cancer QLQ-C30: a quality-of-life instrument for use in international clinical trials in oncology. J. Natl. Cancer Inst., 85, 1993, s. 365-376.
11. Aaronson, N. K., Bullinger, M., Ahmedzai, S.: A modular approach to quality-of-life assessment in cancer clinical trials. Recent Results Cancer Res., 111, 1988, s. 231-249.
12. Aaronson, N. K., Meyerowitz, B. E., Bard, M. et al.: Quality of life research in oncology. Past achievements and future priorities. Cancer, 67, 1991, s. 839-843.
13. Aaronson, N. K., Snyder, C. et al.: Using patient-reported outcomes in clinical practice: proceedings of an International Society of Quality of Life Research conference. Qual Life Res., 17, 2008, s. 1295.
14. Aaronson, N. K., Sprangers, M. A. et al.: Measuring quality of life in every oncological patient. Ned Tijdschr Geneeskd, 155, 2011, A3749.
15. Arunachalam, D., Thirumoorthy, A., Devi, S. et al.: Quality of life in cancer patients with disfigurement due to cancer and its treatments. Indian J. Pallia. Care, 17, 2011, s. 184-190.
16. Billington, D. R., Landon, J., Krageloh, C. U. et al.: The New Zealand World Health Organization Quality of Life (WHOQOL) Group. N Z Med. J., 123, 2010, s. 65-70.
17. Bjordal, K., Hammerlid, E., Ahlner-Elmqvist, M. et al.: Quality of life in head and neck cancer patients: validation of the European Organization for Research and Treatment of Cancer Quality of Life Questionnaire-H&N35. J. Clin. Oncol., 17, 1999, s. 1008-1019.
18. Bossola, M. et al.: Nutritional Interventions in head and neck cancer patients undergoing chemoradiotherapy: A narrative review. Nutrients, 7, 2015, s. 265-276.
19. Bozzetti, F. et al.: Nutrition and gastrointestinal cancer. Curr. Opin. Clin. Nutr. Metab. Care, 4, 2001, s. 541-546.
20. Bozzetti, F. et al.: Quality of life and enteral nutrition. Curr. Opin. Clin. Nutr. Metab. Care, 11, 2008, s. 661-665.
21. Bozzetti, F. et al.: Management of cancer cachexia. Tumori, 100, 2014, e1.
22. Bozzetti, F. et al.: Nutritional supplementation in advanced cancer patients: Re: „Influence of a nutritional intervention on dietary intake and quality of life in cancer patients“. Nutrition, 30, 2014, s. 957-958.
23. Bozzetti, F. et al.: Nutrition, hydration, and patient‘s preferences at the end of life. Support Care Cancer, 2015, Suppl.
24. Bozzetti, F., Arends. J., Lundholm, K. et al.: ESPEN Guidelines on Parenteral Nutrition: non-surgical oncology. Clin. Nutr., 28, 2009, s. 445-454.
25. Bozzetti, F., Cozzaglio, L., Gavazzi, C. et al.: Nutritional support in patients with cancer of the esophagus: impact on nutritional status, patient compliance to therapy, and survival. Tumori, 84, 1998, s. 681-686.
26. Bozzetti, F., Cozzaglio, L., Gavazzi, C. et al.: Total nutritional manipulation in humans: report of a cancer patient. Clin. Nutr., 15,1996, s. 207-209.
27. Bozzetti, F., Gavazzi, C., Mariani, L. et al.: Artificial nutrition in cancer patients: which route, what composition? World J. Surg., 23,1999, s. 577-583.
28. Cacicedo, J., Casquero, F., Martinez-Indart, L. et al.: A prospective analysis of factors that influence weight loss in patients undergoing radiotherapy. Chin. J. Cancer, 33, 2014, s. 204-210.
29. Capuano, G., Gentile, P. C., Bianciardi, F. et.al.: Prevalence and influence of malnutrition on quality of life and performance status in patients with locally advanced head and neck cancer before treatment. Support Care Cancer, 18, 2010, s. 433-437.
30. Charlson, M., Szatrowski, T. P., Peterson, J. et al.: Validation of a combined comorbidity index. J. Clin. Epidemiol., 47,1994, s. 1245-1251.
31. Charlson, M., Wells, M. T., Ullman, R. et al.: The Charlson comorbidity index can be used prospectively to identify patients who will incur high future costs. PLos One, 9. 2014, e112479.
32. Denaro, N., Merlano, M. C., Russi, E. G. et al.: Dysphagia in head and neck cancer patients: Pretreatment evaluation, predictive factors, and assessment during radio-chemotherapy, recommendations. Clin. Exp. Otorhinolaryngol., 6, 2013, s. 117-126.
33. Dodesini, A. R., Benedini, S., Terruzzi, I. et al.: Protein, glucose and lipid metabolism in the cancer cachexia: A preliminary report. Acta Oncol., 46, 2007, s. 118-120.
34. Dusek, L., Pavlik, T., Májek, O. et al.: Odhady incidence, prevalence a počtu onkologických pacientů léčených protinádorovou terapií v letech 2015-2020, analýza Národního onkologického registru . Klin. Onkol., 28, 2015, 1, s. 30-43.
35. Dusek, L., Muzik, J., Gelnarova, E. et al.: Cancer incidence and mortality in the Czech Republic. Klin. Oncol., 23, 2010, s. 311-324.
36. Fearon, K., Arends, J., Baracos, V. et al.: Understanding the mechanisms and treatment options in cancer cachexia. Nat. Rev. Clin. Oncol., 10, 2013, s. 90-99.
37. Fearon, K., Strasser, F., Anker, S. D. et al.: Definition and classification of cancer cachexia: an international consensus. Lancet Oncol., 12, 2011, s. 489-495.
38. Galbraith, J. K. et al.: Economics and the quality of life. Science, 14, 1964, s. 145, 117-123.
39. Gaziano, J. E. et al.: Evaluation and management of oropharyngeal Dysphagia in head and neck cancer. Cancer Control., 9, 2002, s. 400-409.
40. Johnson, G., Salle, A., Lorimier, G. et al.: Cancer cachexia: measured and predicted resting energy expenditures for nutritional needs evaluation. Nutrition, 24, 2008, s. 443-450.
41. Karnofsky, D. A., Ellison, R. R., Golbey, R. B. et al.: Selection of patients for evaluation of chemotherapeutic procedures in advanced cancer. J. Chronic. Dis., 15, 1962, s. 243-249.
42. Karnofsky, D. A., Rawson, R. W. et al.: Symposium on the medical aspects of cancer; introduction. Med. Clin. North Am., 40, 1956, s. 575-579.
43. Laviano, A., Renvyle, T., Yang, Z. J. et al.: From laboratory to bedside: new strategies in the treatment of malnutrition in cancer patients. Nutrition, 12, 1996, s. 112-122.
44. Lochs, H., Valentini, T., Schutz, S. P. et al.: ESPEN Guidelines on adult enteral nutrition . Clinical Nutrition, 25, 2015, s. 177-360.
45. Lochs, H, Allison, S. P., Meier, R. et al.: Introductory to the ESPEN Guidelines on Enteral Nutrition: Terminology, definitions and general topics. Clin. Nutr., 25, 2006, s. 180-186.
46. Loser, C., Aschl, G., Hebuterne, X. et al.: ESPEN guidelines on artificial enteral nutrition--percutaneous endoscopic gastrostomy (PEG). Clin. Nutr., 24, 2005, s. 848-861.
47. Lovik, A., Almendingen, K., Dotterud, M. et al.: (Dietary information after radiotherapy of head and neck cancer). Tidsskr Nor Laegeforen, 116, 1996, s. 2303-2306.
48. Meier, R. et al.: Enteral feeding in tumor patients. Schweiz Med Wochenschr., 125, 1995, s. 159-162.
49. Power, M. J., Green, A. M.: Development of the WHOQOL disabilities module. Qual. Life Res., 19, 2010, s. 571-584.
50. Prevost, V., Joubert, C., Heutte, N. et al.: Assessment of nutritional status and quality of life in patients treated for head and neck cancer. Eur. Ann. Otorhinolaryngol. Head Neck Dis., 131, 2014, s. 113-120.
51. Ravasco, P. et al.: Cancer and nutrition: key determinants of quality of life. Eur. J. Cancor, 45, 2009, Suppl 1, s. 409.
52. Ravasco, P., Monteiro-Grillo, I., Marques, V. P. et al.: Quality of life in gastrointestinal cancer: what is the impact of nutrition?. Acta Med. Port., 19, 2006, s. 189-196.
53. Takenaka, Y., Takemoto, N., Nakahara, S. et al.: Prognostic significance of body mass index before treatment for head and neck cancer. Head Neck, 9, 2014, s. 224-311.
54. Takenaka, Y., Yamamoto, M., Nakahara, S. et al.: Factors associated with malnutrition in patients with head and neck cancer. Acta Otolaryngol., 134, 2014, s. 1079-1085.
55. van Bokhorst,-de van der Schuer, van Leeuwen, P. A., Kuik, D. J. et al.: The impact of nutritional status on the prognoses of patients with advanced head and neck cancer. Cancer, 86, 1999, s. 519-527.
56. van den Berg, M. G., Rasmussen-Conrad, E. L., van N. L. et al.: A prospective study on malnutrition and quality of life in patients with head and neck cancer. Oral Oncol., 44, 2008, s. 830-837.
57. van den Berg, M. G., Rutten, H., Rasmussen-Conrad, E. L. et al.: Nutritional status, food intake, and dysphagia in long-term survivors with head and neck cancer treated with chemoradiotherapy: a cross-sectional study. Head Neck, 36, 2014, s. 60-65.
58. van den Berg, E. J. et al.: Nutrition and cancer: physiological interrelationships. Ann. Rev. Nutr. 5, 1985, s. 435-461.
Labels
Audiology Paediatric ENT ENT (Otorhinolaryngology)
Article was published inOtorhinolaryngology and Phoniatrics

2016 Issue 1-
All articles in this issue
- Flexibilní endoskopie horních dýchacích cest v léky navozeném spánku
- Nosní tamponády – přehled materiálů
- Vizuálně podporovaná audiometrie Behaviorální metoda vyšetřování sluchu malých dětí
- Klinické využití nové audiometrické metody – vizuálně podporovaná audiometrie
- Význam exprese C kit a MYB genu pro diagnostiku, prognózu a léčbu adenoidně cystických karcinomů slinných žláz – současná úroveň výzkumu a jeho aplikace v praxi
- Slizničný malígny melanóm nosnej dutiny
- Diagnostika Menierovej choroby pomocou objektívnych vyšetrovacích metód
- Kvalita života nemocných s rakovinou hlavy a krku ve tříletém sledování nutriční ambulancí
- Mikrobiologické nálezy u dětí s adeno-tonzilární hypertrofií
- Peritonzilární komplikace akutních zánětů patrových tonzil (retrospektivní studie)
- Otorhinolaryngology and Phoniatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nosní tamponády – přehled materiálů
- Peritonzilární komplikace akutních zánětů patrových tonzil (retrospektivní studie)
- Diagnostika Menierovej choroby pomocou objektívnych vyšetrovacích metód
- Flexibilní endoskopie horních dýchacích cest v léky navozeném spánku
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

