-
Medical journals
- Career
Vliv koncentrace na transdermální absorpci pyrenu in vitro
Authors: L. Kotingová 1; V. Voříšek 2; Eva Čermáková 3; L. Borská 4; Z. Fiala 1
Authors‘ workplace: Ústav hygieny a preventivního lékařství, Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové, přednostka doc. MUDr. Jindra Šmejkalová, CSc. 1; Ústav klinické biochemie a diagnostiky, Fakultní nemocnice Hradec Králové, přednosta prof. MUDr. Vladimír Palička, CSc. 2; Oddělení výpočetní techniky, Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové, vedením pověřený Ing. Jiří Špulák 3; Ústav patologické fyziologie, Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové, přednosta prof. MUDr. Miroslav Kuba, DrSc. 4
Published in: Pracov. Lék., 64, 2012, No. 1, s. 18-22.
Category: Original Papers
Overview
Cílem experimentu bylo zjistit vliv koncentrace pyrenu na transdermální absorpci in vitro. K testování byla použita statická difuzní komůrka o objemu 10 ml, s absorpční plochou 1,77 cm2. Penetrační membránu tvořila kůže zadní strany ušního boltce prasete. Byly testovány tři donorové koncentrace pyrenu (0,00095 a 0,0095 a 0,095 g pyrenu/g acetonu). Receptorová tekutina se skládala z Hanksova roztoku, bovinního sérového albuminu a gentamicinu a byla odebírána v intervalu 12, 24, 48 a 72 hodin. Vzorky byly analyzovány pomocí plynové kapilární chromatografie ve spojení s hmotovým spektrometrem. Koncentrace pyrenu v receptorové tekutině narůstala s prodlužující se dobou expozice, rozdíly mezi jednotlivými použitými koncentracemi však nedosáhly statisticky významných hodnot. Statisticky významně rozdílné byly pouze hodnoty lag time (p = 0,047; α = 0,05).
Klíčová slova:
kůže – in vitro absorpce – pyren – polycyklické aromatické uhlovodíkyÚVOD
Kůže představuje největší orgán lidského těla, který je trvale vystaven působení zevních faktorů. Ty mohou působit buď lokálně, kdy bývá zasažen většinou povrch rukou a obličeje, nebo celkově. Celotělové expozice jsou méně časté a vyskytují se v případech silně kontaminovaného oděvu (např. pracovního) nebo v situacích, kdy převážná část těla není oděvem dostatečně chráněna.
Polycyklické aromatické uhlovodíky (PAU) jsou součástí velkého množství směsí vyskytujících se v životním a pracovním prostředí. Příkladem mohou být směsi vznikající při zpracování ropy a uhlí, při spalování fosilních paliv v průmyslových a energetických technologiích a při spalování pohonných směsí v dopravě. Jsou přítomny v kamenouhelném dehtu, asfaltu, minerálních olejích a vazelínách [10]. Skupinu PAU tvoří zhruba 400 látek, z nichž některé disponují mutagenním, karcinogenním a imunosupresivním potenciálem [2, 3, 4, 15]. PAU se v životním nebo pracovním prostředí nevyskytují jednotlivě, ale téměř vždy ve směsích. Významnou standardní součástí těchto směsí je i námi testovaný uhlovodík pyren, který je používán jako ukazatel úrovně expozice PAU [6]. Dermálně vstřebané množství PAU může dosahovat značných hodnot. Van Rooij et al. [16] odhadují, že podíl dermálně vstřebaných PAU může při simultánní inhalační a dermální expozici pracovníků koksáren dosahovat až 75 %. Walter a Knecht [17] uvádějí 50–60% podíl dermálně vstřebaných PAU. Toxikokinetické údaje o mechanismech dermální expozice PAU jsou zatím poměrně omezené.
Předkládaná experimentální studie je součástí širšího výzkumu, zaměřeného na hodnocení absorpce a účinků dermálně aplikovaných přípravků na bázi kamenouhelného dehtu. Studie má toxikokinetický charakter a byla zaměřena na sledování vlivu koncentrace na základní charakteristiky dermální absorpce pyrenu.
MATERIÁL A METODIKA
Chemické látky
V experimentech byly použity pyren, aceton, Hanksův roztok (Hanks’ balanced salt solution), bovinní sérový albumin a gentamicin (Sigma-Aldrich). Všechny látky byly na úrovni čistoty pro HPLC nebo fluorescenci.
Byly připraveny tři roztoky pyrenu v acetonu (donorová tekutina). První koncentrace (0,00095 g pyrenu v 1 g acetonu) odpovídala 5 % koncentrace pyrenu v dehtu. Druhá koncentrace byla 10krát vyšší (0,0095 g pyrenu v 1 g acetonu) a třetí byla 100krát vyšší (0,095 g pyrenu na 1 g acetonu). Množství pyrenu ve farmaceutickém dehtu bylo stanoveno pomocí plynové chromatografie s hmotnostní detekcí GC-MS (Hewlett Packard 5890/5971A). Analyzován byl směsný vzorek tvořený pěti náhodně odebranými vzorky farmaceutického kamenouhelného dehtu (lékárna Fakultní nemocnice v Hradci Králové). Směsný vzorek obsahoval 1,9 g pyrenu/100 g dehtu.
Kůže
Jako absorpční membrána byla použita kůže z ušního boltce prasete. V pokusu byly použity vzorky kůže od tří různých jedinců. Uši byly zakoupeny na lokálních jatkách a byly zpracovány do 4 hodin od usmrcení zvířete. Před experimentem byly omyty vlažnou tekoucí vodou a ostříháním zbaveny viditelných chlupů. Potom byla pomocí chirurgického skalpelu a nůžek odpreparována kůže na zadní straně boltce. Po důkladné vizuální kontrole stavu kůže byla tato rozdělena na menší kousky, jež byly ihned instalovány do statické difuzní komůrky [11] epidermální stranou nahoru.
Experimentální postup, analýzy a statistické vyhodnocení
Experimenty probíhaly ve standardních laboratorních podmínkách při teplotě 22–23 °C a relativní vlhkosti vzduchu 50–60 %. Receptorová část difuzní komůrky (o objemu 10 ml) byla naplněna receptorovou tekutinou (Hanksův roztok + 4 % bovinního sérového albuminu + gentamicin v koncentraci 50 mg/l) a bylo přidáno magnetické míchadlo pro zajištění trvalého pohybu tekutiny. Absorpční plocha kůže činila 1,77 cm2. V souladu s požadavky OECD [14] a EU [9] bylo v experimentu použito 6 komůrek s kůžemi od tří odlišných dárců (celkem 18 komůrek + 3 kontrolní, kde byl aplikován pouze aceton). Komůrky byly umístěny do temperované vodní lázně, zajišťující stálou teplotu kožního povrchu v rozmezí 31 ± 1 °C [13]. Zde kůže 1 hodinu hydratovala. Po uplynutí této doby byl hodnocen stav vnitřní struktury kožních vzorků. Byly hodnoceny transepidermální ztráty vody [8] (TEWL (transepidermal water lost); přístrojem MPA 5, Courage-Khazaka, Německo) a byl měřen elektrický odpor kůže [7] (TER (transcutaneous electrical resistance); přístrojem TECPEL LCR612, Tecpel Co, Taiwan). Nevyhovující vzorky kůže byly vyměněny. Po tomto kroku bylo do donorové části komůrky (na horní část epidermis) aplikováno 100 μl roztoku testované látky (pyren rozpuštěný v acetonu v koncentracích 0,00095 a 0,0095 a 0,095 g pyrenu/g acetonu). Testovaná látka byla ponechána bez okluze po celou dobu trvání pokusu. Po 12, 24, 48 a 72 hodinách byly z každé komůrky odebrány 2 ml receptorové tekutiny a ihned zamrazeny na 20 °C. Odebrané množství tekutiny bylo nahrazeno novou receptorovou tekutinou. Před posledním odběrem receptorové tekutiny byl vyšetřením TEWL a TER opětovně ověřen stav kůže. Po 72 hodinách byl pokus ukončen.
V odebraných vzorcích receptorové tekutiny byla stanovena koncentrace pyrenu pomocí plynové kapilární chromatografie ve spojení s hmotovým spektrometrem na principu iontové pasti s vnější ionizací a možností skenu MSn (Focus - ITQ 1100, Thermo Fischer Scientific). Před nástřikem byl pyren ze vzorku extrahován dvoustupňově (2 x 5 ml) etylacetátem (PESTANAL, Fluka), centrifugován při 4000 ot/min po dobu 5 minut. Supernatant byl dán k vysušení ve vakuové odparce, odparek rekonstituován v n-hexanu (iso-hexanes, PESTANAL, FLUKA) v poměru 190 μl hexanu + 100 μl derivační směsi BSTFA+TMCSi (Sigma-Aldrich). Následovala inkubace při 70 °C po dobu 30 minut a nástřik 1 μl derivatizované směsi na systém GC-MS. Pro kvantifikaci byla použita metoda izotopového zředění značeným (I.S.-d7) vnitřním standardem (1 naphthol-2,3,4,5,6,7,7,8-d7, ISOTEC) o výsledné koncentraci 20 ng/ml (1350 μl vzorku + 150 μl I.S. d7).
Ke statistickému vyhodnocení provedeného experimentu byl použit program NCSS 2007. Byla provedena jednofaktorová analýza rozptylu (ANOVA). Vzhledem k nenormálnímu rozložení získaných dat byla pro výpočet hladiny významnosti použita Kruskalova-Wallisova neparametrická analýza rozptylu.
VÝSLEDKY
Koncentrace pyrenu získané ze vzorků receptorové tekutiny byly přepočteny na množství pyrenu absorbovaného v jednotlivých časových intervalech expozice za 12, 24, 48 a 72 hodin přes jednotku absorpční plochy (nmol/cm2/čas). Z výsledků byly vypočítány parametry absorpce, dané hodnotou „flux“, která udává průměrnou rychlost absorpce v závislosti na absorpční ploše (nmol/cm2/hod) a hodnotou „lag time“, která udává čas potřebný k průniku testované látky do receptorové tekutiny. Tento čas odpovídá době, za kterou se látka v podmínkách in vivo dostane do systémové cirkulace organismu. Přehled výsledků uvádí tabulka 1.
Table 1. Množství absorbovaného pyrenu v závislosti na délce expozice, flux a lag time 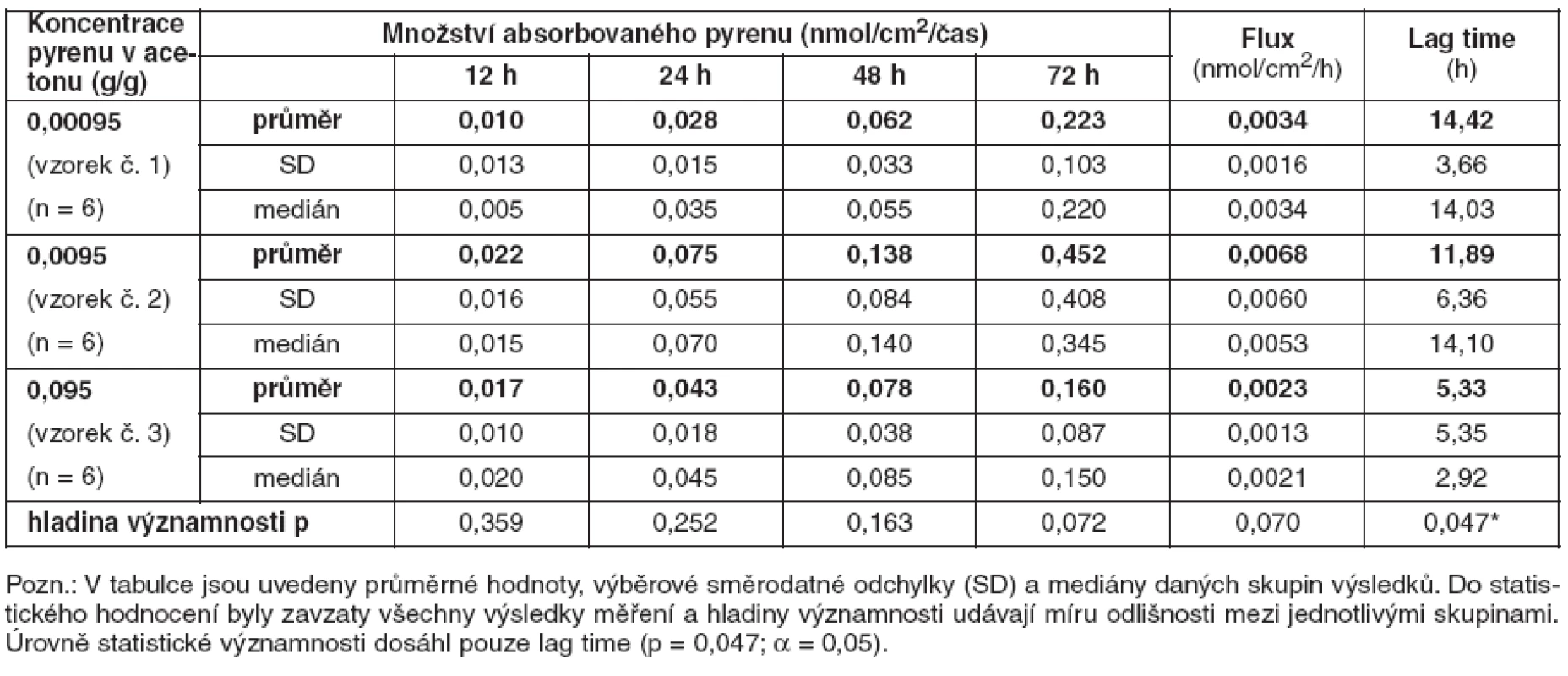
Množství absorbovaného pyrenu narůstalo s prodlužující se dobou expozice. Některá data naznačila trend ve smyslu vyšších receptorových koncentrací, vyšší rychlosti absorpce a kratšího penetračního času u vzorků s vyššími donorovými koncentracemi. Nicméně významně rozdílné byly pouze hodnoty lag time (p = 0,047; α = 0,05).
V pokuse byly použity vzorky kůží od tří různých jedinců. Z tohoto důvodu byl hodnocen i vliv „dárce“ kůže na rychlost a úroveň absorpce pyrenu. Statisticky významné rozdíly v rychlosti a úrovni absorpce pyrenu však nebyly nalezeny.
DISKUSE
Průchod látek přes kůži se děje na základě pasivní difuze [18]. Hnacím „motorem“ pasivní difuze je koncentrační gradient mezi dvěma fázemi. Na tomto základě bylo možno předpokládat, že vyšší koncentrace pyrenu v donorovém roztoku budou indukovat vyšší rychlost přestupu pyrenu přes kožní bariéru [1]. Výsledky naší studie však tyto předpoklady nepotvrdily. Domníváme se, že výše popsané nálezy lze částečně vysvětlovat na základě anatomické struktury kůže. Kůže se vzhledem k absorpci látek chová jako dvoukompartmentový model. Prvním kompartmentem je epidermální stratum corneum, jež je lipofilní. Druhým kompartmentem jsou zbývající vrstvy epidermis a dermis, které jsou hydrofilní [8]. Transport látek přes epidermis probíhá převážně pasivní difuzí látek v mezibuněčných prostorech (první cesta penetrace). Část penetrující látky (druhá cesta) může procházet cestou transcelulární skrze těla korneocytů a keratinocytů. Tato cesta je však časově náročná, neboť látka musí procházet jak přes lipofilní extracelulární prostor, tak přes buněčné stěny a hydrofilní vnitřní prostor buňky. Není tudíž příliš vhodná pro lipofilní látky, které se ve vodném prostředí uvnitř buňky obtížně rozpouští. Vzhledem k tomu, že pyren patří mezi látky lipofilní, můžeme podíl této formy transportu pyrenu považovat za velmi malý až zanedbatelný. Třetí možnou cestou transdermální penetrace je průnik látky cestou vlasových folikulů a vývodů mazových a potních žláz na kůži. Tyto však zabírají pouze 0,1 % tělesného povrchu a díky tomu není ani tato cesta na většině tělesného povrchu významná pro průnik látky z externího prostředí (význam má pouze při absorpci látek skrze vlasatou část hlavy) [19].
Pro bariérové funkce, sloužící k zabránění průniku cizorodých látek z okolního prostředí do vnitřního prostředí organismu, má největší význam stratum corneum (SC). Je tvořeno několika vrstvami plochých polygonálních „buněk“ (v průměru 15–20), které již nemají jádro ani další intraplazmatické organely. Pro bariérovou funkci je nejdůležitější dolní třetina SC. Horní třetina SC je tvořena odlupujícími se korneocyty, které bariérovou funkci již téměř neplní. Střední třetina představuje přechod mezi dolní a horní třetinou a její bariérová funkce se postupně snižuje. Snadnější průnik skrze tuto bariéru mají lipofilní látky a látky o malé molekulové hmotnosti do 500 Daltonů [5]. Molekulová hmotnost pyrenu je 202,26, neměl by tudíž být svojí velikostí limitován. Při průchodu látky pasivní difuzí intercelulárními prostory musí látka překonat vzdálenost mezi povrchem kůže a bazální membránou epidermis, jež je odhadována na 100–150 μm [19] nebo až 500 μm [12]. Vzhledem k tomu, že tyto prostory mají určitou „kapacitu“, je možné se domnívat, že při pasivní difuzi se úroveň transportu látek zvyšuje pouze do té doby, než je daná kapacita naplněna.
Námi zjištěné průměrné hodnoty absorpce různých koncentrací pyrenu se v jednotlivých časových intervalech statisticky významně neliší. Na základě těchto údajů se lze domnívat, že již koncentrace pyrenu č. 1 (0,00095 g pyrenu/1 g acetonu) by mohla mít dostatečnou kapacitu k saturování transportních mechanismů dermální absorpce. Výše uvedené vysvětlení však není v úplném souladu s trendem pozorovaným u doby potřebné k penetraci pyrenu do receptorové tekutiny (lag time). Se zvyšující se koncentrací pyrenu v donorovém roztoku zde došlo ke zkracování průměrného „lag time“ z 14,42 hodiny u vzorku č. 1, přes 11,89 hodiny u vzorku č. 2 až na 5,33 hodiny u vzorku č. 3. Pokles dosáhl hladiny statistické významnosti (p = 0,047; α = 0,05).
ZÁVĚR
Studie byla zaměřena na sledování vlivu koncentrace na základní charakteristiky dermální absorpce pyrenu. Výsledky naznačují trendy ve smyslu vyšších absorpčních (receptorových) koncentrací, vyšší rychlosti absorpce a kratšího penetračního času u experimentů s vyššími expozičními (donorovými) koncentracemi pyrenu. Lze se domnívat, že na celkové množství vstřebaného pyrenu má významnější vliv expoziční (aplikační) plocha než koncentrace pyrenu v expozičním (donorovém) médiu.
Seznam použitých zkratek a odborných výrazů bez českého ekvivalentu:
EU – Evropská unie
Flux – průměrná rychlost absorpce (nmol/cm2/h)
Lag time – doba potřebná k transdermálnímu průniku látky do receptorové tekutiny (v in vitro experimentu) nebo do systémové cirkulace (za in vivo podmínek)
OECD – Organizace pro hospodářskou spolupráci a rozvoj (Organisation for Economic Co-operation and Development)
PAU – polycyklické aromatické uhlovodíky
SC – rohová vrstva pokožky (stratum corneum)
TER – elektrický odpor kůže (transcutaneous electrical resistance)
TEWL – transepidermální ztráta vody (transepidermal water lost)
Práce byla finančně podporována Univerzitou Karlovou v Praze, Lékařskou fakultou v Hradci Králové v rámci projektu PRVOUK.
Došlo dne 8. 12. 2011.
Přijato do tisku dne 28. 12. 2011.
Kontaktní adresa:
MUDr. Lenka Kotingová
Ústav hygieny a preventivního lékařství
Šimkova 870
500 38 Hradec Králové
e-mail: kotingoval@lfhk.cuni.cz
Sources
1. BENSON, H. A. Transdermal drug delivery: penetration enhancement techniques. Curr. Drug. Deliv., 2005, 2, 1, s. 23–33.
2. BOSETTI, C., BOFFETTA, P., LA VECCHIA, C. Occupational exposures to polycyclic aromatic hydrocarbons, and respiratory and urinary tract cancers: a quantitative review to 2005. Ann. Oncol., 2007, 18, 3, s. 431–446.
3. BOFFETTA, P., JOURENKOVA, N., GUSTAVSSON, P. Cancer risk from occupational and environmental exposure to polycyclic aromatic hydrocarbons. Cancer Causes Control., 1997, 8, 3, s. 444–472.
4. BORSKÁ, L., ANDRÝS, C., KREJSEK, J., HAMÁKOVÁ, K., KREMLÁČEK, J., RANNÁ, D., KOTINGOVÁ, L., FIALA, Z. Plasma levels of p53 protein and chromosomal aberrations in patients with psoriasis treated with the Goeckerman regiment. Clin. Exp. Dermatol., 2009, 34, 8, s. e881–883.
5. BOS, J. D., MEINARDI, M. M. The 500 Dalton rule for the skin penetration of chemical compounds and drugs. Exp. Dermatol., 2000, 9 (3), s. 165–169.
6. BRANDT, H. C., WATSON, W. P. Monitoring human occupational and environmental exposures to polycyclic aromatic compounds. Ann. Occup. Hyg., 2003, 47 (5), s. 349–378.
7. DAVIES, D. J., WARD, R. J., HEYLINGS, J. R. Multi-species assessment of electrical resistance as a skin integrity marker for in vitro percutaneous absorption studies. Toxicol. In Vitro, 2004, 18 (3), s. 351–358.
8. ELMAHJOUBI, E., FRUM, Y., ECCLESTON, G. M., WILKINSON, S. C., MEIDAN V. M. Transepidermal water loss for probing full-thickness skin barrier function: correlation with tritiated water flux, sensitivity to punctures and diverse surfactant exposures. Toxicol. In Vitro, 2009, 23 (7), s. 1429–1435.
9. EU-SCCP: Basic criteria for the in vitro assessment of dermal absorption of cosmetic ingredients. Brusel, 2006.
10. FIALA, Z., VYSKOČIL, A., KRAJÁK, V., MAŠÍN, V., EMMINGER, S., SRB, V., TEJRAL, J. Polycyklické aromatické uhlovodíky I. Kontaminace prostředí a expozice osob. Acta Medica Suppl., 1999, 42, s. 77–89.
11. FRANZ, T. J. Percutaneous absorption on the relevance of in vitro data. J. Invest. Dermatol., 1975, 64 (3), s. 190–195.
12. HADGRAFT, J. Skin deep. Eur. J. Pharm. Biopharm., 2004, 58, 2, s. 291–299.
13. OECD: Guidance document for the conduct of skin absorption studies. OECD Environmental Health and Safety Publications, Series on Testing and Assessment No. 28. Paris, 2004.
14. OECD: Guideline for testing of chemicals – Guideline 428: Skin absorption: In vitro method. Paris, 2004.
15. ROOS, P. H., BOLT H, M. Cytochrome P450 interactions in human cancers: new aspects considering CYP1B1. Expert. Opin. Drug. Metab. Toxicol., 2005, 1, 2, s. 187–202.
16. VANROOIJ, J. G., BODELIER-BADE, M. M., JONGENEELEN, F. J. Estimation of individual dermal and respiratory uptake of polycyclic aromatic hydrocarbons in 12 coke oven workers. Br. J. Ind. Med., 1993, 50, 7, s. 623–632.
17. WALTER, D., KNECHT, U. Standardized investigation of percutaneous absorption of bitumen emission in humans. J. Occup. Environ. Hyg., 2007, 4, S1, s. 144–153.
18. WHO: Environmental Health Criteria 235 – Dermal Absorption. Ženeva: WHO Press, 2006.
18. WILLIAMS, A. C. Transdermal and topic drug delivery. Londýn: Pharmaceutical Press, 2003, 242 s.
Labels
Hygiene and epidemiology Hyperbaric medicine Occupational medicine
Article was published inOccupational Medicine

2012 Issue 1-
All articles in this issue
- Kliešťová encefalitída z pohľadu profesie – desaťročná analýza hlásených prípadov v Epidemiologickom informačnom systéme SR
- Retrospektívny pohľad na epidemiológiu profesionálnych ochorení dýchacích ciest. Aký bude vývoj v ďalších rokoch?
- Vliv koncentrace na transdermální absorpci pyrenu in vitro
- Nový přístup k hodnocení tepelně vlhkostních podmínek na pracovištích
- Problematika užívání drog v pracovnělékařské péči
- Onemocnění pohybového systému horních končetin u referentky při zadávání dat do počítače
- Exogenní alergická alveolitida – kazuistika
- Závodní preventivní péče v praxi – včasná diagnostika sarkomu měkkých tkání u zdravotníka
- VIth Congress of Occupationalk Diseases with International Participation
- Vliv hyperbarické oxygenoterapie na nehojící se defekty
- Occupational Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Onemocnění pohybového systému horních končetin u referentky při zadávání dat do počítače
- Vliv hyperbarické oxygenoterapie na nehojící se defekty
- Problematika užívání drog v pracovnělékařské péči
- Exogenní alergická alveolitida – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

