-
Medical journals
- Career
Metastáza maligního melanomu v páteři detekovaná pomocí SPECT/CT při galliové scintigrafii
: Otto Lang 1; Martin Krbec 2
: Klinika nukleární medicíny, Universita Karlova, 3. LF a FN Královské Vinohrady, Praha 1; Ortopedicko-traumatologická klinika, Universita Karlova, 3. LF a FN Královské Vinohrady, Praha 2
: NuklMed 2013;2:71-75
: Casuistry
Prezentována kazuistika šedesátisedmiletého pacienta s nádorovou duplicitou. Od roku 2009 byl léčen pro karcinom prostaty, od května 2010 pro maligní melanom na zádech s pozitivní sentinelovou uzlinou. Pro obě choroby byl pacient léčen chemo-radioterapií, klinicky byl ve stabilizovaném stavu bez známek generalizace. Na naší klinice byl vyšetřován galliovou scintigrafií pro maligní melanom v srpnu 2010 a v červnu 2011. Obě vyšetření byla interpretována jako negativní. V březnu 2011 byl zjištěn plicní infiltrát, bronchoskopie s cytologií neprokázala maligní příčinu. Od února 2013 měl pacient bolesti zad, na CT zjištěna kompresivní fraktura Th9 při nádorové infiltraci. Vzorek tkáně odebraný při stabilizaci páteře v dubnu 2013 prokázal metastázu amelanotického maligního melanomu. Při revizi nálezu na galliové scintigrafii byla zjištěna zvýšená akumulace 67Ga citrátu v Th9 při vyšetření v červnu 2011 ve srovnání s vyšetřením v srpnu 2010. Detekce byla umožněna fúzí SPECT obrazů s nízkodávkovým CT.
Klíčová slova:
maligní melanom, metastáza páteře, galliová scintigrafie, SPECT/CTÚvod
Maligní melanom tvoří asi 5 % všech kožních nádorů. V závislosti na stupni choroby v době diagnózy se doba přežití pohybuje v širokém rozmezí několika měsíců až mnoha let. Při generalizaci choroby je doba přežití neléčených pacientů 6 až 9 měsíců. Správné stanovení rozsahu choroby je tedy nezbytné pro správnou léčebnou strategii. 1 Jednou z diagnostických metod, které lze v této indikaci využít, je scintigrafie s 67Ga citrátem.
Kazuistika
Na naši kliniku byl odeslán 67letý pacient s nádorovou duplicitou karcinomu prostaty a maligního melanomu na galliovou scintigrafii k určení stadia melanomu před zahájením léčby. Maligní melanom byl lokalizován na zádech nad pravou lopatkou, excize byla provedena na kožní klinice v květnu 2010. Vzhledem k tomu, nádor dosahoval do chirurgické spodiny resekátu, byla v červnu 2010 provedena reexcize nádoru na klinice plastické chirurgie spolu s exenterací pravé axily, kde byla scintigraficky detekována sentinelová uzlina. V ní se při histologickém vyšetření prokázala metastáza maligního melanomu, ostatní lymfatické uzliny této axily nebyly nádorem postiženy. Nádor vykazoval expresi S-100 proteinu a HMB-45, proliferační aktivita (MiB-1) odpovídala asi 20 - 30 % celkové buněčné populace nádoru. Klasifikován byl Clark IV, Breslow 2,75 mm (nejméně), pT3b (nejméně), NX, MX.
Galliová scintigrafie byla provedena v srpnu 2010 standardním způsobem po aplikaci 160 MBq 67Ga citrátu na gamakameře Infinia Hawkeye s kolimátorem pro střední energie. Po 48 hodinách byly provedeny celotělové skeny a SPECT/CT hrudníku a břicha. (Obr. 1) Byla zjištěna fyziologická distribuce v játrech, kostní dřeni, orofaryngu a ve skrotu, lehce v colon, nález byl hodnocen jako normální. Pacient byl léčen radioterapií na oblast jizvy na zádech a pravé axily do celkové dávky 48 Gy ve 12 frakcích od října do prosince 2010 s adjuvantní léčbou interferonem od září 2010 do prosince 2011. V lednu 2011 byl při rtg hrudníku pro respirační infekci zjištěn infiltrát v horním poli plicním vpravo, který byl v březnu 2011 na CT popsán jako tumor. (Obr. 2) Bronchoskopie provedená v dubnu 2011 však přítomnost maligních buněk neprokázala, biopsie lymfatické uzliny prokázala zánětlivé změny.
1. Galliová scintigrafie v srpnu 2010. Celotělový scan a SPECT hrudníku a břicha po 48 hodinách. Je patrná fyziologická distribuce v játrech, kostní dřeni a skrotu. 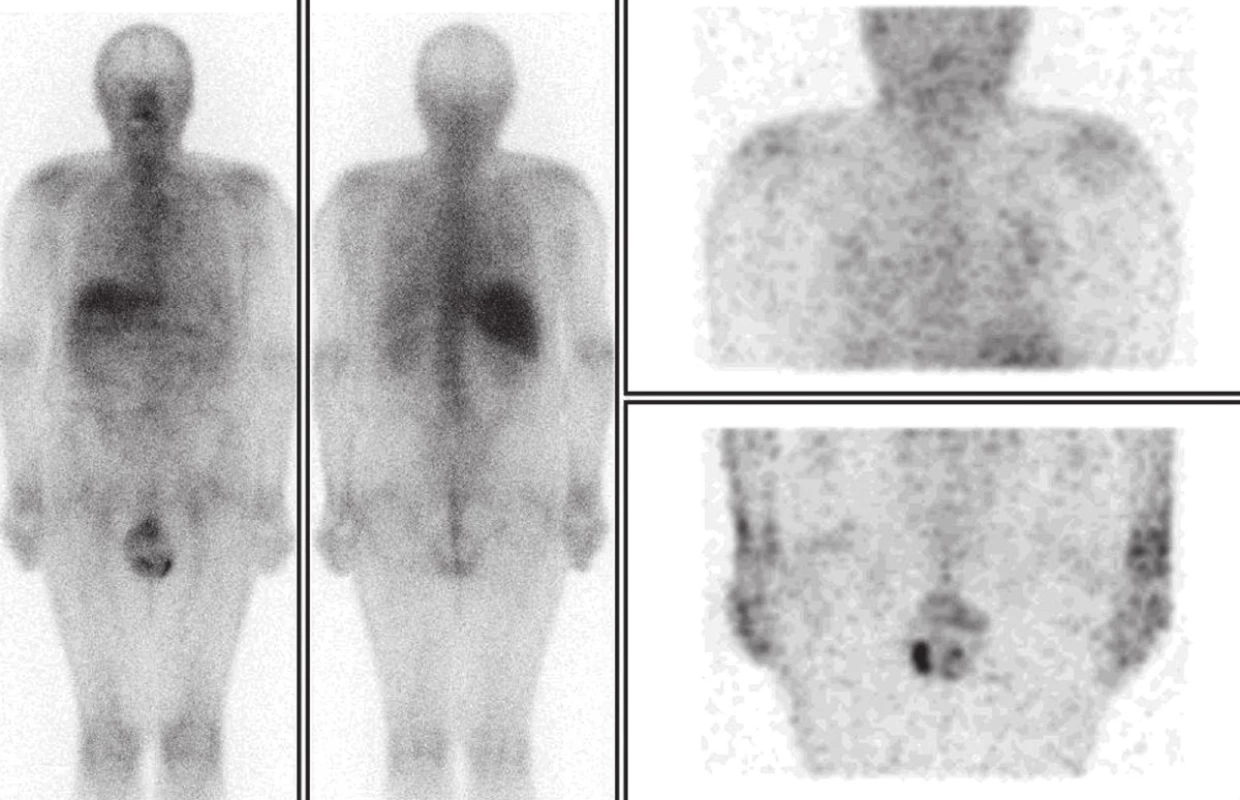
2. CT plic z března 2011. Hyperdenzní ložisko v pravé plíci popsáno jako tumor. 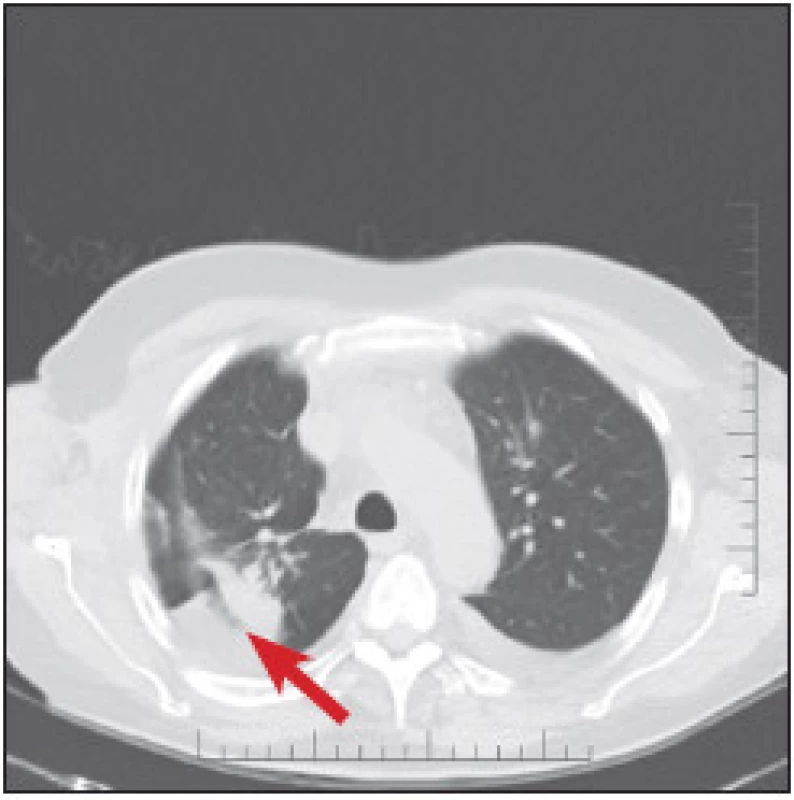
V červnu 2011 byl pacient odeslán na naši kliniku na kontrolní galliovou scintigrafii k posouzení plicního ložiska. Galliová scintigrafie byla provedena stejně jako při předchozím vyšetření, snímky byly zaznamenány navíc také po 72 a 96 hodinách. Hyperdenzní ložisko v horním poli plicním gallium neakumulovalo. (Obr. 3) Na kontrolním CT plic v dubnu 2012 bylo ložisko stacionární, tentokrát popisované jako fibrózní adheze s pleurální adhezí a s apikalizací pravého hilu, hodnoceno jako možné postiradiační změny. Kontrolní CT v březnu 2013 opět neprokázalo progresi, ložisko se mírně zmenšilo. (Obr. 4) Na žádném z CT vyšetření provedených pro zobrazení plicního ložiska v letech 2011 až 2012 nebyly popsány patologické změny na páteři.
3. Galliová scintigrafie v červnu 2011. Celotělový scan a SPECT hrudníku a břicha po 96 hodinách. Opět je patrná fyziologická distribuce, navíc také v colon. Hyperdenzní ložisko v pravé plíci gallium neakumuluje (dolní řada: vlevo CT, uprostřed SPECT, vpravo fúze). 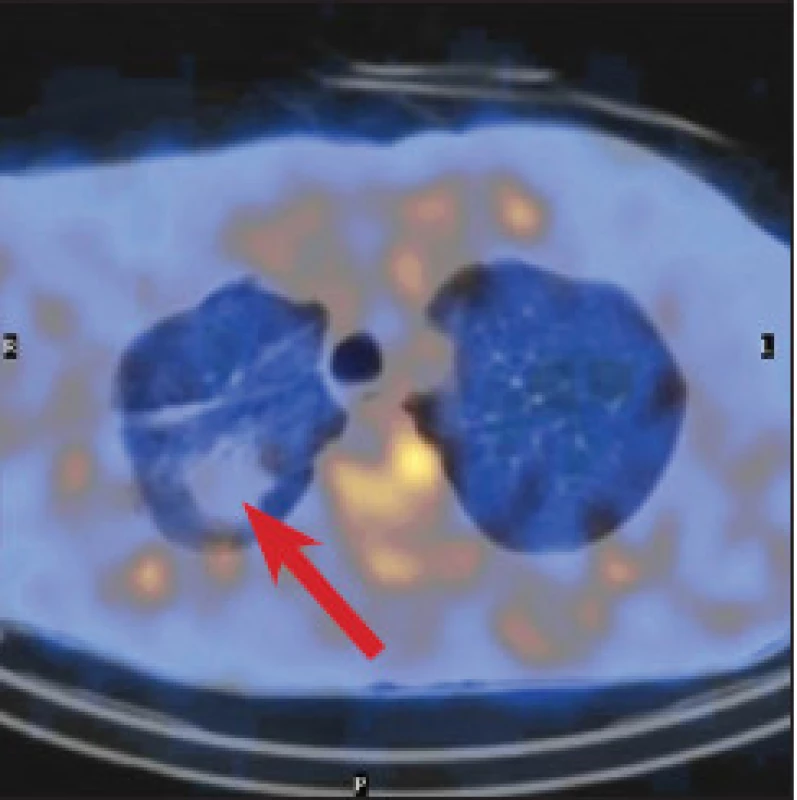
4. CT plic v březnu 2013. Je vidět mírná regrese ložiska. 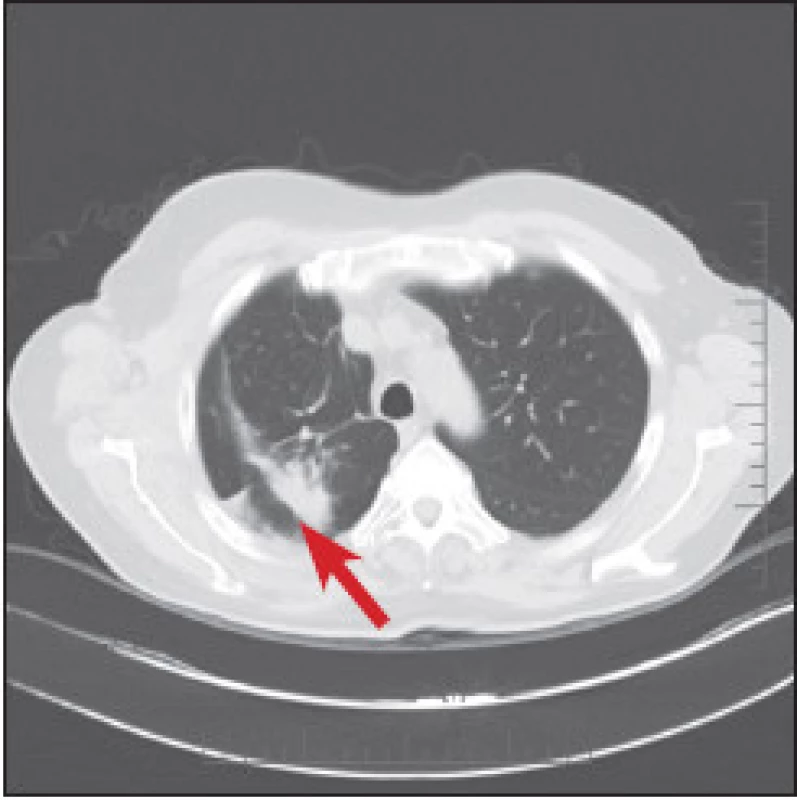
V dubnu 2012 začal mít pacient subfebrilie a objevily se kožní hematomy. Na hematologické klinice byla diagnostikována akutní myeloblastická leukemie myelomonocytárního charakteru s vyšším zastoupením eozinofilní granulopoézy s dysplastickými rysy, která byla označena jako therapy-related (způsobená předchozí léčbou karcinomu prostaty a maligního melanomu). Byla zahájena kombinovaná chemoterapie Daunorubicin, Ara-C a Cytosar, bylo dosaženo kompletní remise.
Od ledna 2013 se u pacienta objevily bolesti zad v thorakolumbální oblasti bez zjevné příčiny, byl léčen infuzemi s Mesocainem, Guajacuranem a Novalginem. Vzhledem k anamnéze bylo v březnu 2013 provedeno CT vyšetření páteře, které odhalilo patologickou zlomeninu obratle Th9. (Obr. 5) Bolesti zad progredovaly až do stavu, kdy pacient nebyl schopen chůze. MRI páteře v dubnu 2013 potvrdilo infiltraci těla Th9 se zúžením páteřního kanálu a míšní kompresi. (Obr. 6) Pacientovi byla doporučena operace páteře. 5. 4. 2013 byla provedena dekomprese páteřního kanálu a zadní stabilizace Th7-11. (Obr. 7) Při operaci byly odebrány vzorky tkáně, histologicky se potvrdila metastáza amelanotického maligního melanomu.
5. CT páteře v březnu 2013. Je patrná patologická fraktura obratlového těla Th9. 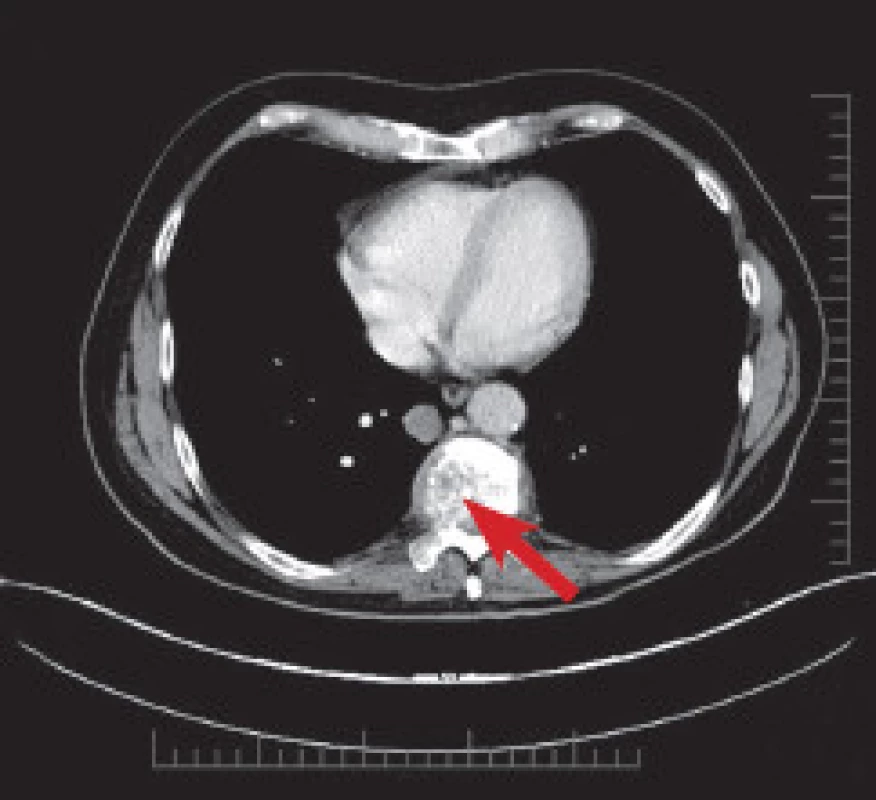
6. MRI páteře potvrzuje nádorovou infiltraci obratlového těla Th9 se zúžením páteřního kanálu a míšní kompresi. 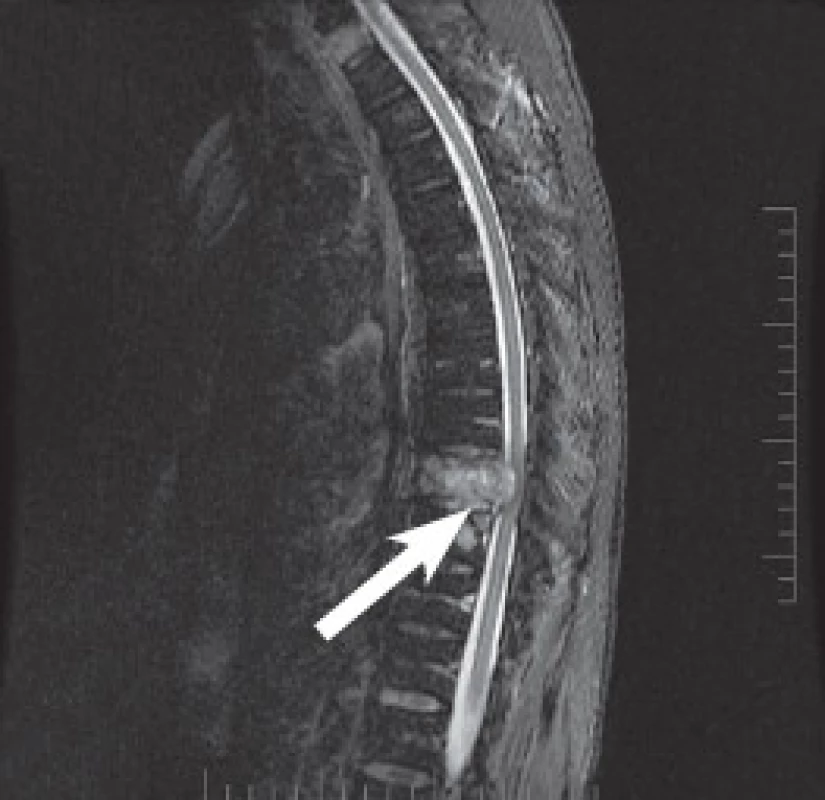
7. Kontrolní rtg snímek páteře po provedené stabilizaci páteře s dekompresí páteřního kanálu. 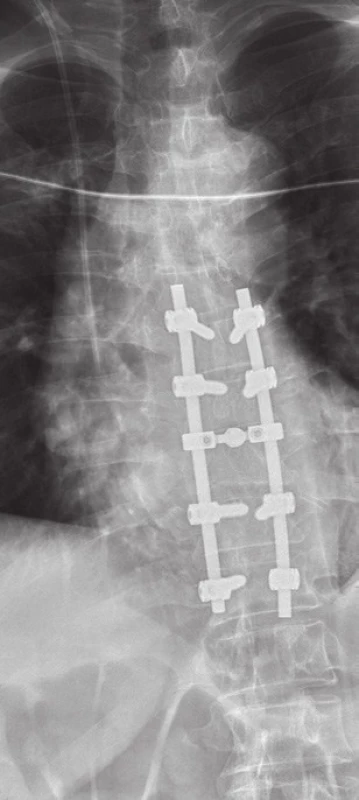
Na základě tohoto nálezu jsme revidovali snímky z obou galliových scintigrafií a zaměřili jsme se na hrudní páteř. Využili jsme k tomu fúzované obrazy SPECT/CT, které umožňují přesnější lokalizaci případné zvýšené akumulace radiofarmaka. Srovnali jsme transversální řezy hrudníkem z obou scintigrafií se zaměřením na Th9. Na vyšetření ze srpna 2010 byla vcelku fyziologická akumulace 67Ga citrátu, na kontrolním skenu v červnu 2011 však byla patrná zvýšená akumulace v pravé polovině obratlového těla Th9 korespondující s CT nálezem v březnu 2013. (Obr. 8)
8. Srovnání SPECT/CT obrazů galliové scintigrafie. V horní polovině vyšetření v červnu 2011, v dolní polovině vyšetření v srpnu 2010, vlevo fúze SPECT/CT, vpravo SPECT. Je patrný nárůst akumulace 67Ga citrátu v pravé polovině obratlového těla Th9. Rovněž je patrné, že bez fúze obrazů je interpretace prakticky nemožná. 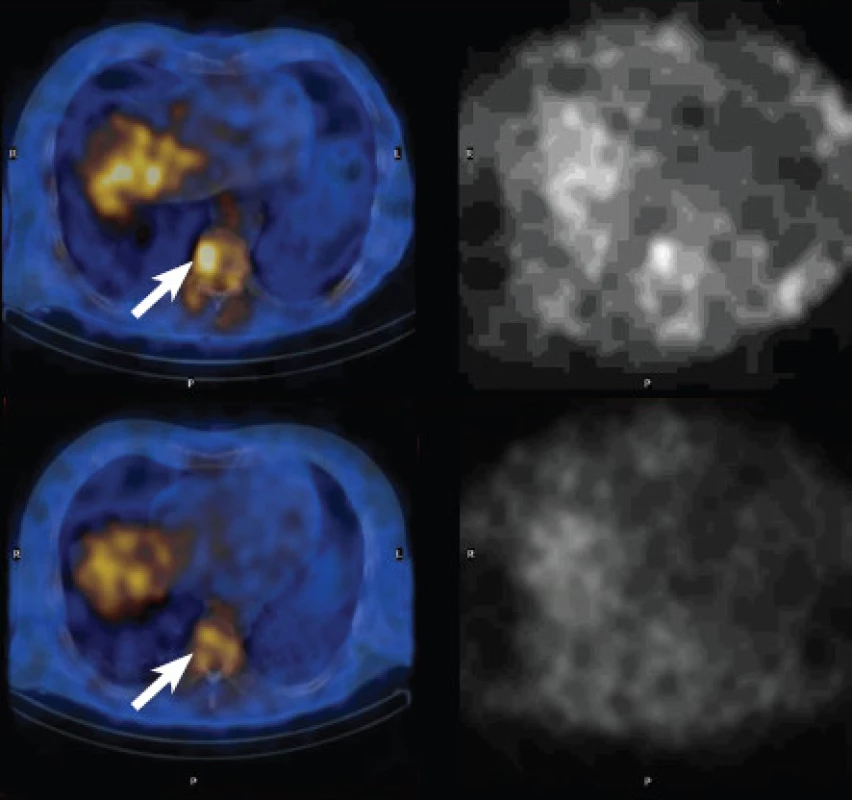
Diskuse
Incidence maligního melanomu posledních 40 let dramaticky roste, poněkud více u mužů než u žen. 2 Medián věku v době diagnózy je 59 let. Rozhodující pro průběh choroby je stadium v době diagnózy, které také rozhoduje o způsobu léčby. Maligní melanom může metastazovat prakticky do jakéhokoli orgánu, nejčastěji do kůže, lymfatických uzlin, plic, jater, mozku a skeletu. 3 U našeho pacienta byla zachycena metastáza v sentinelové uzlině a později i v páteři. Vyšetření sentinelové uzliny patří ke standardním metodám určení stadia choroby a její postižení má výrazný vliv na přežití pacienta. 4 Stejně tak jsou v tomto ohledu důležité tloušťka tumoru podle Breslowa, mitotická aktivita, invaze podle Clarka, lokalizace tumoru a věk pacienta. 5 Námi prezentovaný pacient měl v době stanovení diagnózy všechny tyto faktory velmi prognosticky nepříznivé.
67Gallium je cyklotronový produkt získávaný bombardováním obohacených izotopů zinku protony nebo deuterony. Fyzikální poločas má 78 hodin a emituje fotony různých energií vhodných pro detekci gamakamerou: 93 keV (40 %), 184 keV (24 %), 296 keV (22 %) a 388 keV (7 %). 6 67Ga je navíc potenciálně možné použít i pro léčbu vzhledem k tomu, že emituje Augerovy a konverzní elektrony. Relativně dlouhý fyzikální poločas také umožňuje jeho distribuci z místa produkce. 7
67Ga citrát je pro diagnostiku nádorů používán více než 40 let. 6, 8 Je vázán pouze rostoucími a životaschopnými nádorovými buňkami, nikdy není akumulován nekrotickým nádorem nebo fibrózou. Stupeň jeho akumulace je v přímém poměru k metabolizmu nádoru. 9 10 - 25 % aplikované aktivity je vyloučeno ledvinami během prvních 24 hodin, poté je hlavním exkrečním orgánem tlusté střevo. Druhý až třetí den po aplikaci je asi 75 % podané aktivity v těle rovnoměrně rozděleno v měkkých tkáních, játrech a kostní dřeni. 6
Kromě nádorů je však 67Ga citrát akumulován také zánětlivými tkáněmi, s výhodou se používá pro detekci infekcí kostí, kloubů a měkkých tkání 10, ale i neinfekčních zánětů. 11 V tomto směru je vyšetření pro detekci maligního melanomu nespecifické.
Zavedení tomografické scintigrafie do nukleární medicíny v devadesátých letech minulého století znamenalo vyšší senzitivitu galliové scintigrafie díky lepšímu kontrastu obrazů a zpřesnění prostorové lokalizace ve srovnání s planární scintigrafií. 3 CT přidává ke SPECT vyšší specificitu a má dobré anatomické rozlišení, takže dále zpřesňuje prostorovou lokalizaci lézí, jak se také ukázalo u našeho pacienta. CT může také odkrýt doprovodné komplikace, jako jsou fraktury nebo komprese durálního vaku. Velkým přínosem SPECT/CT je správná specifikace nejednoznačných scintigrafických lézí v páteři, ve skeletu hrudního koše, v lebce a pánvi. Pokud vyšetřujeme léze v oblasti hrudníku, je rovněž výhodné, že SPECT/CT je méně ovlivňováno pohybovými artefakty než MRI. 12
V poslední době je patrný trend nahradit při zobrazování maligního melanomu galliovou scintigrafii novými metodami, zejména pozitronovou tomografií s fluorodeoxyglukózou (FDG). 1, 13 Ta byla testována u pacientů s časným stadiem melanomu T1b - T3b, efektivita se však neprokázala. Rovněž se FDG zkoušela ve snaze nahradit glukózovým scanem biopsii sentinelové uzliny, ale ani v této indikaci se neosvědčila. Pouze u pacientů s pokročilým nádorem se zdá, že by glukózová scintigrafie mohla být užitečná pro detekci vzdálených metastáz. 14 Problémem FDG je však podobně jako u 67Ga citrátu afinita k zánětům, takže je vyšetření pro detekci maligního melanomu nespecifické. V tomto směru se jeví nadějnými nová peptidová radiofarmaka, která by se vázala na specifické receptory melanomových buněk, např. MC1 receptory. 7
Závěr
Galliová scintigrafie u našeho pacienta včasně detekovala metastázu maligního melanomu v páteři. Souhrou okolností však nebyla tomuto nálezu věnována patřičná pozornost a správná interpretace byla provedena ex post. Planární scintigrafie stejně jako SPECT byla nepřínosná, teprve hybridní zobrazení SPECT/CT zejména při porovnání dvou vyšetření provedených s ročním odstupem umožnilo správnou interpretaci.
Otto Lang 1, Martin Krbec 2
1 Klinika nukleární medicíny, Universita Karlova, 3. LF a FN Královské Vinohrady, Praha 10
2 Ortopedicko-traumatologická klinika, Universita Karlova, 3. LF a FN Královské Vinohrady, Praha 10
otto.lang@fnkv.cz
Sources
1. Schröer-Günther MA, Wolff RF, Westwood ME et al. F-18-fluoro-2-deoxyglucose positron emission tomography (PET) and PET/computed tomography imaging in primary staging of patients with malignant melanoma: a systematic review. Syst Rev 2012;1 : 62
2. Trotter SC, Sroa N, Winkelmann RR et al. A Global Review of Melanoma Follow-up Guidelines. J Clin Aesthet Dermatol 2013;6 : 18–26
3. Doležal J, Vižďa J, Klzo L. Zobrazení izolované metastázy maligního melanomu v pravé srdeční komoře pomocí scintigrafie s 67Galium - citrátem. Vnitr Lek 2008;54 : 862-865
4. Dickson PV, Gershenwald JE. Staging and prognosis of cutaneous melanoma. Surg Oncol Clin N Am 2011;20 : 1-17
5. Mervic L. Prognostic factors in patients with localized primary cutaneous melanoma. Acta Dermatovenerol Alp Panonica Adriat 2012;21 : 27-31
6. Love C, Palestro C. Altered biodistribution and incidental findings on Gallium and labeled leukocyte/bone marrow scans. Semin Nucl Med 2010;40 : 271-282
7. Guo H, Yang J, Shenoy N et al. Gallium-67-Labeled Lactam Bridge-Cyclized Alpha-Melanocyte Stimulating Hormone Peptide for Primary and Metastatic Melanoma Imaging. Bioconjug Chem 2009;20 : 2356–2363
8. Nelson B, Hayes RL, Edwards L et al. Distribution of Gallium in human tissues after intravenous administration. J Nucl Med 1972;13 : 92-100
9. Vižďa J, Urbanová E. Atlas galiové scintigrafie. Praha: Agentura Pankrác 2001
10. Chen WC, Tsai KD, Chen CH et al. Role of gallium-67 scintigraphy in the evaluation of occult sepsis in the medical ICU. Intern Emerg Med 2012;7 : 53-58
11. Basu S, Zhuang H, Torigian DA et al. Functional imaging of inflammatory diseases using nuclear medicine techniques. Semin Nucl Med 2009;39 : 124-145
12. Zadražil L, Libus P. Specifikace nejistých lézí na planární celotělové kostní scintigrafii s použitím SPECT/CT u onkologických pacientů. NuklMed 2013;2 : 25-30
13. Visioni A, Kim J. Positron emission tomography for benign and malignant disease. Surg Clin North Am 2011;91 : 249-266
14. Tyler DS, Onaitis M, Kherani A et al. Positron emission tomography scanning in malignant melanoma. Cancer 2000;89 : 1019–1025
Labels
Nuclear medicine Radiodiagnostics Radiotherapy
Article was published inNuclear Medicine

2013 Issue 4
Most read in this issue- Pyogenic staphylococcal sacroiliitis diagnosed by three-phase bone scan
- Spine metastasis of malignant melanoma detected by SPECT/CT on gallium scintigraphy
- Scintigraphy and diabetic cardiomyopathy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career





