-
Medical journals
- Career
Menopauzální genitourinární syndrom: těžký komunikační problém, snadná léčba
Authors: Tomáš Fait
Authors‘ workplace: Gynekologicko-porodnická klinika 2. LF UK a FN Motol, Praha
Published in: Čas. Lék. čes. 2019; 158: 101-106
Category: Review Article
Overview
Vulvovaginální atrofie trápí zhruba 40 % žen po menopauze. Na její projevy je vhodné se cíleně ptát. Pro ženy je snazší na takovou otázku odpovědět než o problému začít hovořit spontánně, což dělá problém 70 % postižených. V léčbě a prevenci urogenitální atrofie je lékem volby vaginálně aplikovaný estriol nebo estradiol v nízkých dávkách, které jsou vysoce účinné a bezpečné.
Klíčová slova:
menopauzální genitourinární syndrom – vulvovaginální atrofie – vaginální aplikace – estriol – estradiol – ospemifen – prasteron
ÚVOD
Menopauzální genitourinární syndrom (GSM) je v literatuře uváděn od roku 2014. Zastřešuje dříve užívané výrazy jako např. urogenitální atrofie či vulvární a vaginální atrofie (VVA) (1).
Podkladem obrazu atrofické vulvovaginitidy spojené s dyspareunií, pruritem a chronickou vaginitidou je nedostatkem estrogenů způsobená atrofie kůže a kožních adnex vulvy a sliznice poševní. Nedostatečná stimulace estrogenních receptorů v buňkách sliznice poševní vede k poklesu vaskularizace a snížení obsahu glykogenu v epitelu, což má za následek snížení počtu laktobacilů, pokles pH poševního prostředí a následně dysmikrobii spojenou se zánětem a fluorem.
Nižší prokrvení urogenitálního traktu a degenerace sliznice ve svém důsledku snižují uzávěrový uretrální tlak i odolnost vůči uroinfekci. Z toho vyplývající nykturie, dysurie a urgentní inkontinence jsou výraznými projevy estrogenního deficitu. Tyto potíže mohou být přítomné bez objektivně zjistitelných změn (uretrální syndrom) či s jasnými známkami atrofie urogenitálního traktu (atrofickou senilní uretritidou, hypoestrinní cystopatií).
U pacientek s urogynekologickými obtížemi v postmenopauze je indikované lokální podávání estrogenů. Estrogeny pozitivně ovlivňují trofiku epitelu pochvy, uretry i močového měchýře (2), zlepšují vaskularizaci tkání a plnění cév, zejména submukózního venózního plexu v uretře (3), zvyšují tkáňový turgor, vedou k zesílení svaloviny a pojivové tkáně v oblasti pochvy, uretry a pánevního dna (4). Tyto změny způsobují nárůst hodnot transmise a uzávěrového uretrálního tlaku (5).
Dříve propagované systémové podávání estrogenů (6) překvapivě nemá tak dobré klinické výsledky, v některých studiích je dokonce spojováno se zhoršováním příznaků inkontinence (7).
KOMUNIKACE O GSM
Studie ukazují, že problematika urogenitální atrofie je lékaři málo diskutována a možná i v důsledku toho se část žen stále chybně domnívá, že jde o přirozený projev stárnutí organismu, který nemá žádné řešení.
Podle metaanalýzy studií na toto téma z roku 1998 (8) trpí příznaky vaginální atrofie 10–40 % žen po menopauze, ale jen zhruba 25 % z nich hledá lékařskou pomoc. Pro ženy je obtížné hovořit se zdravotníky o svém sexuálním životě, a tedy i o poševním zdraví.
Výzkum International Vagina Dialogue Survey probíhající ve 13 zemích zjistil i u mladých žen (18–44 let) ve více jak polovině případů neschopnost bez potíží hovořit se zdravotníky o problematice spojené s pochvou (9). Tím spíše lze tento komunikační problém očekávat u žen starších.
Hodnocením této problematiky se v roce 2009 zabývala studie zahrnující 4246 žen ve věku 55–65 let ze Švédska, Finska, Velké Británie, Spojených států amerických a Kanady (10). V souboru bylo 98 % žen (4178) po menopauze a 71 % déle než 5 let od poslední menstruace. Z postmenopauzálních žen 39 % (1622) udávalo příznaky vaginálního dyskomfortu spojeného s menopauzou a 52 % z nich uvádělo, že tyto potíže ovlivnily kvalitu jejich života (tab. 1). Při diskusi o poševním dyskomfortu spojeném s menopauzou se necítí dobře 77 % dotázaných. Nepřekvapí tedy, že 71 % žen s potížemi se nesvěří svému praktickému lékaři a 70 % svému gynekologovi – podle toho, kdo v dané zemi řeší gynekologické problémy. Nicméně 30 % pacientek se nesvěří žádnému odborníkovi. U čtvrtiny léčených žen trvaly potíže před zahájením léčby déle než 1 rok, u 8 % více než 3 roky. Existenci edukačního materiálu, který vysvětlí, s čím se na lékaře obracet a s čím ne, by uvítalo 49 % žen, zahájení diskuse o problému ze strany lékaře 31 %.
Table 1. Četnost projevů urogenitální atrofie 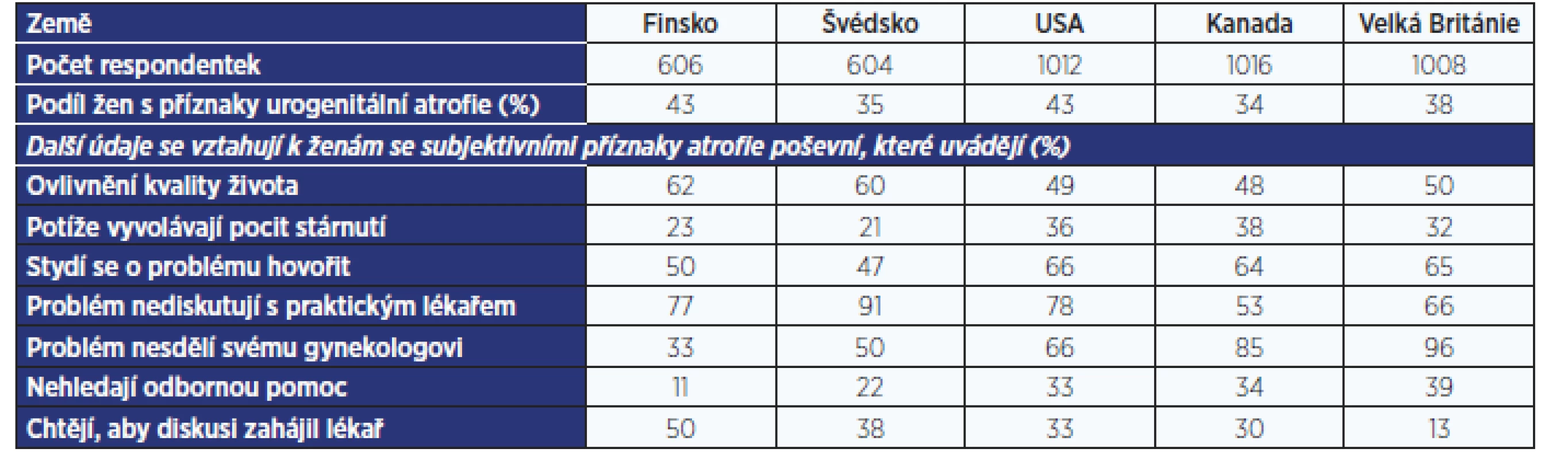
Studie VIVA (Vaginal Health: Insights Views & Attitudes) analyzovala soubor 3250 žen ve věku 55–65 let minimálně 1 rok po menopauze s prevalencí příznaků poševní atrofie 45 %. Více než polovina (51 %) postižených měla potíže se s problémem svěřit a 55 % z nich byla možná i kvůli tomu déle než 3 roky bez léčby. Negativní vliv na sexuální život uvedlo 65 %, negativní vliv na partnerský vztah 40 %. Hlavním zdrojem informací o menopauze byl pro 77 % zúčastněných lékař, přesto polovině žen nikdy neřekl nic o vaginálním zdraví po menopauze. Jen 33 % žen uvádí, že je matky varovaly před příznaky menopauzy. Průměrně ženy váhají se sdělením problémů spojených s vaginální atrofií 6 měsíců. 8 z 10 žen zkusilo léčbu, ale 49 % zvolilo symptomatickou terapii lubrikanty, 22 % systémovou hormonální terapii a jen 12 % se vydalo správnou cestou vaginální estrogenní léčby (11).
Studie CLOSER sledovala vliv poševní atrofie na vztahy mezi ženami ve věku 55–65 let a jejich partnery. Vstupním kritériem byl odstup minimálně l rok od menopauzy, existence sexuálního partnera a příznaky poševní atrofie. Zařazeno bylo 1600 žen ze severní (Dánska, Norska, Finska, Švédska) a 1000 žen z jižní Evropy (Francie, Itálie). 28 % z nich v severní a 38 % z nich v jižní Evropě vyjádřilo obavy, že se již příznaků vaginální atrofie nezbaví a 21 %, resp. 27 % se obávalo, že vaginální dyskomfort zničí jejich budoucí sexuální život. Jižní Evropa tedy tento problém vnímá jako významnější (p < 0,05). Překvapivě dvě třetiny z 86 % partnerů, se kterými se chtějí ženy o problému bavit, s tím neměly problém. 15 %, resp. 11 % mužů se obává, že diskuse o vaginálním dyskomfortu zničí jejich intimní život, zatímco 29 %, resp. 19 % věří, že samotný problém je větším rizikem. Základním problémem se pak ukazuje obava z bolestivého styku. Ženy z jihu Evropy mají větší obavy o dlouhodobý vliv na jejich vztahy a udávají větší zlepšení po léčbě.
Nejčastějším příznakem menopauzy v severní i jižní Evropě byla vaginální suchost v 74 %, resp. 73 % případů, dále návaly horka v 67 %, resp. 70 % případů. V severní Evropě následuje noční pocení v 61 % případů, poruchy spánku v 52 % případů, bolestivý styk v 42 % případů a nárůst hmotnosti v 41 % případů. V jižní Evropě následuje přírůstek hmotnosti v 57 % případů, noční pocení v 52 % případů, poruchy nálady v 48 % případů a poruchy spánku ve 46 % případů (12).
HODNOCENÍ UROGENITÁLNÍ ATROFIE
Vaginální atrofie jako důsledek estrogenního deficitu významně ovlivňuje kvalitu života a je také jedním z kritérií hodnocení klimakterického syndromu a jeho případné léčby.
Objektivní hodnocení trofiky poševní se opírá o hormonální cytologii: maturační index, karyopyknotický index a měření poševního pH.
Existují také dotazníky používané k hodnocení urogenitální atrofie jako takové. Nejčastěji se používá Vaginal Health Index (VHI, tab. 2), Vulvo-Vaginal Health Index (VVHI), DIVA či Vulvovaginal Symptoms Questionnaire (VSQ, tab. 3) (13, 14).
Table 2. Vaginal Health Index – je dán součtem hodnot, celkový součet menší než 15 je hodnocen jako VVA 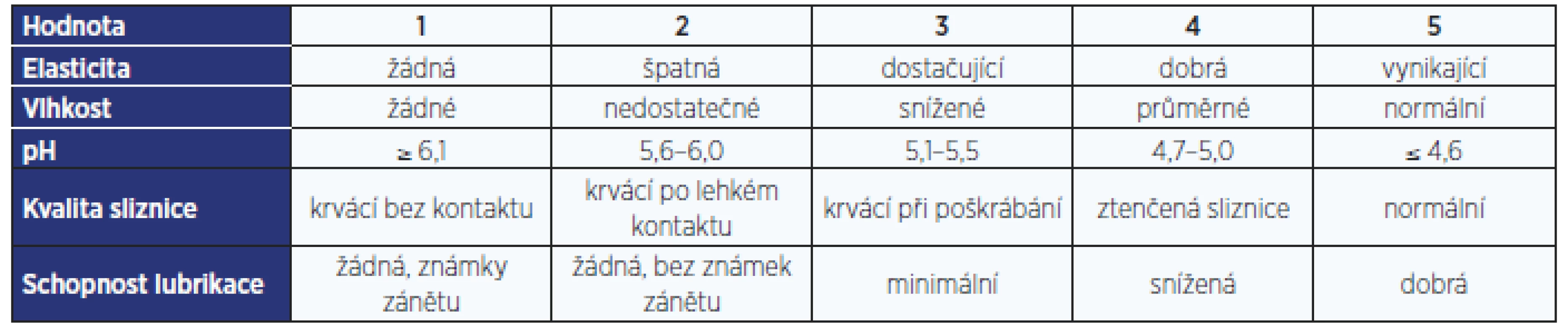
Image 1. Vulvolaginal Symptoms Questionnaire 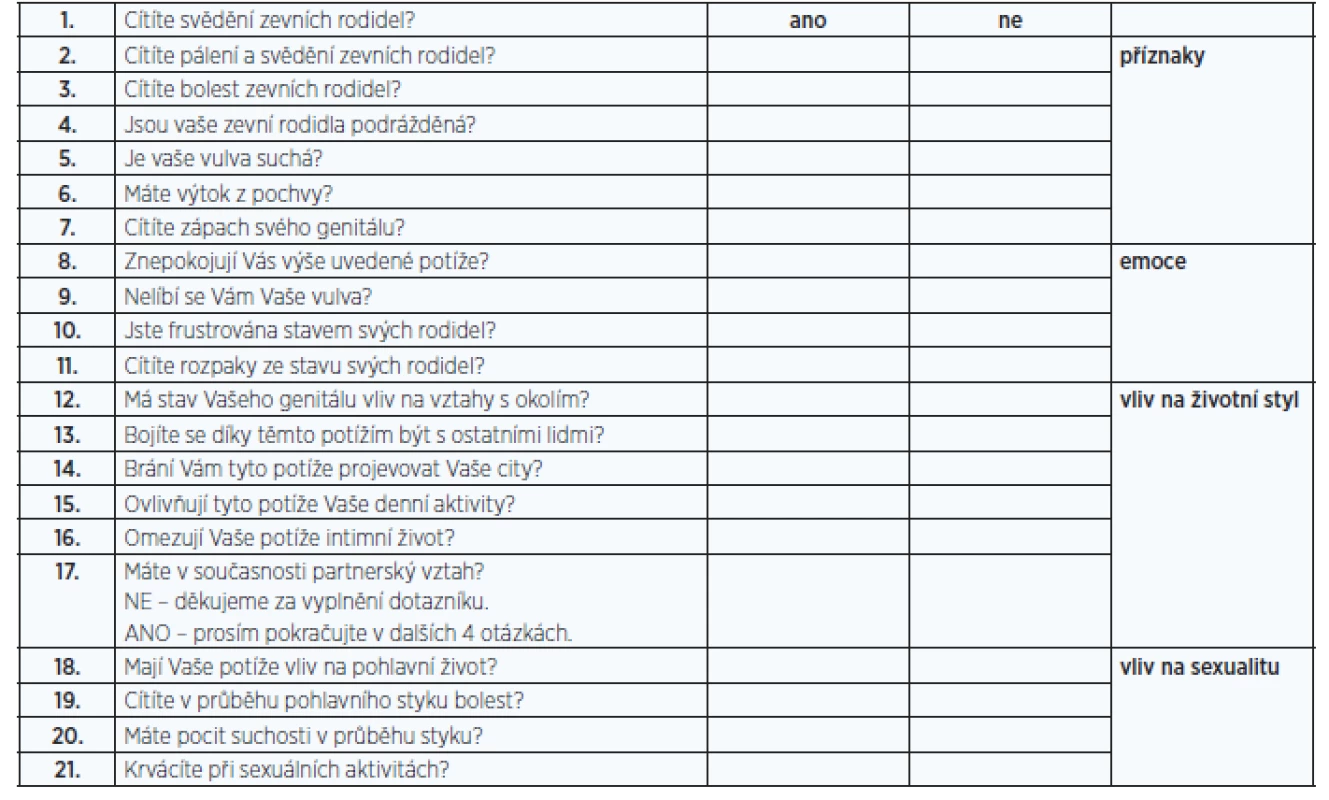
LÉČBA GSM
Pro genitourinární menopauzální syndrom nereagující na volně prodejné přípravky při neexistenci indikace k systémové hormonální terapii je doporučována nízkodávkovaná vaginální estrogenní terapie.
Estrogenní léčba je nejúčinnějším řešením GSM (vulvovaginální atrofie, poševní suchosti, pálení a podráždění, bolesti při styku a snížené lubrikace, urgentní inkontinence, dysurie a opakovaných zánětů močových cest). Nízkodávkované vaginální přípravky jsou účinné a bezpečné díky minimálnímu systémovému účinku. Ve spolupráci s onkologem je lze užít i u pacientek s anamnézou karcinomu prsu na terapii tamoxifenem či inhibitory aromatázy. Není nutná opozice lokálních estrogenů progestiny.
Léčbu vždy zahajujeme desetidenní aplikací 1× denně, dále pokračujeme podáváním 2× týdně (tab. 4).
Table 3. Přehled nejčastěji užívaných vaginálních estrogenů užívaných pro léčbu GSM v České republice 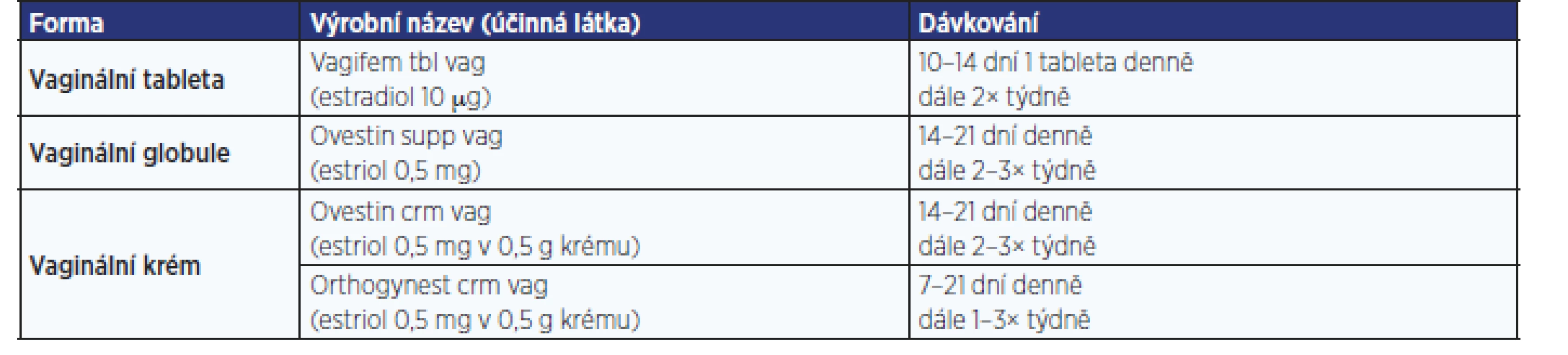
Prevence rekurentní uroinfekce je prokázána pouze pro vaginální a nikoli pro systémové podání estrogenů. Vaginální estrogeny zlepšují prokrvení periuretrálně a oblasti krčku močového měchýře, zlepšují trofiku sliznice močového měchýře, kvalitu kolagenu a snižují detruzorovou aktivitu (15).
Schopnost estrogenů snížit výskyt recidivujících infekcí dolního močového traktu u postmenopauzálních žen díky navození původního poševního prostředí byla opakovaně prokázána (tab. 5). Již po měsíci léčby je dosaženo původní kolonizace laktobacilem. Efektivitu této léčby potvrzuje komise HUT (Hormones and Urogenital Therapy) (16).
Table 4. Placebem kontrolované studie potvrzující protektivní vliv estrogenů pro poševní infekce 
Účinnost velmi nízko dávkované vaginální tablety s 10 μg estradiolu
Studie prokázaly vyšší compliance pacientek s tabletovou formou terapie proti krémům, zejména díky přesnému dávkování a jednoduchosti aplikace (17). Stejně jako v systémové hormonální terapii i ve vaginální se snažíme pracovat s minimální dávkou estrogenu.
V roční studii bylo léčeno 205 žen a 104 ženám bylo podáváno placebo. Ženy byly starší 45 let, minimálně 2 roky po menopauze (FSH > 40 mIU/ml, estradiol < 20 pg/ml) a měly alespoň 3 z 6 subjektivních příznaků poševní atrofie (vaginální suchost, pálení, bolest, dysurii, dyspareunii, krvácení po styku). Na počátku léčby měly ve vaginální cytologii ≤ 5 % povrchových buněk a ultrazvuková tloušťka endometria nepřesahovala 4 mm. Z objektivních známek byl sledován maturační index, který se významně zlepšil od konce druhého týdne léčby a zlepšení trvalo i v jejím 52. týdnu (obr. 1). V léčené skupině narostl počet povrchových buněk na 13 % (p < 0,001), stejně významně pokleslo poševní pH (obr. 2). Výzkumníci byli dle makroskopického obrazu poševní sliznice schopni určit, která žena užívá účinnou léčbu, a to od konce druhého týdne. K subjektivnímu zlepšení příznaků poševní atrofie došlo od 4. týdne léčby a statisticky významného zlepšení (p = 0,003) bylo dosaženo v 8. týdnu léčby (18).
Image 2. Ovlivnění poševní trofiky (16)
Pozn.: LOCF = poslední dostupné sledování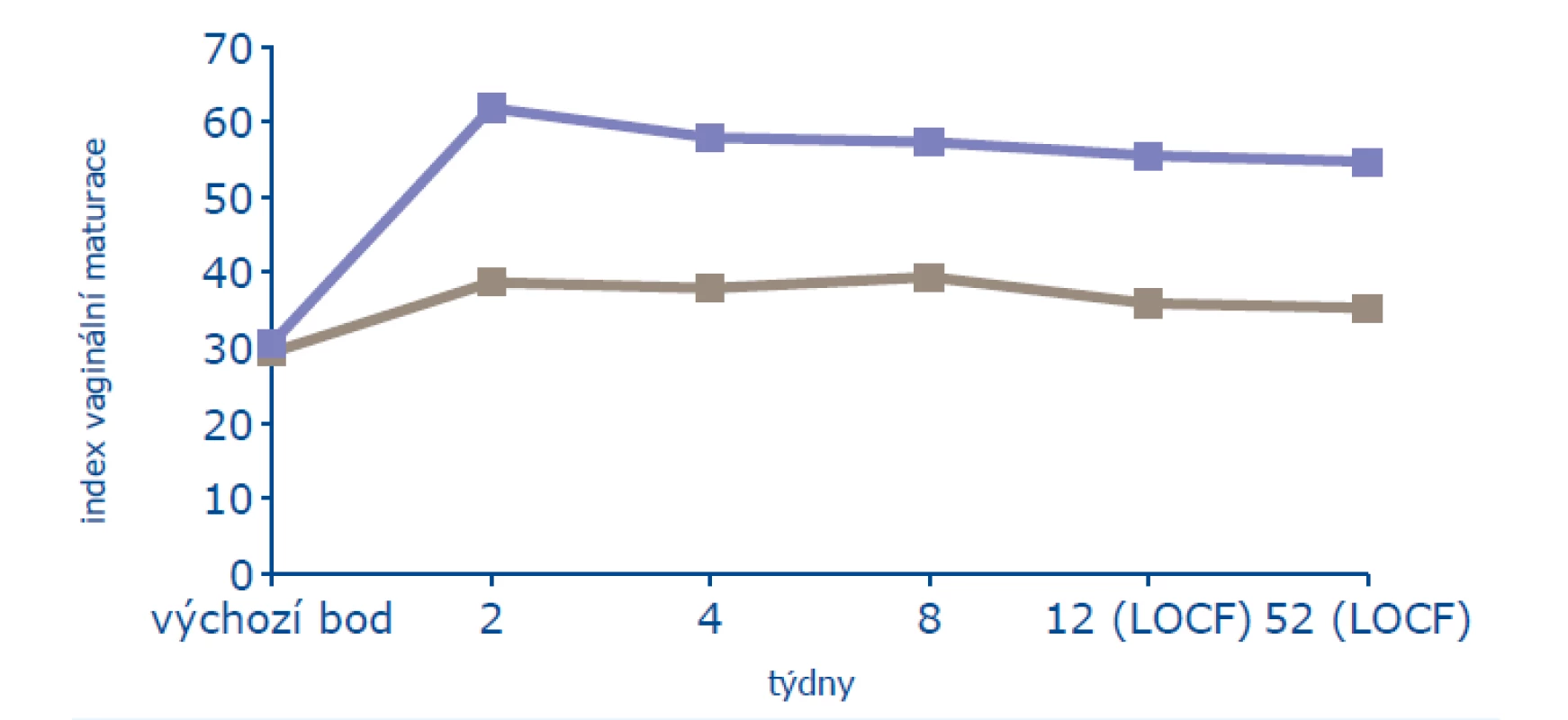
Image 3. Ovlivnění poševního pH (16)
Pozn.: LOCF = poslední dostupné sledování.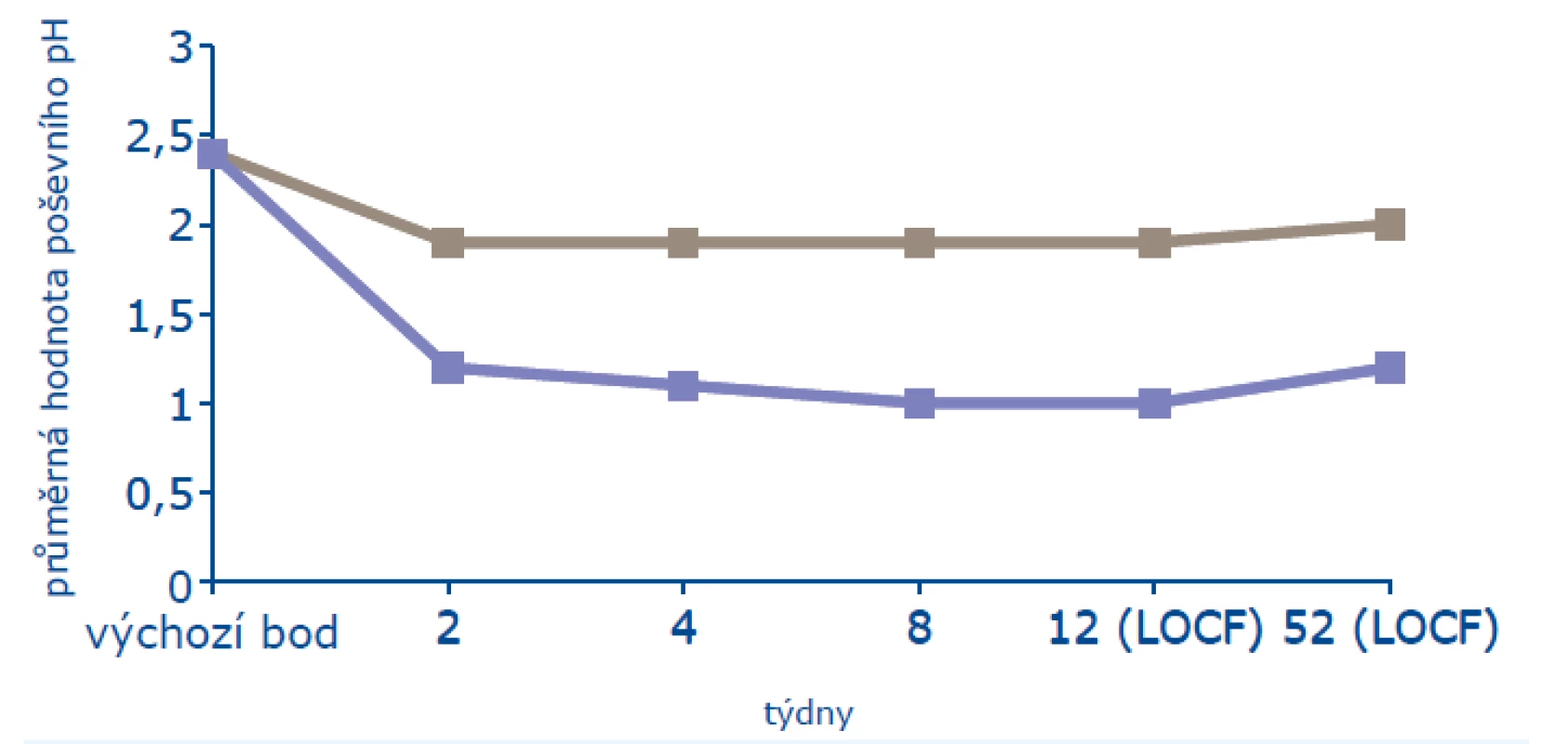
V bezpečnostní studii reakce endometria na léčbu bylo sledováno 336 žen. Po ročním sledování byl v 0,7 % případů nalezen polyp endometria a v 0,3 % slabá proliferace. Ultrazvuková tloušťka endometria se v léčené skupině nezměnila (2,04 mm na počátku, 1,94 mm po roce léčby) (19). S celkovou dávkou 1,14 mg estradiolu ročně lze tedy bezpečně a účinně léčit příznaky GSM.
Tato studie byla rozšířena přidáním 205 aktivních uživatelek a 103 uživatelek placeba a bylo potvrzeno, že roční užívání vaginálních tablet s 10 μg estradiolu nezvyšuje incidenci endometriální hyperplazie ani karcinomu endometria, která se v běžné populaci pohybuje pod 1 % (20).
Prasteron
Zatímco produkce estradiolu v ovariích s menopauzou prakticky skokově skončí, produkce dehydroepiandrostendionu (DHEA, prasteronu) v nadledvinách poklesne o 50 % a poté zvolna klesá. Díky konverzi v cílových tkáních se pak DHEA stává jediným zdrojem estrogenů i androgenů pro postmenopauzální organismus. Jejich tvorba i degradace jsou v cílové tkáni převážně intracelulární. Pokles DHEA je spojen se snížením lokální estrogenní produkce v buňkách pochvy a vede k rozvoji vulvovaginální atrofie, jež trápí ve věku 50–60 let polovinu, a ve věku 70 let dokonce tři čtvrtiny postmenopauzálních žen, což je vysvětlitelné více poklesem DHEA než jen poklesem hladiny samotného estradiolu.
V léčbě střední a těžké dyspareunie na podkladě postmenopauzální urogenitální atrofie je recentně registrován přípravek s 6,5 mg prasteronu ve vaginální tabletě s aplikací denně. Lokální produkce estrogenu a testosteronu bez změn systémových hladin je typická pouze pro minimální vaginálně aplikovanou denní dávku.
Údaje o účinnosti byly získány ze dvou randomizovaných dvojitě zaslepených placebem kontrolovaných multicentrických studií na postmenopauzálních ženách s atrofickou vulvovaginitidou ve věku 40–80 let (jejich průměrný věk činil 58,6, resp. 59,5 roku). Na počátku měly ženy ve vaginálním stěru ≤ 5 % superficiálních buněk, vaginální pH ≥ 5 a udávaly středně těžkou až těžkou dyspareunii. Po 12 týdnech léčby (n = 81, resp. n = 325) došlo ve srovnání s placebem (n = 77, resp. n = 157) ke zvýšení poměru superficiálních buněk, snížení poměru parabazálních buněk (p > 0,0001) a poklesu vaginálního pH (p < 0,0001) (21, 22).
Ospemifen
Ospemifen je SERM (selektivní modulátor estrogenních receptorů) určený v dávce 60 mg perorálně k léčbě dyspareunie spojené s GSM. Chemicky je ospemifen trifenylethylen podobný chemickou strukturou tamoxifenu a toremifenu. Nejedná se tedy o steroidní hormon. Ospemifen účinkuje na poševní sliznici jako estrogenní agonista. Má příznivý vliv na kost a lipidové spektrum, neutrální vliv na endometrium a antiestrogenní vliv na prsní tkáň (23–25).
Do pilotní studie III. fáze bylo zařazeno 826 postmenopauzálních žen trpících GSM. Vstupní kritéria zahrnovala < 5 % povrchových buněk v poševním stěru, poševní pH > 5 a minimálně jeden obtěžující příznak VVA (poševní suchost, pálení, dysurii, krvácení, dyspareunie). Srovnáváno bylo placebo s 30 a 60 mg ospemifenu užívanými po dobu 12 týdnů. Snášenlivost byla ve všech skupinách srovnatelná, laboratorní parametry se neměnily, nebyla zachycena žádná hyperplazie endometria. Statisticky významný rozdíl proti placebu byl zjištěn v nárůstu procenta superficiálních buněk (2 % pro placebo, 8 % pro 30 mg, 11 % pro 60 mg) i poklesu parabazálních buněk (4 %, 22 %, 30 %). Také pH u obou léčebných dávek pokleslo významně proti placebu. Zlepšení symptomů (dyspareunie, poševní suchosti) bylo statisticky významné pro dávku 60 mg (26).
V další studii III. fáze byla již během 12 týdnů trvající léčby srovnávána jen dávka 60 mg s placebem v souboru 605 žen s dyspareunií. Opět byl prokázán významný vliv na nárůst procenta povrchových buněk, pokles procenta parabazálních buněk, pokles poševního pH a pokles závažnosti dyspareunie. Byly potvrzeny vysoká snášenlivost a bezpečnost ve vztahu k endometriu (27).
V roční studii bezpečnosti pro endometrium byl v souboru 294 žen na ospemifenu 60 mg a 55 žen užívajících placebo zjištěn u 1 % žen na ospemifenu nárůst tloušťky sliznice nad 8 mm proti 0 % u placeba, ale nebyl zjištěn žádný případ hyperplazie či karcinomu. Nejčastějším vedlejším nežádoucím účinkem léčby jsou návaly horka (7,5 % vs. 2,6 % u placeba), vaginální výtok (3,8 vs. 0,3 %) a svalové křeče (3,2 vs. 0,9 %). Nebylo prokázáno zvýšení kardiovaskulárních příhod, proliferační vliv na endometrium ani negativní vliv na prsní tkáň (28).
Laser
Využitím CO2 laserové technologie lze remodelovat a stimulovat produkci kolagenu, obnovit struktury matrixu pojivové tkáně a tím navrátit sliznici správný stupeň hydratace. Speciální typ emise s přerušovanými pulzy (chopped sequence) zaručuje kontrolovanou distribuci energie do tkáně s homogenní tepelnou difuzí do sliznice a do dermis, až do hloubky 200–300 μm, zaručující bezpečnou stimulaci fibroblastů, která spustí hojivý a regenerační proces v tkáni s reorganizací matrixu a syntézou nového kolagenu.
Pomocí aplikátorů se v 10 úrovních aplikuje cirkulárně na 8 míst, následně se ošetřuje oblast stydkých pysků. Léčba se nedoporučuje u žen s aktivní genitální infekcí, sklonem k tvorbě keloidních jizev, obezitou s BMI > 40 a při užívání fotosenzitivních látek. Některé zdroje nedoporučují tuto léčbu u žen po páskových operacích a technikách MESH.
Dle informace, která zazněla na 16. světovém kongresu IMS, je v současnosti publikováno 34 odborných sdělení s poznatky celkem na 1600 pacientkách, které sledují účinnost laserterapie. Nicméně žádná z nich nemá kontrolní placebovou skupinu (29, 30).
Nejvíce studií publikovala skupina výzkumníků z Milána, kteří nejprve prokázali účinnost frakcionovaného CO2 laseru na tkáních pochvy mimo organismus (31). Siliquini et al. (32) sledovali po dobu 15 měsíců soubor 91 pacientek s projevy vulvovaginální atrofie (VVA) v menopauze. Průměrný věk žen činil 59 let, BMI 21,9; 35 % z nich dříve zkusilo lokální terapii estrogeny, 13 z nich mělo anamnézu karcinomu prsu. 1 žena nedokončila léčbu pro pocit horka, 2 z osobních důvodů a 1 pro užívání amitriptylinu. S odstupem 4 týdnů byly provedeny 3 aplikace (SmartXide MonaLisa Touch, DEKA, Florencie), které absolvovalo 87 žen. Nicméně na kontrolu po 15 měsících se dostavilo jen 11 žen. Pálivý pocit udávalo při první aplikaci 50 % žen, při třetí již jen 10 %. Počet sexuálně neaktivních žen z důvodů VVA se snížil z 35 na 13 %, u všech žen došlo ke statisticky významnému zlepšení. Lze tedy vyvozovat, že masivní úbytek žen mezi kontrolou po 6 a 12 měsících odpovídá ústupu efektu.
ZÁVĚR
Na projevy urogenitální atrofie je vhodné se žen cíleně ptát. Studie ukazují, že pro ženy je snazší na takovou otázku odpovědět než o problému začít hovořit spontánně.
Přes záplavu informací mnohé ženy netuší, jak snadno, účinně a bezpečně můžeme pouhou vaginální aplikací estrogenů tyto potíže zmírnit či odstranit a zvýšit tak jejich kvalitu života.
V léčbě a prevenci urogenitální atrofie je lékem volby vaginálně aplikovaný estriol nebo estradiol v nízké dávce. Další klinickou možností bude ospemifen či lokálně aplikovaný prasteron.
Adresa pro korespondenci:
doc. MUDr. Tomáš Fait, Ph.D.
Gynekologicko-porodnická klinika 2. LF UK a FN Motol
V Úvalu 84, 150 06 Praha 5
Tel.: 224 434 258
e-mail: tomas.fait@fnmotol.cz
Sources
-
Portman DJ, Gass MLS. Genitourinary syndrome of menopause. Climacteric 2014; 1 : 557–556.
-
Bhatia NN, Bergman A, Karram MM. Effects of estrogen on urethral function in women with urinary incontinence. AJOG 1989; 16 : 176–181.
-
Versi E, Cardozo L. Urethral vascular pulsation. Proc Int Cont Soc 198 : 503–594.
-
Ulmsten U, Ekman G, Gierrz G, Malmstrom A. Different biochemical composition of connective tissue in continents and stress incontinent women. Acta Obstet Gynecol Scand 1987; 6 : 147–152.
-
Rud T. The effect of estrogens and gestagens on the urethral pressure profile in urinary continent and stress incontinent women. Acta Obstet Gyn Scand 1980; 5 : 265–270.
-
Fantl JA, Cardozo L, McClish DK. Estrogen therapy in the management of urinary incontinence in postmenopausal women: a meta-analysis. First report of the Hormones and Urogenital Therapy Committee. Obstet Gynecol 1994; 8 : 12–18.
-
Nappi RE, Davis SR. The use of hormone therapy for the maintenance of urogynecological and sexual health post WHI. Climacteric 2012; 15 : 267–274.
-
Cardozo L, Bachmann G, Mc Clish D et al. Metaanalysis of estrogen therapy in the management of urogenital atrophy in postmenopausal women. Obstet Gynecol 1998; 9 : 722–727.
-
Nappi RE, Liekens G, Brandenburg U. Attitudes, perceptions and knowledges about vagina. the International Vagina Dialogue Survey. Contraception 2006; 7 : 493–500.
-
Nappi RE, Kokot-Kierepa M. Women’s voices in the menopause. Results from an international survey on vaginal atrophy. Maturitas 2010; 6 : 233–238.
-
Nappi RE, Kokot-Kierepa M. Vaginal Health. Insights Views & Attitudes (VIVA) – results from an international survey. Climacteric 2012; 1 : 36–44.
-
Nappi RE, Mattsson LA, Lachowsky M et al. The CLOSER survey. Impact of postmenopausal vaginal discomfort on relationships between women and their partners in Northern and Southern Europe. Maturitas 2013; 75 : 373–379.
-
Erekson EA, Yip SO, Wedderburn TS et al. The VSQ: a questionnaire to measure vulvovaginal symptoms in postmenopausal women. Menopause 2013; 20 : 973–979.
-
Huang AJ, Gregorich SE, Kuppermann M et al. Day-to-day impact of vaginal aging questionnaire. Menopause 2014; 2 : 144–154.
-
The North American Menopause Society. The 2017 hormone therapy position statement of the North American Menopause Society. Menopause 2017; 2 : 728–753.
-
Cardozo L. A systematic review of estrogens for recurrent urinary tract infections. Int Urogynecol J 1999; 10(Suppl. 1), S32.
-
Rioux JE. Demlin C, Gelfand EE et al. 17beta-estradiol vaginal tablet versus conjugated equine estrogen vaginal cream to relieve menopausal atrophic vaginitis. Menopause 2000; 7 : 156–161.
-
Simon J, Nachtigall L, Gut R et al. Effective treatment of vaginal atrophy with an ultra-low-dose estradiol vaginal tablet. Obstet Gynecol 2008; 112 : 1053–1060.
-
Ulrich LSG, Naessen T, Elia D et al. Endometrial safety of ultra-low-dose Vagifem 10 μg in postmenopausal women with vaginal atrophy. Climacteric 2010; 1 : 228–237.
-
Simon J, Nachtigall L, Ulrich LG et al. Endometrial safety of ultra-low-dose estradiol vaginal tablets. Obstet Gynecol 2010; 116 : 876–883.
-
Labrie F, Martel C, Bélanger A, Pelletier G. Androgens in women are essentially made from DHEA in each peripheral tissue according to intracrinology. J Steroid Biochem Mol Biol 2017; 16 : 9–18.
-
Labrie F, Derogatis L, Archer DF et al. Effect of intravaginal prasterone on sexual dysfunction in postmenopausal women with vulvovaginal atrophy. J Sex Med 2015; 12 : 2401–2412.
-
DeGregorio MW, Zerbe RL, Wurz GT. Ospemifene. a first-in-class, non-hormonal selective estrogen receptor modulator approved for the treatment of dyspareunia associated with vulvar and vaginal atrophy. Steroids 2014; 9 : 82–93.
-
Portman D, Palacios S, Nappi RE, Mueck AO. Ospemifene, a non-estrogen selective estrogen receptor regulator for the treatment of vaginal dryness associated with postmenopausal vulvar and vaginal atrophy. Maturitas 2014; 7 : 91–98.
-
Constatine G, Graham S, Portman DJ. et al. Female sexual function improved with ospemifene in postmenopausal women with vulvar and vaginal atrophy. Climacteric 2014; 1 : 1–7.
-
Bachmann GA, Komi JO. Ospemifene effectively treats vulvovaginal atrophy in postmenopausal women. Menopause 2010; 1 : 480–486.
-
Portman DJ, Bachman GA, Simon JA. Ospemifene, a novel selective estrogen receptor modulator for treating dyspareunia associated with postmenopausal vulva rand vaginal atrophy. Menopause 2013; 2 : 623–30.
-
Simon JA, Lin VH, Radovich C, Bachmann GA. One-year long-term safety extension study of ospemifene for the treatment of vulvar and vaginal atrophy in postmenopausal women with a uterus. Menopause 2013; 2 : 418–27.
-
Behnia-Willison F, Sarraf S, Miller J et al. Safety and long-term efficacy of fractional CO2 laser treatment in women suffering from genitourinary syndrome of menopause. Eur J Obstet Gynecol Reprod Biol 2017; 21 : 39–44.
-
Perino A, Cucinelle G, Gugliotta G et al. Is vaginal fractional CO2 laser treatment effective in improving overactive bladder symptoms in post-menopausal patients. Preliminary results. Eur Rev Med Pharm Sci 2016; 20; 1 : 2491–2497.
-
Salvatore S, Leone RMU, Athanasiou S et al. Histological study on the effects of microablative fractional CO2 laser on atrophic vaginal tissue. an ex vivo study. Menopause 2015; 22 : 845–849.
-
Siliquini GP, Tuninetti V, Bournous VE et al. Fractional CO2 laser therapy. a new challenge for vulvovaginal atrophy in postmenopausal women. Climacteric 2017;20 : 379–384.
-
Eriksen B. A randomized, open, parallel group-study on the preventive effect of an estradiol-releasing vaginal ring (Estring) on recurrent urinary tract infection in postmenopausal women. Am J Obstet Gynecol 1999; 180 : 1072–1079.
-
Raz R, Stamm WE. A controlled trial of intravaginal estriol in postmenopausal women with recurrent urinary tract infections. New Engl J Med 1993; 32 : 753–756.
-
Kirkengen AL, Andersen P, Gjersoe E et al. Oestriol in the prophylactic treatment of recurrent urinary tract infections in postmenopausal women. Scan J Prim Health Care 1992; 1 : 139–142.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

2019 Issue 3-4-
All articles in this issue
- Úvodem
- Editorial
- Vzpomínky aneb honem, než to zapomenu
- Mezinárodní konference o biobankách Dauhá, 25.–27. března 2019
- Michael Stuart Brown (1941–) a Joseph Leonard Goldstein (1940–)
- Odešel jeden z nejznámějších českých lékařů profesor Josef Koutecký
- Profesor Jan Pfeiffer zemřel
- Menopauzální genitourinární syndrom: těžký komunikační problém, snadná léčba
- Tibolon – jediný zástupce skupiny STEAR
- Sedavé chování a adipozita u žen starších 55 let
- Vliv věku matky na porodní hmotnost novorozenců
- Reprodukční stárnutí v Česku v kontextu Evropy
- Odkládání rodičovství do pozdějšího věku a jeho možné důsledky
- Význam vitaminu D v gynekologii
- Doporučený příjem tekutin a evidence-based medicine
- Vyhodnocení adresného zvaní českých občanů do screeningových programů
- Jak omezovat stigmatizaci lidí s duševním onemocněním při výuce lékařství: intervence READ
- Přednáškové večery spolku českých lékařů v Praze (ZÁŘÍ 2019)
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Tibolon – jediný zástupce skupiny STEAR
- Menopauzální genitourinární syndrom: těžký komunikační problém, snadná léčba
- Vliv věku matky na porodní hmotnost novorozenců
- Doporučený příjem tekutin a evidence-based medicine
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

