-
Medical journals
- Career
Aktuální pohled na fibromyalgii
Authors: Jan Tomš
Authors‘ workplace: Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové, 2. interní klinika FN, Oddělení revmatologie a klinické farmakologie
Published in: Čas. Lék. čes. 2012; 151: 415-419
Category: Review Articles
Overview
Fibromyalgie je chronický syndrom charakterizovaný poruchou zpracování a regulace bolesti. Přestože dosud není známa jednoznačná etiologie, v patogenezi tohoto syndromu hraje zřejmě ústřední roli proces centrální senzitizace s rozvojem chronické (centrální) bolesti a dalších přidružených symptomů (únava, ztuhlost, poruchy spánku, kognitivní a vegetativní poruchy). Absence objektivních diagnostických testů bývá často příčinou opožděně stanovené diagnózy a fluktuace pacientů mezi řadou specialistů s nejistotou a strachem se závažného onemocnění. Základem léčby je individuálně nastavený a multidisciplinární přístup k pacientovi a kombinace farmakologické a nefarmakologické terapie. Nové léky zavedené do terapie fibromyalgie v posledních letech mohou mít příznivý vliv na zmírnění symptomů a zlepšení kvality života pacientů.
Klíčová slova:
fibromyalgie, chronická bolest, únava, centrální senzitizace.ÚVOD
Popis případů pacientů trpících obtížemi, které jsou charakteristické pro fibromyalgii (FM), lze nalézt v lékařské i neodborné literatuře v průběhu několika předchozích století (1). Teprve v poslední třetině 20. století se ale objevil komplexní pohled na tento syndrom. Snaha o větší klinickou a epidemiologickou homogenitu zkoumaných souborů pacientů kulminovala vypracováním klasifikačních kritérií ACR (American College of Rheumatology) v roce 1990 (2). Od tohoto zlomového bodu narůstá všeobecné povědomí o FM a progresivně se zvyšuje počet vědeckých prací zaměřených na toto téma. V roce 1992 byla na základě Kodaňské deklarace uznána koncepce FM Světovou zdravotnickou organizací (3). V Mezinárodní klasifikaci nemocí (MKN-10) je FM přiřazen kód M797.
FM je chronický syndrom charakterizovaný difuzní plošnou muskuloskeletální bolestí a zvýšenou citlivostí na dotek (tlak při digitální palpaci), která je odrazem sníženého prahu bolesti, což se projevuje allodynií a hyperalgezií. FM přichází jednak ve formě primární, tj. jako samostatná nozologická jednotka, jednak jako konkomitující forma (dříve označovaná sekundární) doprovázející zejména systémová autoimunitní onemocnění pojiva (4). FM nepředstavuje pravděpodobně striktně ohraničenou nozologickou entitu, ale je součástí spektra řady bolestivých syndromů, které se více či méně překrývají a mají podobnou patogenezi (5). Na jednom konci tohoto spektra stojí regionální myofasciální bolestivé syndromy a na opačném pólu FM jako představitel generalizované plošné bolesti.
EPIDEMIOLOGIE
Prevalence chronické plošné (muskuloskeletální) bolesti (CPB), která je nedílnou součástí a projevem FM, se pohybuje mezi 4,2–13 % (6, 7). Prevalence CPB se u obou pohlaví zvyšuje se vzrůstajícím věkem. Pouze část osob trpících CPB ovšem splňuje klasifikační kritéria pro FM. Ve Spojených státech amerických a v zemích západní Evropy se prevalence FM v dospělé populaci pohybuje nejčastěji kolem 2 %. Ženy bývají postiženy daleko častěji než muži (7–9 : 1), a to zejména ve věkovém rozmezí 40–70 let (8). Prevalence FM se zvyšuje s věkem a nejvyšších hodnot dosahuje ve věkovém rozmezí 60–79 let (8 %). FM se nevyhýbá ani dětskému věku, jak dokládají studie s výslednou prevalencí 6–7 % u dětí s povinnou školní docházkou (9). Pacienti s FM tvoří v některých zemích až 5 % klientely praktických lékařů a až 20 % klientely revmatologů (10).
ETIOLOGIE A PATOGENEZE
Příčina FM není dosud objasněna, ale v současné době se FM považuje za syndrom s poruchou přenosu a zpracování nociceptivních impulzů a významnou úlohu při tom hraje proces centrální senzitizace (CS) (5, 11, 12). Původní představa primárně svalového onemocnění (13, 14) nebyla potvrzena, jelikož u pacientů s FM neprokázala vyšetření svalové tkáně optickým a elektronovým mikroskopem žádné specifické změny (15). Proces CS je charakterizován hyperresponzivitou na senzorické afferentní podněty, zvýšenou neuronální excitabilitou v centrálním nervovém systému a amplifikací bolesti. Tento proces není ohraničený pouze na fibromyalgii, ale podílí se obecně na rozvoji chronické (centrální) bolesti u řady dalších onemocnění a je zodpovědný za „autonomii“ perzistující bolesti, i když algické podněty již nemusí být přítomné nebo nejsou významné. Bolest je dynamický fenomém, ovlivňovaný nejen mechanismy excitačními ale i inhibičními. K rozvoji FM přispívá také dysregulace descendentní inhibiční cesty bolesti. U zdravých osob signály z mozku redukují míšní reakce na bolestivé podněty, zatímco u FM je tato modulace bolesti snížená (16).
U pacientů s FM byla prokázána řada biochemických a metabolických změn v centrálním nervovém systému (snížená hladina serotoninu v plazmě i v mozkomíšním moku, zvýšená hladina substance P a nervového růstového faktoru v mozkomíšním moku aj.) (17, 18). Tyto změny jsou spíše odrazem než příčinou porušeného procesu regulace bolesti. Pro možnou genetickou dispozici k FM svědčí jednak epidemiologické studie o familiární agregaci, jednak práce zkoumající různé typy genových polymorfismů (např. katechol-O-methyl-transferáza, dopaminový D4 receptor, 5-hydroxytryptamin 2A receptor), které hrají důležitou roli při stresové odpovědi a v senzorické dráze bolesti (19, 20).
DIAGNÓZA A KLASIFIKAČNÍ KRITÉRIA
Diagnóza FM se opírá o klasifikační kritéria ACR vypracovaná v roce 1990 odbornou komisí na základě rozsáhlé multicentrické studie (2). Je nutné zdůraznit, že se jedná o klasifikační kritéria určená pro epidemiologické a klinické studie (s cílem umožnit porovnání homogenních souborů pacientů) a nikoliv pro stanovení diagnózy FM u konkrétního pacienta v klinické praxi. Pro revmatologickou praxi nejsou dosud k dispozici všeobecně přijímaná diagnostická kritéria. Lékař by měl při stanovení diagnózy vycházet jednak z kombinace typických symptomů a jednak z vyšetření definovaných citlivých bodů (tender points), ale bez nutnosti striktního dodržení minimálního počtu pozitivních bodů, jak vyžadují klasifikační kritéria ACR. Stanovení diagnózy FM podle ACR kritérií vyžaduje splnění obou podmínek, které jsou uvedeny v tabulce 1. Bolestivost v definovaných bodech (obr. 1) není podmíněna prokazatelnou lokální patologií, ale reflektuje celkově snížený práh pro bolest. FM nemusí být provázena difuzně sníženou tolerancí tlakové bolesti, což dokládá dobře snášená tlaková palpace v tzv. kontrolních bodech (uprostřed čela, uprostřed volární plochy předloktí, na distálním článku palce pod nehtovým lůžkem a uprostřed zevní plochy stehna). Vyšetření těchto kontrolních bodů ovšem není nutné pro splnění klasifikačních kritérií a v klinické praxi pozbývá významu.
Table 1. Klasifikační kritéria pro fibromyalgii podle American College of Rheumatology (Wolfe et al., 1990) (2) 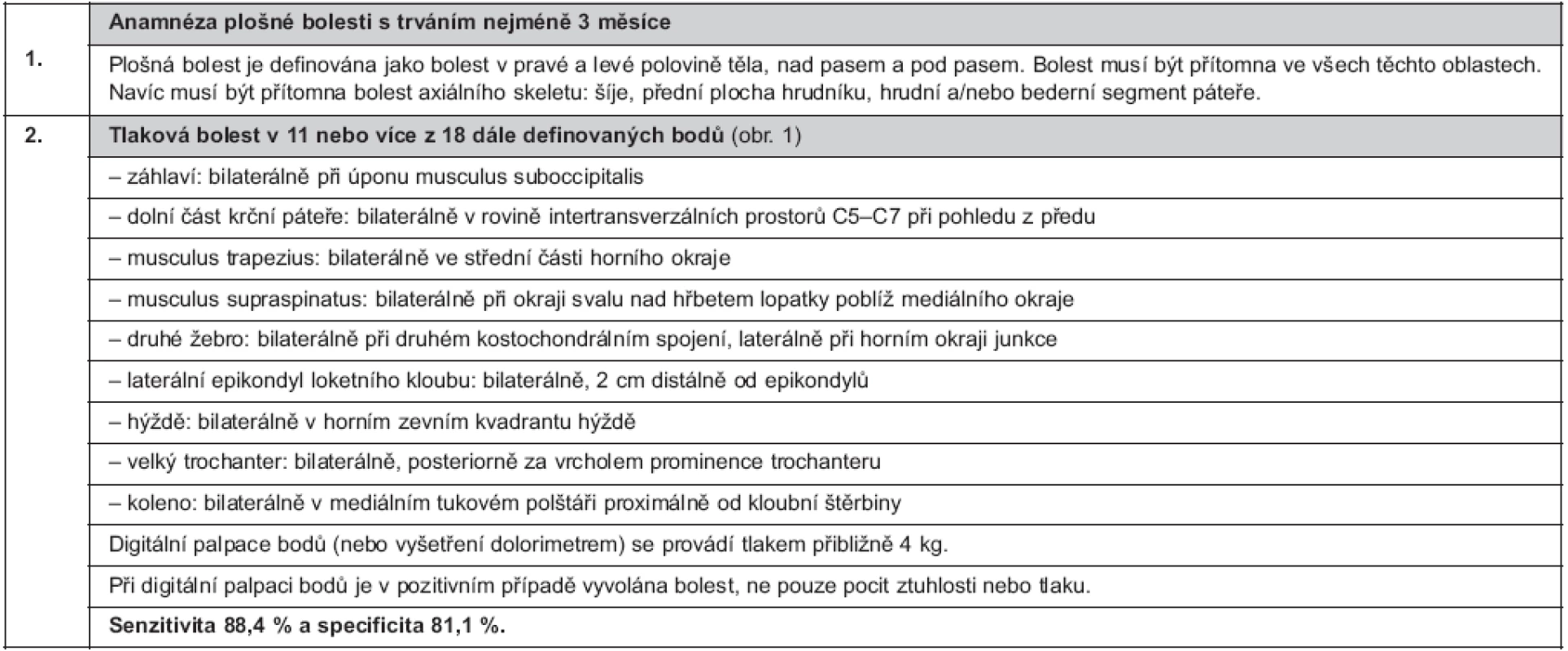
Image 1. Lokalizace 18 definovaných bolestivých bodů u fibromyalgie podle klasifikačních kritérií American College of Rheumatology (Wolfe et al., 1990; podle Pavelka K. et al (2003), obrázek použit se svolením hlavního autora) 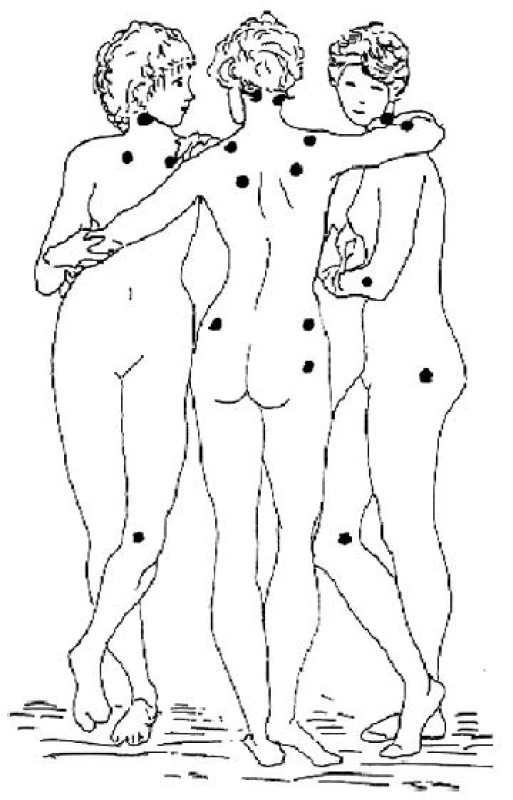
V nedávné době byla publikována Předběžná diagnostická kritéria ACR 2010 pro fibromyalgii (21), jejichž cílem není nahradit původní kritéria z roku 1990, ale poskytnout alternativní metodu ke stanovení diagnózy. Nově navržená kritéria nevyžadují fyzikální vyšetření pacienta, neboť vyšetření bolestivých bodů bylo nahrazeno výčtem symptomů a zhodnocením jejich intenzity. Při stanovení Indexu plošné bolesti (WPI – widespread pain index) pacient označí regiony těla (19 definovaných oblastí), v nichž během posledního týdne cítil bolest. Každá bolestivá oblast je hodnocena jedním bodem (index WPI 0-19). Škála intenzity symptomu (SSS – symptom severity scale) je součtem intenzity tří hlavních příznaků (únava, poruchy spánku, kognitivní příznaky) a počtem dalších somatických příznaků. Každý ze tří hlavních příznaků je skórován 0–3 (0 – žádný problém, 1 – mírný, 2 – střední, 3 – těžký). Somatické symptomy zahrnují 41 různých obtíží (např. svalová bolest, svalová slabost, parestezie, únava, poruchy paměti, nervozita, deprese, nespavost, suchost v ústech, Raynaudův fenomén, frekventní močení, dráždivý tračník aj.). V součtu nabývají také hodnoty 0–3 (0 – žádné symptomy, 1 – několik symptomů, 2 – středně velké množství symptomů, 3 – velké množství symptomů). Konečné skóre SSS se pohybuje v rozmezí 0–12. Diagnóza FM je stanovena v případě WPI ≥ 7 a SS ≥ 5 nebo WPI 3–5 a SSS ≥ 9. Podmínkou je trvání symptomů FM minimálně 3 měsíce a vyloučení jiného onemocnění, které by mohlo vysvětlit (chronickou) bolest.
KLINICKÉ PROJEVY
Hlavními projevy FM jsou chronická plošná bolest a zvýšená citlivost na dotek (2). Bolest je obtížně lokalizovatelná a je vnímána především v měkkých mimokloubních tkáních (svaly, šlachy, úpony), ale také v kloubech nebo kostech. Intenzita bolesti je v průběhu času proměnlivá, ale prakticky nikdy nedochází k úplné úlevě. Bolest kolísá jednak v dlouhodobém horizontu (měsíce až roky), jednak diurnálně s maximem obtíží ráno a navečer (22). U řady pacientů lze vysledovat tzv. polední okénko, tj. zmírnění bolesti a zvýšení výkonnosti mezi 10. a 16. hodinou. Svalová bolest je obvykle doprovázena ztuhlostí, která má obdobný charakter jako u revmatoidní artritidy. Někteří pacienti uvádějí, že je bolí celé tělo („celý člověk“), v jiných případech je bolest pociťována současně v několika oddělených oblastech (regionální bolestivé syndromy). Často si pacienti s FM stěžují na otoky kloubů, které se ale při objektivním vyšetření nepotvrdí.
Kromě muskuloskeletálních obtíží popisují pacienti s FM řadu dalších nespecifických symptomů, z nichž nejčastěji se jedná o chronickou únavu až pocit vyčerpanosti. Únava je nejvýraznější po ránu, ale perzistuje během celého dne a způsobuje problémy při zvládání běžných každodenních činností. Poruchy spánku se projevují špatným usínáním, častým probouzením během noci a nedostatečným pocitem odpočinutí po probuzení. Kognitivní poruchy u FM zahrnují především potíže s krátkodobou pamětí. Poměrně frekventní jsou projevy deprese nebo zvýšená anxiozita, bolesti hlavy (migrenózního charakteru), závratě, parestezie, vazomotorické poruchy (Raynaudův fenomén, livedo reticularis) a dysmenorea u žen. Další přidružené obtíže vycházejí z funkčních poruch některých orgánů: syndrom dráždivého tračníku, dráždivý močový měchýř.
DIFERENCIÁLNÍ DIAGNOSTIKA
Rozpoznání FM na podkladě CPB, přidružených symptomů a přítomnosti vícečetných bolestivých bodů je poměrně snadné. Obtížnější situace nastává v případě asociace s jiným revmatickým nebo nerevmatickým onemocněním a v rámci tzv. překryvných syndromů. Přestože vlastní diagnostika FM nevyžaduje žádné specifické testy, je vhodné v případě diagnostické nejistoty doplnit několik laboratorních a/nebo zobrazovacích metod k odhalení možných souběžných onemocnění. Tyto základní testy zahrnují sedimentaci erytrocytů, krevní obraz, revmatoidní faktor a antinukleární protilátky, hormony štítné žlázy, svalové enzymy (kreatinkináza) a eventuálně rentgenové vyšetření křížokyčelních a ručních kloubů. Souhrn onemocnění, která lze mylně zaměnit s FM je uveden v tabulce 2.
Table 2. Diferenciální diagnostika fibromyalgie 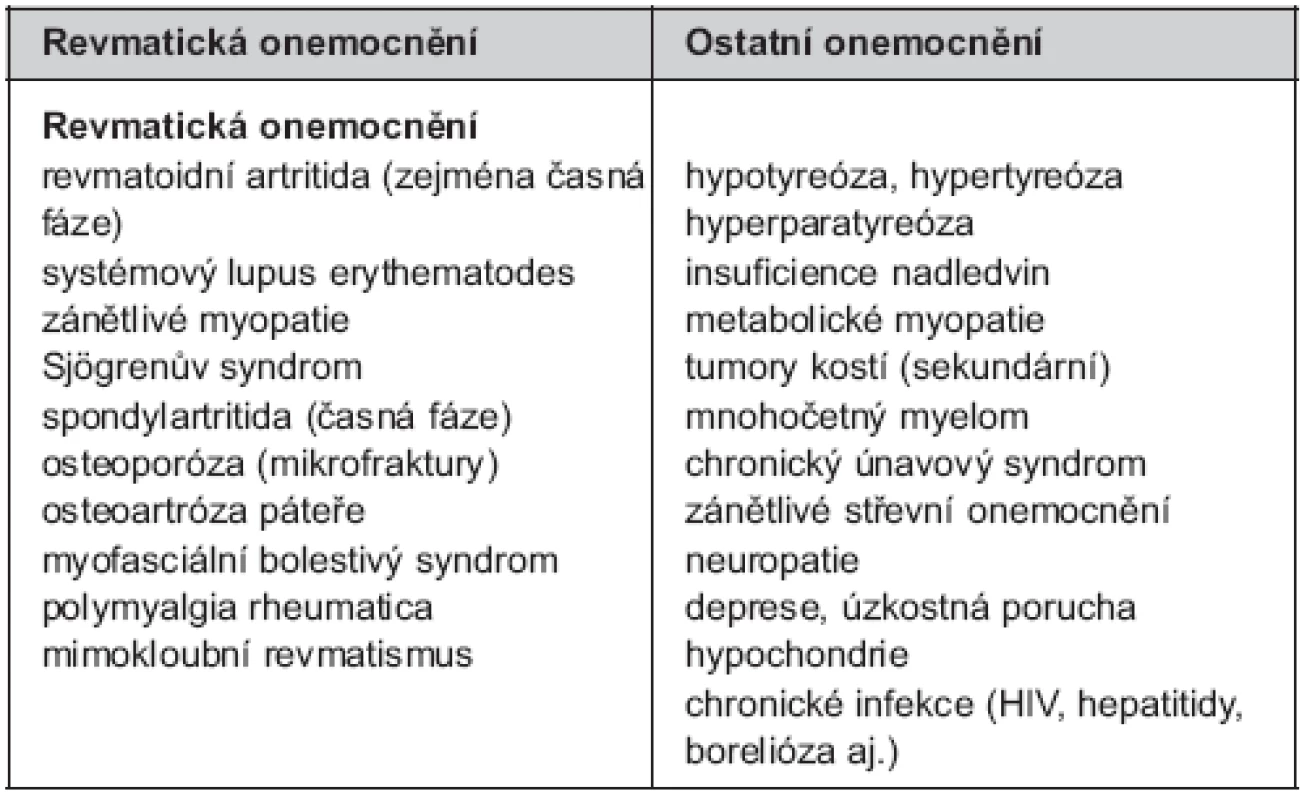
Přestože stanovení diagnózy FM není složité a je možné je provést i v podmínkách ambulantní praxe praktického lékaře, dochází u většiny pacientů s FM k významnému prodlení, než je FM odhalena. Bennett et al. oslovili 2596 pacientů s FM a zjistili, že 42 % z nich navštívilo tři až šest lékařů a 24,6 % dokonce více než šest lékařů, než byla stanovena diagnóza FM (23). Příčina je zřejmě v nedostatku objektivně hodnotitelných projevů FM.
Zvláštní pozornost v diferenciální diagnostice si zasluhuje vztah FM k tzv. překryvným syndromům. Jedná se o skupinu syndromů (tab. 3), které se navzájem překrývají ve své symptomatologii, často se vyskytují asociovaně, postrádají strukturální patologické změny a mají obdobný patogenetický podklad. V současné době jsou zahrnuty do jednotné koncepce tzv. syndromů centrální senzitizace (5). Předpokládá se, že u nich hraje významnou roli CS spojená s hyperexcitabilitou centrálních neuronů na podkladě různých synaptických a neurotransmiterových (neurochemických) procesů. Dříve bylo toto uskupení označováno také jako „funkční somatické syndromy“, „medicínsky nevysvětlitelné syndromy“ aj.
Table 3. Současný návrh výčtu členů rodiny syndromů centrální senzitizace – upraveno podle Yunuse (5) 
LÉČBA
Multidisciplinární přístup
Dosud ne zcela objasněná etiopatogeneze je příčinou toho, že léčba FM zůstává problematická a obtížná. Neexistuje jeden lék nebo jeden typ léčby, který by příznivě působil na všechny projevy FM. Rozmanitost příznaků, významný vliv psycho-sociálních faktorů a stresu vyžadují komplexní a multidisciplinární přístup s cílem minimalizovat symptomy FM a zlepšit úroveň celkového zdraví. Často se zdůrazňuje „terapie šitá na míru“ u každého jednotlivého pacienta, protože FM je heterogenní syndrom s rozdílnou individuální manifestací. V současné době máme k dispozici doporučení pro léčbu FM založená na důkazech, vypracovaná odbornou skupinou pod záštitou EULAR (European League Against Rheumatism) (24), a také doporučení vydaná American Pain Society (APS) (25).
Včasné rozpoznání diagnózy FM umožní včasnou terapeutickou intervenci. Zásadní význam v léčbě má úvodní nebo lépe průběžná edukace pacienta, ať již formou individuální, nebo na skupinové bázi. Úkolem lékaře je získat důvěru nemocného a zapojit pacienta i jeho rodinu do aktivního přístupu k této nemoci. Je důležité také identifikovat a léčit přidružená onemocnění, především spánkové poruchy nebo poruchy nálady.
FM je vzhledem k muskuloskeletální symptomatologii většinou diagnostikována revmatology, ale v dlouhodobé péči se preferuje úloha praktických a rodinných lékařů, kteří v případě potřeby zajistí spolupráci s revmatologem, neurologem, psychiatrem, algeziologem nebo fyzioterapeutem.
Farmakologická léčba
V letech 2008–2009 schválila FDA (Food and Drug Administration) v USA tři léky k terapii FM. V zemích Evropské unie dosud EMEA (European Medicines Agency) v této indikaci neschválila žádný medikament (26).
Tricyklická antidepresiva
Pro tricyklická antidepresiva (TCA) starší generace existuje nejsilnější evidence účinnosti u FM a je s nimi nejdelší zkušenost v léčbě. Právě efekt TCA, které byly zprvu zkoušeny empiricky, vedl k výzkumu zaměřenému na deficit serotoninu v patogenezi FM. Nejčastěji je doporučován amitriptylin v dávce 25–50 mg na noc, při vyšších dávkách hrozí větší riziko nežádoucích účinků (útlum, zácpa, suchost v ústech aj.). Antidepresiva obecně mohou zlepšit kvalitu spánku, mohou ovlivnit přidruženou depresi a mají analgetický efekt právě u stavů spojených s centrální poruchou bolesti (27).
Inhibitory zpětného vychytávání serotoninu
Z inhibitorů zpětného vychytávání serotoninu – SSRI (selective serotonin reuptake inhibitors) antidepresiv se u FM používají fluoxetin a sertralin v dávce 20 mg, resp. 50 mg denně. Léčba SSRI preparáty vedla u pacientů s FM jak ke zlepšení celkového skóre FIQ (Fibromyalgia Impact Questionnaire), tak i jednotlivých skóre pro bolest, únavu a depresi (25). Výhodou SSRI je lepší snášenlivost a méně nežádoucích účinků než u amitriptylinu.
Inhibitory zpětného vychytávání serotoninu a noradrenalinu
Mezi moderní představitele antidepresiv – SNRI (serotonin and norepinephrine reuptake inhibitors), se řadí venlafaxin, duloxetin a milnacipran. Poslední dva jmenovaní byli schváleni FDA jako léky indikované k terapii FM, protože vykázaly efekt v řadě sledovaných parametrů během kvalitních multicentrických studiích (25, 26). Podávání duloxetinu se zahajuje denní dávkou 30 mg (po dobu jednoho týdne), při dobré toleranci se dávka zvyšuje na 60 mg. Léčba milnacipranem startuje dávkou 12,5–25 mg denně s postupnou titrací na udržovací denní dávku 2 × 50 mg.
Antikonvulziva moderní generace
Jedná se o léky účinné u epilepsie, protože blokují kalciový a sodíkový kanál v centrálním nervovém systému, a tím snižují uvolnění neurotransmiterů, jako je substance P, glutamát aj. Stejný mechanismus je zodpovědný i za analgetický efekt. Pregabalin byl prvním lékem schváleným FDA k léčbě FM. U pacientů s FM v dávce 300–450 mg denně významně ovlivňuje intenzitu bolesti, únavy a poruchy spánku (28). Dalším zástupcem této skupiny je gabapentin používaný stejně jako pregabalin zejména k léčbě neuropatické bolesti.
Analgetika a protizánětlivé léky
Do terapeutického spektra u FM patří také paracetamol a tramadol, ať již v monoterapii, nebo lépe v kombinaci. Tramadol, jenž se řadí mezi centrálně působící analgetika, je u pacientů s FM účinný v redukci bolesti a dobře tolerovaný. O účinku silných opiátových analgetik u FM není dostatek validních informací, proto jejich nasazení by mělo být zvažováno jen v případě vyčerpání ostatních terapeutických možností. Přestože FM není zánětlivým onemocněním, jsou perorálně podávaná nesteroidní antirevmatika pacienty s FM hojně využívána, pro jejich účinnost v monoterapii ovšem neexistuje žádný důkaz. Užitečné může být jejich podávání v kombinaci s TCA (25) nebo ve formě externích lokálních přípravků. Pro léčbu glukokortikoidy není žádné opodstatnění, protože se ukázaly u FM neúčinné, srovnatelné s placebem.
Hypnotika a anxiolytika
Benzodiazepiny by mohly být díky svému anxiolytickému a myorelaxačnímu efektu u FM prospěšné, ale dosud nebyl podán důkaz o jejich účinnosti a navíc riziko vzniku závislosti jejich využití u FM omezuje. I přes nedostatek důkazů o efektu nebenzodiazepinových anxiolytik jsou tato někdy doporučována s ohledem na možnost ovlivnění spánkových potíží a obdobné důvody platí také po moderní hypnotika.
Nefarmakologická léčba
Nefarmakologická terapie je nedílnou součástí komplexního přístupu k pacientům s FM. Pro účinnost aerobního, kardiovaskulárního tréninku svědčí řada důkazů, z nichž první byly podány již před více než 20 lety. Pohybový léčebný program by měl být dlouhodobý a pravidelný, s frekvencí 3–4krát týdně po dobu 30 minut. Enormní fyzická zátěž by mohla vést ke zhoršení projevů FM, proto se doporučuje zátěž stupňovat do 70 % maxima tepové frekvence (22). Na druhé straně pohybovou zátěž doporučujeme i za cenu dočasného zhoršení obtíží. Příznivý vliv na zmírnění symptomů může přinášet také fyzikální léčba (29). Nefarmakologická léčba zahrnuje různé druhy psychoterapie, z nichž největší efekt se ukazuje u kognitivně-behaviorální terapie, jenž podporuje pacienty v umění zvládnout stresovou zátěž. Možnosti alternativní medicíny (akupunktura, hypnoterapie aj.) jsou sice pacienty s FM velmi často vyhledávány, ale jednoznačně přínosný efekt nebyl zatím potvrzen (24). Dosud nebyly podány přesvědčivé důkazy o účinku aplikace injekcí do bolestivého nebo spouštěcího bodu.
PROGNÓZA
FM je chronické onemocnění s fluktuující intenzitou širokého spektra obtíží. Forseth et al. pozorovali zlepšení po 5 letech sledování jen u malé části pacientů (30). Granges et al. se zabývali pacienty s FM sledovanými spádovými revmatology a ukázalo se, že po 2 letech bylo 24 % pacientů v remisi a 47 % nesplnilo ACR kritéria (31). Tyto nadějnější výsledky z hlediska prognózy jsou dány tím, že se nejednalo o FM pacienty v terciárních centrech jako v ostatních studiích, jelikož tam jsou většinou odesílány případy s největší intenzitou obtíží a komorbiditami včetně závažné deprese. Wolfe et al. (32) zjistili při analýze kohorty 8186 pacientů, že během třicetipětiletého sledování nebyla FM asociována se zvýšenou mortalitou, ale riziko úmrtí v důsledku suicidia bylo zvýšené (míra relativního rizika – OR 3,31).
ZÁVĚR
Přes intenzivní výzkum v posledních dvou dekádách zůstává jednoznačná příčina FM stále zahalena v mlze nevědomosti. Nicméně pokrok v porozumění patogeneze FM jako syndromu s poruchou regulace bolesti vedl k zavedení nových léků, které mohou mít příznivý vliv na zmírnění symptomů a zlepšení kvality života, optimálně v kombinaci s nefarmakologickou terapií v rámci individuálně nastaveného a multidisciplinárního přístupu k pacientovi.
Absence objektivních diagnostických testů a častý překryv s dalšími chronickými onemocněními bývají příčinou prodlení ve stanovení diagnózy FM a vedou k fluktuaci pacientů mezi řadou odborných specialistů. Zvýšené povědomí o FM zejména mezi lékaři primární péče může přispět k včasné diagnóze a pro pacienta zkrácení období nejistoty a strachu z neurčeného závažného onemocnění. I přes dlouholeté trvání klinických obtíží ztrpčujících život nepřináší FM riziko deformit nebo zkrácení života a o tom je nutné pacienty ubezpečit.
Zkratky
- ACR – American College of Rheumatology
- APS – American Pain Society
- CPB – chronická plošná bolest
- CS – centrální senzitizace
- EMEA – European Medicines Agency
- EULAR – European League Against Rheumatism
- FDA – Food and Drug Administration
- FIQ – Fibromyalgia Impact Questionnaire
- FM – fibromyalgie
- SNRI – inhibitory zpětného vychytávání serotoninu a noradrenalinu (serotonin and norepinephrine reuptake inhibitors)
- SSRI – selektivní inhibitory vychytávání serotoninu (selective serotonin reuptake inhibitors)
- SSS – škála intenzity symptomu (symptom severity scale)
- TCA – tricyklická antidepresiva
- WPI – index plošné bolesti (widespread pain index)
ADRESA PRO KORESPONDENCI:
MUDr. Jan Tomš
Oddělení revmatologie a klinické farmakologie
2. interní klinika LF UK a FN
Sokolská 581, 500 06 Hradec Králové
fax: +420 495 834 785, e-mail: toms.jan@seznam.cz
Sources
1. Inanici F, Yunus MB. History of fibromyalgia: past to present. Curr Pain Headache Rep 2004; 8 : 369–378.
2. Wolfe F, Smythe A, Yunus MB, et al. The American College of Rheumatology 1990 criteria for the classification of fibromyalgia: report of Multicenter Criteria Committee. Arthritis Rheum 1990; 33 : 160–172.
3. Csillage C. Fibromyalgia: the Copenhagen declaration. Lancet 1992; 340 : 663–664.
4. Tomš J, Soukup T, Bradna P, Hrnčíř Z. Konkomitující fibromyalgie u pacientů s revmatoidní artritidou. Čes Revmatol 2009; 17(3): 120–126.
5. Yunus MB. Fibromyalgia and overlapping disorders: the unifying concept of central sensitivity syndromes. Semin Arthritis Rheum 2007; 36 : 339–356.
6. Croft P, Rigby AS, Boswell R, et al. The prevalence of chronic widespread pain in the general population. J Rheumatol 1993; 20 : 710–713.
7. Lindell L, Bergman S, Petersson IF, et al. Prevalence of fibromyalgia and chronic wide–spread pain. Scand J Prim Health Care 2000; 18 : 149–153.
8. White KP, Harth M. Classification, epidemiology and natural history of fibromyalgia. Curr Pain Headache Rep 2001; 53 : 320–329.
9. Schanberg L. Widespread pain in children: when is it pathologic? Arthritis Rheum 2003; 48 : 2402–2405.
10. Bennett RM. The fibromyalgia syndrome. In: Kelley WN, Harris ED, Ruddy S, et al. Textbook of rheumatology, 5th ed. Philladelphia: W.B. Saunders 1997; 511–519.
11. Price DD, Staud R. Neurobiology of fibromyalgia syndrome. J Rheumatol 2005; 75(Suppl): 22–28.
12. Tomš J. Současný pohled na etiopatogenezi fibromyalgie. Čes Revmatol 2009; 17(3): 162–166.
13. Gowers WR. Lumbago: Its lessons and analogues. Br Med J 1904; 1 : 117–121.
14. Stockman R. Rheumatism and arthritis. Edinburgh: Green and Son Ltd. 1920; 132.
15. Yunus MB, Kalyan-Raman UP, Masi AT, et al. Electron microscopic studies of muscle biopsy in primary fibromyalgia syndrome: a controlled and blinded study. J Rheumatol 1989; 16 : 97–101.
16. Gebhart GF. Descending modulation of pain. Neurosci Biobehav 2004; 27 : 729–737.
17. Russell IJ, Orr MD, Littman B, et al. Elevated cerebrospinal fluid levels of substance P in patients with fibromyalgia syndrome. Arthritis Rheum 1994; 11 : 1593–1601.
18. Russell IJ, Vaeroy H, Javors M, et al. Cerebrospinal fluid biogenic aminometabolites in fibromyalgia/fibrositis syndrome and rheumatoid arthritis. Arthritis Rheum 1992; 35 : 550–556.
19. Arnold LM, Hudson JI, Hess EV, et al. Family study of fibromyalgia. Arthritis Rheum 2004; 50 : 944–592.
20. Vargas-Alarcón G, Fragoso JM, et al. Catechol-O-methyltransferase gene haplotypes in Mexican and Spanish patients with fibromyalgia. Arthritis Res Ther 2007; 9: R110.
21. Wolfe F, Clauw DJ, Fitzcharles M, et al. The American College fo Rheumatology Preliminary Diagnostic Criteria fo Fibromyalgia and measurement of Symptom Severity. Arthritis Care Res 2010; 62(5): 600–610.
22. Hrnčíř Z, Dvořák Z. Fibromyalgie a chronický únavový syndrom. In: Pavelka K, Rovenský J et al. Klinická revmatologie, Galén, Praha, 2003; 679–684.
23. Bennett RM, Jones J, Turk DC, et al. An internet survey of 2596 people with fibromyalgia. BMC Musculoskeletal Disorders 2007; 8 : 27–37.
24. Carville SF, Arendt-Nielsen S, Bliddal H, et al. EULAR evidence-based recommendations for the management of fibromyalgia syndrome. Ann Rheum Dis 2008; 67(4): 536–541.
25. Goldenberg DL, Burckhardt C, Crofford L. Management of fibromyalgia syndrome. JAMA 2004; 292 : 2388–2395.
26. Votavová M, Pavelka K. Současné možnosti léčby fibromyalgie. Remedia 2009; 4 : 251–255.
27. Arnold LM, Keck PE. Antidepressant treatment of fibromyalgia: a meta–analysis and review. Psychosomatics 2000; 41 : 104–113.
28. Croford LJ, Rowbotham MS, Mease PJ, et al. Pregabalin for the treatment of fibromyalgia syndrome. Results of randomised, double blind placebo controlled trial. Arthritis Rheum 2005; 52 : 1264–1273.
29. Jeřábek J. Fibromyalgie 2009 – kde, jak a proč může pomoci fyzikální léčba. Rehabil Fyz Lék 2009; 2 : 60–68.
30. Forseth KĮ, Gran JT, Husby G. A population study of incidence of fibromyalgia among women aged 26–55 yr. Br J Rheumatol 1997; 36 : 1318–1323.
31. Granges G, Zilko P, Littlejohn GO. Fibromyalgia syndrome: assessment of the severity of the condition 2 years after diagnosis. J Rheumatol 1994; 21 : 523–529.
32. Wolfe F, Hassett AL, Wallitt B, et al. Mortality in Fibromyalgia: A Study of 8186 Patients Over Thirty-Five Years. Arthritis Care Res 2011; 63(1): 94–101.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Aktuální pohled na fibromyalgii
- Obecná psychopatologie – podklad pro objektivní psychiatrický nález*
- Fytoterapia kožných rán – prehľad experimentálnych a klinických štúdií v prvom decéniu 21. storočia
- Léčba závislosti na tabáku – zlepšení dostupnosti v klinické praxi
- Význam DNA vyšetření mutací C282Y, H63D a S65C v HFE genu
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Aktuální pohled na fibromyalgii
- Význam DNA vyšetření mutací C282Y, H63D a S65C v HFE genu
- Fytoterapia kožných rán – prehľad experimentálnych a klinických štúdií v prvom decéniu 21. storočia
- Obecná psychopatologie – podklad pro objektivní psychiatrický nález*
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

