-
Medical journals
- Career
Mozgový natriuretický peptid môže predikovať zmenu geometrie srdca u detí s chronickou obličkovou chorobou
Authors: J. Hedvig 1; Ľ. Podracká 1; D. Potočeková 2
Authors‘ workplace: I. Klinika detí a dorastu LF UPJŠ a DFN, Košice 1; Ústav lekárskej informatiky LF UPJŠ, Košice 2
Published in: Čas. Lék. čes. 2008; 147: 90-95
Category: Original Article
Overview
Východisko.
Kardiovaskulárne choroby sú vedúcou príčinou morbidity/mortality u detí s chronickou obličkovou chorobou. Nedávne štúdie ukázali, že mozgový nátriuretický peptid je vhodný kardiálny biomarker na stratifikáciu kardiovaskulárneho rizika u dospelých. Či má mozgový nátriuretický peptid rovnaký diagnostický potenciál u detí s chronickou obličkovou chorobou, nie je známe. Cieľom práce bolo zistiť, či mozgový nátriuretický peptid môže predikovať kardiálnu dysfunkciu u detí s chronickou obličkovou chorobou.Metódy a výsledky.
Autori študovali vzťah medzi plazmatickými koncentráciami mozgového nátriuretického peptidu, echokardiografickými nálezmi a kardiovaskulárnym rizikom (hypertenzia, anémia, lipidy, C‑reaktívny proteín, i-parathormón, kalciovofosforový metabolizmus) u 46 detí (10 detí v predialyzačnom štádiu, 14 na dialýze, 11 po transplantácií obličky a 11 zdravých kontrol). Hodnoty log10 mozgového nátriuretického peptidu boli u dialyzovaných detí (2,09 ± 0,78) signifikantne vyššie ako u zdravých detí (1,43 ± 0,34, p = 0,012), u pacientov v predialyzačnom štádiu chronickej obličkovej choroby (1,52 ± 0,42, p = 0,039) a po transplantácií obličky (1,71 ± 0,46, p = 0,19). Abnormálnu geometriu srdca malo 19 detí (54,28 %). Pacienti s excentrickou hypertrofiou ľavej komory mali vyššie hodnoty log10 mozgového nátriuretického peptidu voči zdravým kontrolám ako chorí s koncentrickou hypertrofiou ľavej komory (2,178 ± 0,956 vs. 1,496 ± 0,395, p = 0,05, resp. 1,982 ± 0,618 vs. 1,496 ± 0,395, p = 0,04). Mozgový natriuretický proteín koreloval s hypertrofiou ľavej komory (p = 0,00l), s i-PTH (p = 0,03) a s anémiou (p = 0,027).Závery.
BNP môže predikovať zmenu geometrie srdca u detí s chronickou renálnou insuficienciou a je vhodným markerom kardiovaskulárnej stratifikácie aj v tejto skupine pediatrickej populácie.Kľúčové slová:
mozgový natriuretický peptid, chronická obličková choroba, hypertrofia ľavej komory, geometria srdca.Demografické údaje mapujúce smrtnosť obyvateľstva západnej civilizácie už roky konštatujú, že kardiovaskulárne choroby sú vedúcou príčinou morbidity a mortality u dospelých. V ostatnom čase sa ukazuje, že rovnaký trend platí aj pre rizikovú populáciu detských pacientov. K skupinám so smrtonosným kardiovaskulárnym „bremenom“ patria aj deti s chronickou obličkovou chorobou (CKD – chronic kidney disease). Zníženie kardiovaskulárneho (KV) rizika sa preto stalo otvorenou a naliehavou výzvou, ktorej čelia pediatri aj detskí nefrológovia.
Celková mortalita detí s pokročilou obličkovou chorobou je napriek dramatickým medicínskym pokrokom až o 35 až 47 % vyššia v porovnaní s ich zdravými rovesníkmi (1). K jej najčastejším príčinám patria KV ochorenia, ktoré tvoria štvrtinu všetkých úmrtí u detí s renálnym zlyhaním (2) a dominujú aj u mladistvých po transplantácií obličky. Tieto údaje majú veľký klinický význam, ak si uvedomíme, že KV mortalita v bežnej pediatrickej populácií je extrémne nízka. Preto včasná diagnostika a liečba srdcových chorôb môže významne zlepšiť prežívanie detí s CKD.
Najčastejšou KV komplikáciou je hypertrofia ľavej komory (HĽK), ktorá sa vyskytuje až u 75 % dialyzovaných pacientov (3–6). Početné klinické štúdie dokladajú, že HĽK podporuje rozvoj koncentrických a excentrických zmien geometrie srdca a je relevantným indikátorom KV rizika nielen u pacientov s urémiou (7, 8), ale aj v bežnej populácii (9). Preto nedávne správy o výskyte HĽK až u 1/3 detí so včasným štádiom CKD vyvolali obavy pediatrov (10). Interpretácia príčinných súvislostí nie je jednoduchá, ale predpokladá sa, že môže ísť o interakciu hemodynamických a nehemodynamických faktorov. Toto vysvetlenie podporuje detailnejšia klinická analýza, ktorá ukázala, že mužské pohlavie, vysoký body mass index, anémia, objemové preťaženie a chronický zápal sú hlavné určujúce deteminanty zmien geometrie srdca. Na druhej strane sa zdá, že podiel artériovej hypertenzie v tomto procese sa u detí preceňoval.
So zreteľom na alarmujúce demografické údaje je v centre pozornosti klinikov hľadanie neinvazívnych a spoľahlivých markerov, ktoré dokážu stratifikovať pacientov s CKD podľa KV rizika. K najsľubnejším prediktívnym markerom patrí mozgový natriuretický peptid (BNP). V medicínskej praxi sa osvedčil najmä pri diagnostike kongestívneho zlyhania srdca, avšak recentné klinické štúdie u dospelých ukázali, že BNP spoľahlivo detekuje ventrikulárnu dysfunkciu aj u chorých s urémiou. Skúsenosti s monitorovaním BNP u detí sú len sporadické a obmedzujú sa na kongenitálne srdcové chyby, či stavy po transplantácií srdca, údaje u detí s renálnou insuficienciou chýbajú. Cieľom našej štúdie bolo zistiť, či môžu sérové hodnoty BNP odrážať kardiálnu dysfunkciu u pediatrických pacientov s CKD.
SÚBOR PACIENTOV A POUŽITÉ METÓDY
Do štúdie sme zaradili 46 detí (35 pacientov s CKD, 19 chlapcov, 16 dievčat, x– = 16,12 ± 5,14 rokov) a 11 zdravých kontrol (5 chlapcov, 6 dievčat, x– = 14,73 ± 5,04 rokov) porovnateľných vekom a pomerom pohlaví. Pacienti boli rozdelení do 4 skupín:
1. skupinu tvorilo 10 detí s chronickou obličkovou chorobou v predialyzačnom období (x– = GF: 58,09 ml/min/1,73 m2), v 2. skupine bolo 14 detí na chronickej hemodialýze (x– = 9 ± 7 mesiacov). Do 3. skupiny sme zaradili 11 detí po transplantácií obličky (x– = 62 ± 38 mesiacov, x– = GF: 88,55 ml/min/1,73 m2). Kontrolná skupina pozostávala z 11 zdravých detí (bez ochorenia srdca a obličiek s GF > 90 ml/min/1,73 m2).
U všetkých detí sme vyšetrili krvný obraz, CRP, základné biochemické parametre, renálne funkcie, kostný metabolizmus (kalcium, fosfor, ich súčin), intaktný parathormón (i-PTH), BNP, kvantitatívnu proteinúriu a echokardiografické vyšetrenie (echokg). Krv na BNP sme odobrali do 2,5 ml skúmavky s EDTA. Vzorka sa hneď scentrifugovala rýchlosťou 6000 otáčok/min počas 20 minút pri teplote 4 oC a získaná plazma sa zmrazila pri teplote -80 oC až do vyšetrenia BNP. BNP (fy Abbott) sa vyšetrovalo metódou MEIA (microparticle enzyme immunoassay). Echokg sa realizovalo na ultrazvukovom prístroji Siemens Acuson CV70 3,5 MHz sektorovou sondou podľa odporúčaní Americkej spoločnosti pre echokardiografiu (11). U každého dieťaťa sa merala diastolická hrúbka interventrikulárneho septa (IVSd), zadnej steny ľavej komory (LVPWd), systolický a diastolický rozmer ľavej komory (LVDs, LVDd). Masa ľavej komory sa indexovala k výške a vyjadrovala sa v g/m2,7 (IMĽK). Relatívna hrúbka stien (RWT) sa určovala z podielu súčtu interventrikulárneho septa so zadnou stenou ľavej komory a diastolického rozmeru ľavej komory (IVSD+LVPWd/LVDd). Koncentrická remodelácia sa definovala ako RWT nad 0,45, čo zodpovedalo 95. percentilu tejto hodnoty nameranej v kontrolnej skupine detí. Hypertrofia ľavej komory bola definovaná ako IMĽK väčší ako 37,6 g/m2,7 (95. percentil v zdravej kontrolnej skupine). Za koncentrický typ HĽK sa považoval nález RWT > 0,45; LVM/výška2,7 > 37,6 g/m2,7, za excentrický typ HĽK hodnoty RWT < 0,45; LVM/výška2,7 > 37,6 g/m2,7.
Štatistika
Získané výsledky sa spracovali štatistickým programom Statistica Cz 6.0 firmy StatSoft, štatistickým programom Arcus Quickstat Biomedical v.1.1 a programom Microsoft Excel 2003. Na overenie hypotézy rovnosti stredných hodnôt príslušných parametrov u dvoch skupín sme použili Studentov t-test pre nezávislé vzorky, v prípade viacerých skupín sme použili ANOVU s následným LSD testom. Pri porušení predpokladu normality dát sme použili Mann--Whitneyho U test resp. Kruskal-Wallisovu ANOVU. Vzťah medzi premennými sa vyhodnocoval Pearsonovou korelačnou analýzou. Rozdielnosť výskytu sledovaného znaku vo vybraných vzorkách sme testovali χ2-testom resp. Fisherovým exaktným testom. Aby sa vylúčil vplyv rozdelenia hodnôt plazmatickej koncentrácie BNP, zvolili sme transformáciu dát ako logaritmus BNP so základom 10 (log10 BNP, ďalej len logBNP). Osobitne sa vyhodnotil vzťah medzi sekundárnym hyperparatyreoidizmom, resp. anémiou a poškodením srdca. Za štatisticky významný rozdiel sme považovali hodnoty p ≤ 0,05.
Výsledky
Klinické charakteristiky súboru
Najčastejšou základnou chorobou bola renálna hypo/dysplázia, ktorá sa vyskytovala u 41 % chorých. Vrodené alebo hereditárne nefropatie malo 34 % pacientov a glomerulonefritídu 25 % chorých detí. Obličkové choroby boli v jednotlivých skupinách porovnateľne zastúpené. 54 % pacientov sa liečilo na hypertenziu. Z 1. skupiny (predialyzačné štádium CKD) malo 41 % detí hypertenziu, v 2. skupine (dialýza) 54 % a v 3. skupine (transplantácia) 63 % chorých. 32 % pacientov užívalo inhibítory ACE v monoterapii, 16 % detí kombináciu ACE inhibítora a blokátora angiotenzínového receptoru, 52 % chorých malo inú antihypertenzívnu liečbu.
V tabuľke 1 a na grafoch 1 a 2 sú uvedené základné klinické, hematologické a biochemické parametre v celom súbore chorých. Priemerné hodnoty sledovaných parametrov sú porovnávané medzi jednotlivými skupinami súboru.
Table 1. Základné laboratórne charakteristiky v súbore 46 detí 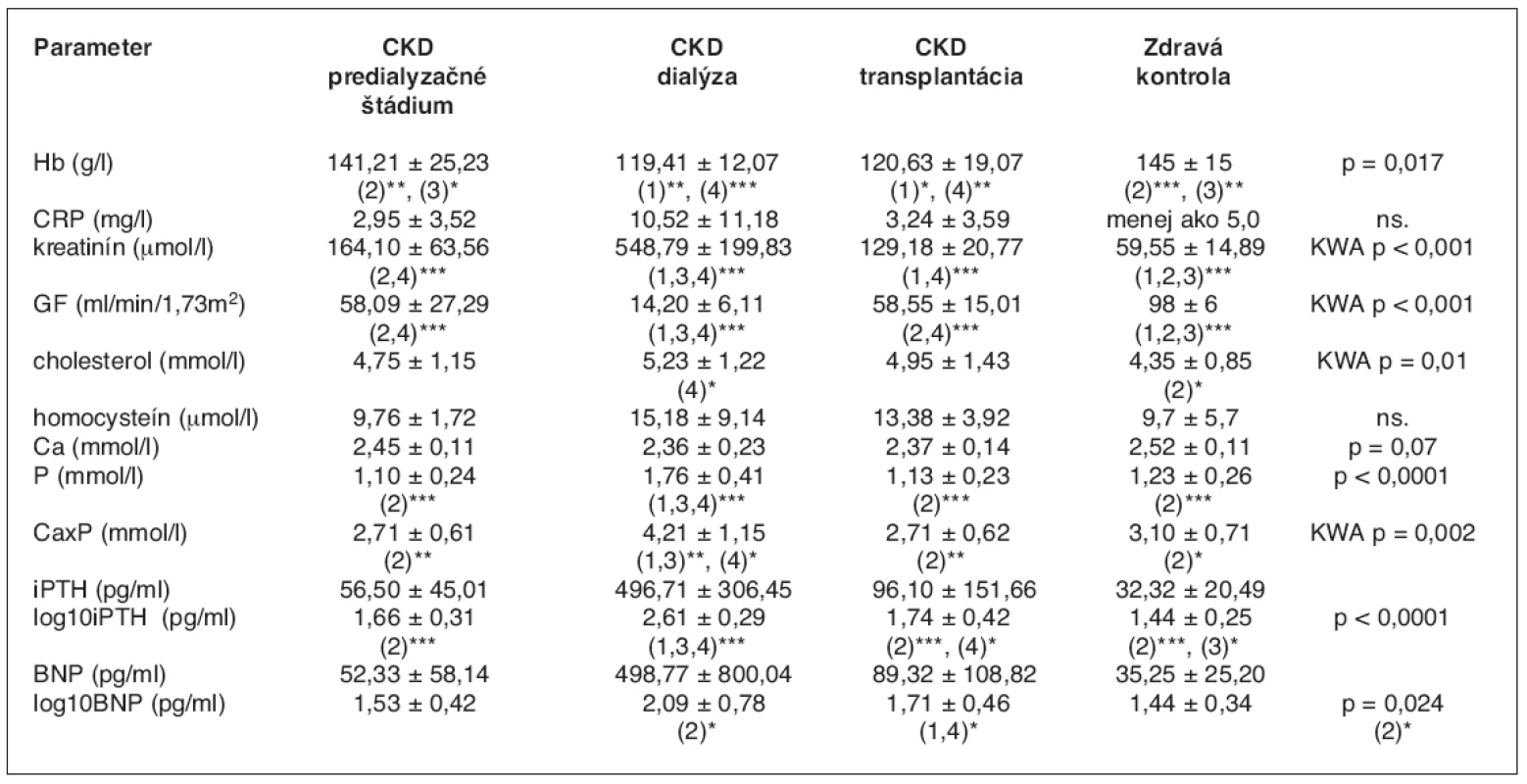
1. skupina CKD – predialyzačné štádium, 2. skupina CKD – dialýza, 3. skupina CKD – transplantácia, 4. skupina – zdravá kontrola ***p < 0,001, **p < 0,01, *p < 0,05 KWA – Kruskal-Wallisova ANOVA Graph 1. Index masy ľavej komory u predialyzovaných, dialyzovaných a transplantovaných pacientov 
Graph 2. Distribúcia BNP v závislosti od indexu masy ľavej komory (IMĽK) 
Echokardiografické vyšetrenie
Výsledky echokg nálezov sú zhrnuté v tabuľke 2. Zo súboru 35 chorých malo 19 detí abnormálnu geometriu srdca, čo tvorí 54,28 %. Jednalo sa o 3 pacientov v predialyzačnom štádiu, 10 detí na dialýze a 6 pacientov po renálnej transplantácii. Z hľadiska kardiálnej patológie malo 10 pacientov (28,57 %) koncentrickú hypertrofiu ľavej komory, šesť pacientov (17,14 %) malo excentrickú hypertrofiu ľavej komory a u troch pacientov (8,57 %) sme zistili koncentrickú remodeláciu ĽK. IMĽK a RWT sa signifikantne líšili u dialyzovaných (p < 0,001) a transplantovaných pacientov (p < 0,015) v porovnaní so zdravou kontrolou. Inými slovami, u dialyzovaných a transplantovaných detí sa významne častejšie vyskytovala hypertrofia ľavej komory ako u chorých v predialyzačnom období CKD a v skupine zdravých rovesníkov. Distribúciu IMĽK, ktorý je indikátor hypertrofie ľavej komory, a RWT v jednotlivých skupinách znázorňuje graf 1.
Table 2. Echokardiografické nálezy v súbore 46 detí 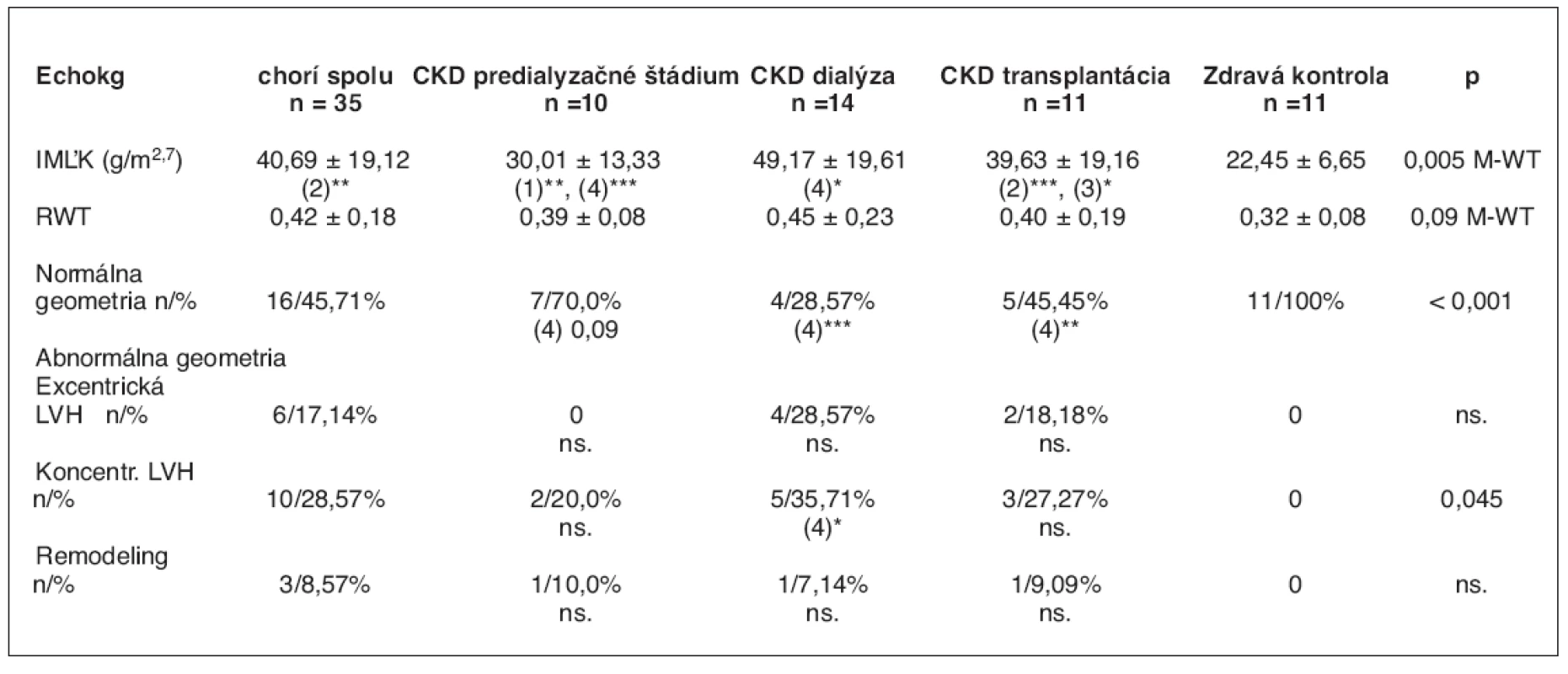
1. skupina CKD – predialyzačné štádium, 2. skupina CKD – dialýza, 3. skupina CKD – transplantácia, 4. skupina – zdravá kontrola *p < 0,05; **p < 0,01; ***p < 0,001 M-WT – Mann-Whitney U test V pravom (poslednom) stĺpci sú porovnania všetkých chorých ku kontrolnej skupine. Hodnoty sú uvedené ako priemery a štandardné odchýlky
Výsledky vyšetrenia BNP v sére
Analýzou rozptylu sa potvrdil signifikantný rozdiel log BNP medzi jednotlivými skupinami (p = 0,024). Hodnoty logBNP u dialyzovaných detí (2,09 ± 0,78) boli signifikantne vyššie v porovnaní so zdravými kontrolami (1,43 ± 0,34, p = 0,012) a chorými v predialyzačnom štádiu CKD (1,52 ± 0,42, p = 0,039) ako aj v porovnaní s transplantovanými pacientmi (1,71 ± 0,46, p = 0,19).
BNP a echokardiografia
Pri členení súboru s/ a bez hypertrofie ĽK sa ukázalo, že významne vyššie priemerné hodnoty logBNP majú chorí s HĽK ako pacienti bez hypertrofie ľavej komory (2,01 ± 0,71 vs. 1,54 ± 0,43, p = 0,038, Mann-Whitney test). Štatisticky signifikantný vzťah medzi HĽK a logBNP potvrdila aj korelačná analýza (r = 0,515, p < 0,001, y = 1,126 + 0,016*x). Porovnaním log BNP u detí s HĽK sme zistili, že chorí s excentrickou HĽK mali vyššie hodnoty logBNP voči zdravým kontrolám ako chorí s koncentrickým typom HĽK (2,178 ± 0,956 vs. 1,496 ± 0,395, p = 0,05) (1,982 ± 0,618 vs. 1,496 ± 0,395, p = 0,04).
BNP a sekundárny hyperparatyreoidizmus
Pacienti so sekundárnym hyperparatyreodizmom mali vyšší logBNP (1,95 ± 0,71 vs. 1,53 ± 0,39, p = 0,03 Mann-Whitney test) a vysokú signifikantnú závislosť medzi HĽK a logBNP (r = 0,716, p = 0,0003) v porovnaní s chorými, ktorí mali nízky PTH. Inými slovami, čím bol vyšší iPTH, tým bol vyšší BNP (log10iPTH vs. log10BNP: r = 0,374, p = 0,010; y = 0,979 + 0,388*x) a HĽK. Navyše, BNP signifikantne korelovalo aj so súčinom Ca × P (r = 0,4413, p = 0,0021) a s RWT (r = 0,3583, p = 0,0145).
Graph 3. Korelácia medzi log10BNP a log10 i-PTH 
BNP a anémia
U chorých s anémiou sme pozorovali štatisticky významne vyššie hodnoty logBNP ako u pacientov bez anémie (2,074 ± 0,755 vs. 1,561 ± 0,353, p = 0,027, Mann-Whitney test). Naviac, u chorých s vysokými hodnotami BNP (nad 100 pg/ml) sa zistila vysoká prediktívna hodnota pre výskyt anémie (Odds Ratio, OR = 7,111; 95% CI (1,23;40,98)).
Diskusia
Deti s chronickou obličkovou chorobou nesú ťažké bremeno srdcovo-cievneho poškodenia, čím patria k najohrozenejšej skupine z celej pediatrickej populácie. Príčiny kardiovaskulárneho postihnutia pri renálnych chorobách sú multifaktoriálne. Okrem tradičných KV rizík sa uplatňujú aj s urémiou asociované faktory ako napr. anémia, HĽK, kostno-cievna choroba (hyperparatyreoidizmus, hypokalciémia, hyperfosfatémia, nedostatok vitamínu D), hyperhomocysteinémia, zápal a iné. Najbežnejšou kardiálnou abnormalitou asociovanou s renálnou insuficienciou je HĽK. Prístup k definovaniu HĽK u detí podľa echokg môže byť rozdielny. Väčšina detských kardiológov odporúča kalkulovať index masy ľavej komory k výške dieťaťa (12, 13). Nedávne práce potvrdili, že „táto indexácia“ sa osvedčila aj pri prognózovaní KV rizika u dospelých (14). V predloženej práci, sme rovnako ako ďalší autori (10, 12, 13) definovali IMĽK vo vzťahu k aktuálnej telesnej výške vyšetrovaného dieťaťa, preto môžeme naše výsledky relevantne porovnávať s literárnymi údajmi. Z nášho súboru 35 detí malo až 19 pacientov (t.j. 54,28 %) abnormálnu geometriu srdca. Z hľadiska stupňa renálneho zlyhania boli 3 chorí v predialyzačnom štádiu CKD, 10 detí na chronickej dialýze a 6 pacienti po transplantácií obličky. Koncentrická hypertrofia sa vyskytovala častejšie ako excentrická hypertrofia. Desať pacientov (28,57 %) malo koncentrickú a 6 pacientov (17,14 %) excentrickú HĽK. U ďalších 3 pacientov (8,57 %) sme zistili koncentrickú remodeláciu ĽK. Naše výsledky sú v súlade so závermi veľkej multicentrickej európskej štúdie, ktorá odhalila prekvapivo častý výskyt HĽK u detí s CKD (10). Autori zistili, že až 35 % zo 156 detí v predialyzačnom štádiu CKD malo HĽK. Vyšší výskyt HĽK v našom súbore (54 %) možno vysvetliť tým, že tretina našich chorých bola už na chronickej dialýze. Toto vysvetlenie podporujú aj klinické pozorovania u dospelých, z ktorých je známe, že IMĽK rastie úmerne s poklesom renálnych funkcií a u chorých na dialýze môže dosiahnuť až dvojnásobok normálnej hodnoty (15). Na druhej strane 30 % našich detí v predialyzačnom štádiu už malo prítomnú abnormálnu geometriu srdca. Aj v dvoch detských štúdiách zameraných na sledovanie vzťahu medzi geometriou srdca a včasným (predialyzačným) štádiom renálnej insufiencie sa zistila koncentrická HĽK častejšia ako excentrická forma, ktorá dominovala u detí na dialyzačnej liečbe (16). Tieto, ale aj ďalšie výsledky potvrdzujú, že remodelácia ľavej komory koncentrického alebo excentrického typu sa odohráva už vo včasných štádiách CKD. V pokročilom a/alebo koncovom štádiu renálnej insuficiencie je hlavným faktorom podporujúcimi vznik koncentrickej a/alebo excentrickej remodelácie hypertenzia a objemové preťaženie. Ľavá komora sa prispôsobuje na zvýšený afterload koncentrickou remodeláciou a zvýšený preload vyvoláva excentrickú remodeláciu (17). Na úlohu objemového preťaženia môže nepriamo poukazovať aj vyšší log BNP u detí s excentrickou ako s koncentrickou HĽK (2,178 ± 0,956 vs.1,982 ± 0,618). Ďalším prekvapivým záverom multicentrickej pediatrickej štúdie bol fakt, že distribúcia geometrie ľavej komory je nezávislá na prítomnosti artériovej hypertenzie. Je zaujímavé, že ani u našich chorých hypertenzia nekorešpondovala s echokg a nekorešpondovala ani so žiadnou skupinou antihypertenzív. Či má u detí artériová hypertenzia v tomto procese menší význam, ako sa pôvodne predpokladalo, treba ešte overiť. Jedným zo špekulatívnych vysvetlení môže byť kardioprotektívny na krvnom tlaku nezávislý vplyv ACEI event. ich kombinácia s AT1 blokátormi a dobrá kontrola hypertenzie.
Echokardiografické vyšetrenie je indikované v selektovanej skupine chorých, preto sa hľadajú neinvazívne testy, ktoré môžu slúžiť ako diagnostický marker kardiálnej dysfunkcie. Nedávno sa na predikciu KV morbidity a mortality osvedčilo monitorovanie BNP a N - terminálu proBNP (NT BNP) v sére. Vzostup masy ľavej komory a tlakovej nálože nezávisle stimuluje syntézu BNP a preto plazmatické koncentrácie BNP a N - terminálu proBNP (NT-BNP) „verne“ odrážajú masu a funkciu srdca (12–15). Z observačných štúdií vyplynulo, že na zvýšení BNP sa môže podieľať nielen myokardiálna dysfunkcia ale aj renálne funkcie (18, 19). Preto interpretácia vyšších sérových koncentrácií BNP u chorých s CKD je zložitá. Či ide len o dôsledok zníženej glomerulovej filtrácie alebo priamy vplyv kardiálneho poškodenia sa skúmalo Cox-ovou regresnou multivariačnou analýzou, ktorá dokáže „matematicky odseparovať“ podiel nižšieho renálneho klírensu na sérovej koncentrácií BNP. Použitie tohto štatistického modelu exaktne potvrdilo, že vyššie hodnoty BNP sú nezávislým prediktorom chorého srdca aj u pacientov s renálnou insuficienciou. Zoccali et al. vo veľkej skupine 246 dialyzovaných dospelých bez srdcového zlyhania ako prvý zistil, že srdcové natriuretické peptidy (ANP a BNP) sú nezávisle prediktory pre ejekčnú frakciu. BNP vo všetkých sledovaných parametroch spoľahlivejšie odrážalo HĽK ako ANP a nezávisle predikovalo mortalitu chorých (8). Aj Cataliotti uvádza, že pacienti, ktorí zomreli na KV príčiny, mali signifikantne vyššie BNP ako chorí, ktorí prežili (18). Dobrú výpovednú hodnotu BNP podporujú aj naše pozorovania. Demonštrovali sme, že deti s HĽK majú významne vyššie priemerné hodnoty BNP ako pacienti bez hypertrofie ľavej komory (404,15 ± 723,90 vs. 57,21 ± 73,93; p < 0,038). Pozitívnu koreláciu medzi HĽK a BNP sme potvrdili aj regresnou analýzou s logaritmom BNP (p < 0,038).
Príčiny kardiovaskulárneho postihnutia u chorých so zlyhaním obličiek sú multifaktoriálne. Z celého radu kauzálnych súvislosti sa v ostatných rokoch študuje najmä anémia a kostná choroba. Renálna anémia je „klasickou“ sprievodnou komplikáciou chronickej obličkovej choroby. Dodávka kyslíka do myokardu u chorých v urémií klesá napriek jeho rastúcim potrebám. Zvýšený preload a znížený afterload síce kompenzatórne udržujú tkanivovú oxygenáciu, ale konečným dôsledkom ochranného patofyziologického mechanizmu je remodelácia myokardu. Význam anémie podčiarkujú longitudinálne štúdie u dospelých, ktoré exaktne dokladajú, že zmeny hemoglobínu paralelne sprevádzajú zmeny v raste myokardu ľavej komory (14). V našom súbore sme u pacientov s vysokými hodnotami BNP (nad 100 pg/ml) zistili signifikantne vyšší výskyt anémie (p = 0,023) s vysokou prediktívnou hodnotou (Odds Ratio, OR = 7,111; 95%CI (1,23;40,98)).
Nedávno sa dokázalo, že vznik vaskulárnych kalcifikácií podmieňuje najmä hyperfosfatémia a sekundárny hyperparatyreoidizmus (19, 20). Klinické údaje o asociácii KV rizika a kostno-cievnej choroby podporujú aj naše výsledky. Deti so sekundárnym hyperparatyreodizmom mali vyššie BNP (p = 0,01). BNP signifikantne korelovalo so súčinom CaxP (r = 0,4413, p = 0,0021), s RWT (r = 0,3583, p = 0,0145) a tiež s IMĽK (r = 0,3377, p = 0,0217). Naša štúdia prvýkrát demonštruje, že BNP koreluje so sekundárnym hyperparatyreoidizmom u detí s CKD. Získané dáta naznačujú, že abnormality kostného metabolizmu treba akceptovať ako KV rizikový faktor aj v detskom veku.
Záver
Choroby srdca a ciev sú „súputnikom“ urémie a najčastejšou príčinou mortality a morbidity u detí s chronickými chorobami obličiek. Moderná diagnostika kardiovaskulárneho poškodenia sa opiera o kardiálne biomarkery, ku ktorým bezpochyby patrí aj mozgový natriuretický peptid. Výsledky našej štúdie ukazujú, že BNP môže predikovať zmenu geometrie srdca u detí s chronickou obličkovou chorobou a je vhodným markerom kardiovaskulárnej stratifikácie aj v tejto skupine pediatrickej populácie.
Skratky
ACE – angiotensín konvertujúci enzým
ANP – atriálny natriuretický proteín
BMI – body mass index
BNP – mozgový natriuretický peptid
CKD – chronic kidney disease (chronická choroba obličiek)
CRP – C-reaktívny proteín
GF – glomerulová filtrácia
HĽK – hypertrofia ľavej komory
IMĽK – index masy ľavej komory
iPTH – parathormón
KV – kardiovaskulárny
LV mass – hmota ľavej komory
LVDd – diastolický rozmer ľavej komory
LVDs – systolický rozmer ľavej komory
LVPWd – hrúbka zadnej steny ľavej komory v diastole
NT pro BNP – N-terminálna časť mozgového natriuretického peptidu
RWT – relatívna hrúbka steny
prof. MUDr. Ľudmila Podracká, CSc.
I. KDD LF UPJŠ a DFN
Tr. SNP č. 1, Košice 040 66, Slovenská republika
e-mail: ludmila.podracka@upjs.sk
Sources
1. Mitsnefes, M. M.: Pediatric end–stage renal disease: heart as target. J. Pediatr., 2002, 141, s. 162–164.
2. Parekh, R. S, Caroll, C. E, Wolfe, R. A. et al.: Cardiovascular mortality in children and young adults with end–stage kidney disease. J. Pediatr., 2002, 141, s. 191–197.
3. Parfrey, P. S, Foley, R. N.: The clinical epidemiology of cardiac disease in chronic renal failure. J. Am. Soc. Nephrol., 1999, 10, s. 1606–1615.
4. Mitsnefes, M. M, Daniels, S. R, Schwartz, S. M et al.: Severe left ventricular hypertrophy in pediatric dialysis: Prevalence and predictors. Pediatr. Nephrol., 2000, 14, s. 898–902.
5. Longenecker, J. C., Coresh, J., Power, N. R. et al.: Traditional cardiovascular risk factors in dialysis patients compared with general population: The CHOICE study. J. Am. Soc. Nephrol., 2002, 13, s. 1918–1927.
6. Gruppen, M. P, Groothoff, J. W, Prins, M. et al.: Cardiac disease in young adults patients with end–stage renal disease since childhood: A Dutch cohort study. Kidney Int., 2003, 63, s. 1058–1065.
7. Sillberg, J. S, Barre, P. E, Prichard, S. S. et al.: Impact of left ventricular hypertrophy on survival in end–stage renal disease. Kidney Int.,1989, 36, s. 286–290.
8. Zoccali, C., Benedetto, F. A., Mallamaci, F. et al.: Left ventricular mass monitoring in the follow–up of dialysis patients: Prognostic value of left ventricular hypertrophy progression. Kidney Int., 2004, 65, s. 1492–1498.
9. Levy, D., Garrison, R. J., Savage, D. D. et al.: Prognostic implications of echocardiographically determined left ventricular mass in Framingham Heart Study. N. Eng. J. Med., 1990, 322, s. 1561–1566.
10. Matteucci, M. C., Wühl, E., Picca, S. et al.: Left ventricular geometry in children with mild to moderate chronic renal insufficiency. J. Am. Soc. Nephrol., 2006, 17, s. 218–226.
11. Members of the Chamber Quantification Writing Group are: Lang, R. M., Bierig, M., Devereux, R. B. et al: Recommendations for Chamber Quantification: A Report from the American Society of Echocardiography’s Guidelines and Standards Committee and the Chamber Quantification Writing Group, Developed in Conjunction with the European Association of Echocardiography, a Branch of the European Society of Cardiology. J. Am. Soc. Echocardiogr., 2005, 18, s. 1440–1460.
12. Daniels, S. R., Kimball, T. R., Morrison, J. A. et al.: Indexing left ventricular mass to account for differencies in body size in children and adolescents without cardiovascular disease. Am. J. Cardiol., 1995, 76, s. 699–701.
13. Urbina, E. M., Gidding, S. S., Bao, W. et al.: Effect of body size, ponderosity, and blood pressure on left ventricular growth in children and young adults in the Bogalusa Heart Study. Circulation, 1995, 91, s. 2400–2406.
14. de Simone, G., Kizer, J., Chinali, M. et al.: Normalisation for body size and population attributable risk of left ventricular hypertrophy: The Strong Heart Study. Am. J. Hypertens., 2005, 18, s. 191–196.
15. Mitsnefes, M. M., Kimball, T. R., Witt, S. A. et al.: Left ventricular mass and systolic performance in pediatric patients with chronic renal failure. Circulation, 2003, 107, s. 864–868.
16. Mitsnefes, M. M, Kimball, T. R., Border, W. L. et al.: Impaired left ventricular diastolic function in children with chronic renal failure. Kidney Int., 2004, 65, s. 1461–1466.
17. Grossman, W., Jones, D., McLaurin, L. P.: Wall stress and patterns of hypertrophy in the human left ventricle. J. Clin. Invest., 1975, 56, s. 56–64.
18. Cataliotti, A., Malatino, L., Jougasaki, M. et al.: Circulating natriuretic peptide concentrations in patients with end-stage renal disease: role of brain natriuretic peptide as a biomarker for ventricular remodeling. Mayo Clinic Proc., 2001, 76, s. 1111–1119.
19. Clerico, A., Capriolo, R., Del Ry, S. et al.: Clinical relevance of cardiac natriuretic peptides measured by means of competitive and non-competitive immunoassay methods in patients with renal failure on chronic hemodialysis. J. Endocrinol. Invest., 2001, 24, s. 24–30.
20. Blacher, J., Guerin, A. P., Pannier, B. et al.: Arterial calcifications, arterial stiffness, and cardiovascular risk in end–stage renal disease. Hypertension, 2001, 38, s. 938–942.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Zkušenosti s podáváním časné enterální výživy kriticky nemocným na jednotce intenzivní metabolické péče
- Je současný rozsah vyšetření dárců krve dostatečný? Onemocnění zhoubným nádorem u aktivních dárců krve
- Jaký je výskyt zhoubných nádorů mezi bývalými dárci krve?
- Metabolický syndrom a deprese – klinické vztahy
- Metabolické účinky endokanabinoidního systému
- Kvalita spermatu plzeňských vysokoškolských studentů
- Mozgový natriuretický peptid môže predikovať zmenu geometrie srdca u detí s chronickou obličkovou chorobou
- Tracheální intubace bez podání svalového relaxancia – vliv odlišných dávek sufentanilu na kvalitu intubačních podmínek: prospektivní studie
- Komplikace v oblasti kapsy kardiostimulátoru
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Jaký je výskyt zhoubných nádorů mezi bývalými dárci krve?
- Komplikace v oblasti kapsy kardiostimulátoru
- Tracheální intubace bez podání svalového relaxancia – vliv odlišných dávek sufentanilu na kvalitu intubačních podmínek: prospektivní studie
- Je současný rozsah vyšetření dárců krve dostatečný? Onemocnění zhoubným nádorem u aktivních dárců krve
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

