-
Medical journals
- Career
Současné možnosti zpomalení progrese chronického onemocnění ledvin
Authors: Vladimír Tesař
Authors‘ workplace: Klinika nefrologie 1. LF UK a VFN Praha
Published in: Vnitř Lék 2022; 68(7): 420-424
Category: Main Topic
doi: https://doi.org/10.36290/vnl.2022.089Overview
Chronické onemocnění ledvin od určité fáze progreduje do terminálního selhání ledvin vyžadujícího náhradu funkce ledvin dialýzou nebo transplantací. Progresi je možno významně zpomalit inhibicí systému renin‑angiotenzin‑aldosteron (RAAS) inhibitory angiotenzin‑konvertujícího enzymu (ACE) nebo blokátory receptoru typu 1 pro angiotenzin II (ARB). Další novou možností jak posílit efekt inhibice systému RAAS je inhibice sodíko‑glukózového transportéru 2 (SGLT2) glifloziny. Dapagliflozin je v současné době již dostupný a hrazen i pro naše pacienty s diabetickým i nediabetickým onemocněním ledvin. V brzké době by měla být dostupná i léčba inhibitorem mineralokortikoidního receptoru finerenonem, který významně potencuje inhibitor ACE nebo ARB. Recentní data ukazují na možnost ovlivnit progresi renální insuficience cvičením.
Klíčová slova:
SGLT2 – cvičení – dapagliflozin – inhibítor SGLT2 – progrese chronického onemocnění ledvin – finerenon – systém renin‑angiotenzin – mineralokortikoidní receptor
Úvod
Neléčené chronické onemocnění ledvin od dosažení určitého snížení glomerulární filtrace (nejpozději okolo 0,5 ml/s) obvykle progreduje do terminální fáze chronického selhání ledvin, která vyžaduje léčbu náhradou funkce ledvin (dialýzou nebo transplantací). Mechanismus této progrese byl dlouho nejasný a až do 80. let minulého století byla jedinou možností jak progresi ovlivnit dobrá kontrola krevního tlaku.
Progrese renální insuficience je spojena s exponenciálním růstem kardiovaskulárního rizika, zpomalení progrese renální insuficience tak současně snižuje kardiovaskulární morbiditu a mortalitu.
Počátkem 80. let 20. století bylo v experimentech na zvířatech prokázáno, že progrese chronického onemocnění ledvin souvisí s výší glomerulárního tlaku, který je udržován tonem aferentní (vtokové) a eferentní (výtokové) arterioly. Při snížení počtu fungujících nefronů dochází k dilataci aferentní arterioly a konstrikci eferentní arterioly (1). Tato maladaptace sice zajišťuje vzestup glomerulární filtrace v každém zachovaném (reziduálním) glomerulu (takže pokles celkové glomerulární filtrace je menší, než by odpovídalo ztrátě nefronů), ale zvýšení glomerulárního tlaku je spojeno se vzestupem proteinurie a postupným vývojem glomerulosklerózy a intersticiální fibrózy a zrychlenou progresí chronického onemocnění ledvin do selhání ledvin.
Vzniká tak bludný kruh, který významným způsobem přispívá k progresi chronické renální insuficience do terminálního selhání ledvin vyžadujícího léčbu dialýzou nebo transplantací. Snížení glomerulárního tlaku dilatací eferentní arterioly nebo konstrikcí dilatované aferentní arterioly tak sice akutně snižuje glomerulární filtraci, ale z dlouhodobého hlediska renální funkci stabilizuje, resp. významným způsobem zpomaluje rychlost ztráty glomerulární filtrace.
Inhibice systému renin‑angiotenzin a progrese chronického onemocnění ledvin
Důležitou roli ve vzestupu glomerulárního tlaku hraje systém renin‑angiotenzin‑aldosteron (RAAS). Angiotenzin II zvyšuje glomerulární tlak konstrikcí eferentní arterioly.
U pacientů s diabetem 2. typu bylo postupně prokázáno, že blokátor receptoru typu 1 pro angiotenzin II irbesartan snižuje u pacientů s albuminurií 30–300 mg/24 hodin riziko vývoje manifestní proteinurie (2) a irbesartan i losartan zpomalují u pacientů s diabetickým onemocněním ledvin rychlost ztráty glomerulární filtrace o cca 20–30 % (3, 4). Léčba inhibitorem angiotenzin konvertujícího enzymu (ACE) trandolaprilem snížila u normoalbuminurických pacientů s diabetem 2. typu riziko vzestupu albuminurie nad 30 mg/24 hodin (5). Inhibice systému RAAS by tak u pacientů s diabetem 2. typu měla být zahájena co nejdříve.
Pacienti s nediabetickým onemocněním ledvin představují nehomogenní skupinu, u které mohou být kromě výše popsaných hemodynamických změn další mechanismy progrese typické pro jednotlivé renální onemocnění (např. růst cyst u autosomálně dominantních polycystických ledvin). Příznivý vliv léčby inhibitorem ACE benazeprilem (6) a ramiprilem (7) byl ale prokázán i pro pacienty s nediabetickým onemocněním ledvin.
Snaha o intenzivnější blokádu systému renin‑angiotenzin‑aldosteron kombinací inhibitoru ACE a ARB (8) nebyla úspěšná, zejména v důsledku zvýšeného výskytu hyperkalemie a akutního zhoršení renální funkce.
Renoprotektivní účinky inhibice mineralokortikoidního receptoru
Stupeň blokády RAAS lze také zvýšit kombinací inhibitoru ACE nebo ARB s blokátorem mineralokortikoidního receptoru. Široké využití nejstaršího, již více než padesát let dostupného, inhibitoru mineralokortikoidního receptoru spironolaktonu bylo ale vždy omezeno jeho nežádoucími účinky, souvisejicími se současnou blokádou receptoru pro androgeny a progesteron, např. gynekomastií, impotencí nebo nepravidelností menstruačního cyklu.
Proto byla vyvinuta druhá generace antagonistů aldosteronu, kterou představuje selektivní inhibitor mineralokortikoidního receptoru eplerenon a třetí generace zastoupená recentně vyvinutým vysoce selektivním nesteroidním inhibitorem mineralokortikoidního receptoru finerenonem.
Studie FIDELIO‑DKD a FIGARO‑DKD prokázaly u pacientů s diabetickým onemocněním ledvin renoprotektivní i kardioprotektivní účinky finerenonu
Recentně publikovaná dvojslepá randomizovaná placebem kontrolovaná studie fáze 3 FIDELIO‑DKD (9) srovnávala účinek finerenonu a placeba (přidaných navíc ke standardní léčbě včetně inhibitoru ACE) na progresi onemocnění ledvin u pacientů s diabetem 2. typu a klinickou diagnózou diabetického onemocnění ledvin (perzistující albuminurií na léčbě inhibitorem ACE nebo blokátorem receptoru pro angiotenzin v maximální tolerované dávce).
5 734 pacientů s diabetem 2. typu a chronickým onemocněním ledvin s albuminurií 30–300 mg/g kreatininu, odhadovanou glomerulární filtrací 0,41–1 ml/s/1,73 m2 a diabetickou retinopatií nebo albuminurií 300–5000 mg/g kreatininu a odhadovanou glomerulární filtrací 0,41–1,25 ml/s/1,73 m2 bylo randomizováno k léčbě finerenonem nebo placebem. Před vstupem do studie museli být všichni pacienti léčeni inhibitorem ACE nebo ARB v maximální dávce doporučené výrobcem (pokud tato dávka nevyvolávala nepřijatelné nežádoucí účinky).
Primárním složeným cílovým parametrem byl trvalý pokles odhadované glomerulární filtrace o ≥ 40 % proti vstupní hodnotě nebo selhání ledvin nebo smrt ve vztahu k onemocnění ledvin. Hlavním sekundárním sledovaným parametrem byl kompozit kardiovaskulární morbidity, nefatálního infarktu myokardu, cévní mozkové příhody a hospitalizace pro srdeční selhání.
Průměrný věk pacientů ve studii byl 65,6 let, 70 % z nich byli muži, 63 % běloši, 25 % Asiaté, diabetes trval u pacientů v průměru více než 16 let, kompenzace diabetu i kontrola krevního tlaku byla uspokojivá. Průměrná odhadovaná glomerulární filtrace byla 0,73 ml/s/1,73 m2, 33 % pacientů mělo odhadovanou glomerulární filtraci 0,75–1 ml/s/1,73 m2 a 53 % pacientů mělo odhadovanou glomerulární filtraci 0,41 – 0,75 ml/s/1,73 m2. Průměrná albuminurie byla 852 mg/g kreatininu. Průměrná kalemie před vstupem do studie byla 4,37 mmol/l.
Před vstupem do studie bylo 34,2 % pacientů léčeno inhibitory ACE, 65,7 % blokátory receptoru 1 pro angiotenzin, 56,6 % diuretiky a 74,3 % statiny. Z hlediska terapie diabetu bylo 64,1 % pacientů léčeno inzulinem, 6,9 % agonisty GLP-1 a jen 4,6 % inhibitory SGLT2.
Pacienti v aktivní a placebové větvi se nelišili ve vstupních charakteristikách, více než 98 % pacientů bylo léčeno ACEI nebo ARB v maximální doporučované dávce. Během doby sledování přerušilo účast ve studii 29 % pacientů léčených finerenonem a 28,2 % pacientů v placebové větvi.
Po střední době sledování 2,6 roku se primární sledovaný parametr vyskytl u 17,8 % pacientů léčených finerenonem a u 21,1 % pacientů v placebové větvi (relativní riziko 0,82, p = 0,001). Vliv finerenonu byl srovnatelný ve všech prespecifikovaných skupinách pacientů. K zabránění jednomu primárnímu endpointu bylo nutno léčit 29 pacientů. U pacientů léčených finerenonem došlo ve srovnání s pacienty léčenými placebem k většímu (o 31 %) poklesu poměru albumin/kreatinin v moči. Rozdíl mezi finerenonem a placebem byl numericky ještě o trochu větší při použití sekundárního renálního kompozitního cílového parametru (selhání ledvin, trvalý pokles odhadované glomerulární filtrace o více než 57 % nebo smrt z renálních příčin – relativní riziko 0,76).
Hlavní sekundární (kardiovaskulární) cílový parametr se vyskytl u 13 % pacientů na finerenonu a u 14,8 % pacientů v placebové skupině (relativní riziko 0,86, p = 0,03).
Výskyt nežádoucích účinků byl podobný v aktivní i placebové větvi, pacienti léčení finerenonem měli ale ve srovnání s pacienty léčenými placebem častěji (2,3 % vs. 0,9 %) hyperkalemii vyžadující vysazení léku a také častější nežádoucí účinky související s hyperkalemií (18,3 % vs. 9 %). Nevyskytla se ale žádná fatální hyperkalemie.
Iniciální dávka finerenonu byla 10 mg denně u pacientů s odhadovanou glomerulární filtrací nižší než 1 ml/s/1,73 m2 a 20 mg denně u pacientů s odhadovanou glomerulární filtrací vyšší než 1 ml/s/1,73 m2 se snahou dle tolerance zvýšit dávku finerenonu u všech pacientů na 20 mg denně.
Finerenon byl ve studii FIDELIO‑DKD velmi dobře tolerován. Na rozdíl od kombinace ACEI a ARB, lisinoprilu s losartanem (8) nevedlo přidání finerenonu k inhibitoru RAS ke zvýšenému výskytu hypotenzí a akutního zhoršení renální funkce. Ve studii FIDELIO‑DKD se také podstatně méně často vyskytovala hyperkalemie, která vedla k vysazení studijní medikace (2,3 % ve studii FIDELIO‑DKD a 9,2 % ve studii VA NEPHRON‑D).
Do studie FIDELIO‑DKD nebyli zařazeni normoalbuminuričtí pacienti s diabetem a také pacienti s jinými typy chronického onemocnění ledvin, nevíme tedy, zda by mohl být finerenon i u těchto pacientů účinný.
U pacientů s diabetickým onemocněním ledvin a významným snížením glomerulární filtrace léčených inhibicí systému renin‑angiotenzin vedla tedy léčba finerenonem ke statisticky významnému poklesu renálních i kardiovaskulárních událostí. Příznivý vliv na progresi renální insuficience byl patrný již po roce léčby, kardiovaskulární příhody byly ovlivněny již po 1 měsíci léčby.
Renoprotektivní účinky finerenonu byly nedávno potvrzeny i u pacientů s nižším renálním rizikem v primárně kardiovaskulární studii FIGARO‑DKD (10). Studie randomizovala 7 437 pacientů s diabetem 2. typu na léčbě inhibitorem RAS a poměrem albumin/kreatinin v moči 30–300 mg/g a odhadovanou glomerulární filtrací 0,41–1,5 ml/s/1,73 m2 nebo s poměrem albumin/kreatinin 300–5000 mg/g a odhadovanou glomerulární filtrací vyšší než 1 ml/s/1,73 m2 k léčbě finerenonem 10 mg denně nebo placebem. Finerenon nejenže příznivě ovlivnil primární i sekundární kardiovaskulární endpointy, ale významně také (o 23 %) snížil riziko ≥ 57 % poklesu odhadované glomerulární filtrace. Efekt finerenonu byl více vyjádřen u pacientů s vyšší albuminurií. Finerenon tedy snižuje riziko progrese renální insuficience u pacientů s vyšším i nižším kardiovaskulárním rizikem, tedy již od časných stadií chronické renální insuficience.
Nedávno publikovaná kombinovaná (FIDELITY) analýza dat ze studií FIDELIO‑DKD a FIGARO‑DKD (11) zahrnující celkem 13 026 pacientů sledovaných v průměru 3 roky potvrdila snížení kompozitního renální endpointu o 23 %. Nejvíce obávaným nežádoucím účinkem byla hyperkalemie, která ale vedla k vysazení medikace jen u 1,7 % pacientů léčených finerenonem.
V současné době je finerenon testován v klinické studii fáze 3 (FIND) i u pacientů s nediabetickým onemocněním ledvin.
Inhibitory SGLT2 a progrese chronického onemocnění ledvin
Glifloziny (inhibitory sodíko‑glukózového kontransportu – SGLT2) dramatickým způsobem snížily u pacientů s diabetem 2. typu a různým stupněm kardiovaskulárního rizika kardiovaskulární morbiditu, hospitalizace pro srdeční selhání a v některých studiích i celkovou a kardiovaskulární mortalitu.
Již tyto časné primárně kardiovaskulární studie u pacientů s nízkým renálním rizikem ukázaly, že glifloziny jsou také renoprotektivní, a renoprotektivita SGLT2 inhibitorů pak byla potvrzena ve studiích u pacientů s vysokým renálním rizikem a primárně renálními endpointy, a to jak u diabetiků 2. typu (studie CREDENCE a DAPA‑CKD), tak i u nediabetiků s chronickým onemocněním ledvin (studie DAPA‑CKD).
Ve studii CREDENCE (12) snížil kanagliflozin ve srovnání s placebem u pacientů s diabetem 2. typu a odhadovanou glomerulární filtrací v rozmezí 0,5–1,5 ml/s/1,73 m2 a albuminurií 300–5000 mg/g kreatininu léčených blokádou systému renin‑angiotenzin kompozitní endpoint (terminální selhání ledvin vyžadující náhradu funkce ledvin, pokles odhadované glomerulární filtrace pod 0,25 ml/s/1,73 m2, nebo zdvojnásobení sérového kreatininu nebo smrt z renálních či kardiovaskulárních příčin) o 30 %. Kanagliflozin také snížil kardiovaskulární mortalitu, riziko infarktu myokardu, cévní mozkové příhody a hospitalizace pro srdeční selhání.
Ve studii DAPA‑CKD (13) snížil dapagliflozin ve srovnání s placebem u pacientů (diabetiků 2. typu i nediabetiků) s odhadovanou glomerulární filtraci v rozmezí 0,41–1,25 ml/s/1,73 m2 a albuminurii 200–5000 mg/g kreatininu léčených blokádou systému renin‑angiotenzin kompozitní endpoint (trvalý pokles odhadované glomerulární filtrace o nejméně 50 %, terminální selhání ledvin vyžadující náhradu funkce ledvin nebo smrt z renálních či kardiovaskulárních příčin) o 39 % bez rozdílu mezi diabetiky a nediabetiky. Dapagliflozin současně snížil celkovou i kardiovaskulární mortalitu a hospitalizace pro srdeční selhání.
Inhibitory SGLT2 snižují glomerulární tlak podobně jako inhibitory systému RAS, ale jiným způsobem. Inhibice sodíko‑glukózového kotransportéru v proximálním tubulu snižuje nejen zpětnou resorpci glukózy (s následnou glykosurií), ale zvyšuje také dodávku sodíku do místa v distálním nefronu, které se označuje macula densa a působí jako sodíkový senzor. Aktivace tohoto senzoru mechanismem tzv. tubuloglomerulární zpětné vazby vede k vazomodulaci (konstrikci nepřiměřeně dilatované) aferentní arterioly s následným poklesem glomerulárního tlaku.
Většina pacientů s chronickým onemocněním ledvin je dnes léčena inhibitory systému renin‑angiotenzin (inhibitory angiotenzin konvertujícího enzymu nebo blokátory receptoru pro angiotenzin II typu 1), které snižují glomerulární tlak dilatací eferentní arterioly.
Glifloziny vzhledem ke svému diuretickému a natriuretickému účinku snižují tělesnou hmotnost, krevní tlak a pokles krevního tlaku může přispívat jak k jejich kardioprotektivnímu, tak jejich renoprotektivnímu účinku. Renoprotektivita gliflozinů byla ale od počátku vysvětlována hlavně jejich hemodynamickým účinkem na glomerulární mikrocirkulaci.
Modulaci tonu (konstrikci nepřiměřeně dilatované) aferentní arterioly bylo možné až donedávna dosáhnout s částečným efektem jen nízkobílkovinnou dietou. Efekt gliflozinů je zhruba srovnatelné intenzity jako inhibice systému renin‑angiotenzin, oba účinky jsou navíc aditivní (viz Obr. 1). Podání inhibitorů SGLT2 snižuje akutně v závislosti na dávce odhadovanou glomerulární filtraci o cca 5 ml/min/1,73 m2 a albuminurii snižuje o 30–40 %. Akutní pokles odhadované glomerulární filtrace a albuminurie je prediktorem dlouhodobého zpomalení ztráty glomerulární filtrace a tedy renoprotektivního účinku inhibitorů SGLT2.
Image 1. Vliv inhibitorů RAS a SGLT2 na glomerulární hemodynamiku 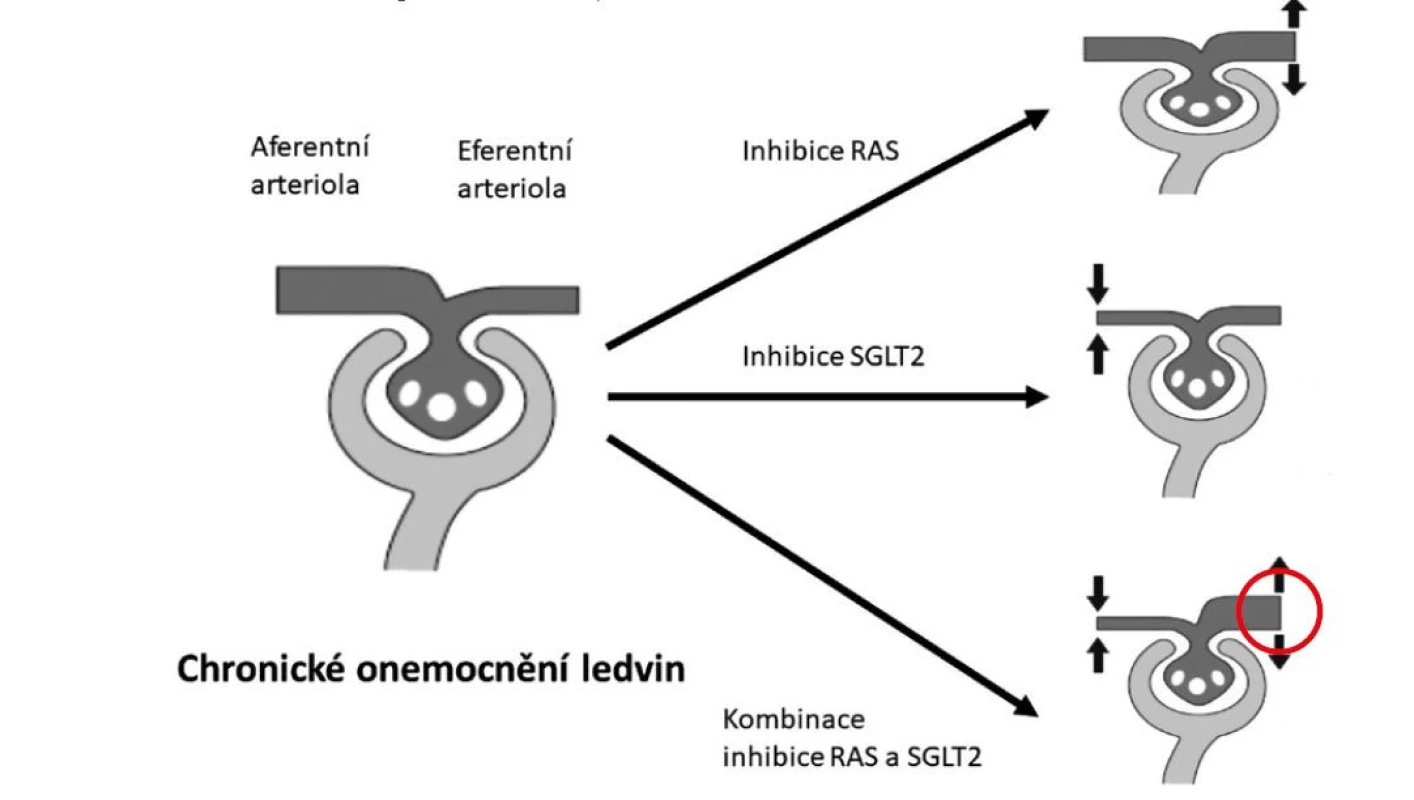
Pacienti s chronickým onemocněním ledvin mají dilataci aferentní arterioly a konstrikci eferentní arterioly s následným zvýšením glomerulárního tlaku. Inhibice RAS dilatuje eferentní arteriolu, inhibitory SGLT2 působí konstrikci patologicky dilatované aferentní arterioly, efekt obou postupů je aditivní. SGLT2 inhibitory také snižují inzulinovou rezistenci a renální sympatickou nervovou aktivitu, zmírňují renální anémii a mají antioxidační účinky. Podíl těchto mechanismů na renoprotektivním účinku inhibitorů SGLT2 je v současné době nejasný a bude jistě předmětem dalšího studia.
Renoprotektivní účinek inhibitorů SGLT2 není závislý na jejich účinku hypoglykemizujícím. Inhibitory SGLT2 navíc nenavozují u diabetiků ani nediabetiků hypoglykemie. Inhibitory SGLT2 tedy svým hemodynamickým účinkem snižují proteinurii a zpomalují progresi renální insuficience nejen u diabetiků 2. typu, ale i u nediabetiků. Studie DAPA‑CKD ukázala, že jejich renoprotektivní účinek bude možno využít i u nediabetických pacientů s chronickým onemocněním ledvin.
Dapagliflozin je od 1. 8. 2022 v České republice plně hrazen ze zdravotního pojištění u dospělých pacientů s chronickým onemocněním ledvin (i nediabetiků) s odhadovanou glomerulární filtrací v rozmezí 25–75 ml/min/1,73 m2 (0,41–1,25 ml/s/1,73 m2) a poměrem albumin/ kreatinin v rozmezí 200–5000 mg/g, kteří jsou léčeni stabilní dávkou inhibitoru ACE, nebo blokátoru receptoru typu 1 pro angiotenzin II (ARB), nebo u kterých je terapie těmito přípravky kontraindikována.
Je možné srovnat účinek finerenonu s účinkem SGLT2 inhibitorů?
Efekt finerenonu se zdá být menší než efekt SGLT2 inhibitoru canagliflozinu v nedávno publikované studii CREDENCE (12). Design obou studií byl ale odlišný (SGLT2 inhibitory byly dovoleny ve studii FIDELIO‑DKD, inhibitory mineralokortikoidních receptorů nebyly dovoleny ve studii CREDENCE, pacienti ve studii FIDELIO‑DKD museli být na maximální doporučené dávce ACEI/ARB) a lišil se také primární cílový parametr, který byl renálně specifický ve studii FIDELIO‑DKD a kombinovaný kardiorenální cílový parametr ve studii CREDENCE. Pokud byli srovnáváni pacienti s podobnými vstupními kritérii, byl efekt canagliflozinu ve studii CREDENCE a finerenonu ve studii FIDELIO‑DKD podobný (14).
Bylo by samozřejmě zajímavé vědět, zda je příznivý efekt léčby finerenonem a canagliflozinem u pacientů s diabetickým onemocněním ledvin aditivní. Nízký počet pacientů ve studii FIDELIO‑DKD léčených SGLT2 inhibitorem asi nebude k posouzení efektu kombinované léčby finerenonem a glifloziny stačit.
Vliv inhibitorů dipeptidylpeptidázy-4 (DPP-4) a agonistů receptoru pro GLP-1 na progresi chronického onemocnění ledvin
Možný vliv inhibitorů DPP-4 na progresi chronického onemocnění ledvin byl studován ve studii CARMELINA (15), která randomizovala 6 991 pacientů s diabetem 2. typu a vysokým kardiovaskulárním a renálním rizikem (snížená odhadovaná glomerulární filtrace nebo makroalbuminurie) k léčbě linagliptinem nebo placebem.
Linagliptin sice snížil v této studii o 14 % riziko progrese albuminurie, ale během v průměru 2,2 let sledování nesnížil ani riziko kardiovaskulárních příhod, ani riziko trvalého snížení odhadované glomerulární filtrace o ≥ 40 %. V několika primárně kardiovaskulárních studiích ovlivnili agonisté GLP1 receptoru liraglutid i semaglutid u pacientů s diabetickým onemocněním ledvin progresi albuminurie, v těchto studiích ale nebyl prokázán příznivý vliv léčby agonisty GLP-1 receptoru na glomerulární filtraci.
Příznivý vliv dalšího agonisty GLP-1 receptoru dulaglutidu na vývoj odhadované glomerulární filtrace byl ale prokázán ve dvou recentně publikovaných studiích AWARD (16) a REWIND (17).
V menší studii AWARD (16) bylo celkem 577 pacientů s diabetem 2. typu a chronickým onemocněním ledvin ve stadiu 3–4 s glykovaným hemoglobinem 7,5–10,5 % (DCCT) na maximální tolerované dávce inhibitoru RAS randomizováno k dulaglutidu v dávce 0,75 mg a 1,5 mg jednou týdně nebo inzulinu glarginu a lispro. Vývoj albuminurie a odhadované glomerulární filtrace představovaly v této studii sekundární sledované parametry (primárním sledovaným parametrem byla změna glykovaného hemoglobinu). Dulaglutid byl v obou dávkách ve srovnání s inzulinem non‑inferiorní z hlediska změny glykovaného hemoglobinu a vývoje albuminurie, ale odhadovaná glomerulární filtrace byla po 52 týdnech vyšší u pacientů léčených oběma dávkami dulaglutidu.
Příznivý vliv dulaglutidu na vývoj glomerulární filtrace u pacientů s diabetem 2. typu a diabetickým onemocněním ledvin byl poté potvrzen i ve studii fáze 3 REWIND (17). Tato studie randomizovala 9 901 pacientů s diabetem 2. typu starších 50 let s kardiovaskulárním onemocněním nebo kardiovaskulárními rizikovými faktory k dulaglutidu 1,5 mg jednou týdně nebo placebu. Primární endpoint byl kardiovaskulární, renální endpoint byl definován jako kompozit nové makroalbuminurie (albuminurie vyšší než 300 mg/24 hodin), trvalého poklesu odhadované glomerulární filtrace o alespoň 30 % nebo terminálního selhání ledvin vyžadujícího náhradu funkce ledvin. Vstupně mělo jen 7,9 % pacientů makroalbuminurii a průměrná odhadovaná glomerulární filtrace byla 76,9 ml/min/1,73 m2. Po střední době sledování 5,4 roku se kompozitní renální endpoint vyskytl u 17,1 % pacientů léčených dulaglutidem a u 19,6 % pacientů v placebové větvi (riziko sníženo statisticky významně o 15 %). Prokázaný renoprotektivní účinek dulaglutidu by tak měl vést k jeho častějšímu použití u pacientů s diabetickým onemocněním ledvin.
Agonisté receptoru pro GLP-1 jsou tak u pacientů s diabetem 2. typu a diabetickým onemocněním ledvin po SGLT2 inhibitorech lékem druhé volby.
Vliv cvičení na progresi chronické renální insuficience
Recentně publikovaná sekundární analýza studie LIFE (18) prokázala, že u 1 199 starších pacientů ve věku 70–89 let (průměrného věku 78,9 let) s omezenou pohyblivostí bylo možno příznivě ovlivnit progresi renální insuficience pravidelným strukturovaným cvičením střední intenzity (18). Po dvou letech byl rozdíl v odhadované glomerulární filtraci (měřené pomocí cystatinu C) statisticky významných 0,96 ml/min/1,73 m2 (0,0155 ml/s). Rozdíl byl zvláště patrný u pacientů s rychlou ztrátou glomerulární filtrace (ve třetím tertilu), u kterých cvičení snížilo rychlost ztráty odhadované glomerulární filtrace o 21 %.
Cílená strukturovaná fyzická aktivita by se tak mohla stát další možností, jak příznivě ovlivnit progresi chronického onemocnění ledvin, i když mechanismus, jakým cvičení zpomaluje progresi renálního onemocnění, zůstává nejasný.
Závěry
Standardní léčbou (i normotenzních) pacientů s diabetickým i nediabetickým onemocněním ledvin byly donedávna jen inhibitory ACE nebo blokátory receptoru typu 1 pro angiotenzin II. Indikovaní pacienti s přetrvávající (i jen velmi malou) proteinurií mohou být nyní léčeni navíc také dapagliflozinem. Dalším lékem, který by měl v brzké době obohatit naše léčebné možnosti, je selektivní nesteroidní inhibitor mineralokortikoidního receptoru finerenon. Příznivý vliv na vývoj renální funkce mohou mít ale u chronického onemocnění ledvin i nefarmakologické intervence, např. nízkobílkovinná dieta nebo strukturovaná fyzická aktivita.
KORESPONDENČNÍ ADRESA AUTORA:
prof. MUDr. Vladimír Tesař, DrSc.
Klinika nefrologie 1. LF UK a VFN Praha
U Nemocnice 2, 128 08 Praha 2
Cit. zkr: Vnitř Lék. 2022;68(7):420-424
Článek přijat redakcí: 24. 7. 2022
Článek přijat po recenzích: 12. 9. 2022
Sources
1. Brenner BM, Meyer RW, Hostetter TH. Dietary protein intake and the progressive nature of kidney disease: the role of hemodynamically mediated glomerular injury in the pathogenesis of progressive glomerular sclerosis in aging, renal ablation, and intrinsic renal disease. N. Engl. J. Med. 1982,307 : 652-9.
2. Parving HH, Lehnert H, Brochner‑Mortensen J et al. The effect of irbesartan on the development of diabetic nephropathy in patients with type 2 diabetes. N. Engl. J. Med.2001,345 : 870-8.
3. Brenner BM, Cooper ME, de Zeeuw D et al. Effects of losartan on renal outcomes in patients with type 2 diabetes and nephropathy. N. Engl. J. Med. 2001,345 : 861-9.
4. Lewis EJ, Husicker LG., Clarke WR et al. Renoprotective effect of the angiotensin‑receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes. N. Engl. J. Med. 2001,345 : 851-60.
5. Ruggenenti P, Fassi A, Ilieva AP et al. Preventing microalbuminuria in type 2 diabetes. N. Engl. J. Med. 2004,351 : 1941-51.
6. Maschio G, Alberti D, Janin G et al. Effect of the angiotensin‑converting‑enzyme inhibitor benazepril on the progression of chronic renal insufficiency. The Angiotensi‑Converting‑Enzyme Inhibition in Progressive Renal Insufficiency Study Group. N. Engl. J. Med.1996, 354 : 939-45.
7. GISEN Group: Randomised placebo‑controlled trial of the effect of ramipril on decline in glomerular filtration rate and risk of terminal renal failure in proteinuric, non‑diabetic nephropathy. Lancet. 1997,349 : 1857-63.
8. Fried LF, Emanuele N, Zhang JH et al. Combined angiotensin inhibition for the treatment of diabetic nephropathy. N. Engl. J. Med. 2013,369 : 1892-1903.
9. Bakris GL, Agarwa lR, Anker SD et al. Effect of finerenone on chronic kidney disease outcomes in type 2 diabetes. N. Engl. J. Med. 2020, October 23, doi: 10.1056/NEJMoa2025845.
10. Ruilope LM, Pitt B, Anker SD et al. Kidney outcomes with finerenone: an analysis from FIGARO‑DKD study. Nephrol. Dial. Tranplant, 2022. doi: 10.1093/ndt/gfac157.
11. Agarwa lR, Filippatos G, Pitt B et al. Cardiovascular and kidney outcomes with finerenone in patients with type 2 diabetes and chronic kidney disease: the FIDELITY pooled analysis. Eur. Heart J. 2022;43 : 474-484.
12. Perkovic V, Jardine MJ, Nea lB et al. Canagliflozin and renal outcomes in type 2 diabetes and nephropathy. N. Engl. J. Med. 2019;380 : 2295-306.
13. Heerspink HJL, Stefánsson BV, Correa‑Rotter R et al. Dapagliflozin in patients with chronic kidney disease. N. Engl. J. Med. 2020;383 : 1436-1446.
14. Agarwa lR, Anker SD, Filippatos G et al. Effects of canagliflozin versus finerenone on cardiorenal outcomes: exploratory post hoc analyses from FIDELIO‑DKD compared to reported CREDENCE results. Nephrol. Dial. Transplant. 2022;37 : 1261-1269.
15. Rosenstock J, Perkovic V, Johansen OE et al. Effect of linagliptin vs placebo on major cardiovascular events in adults with type 2 diabetes and high cardiovascular and renal risk: The CARMELINA randomized controlled trial. JAMA. 2019;321 : 69-79.
16. Tuttle KR, Lakshmanan MC, Rayner B et al. Dulaglutide versus insulin glargine in patients with type 2 diabetes and moderate‑to‑severe chronic kidney disease (AWARD-7): a multicentre, open‑label, randomised trial. Lancet Diabetes Endocrinol. 2018;6 : 605-617.
17. Gerstein HC, Colhoun HM, Dagenais GR et al. Dulaglutide and renal outcomes in type 2 diabetes: an exploratory analysis of the REWIND randomised, placebo‑controlled trial. Lancet. 2019;394 : 1312-138.
18. Shlipak MG, Sheshadri A, Hsu FC et al. Effect of structured, moderate exercise on kidney function declline in sedentary older adults: an ancillary analysis of the LIFE study randomized clinical trial. JAMA Intern. Med. 2022;182 : 650-659.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2022 Issue 7-
All articles in this issue
- Hlavní téma – Nefrologie
- Současné možnosti zpomalení progrese chronického onemocnění ledvin
- Expertní stanovisko ke spolupráci diabetologů a internistů s nefrology v péči o nemocné s chronickým onemocněním ledvin
- Glomerulonefritidy asociované s infekcemi
- Novinky v léčbě renální anémie – erytropoetin vs. inhibitory prolylhydroxylázy?
- Covid-19 u nemocných po transplantaci ledviny
- Reaktivní, infekční nebo postinfekční artritida?
- Účinek inhibitoru SGLT2 empagliflozinu na stabilizaci průběhu srdečního selhání s možností dalších intervencí u pacienta s HFrEF
- Nové technologie ve vývoji hypolipidemik. Inclisiran (LEQVIO®)
- Léčba hypertenze starších osob a její úskalí
- Incidentalomy štítné žlázy
- Můžeme novou léčbou ovlivnit dosavadní terapií neřešený zánět a fibrózu u pacientů s DM2 a CKD?
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Reaktivní, infekční nebo postinfekční artritida?
- Incidentalomy štítné žlázy
- Novinky v léčbě renální anémie – erytropoetin vs. inhibitory prolylhydroxylázy?
- Současné možnosti zpomalení progrese chronického onemocnění ledvin
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

