-
Medical journals
- Career
Novinky v léčbě renální anémie – erytropoetin vs. inhibitory prolylhydroxylázy?
Authors: Romana Ryšavá 1,2
Authors‘ workplace: Klinika nefrologie, 1. LF UK a VFN, Praha 1; Interní klinika 1. LF UK a ÚVN, Praha 2
Published in: Vnitř Lék 2022; 68(7): 438-443
Category: Main Topic
doi: https://doi.org/10.36290/vnl.2022.092Overview
Anémie je velmi častou komplikací chronického onemocnění ledvin (CKD) a renálního selhání. Pohled na léčbu anémie se od doby zavedení ESA (erytropoézu stimulujících látek) do klinické praxe dosti změnil a nyní se upřednostňuje zejména bezpečnost této léčby před kompletní normalizací hodnot hemoglobinu (Hb). Základem léčby i u této skupiny nemocných je podávání železa, kdy jeho intravenózní aplikace se jeví jako účinnější, a přitom bezpečná, a to jak u jedinců v predialýze, tak podstupujících dialyzační léčení. Kromě již dlouho používaných ESA se ke korekci anémie v poslední době zkoušela celá řada nových látek vyvinutých s cílem příznivě ovlivnit erytropoézu. Mezi ty s největším potenciálem patří HIF‑stabilizátory (roxadustat, molidustat, vadadustat a daprodustat), které působí prostřednictvím stimulace genů pro erytropoézu a představují tak zcela nový mechanismus v léčbě anémie. V klinických studiích fáze 3 prokázaly tyto látky stejnou účinnost na zvýšení hladin Hb jako ESA, velký důraz se ale v poslední době klade zejména na jejich bezpečnostní profil. Jde o látky podávané perorálně a některé z nich jsou již schválené a používají se v klinické praxi. První z nich, roxadustat, získal v současné době úhradu i v České republice. I další molekuly ovlivňující anémii, jako sotatercept, potvrdily svoji účinnost v klinických studiích fáze 1 a 2 a čekají na výsledky z větších randomizovaných studií.
Klíčová slova:
Hemoglobin – dialýza – chronické onemocnění ledvin – anémie – ESA – HIF‑stabilizátory
Úvod
Prevalence anémie (Hb < 135 g/l u mužů a < 120 g/l u žen) stoupá se stadiem CKD, ale je závislá také na věku, pohlaví a rase. Až 75 % nemocných s CKD stadia 5 (glomerulární filtrace, GFR < 0,25 ml/s) má Hb < 120 g/l a 27 % z nich má Hb < 100 g/l (1). Vztah mezi poklesem GFR a anémií má exponenciální závislost. U diabetiků se anémie vyskytuje 2–3× častěji než u nediabetiků s renálním postižením. Hlavní příčinou anémie u CKD je snížená produkce erytropoetinu (EPO) v selhávajících ledvinách. Nezanedbatelnou roli zde hrají i další faktory, jako je deficit železa (např. při jeho ztrátách krví během hemodialýzy), jeho špatná využitelnost pro erytropoézu z důvodu vysoké koncentrace hepcidinu (hormon zodpovědný za vstřebání železa v enterocytech a jeho uvolňování ze zásob v retikuloendotelovém systému [RES] a makrofázích), malnutrice a zánět. Pro adekvátní erytropoézu je také nezbytná správná koncentrace kyseliny listové a vitamínu B12 v séru (Obr. 1).
Ačkoli je anémie jedním z hlavních důvodů, který se podílí na zvýšené kardiovaskulární (KV) i celkové mortalitě těchto nemocných, stále zůstává značné procento nemocných, kteří nejsou adekvátně léčeni (2).
Léčba ESA a doporučené cílové hodnoty
Guidelines platná do roku 2012 vesměs doporučovala, aby cílový Hb u nemocných s CKD léčených ESA, včetně těch léčených dialýzou, byl >110 g/l (3). Jako horní mez cílového Hb pak byla uváděna hranice 130 g/l (4). Hodnoty vyšší se považují za nebezpečné (neplatí pro nemocné, kteří dosahují těchto hodnot spontánně, bez naší intervence), jelikož mohou být spojeny se zvýšením rizika KV (zejména cévních mozkových příhod) či trombotických komplikací (např. uzávěrem arterio‑venózní fistule). U nemocných se známkami těžšího srdečního selhávání (NYHA III a IV) a u diabetiků se pak pro horní mez doporučovaly koncentrace Hb 120 g/l.
Graph 1. Faktory přispívající k anémii u chronického onemocnění ledvin 
V posledních dvou dekádách přibylo dat o tom, že vyšší cílové hodnoty Hb mohou být pro nemocné spíše škodlivé, zejména tam, kde bylo těchto hodnot Hb dosahováno pomocí aplikace vysokých dávek ESA. Tato zjištění se opírala o výsledky řady randomizovaných studií, které probíhaly jak u dialyzovaných (CKD 5D) nemocných (studie NHCT a další), tak zejména u pacientů s pokročilou CKD, kteří zatím nepodstupují dialýzu (CKD ND); zde šlo o studie CHOIR, CREATE a TREAT (5, 6, 7, 8). Doporučené cílové hodnoty Hb se proto snížily s tím, že je vhodná jen částečná korekce anémie, a ne normalizace hodnot. Oproti trendu sníženého užívání ESA preparátů je podávání intravenózního železa ve vzrůstající oblibě. Důvodem je fakt, že takto podané železo je plně využitelné pro erytropoézu a jeho utilizace není ovlivněna vysokou koncentrací hepcidinu, která je u nemocných s CKD běžná. Částečnou rehabilitaci také zaznamenalo podávání krevních transfuzí, zejména u některých skupin pacientů (s aktivními nádory či nádory v anamnéze, po cévní mozkové příhodě), kde se to jeví jako výhodné a méně rizikové než podávání ESA. Na druhou stranu pro mladší nemocné, stejně jako pro všechny, kteří by v budoucnu mohli podstoupit transplantaci ledviny, není tento postup doporučován (zvýšená senzibilizace aloprotilátkami).
Různá doporučení pro cílové hodnoty Hb, kterých by nemocní s CKD měli dosáhnout spontánně či po intervenci, jsou uvedena v tabulce 1.
Table 1. Doporučení pro cílové hodnoty hemoglobinu při léčbě erytropoézu stimulujícími léky u nemocných s chronickým onemocněním ledvin (upraveno podle KDIGO guidelinů z roku 2012 a ERBP position statement z roku 2013) 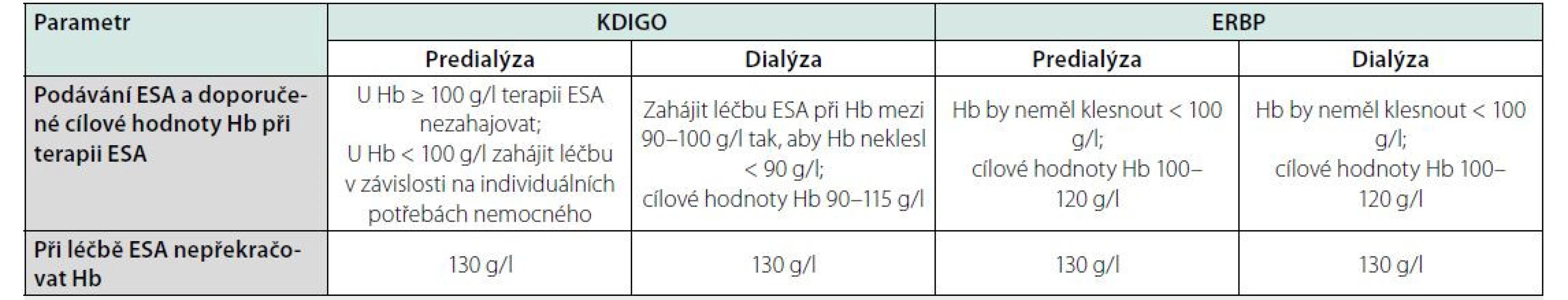
ESA – erytropoézu stimulující léky
Hb – hemoglobinESA a jejich podávání u malignit
Specifickou skupinu pacientů představují jedinci s CKD a malignitou. U této populace jedinců je podávání zejména ESA preparátů považováno za velmi rizikové a měli bychom ho omezit na co nejkratší dobu (abychom omezili potřebu podávat krevní transfúze). Léčba ESA u nich je spojena s výrazně vyšším rizikem vzniku tromboembolických komplikací, ale i s možností progrese nádoru (ESA významně přispívají k neoangiogenezi nádoru stimulací endotelových progenitorových buněk) a zvýšenou mortalitou. Jednoznačně se nedoporučuje, aby ESA byly podávány nemocným s CKD, kteří současně podstupují radioterapii anebo kteří jsou léčeni chemoterapií s kurativním záměrem. Zvažovat podání ESA lze u nemocných s těžkou anémií, kde jejich malignita je v dlouhodobé remisi a u pacientů s nemyeloidními malignitami léčenými chemoterapií s paliativním záměrem. Cílové hodnoty Hb u těchto jedinců jdou doporučovány kolem 100 g/l a léčba by se nejprve měla zahájit podáním preparátů železa a teprve po dosažení jeho adekvátních zásob zvážit podání ESA.
Léčbu ESA není vhodné vysazovat v době akutních stavů, jako je trauma, operace (akutní i plánované), hospitalizace či nekomplikované infekce. Nevysazujeme ji ani v době jakýchkoli krvácivých komplikací, kde je potřeba nemocného přechodně transfundovat.
Molekuly stimulující erytropoézu mimo ESA
Hlavními léky stimulujícími erytropoézu používanými v léčbě anémie stále zůstávají ESA, které všechny stimulují EPO receptor (EPO‑R). V současné době máme k dispozici preparáty s krátkým poločasem účinku, které je potřeba aplikovat 2–3× týdně (epoetin alfa, beta, zeta a theta), či preparáty s delším biologickým poločasem, který je zajištěn buď zvýšenou glykosylací EPO molekuly (darbepoetin alfa) či jeho pegylací (metoxy‑polyetylenglykol‑epoetinu beta). Podávání těchto preparátů v doporučených dávkách je bezpečné (Tab. 2). Dosažení cílových hodnot Hb vysokými dávkami ESA může být doprovázeno jejich nežádoucí toxicitou. Ta je způsobena přílišným vzestupem Hb a objemu krve (hypertenze, křeče, trombózy cévního přístupu, cévní mozkové příhody), ale často jde i o projev stimulace dějů nezávislých na aktivaci EPO‑R (aktivace systému renin‑angiotensin‑aldosteron, stimulace produkce tromboxanu A, endotelinu 1 a asymetrického dimethylargininu, zvýšení koncentrace vonWillebrandova faktoru, stimulace angioneogeneze a proliferace nádorových buněk) (9, 10).
Table 2. Doporučené iniciální dávky pro podávání erytropoézu stimulujících léků (ESA) 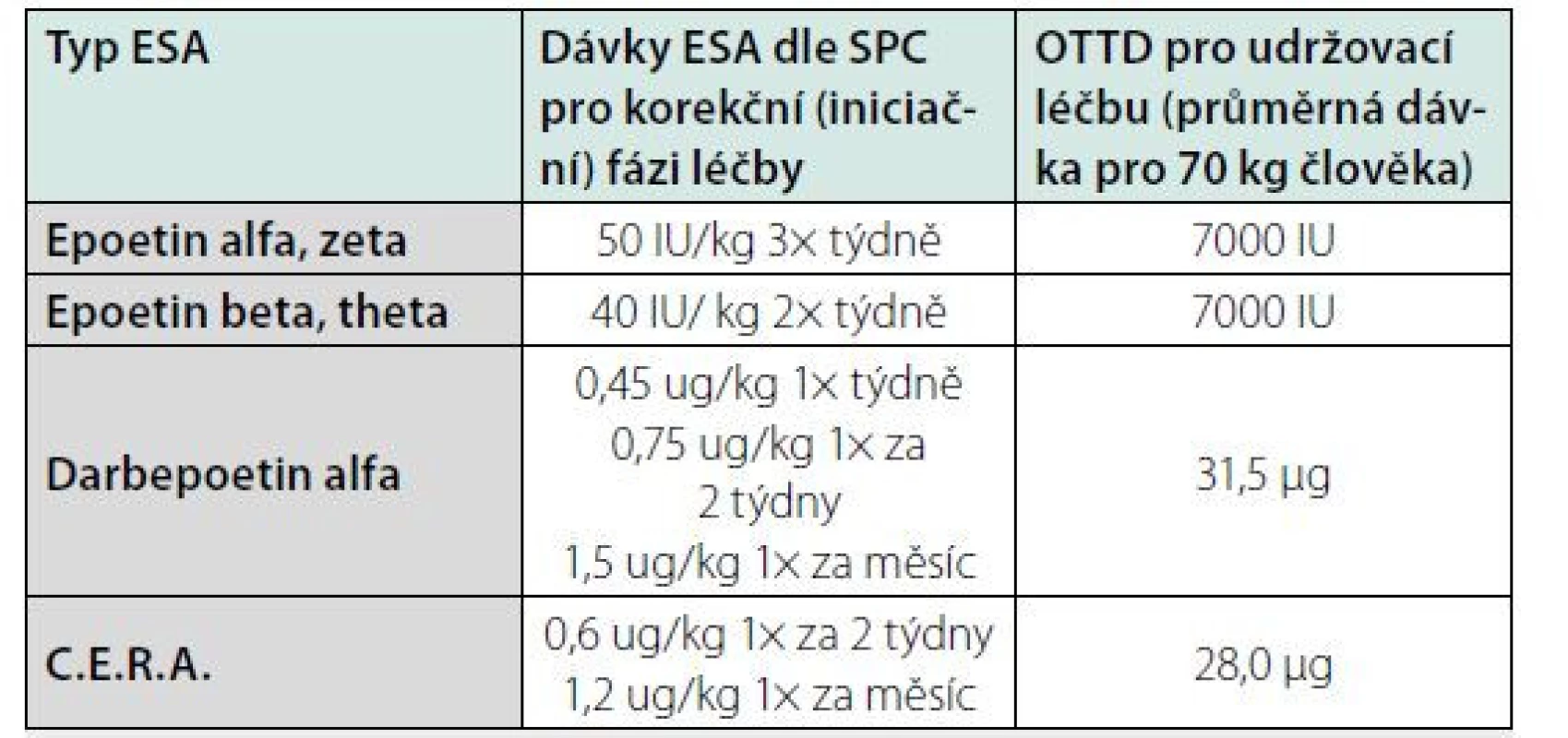
ESA – Erythropoiesis Stimulating Agents
SPC – souhrn údajů o léku
OTTD – obvyklé týdenní terapeutické dávky (= průměrné dávky aplikované průměrnému nemocnému za týden v udržovací fázi léčby)
C.E.R.A. – Continuous Erythropoietin Receptor ActivatorErytropoetin–mimetic peptidy (EMPs) je skupina látek, jejichž podstatou účinku na erytropoézu je rovněž stimulace EPO‑R. Nejnadějnějším zástupcem této skupiny se dlouho jevil peginesatid. Působí jako agonista EPO‑R cestou intracelulární aktivace signálních cest JAK-2/STAT-5. V roce 2013 byly publikovány dvě rozsáhlé studie (EMERALD, PEARL) zaměřené na posouzení účinku peginesatidu na ovlivnění anémie a srovnání jeho efektu s jinými ESA (11, 12). Zatímco z hlediska stimulace erytropoézy byla účinnost léčby peginesatidem hodnocena jako srovnatelná v porovnání s epoetiny, v rámci studie PEARL (nemocní s CKD ND) byl prokázán významný vzestup KV rizika (celková mortalita, výskyt nestabilní anginy pectoris, arytmie) v porovnání s epoetiny. Regulační autority s odůvodněním na výskyt závažných nežádoucích účinků (zvýšené riziko alergických reakcí až anafylaktického šoku po léčbě peginesatidem) a zvýšenou KV mortalitu další léčebné užití peginesatidu proto pozastavily.
Hypoxémie u nemocných s anémií vede ke zvýšené produkci EPO, která je regulována zejména prostřednictvím HIF‑α (hypoxia inducible factor) (13). Ty hrají klíčovou roli v kyslíkové homeostáze a v adaptaci organismu na hypoxii. Doposud byly identifikovány 3 isoformy HIF‑α (HIF-1α, HIF-2α a HIF-3α). Klíčovou roli ve stimulaci erytropoézy pravděpodobně hraje HIF-2α, který je exprimován hlavně na povrchu endoteliálních buněk cév a na hepatocytech. V ledvinách ho lze detekovat v endoteliálních buňkách, v glomerulech, ale zejména v peritubulárních fibroblastech, kterým je přisuzována produkce EPO (zatímco HIF-1α se zde neexprimuje). Ovlivnění HIF-2α se tedy logicky stává žádoucím terapeutickým cílem v léčbě anémie. Zvýšit jeho koncentraci lze pomocí zablokování procesů, které vedou k jeho přirozené degradaci během normoxémie. Protože pro degradaci všech isoforem HIF‑α v proteazomu je nejprve nutné, aby došlo k jejich hydroxylaci, může zablokování této hydroxylace pomocí inhibitorů prolyl hydroxylázy (PHI; někdy také označené jako PHD – prolyl‑hydroxylase domain‑containing protein) vést ke stabilizaci HIF‑α. Inhibitory PHI, které označujeme jako HIF stabilizátory, zvýší transkripci genů závislých na komplexu HIF‑α + HIF‑β, což vede mimo jiné také ke zvýšení koncentrace EPO. V regulaci HIF‑α hraje zásadní roli PHD2, zatímco PHD1 a PH3 se zde příliš neuplatňují. Současně se ukazuje, že HIF hrají významnou roli v regulaci homeostázy železa. Kromě zvýšení koncentrace EPO hepatocyty a ledvinami podporuje HIF-2 transkripci genů důležitých pro vstřebávání železa, jako je gen pro duodenální cytochrom b (DCYTB), gen pro divalentní metalický transportér 1 (DMT1) a gen pro ferroportin (FPN1). HIF-1 a HIF-2 také regulují produkci transferinu, transferinového receptoru a ceruloplasminu a snižují koncentraci hepcidinu, čímž usnadňují utilizaci železa (14). Velkou výhodou těchto látek je, že jsou to malé molekuly, které se podávají perorálně.
V různě pokročilé fázi zkoušení jsou čtyři HIF stabilizátory roxadustat, vadadustat, daprodustat a molidustat (Tab. 3). Souhrnně lze na základě výsledků randomizovaných studií konstatovat, že HIF‑stabilizátory jsou z hlediska vzestupu Hb non‑inferiorní v porovnání s ESA, v řadě studií se ukázal jejich pozitivní vliv na vzestup počtu retikulocytů a saturace tranferinu (TSAT) a současně i pokles koncentrace hepcidinu a ferritinu u léčených pacientů. Některé z těchto látek (daprodustat, molidustat) také pozitivně ovlivňovaly metabolismus tuků, když snižovaly hladinu celkového cholesterolu a triglyceridů (15).
Table 3. Přehled HIF stabilizátorů a některých jejich studií u nemocných s CKD (převzato a upraveno podle: Haase VH. Hypoxia-inducible factor prolyl hydroxylase inhibitors in the treatment of anemia of chronic kidney disease. Kideny Int Suppl 2021;11:8-25) 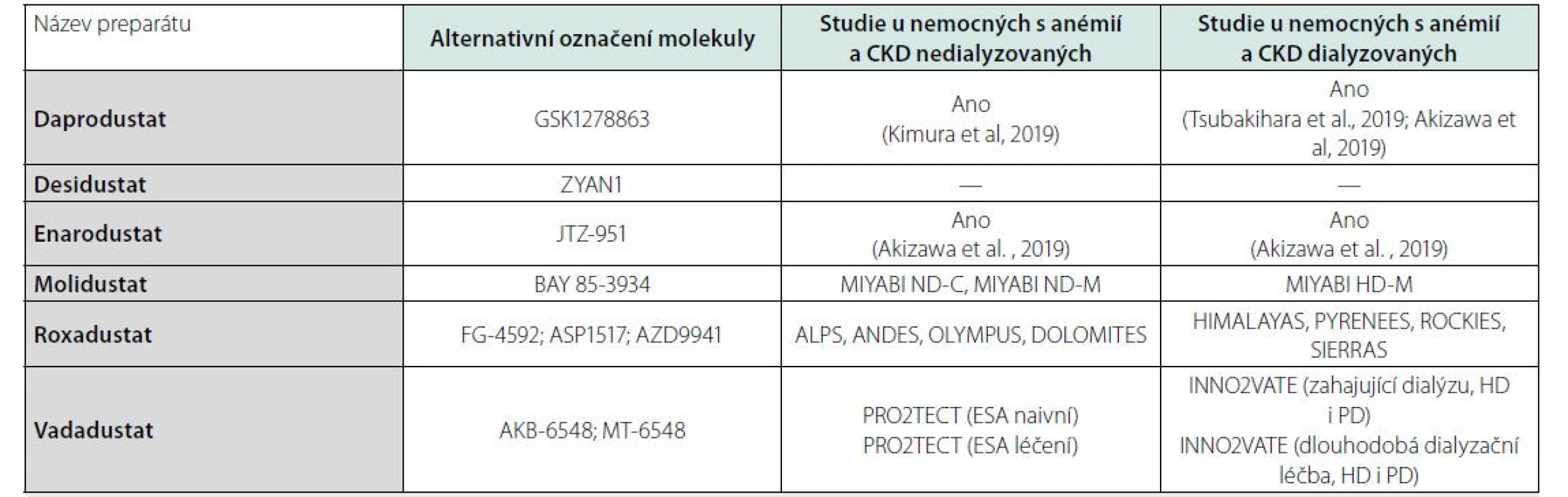
HD – hemodialýza
PD – peritoneální dialýzaNejblíže použití v klinické praxi v ČR je aktuálně roxadustat. U pacientů, kteří zahajují léčbu anémie a kteří nebyli dříve léčeni ESA, je doporučená počáteční dávka 70 mg roxadustatu třikrát týdně u pacientů s tělesnou hmotností nižší než 100 kg a 100 mg třikrát týdně u pacientů s tělesnou hmotností 100 kg a více. U nemocných převáděných z ESA na roxadustat je potřeba pro stanovení iniciální dávky použít převodní tabulku, která vychází z dosud podávaných dávek ESA (Tab. 4). Následně se dávkování upravuje podle reakce Hb (viz SPC přípravku Evrenzo).
Table 4. Počáteční dávky roxadustatu užívané třikrát týdně u pacientů přecházejících z ESA 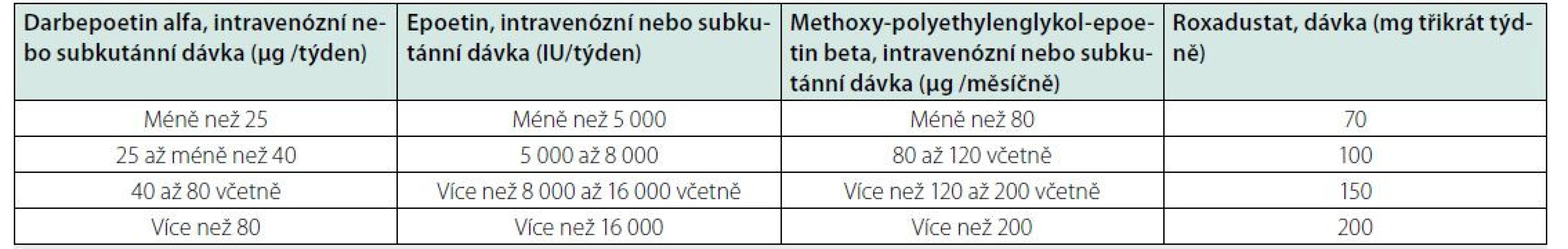
ESA – Erythropoiesis Stimulating Agents Terapeutické benefity při léčbě HIF‑stabilizátory
Na rozdíl od ESA (zejména pokud se ESA podávají intravenózně) nedochází po podání HIF‑stabilizátorů k výraznému zvýšení koncentrací EPO v plazmě, což je považováno za rizikový faktor zvýšené KV a celkové mortality (16). Přesto jejich podávání vede ke stejnému zvýšení Hb, a to nejspíše přímou stimulací erytroidních progenitorových buněk v kostní dřeni, lepší utilizací železa a pravděpodobně i lepším efektem endogenního EPO v porovnání s rekombinantními formami exogenně podávaných ESA. HIF‑stabilizátory také pravděpodobně více ovlivňují extrarenální produkci EPO (hepatální), což ukazují některé studie u anefrických jedinců (17).
Efekt podání HIF‑stabilizátorů na metabolismus železa je stále diskutovaným tématem. Je jasná evidence o tom, že podání HIF‑stabilizátorů vede ke snížení hladiny hepcidinu a tím ke zvýšenému uvolňování železa z RES a zlepšení jeho vstřebávání ve střevě (18). Zdálo se tedy, že potřeba suplementace železem během léčby HIF‑stabilizátory je menší, či dokonce žádná (v některých krátkodobých studiích nemocní nebyli železem vůbec léčeni). S narůstajícím počtem studií a prodloužením jejich trvání se ale ukazuje, že i při léčbě HIF‑stabilizátory dochází po 7–12 týdnech léčby k jakémusi plató v hladině Hb a ten se dále nezvyšuje, pokud nemocným současně nepodáme i železo (19). Z toho pravděpodobně vyplývá, že po určité době dochází k „vyčerpání“ zásobního poolu železa v organismu a dále je již potřeba železo suplementovat. Pozitivní zprávou ale je, že nejen intravenózní, ale i perorální cesta suplementace železem je zde efektivní, a to i u nemocných léčených hemodialýzou (14).
HIF‑stabilizátory, na rozdíl od ESA, také příznivě ovlivňují hladinu Hb i za přítomnosti infekce/inflamace v organismu. Některé studie dokonce naznačují jeho příznivý anti‑inflamatorní efekt u nemocných s akutními formami ischemie či sepse. Tento efekt je velmi komplexní, klíčovou roli zde nejspíše hraje interakce HIF‑stabilizátorů a nukleárního faktoru κB (20). Některé studie s roxadustatem či vadadustatem ukazují dobrý efekt těchto molekul na cílové hodnoty Hb i přes zvýšení C‑reaktivního proteinu v séru, aniž by bylo potřeba navyšovat jejich původně stanovené dávky (14).
Bezpečnost podávání HIF - stabilizátorů
Určité obavy při použití HIF stabilizátorů vyvolává jejich neselektivita a potenciální ko‑stimulace celé řady jiných než cílových genů pro erytropoézu (udává se stimulace až 300 různých genů), např. genu pro vaskulární endoteliální růstový faktor (VEGF) a s tím spojenou stimulací procesů angiogeneze či tumorigeneze. V zatím proběhlých klinických studiích se tyto efekty neprokázaly ve zvýšené míře (nutno ale podotknout, že studie byly většinou jen krátkodobé); v menší míře byly zaznamenány i některé další negativní vlivy léčby, jako vzestup tlaku v plicnici, zvýšený růst renálních cyst či progrese vaskulárních kalcifikací. Mezi nejčastější nežádoucí účinky léčby patří nasofaryngitidy, hyperkalemie a vzestup tlaku (nejspíše sekundární při vzestupu Hb), resp. zvýšená potřeba podávání antihypertenzní terapie.
V poslední době se hojně diskutuje KV bezpečnost HIF‑stabilizátorů na základě některých varování, která vydala FDA či jí podobná agentura v Japonsku. Tato varování upozorňují na možná bezpečnostní rizika spojená se zvýšeným výskytem KV příhod (zejména akutního infarktu myokardu či trombóz), které byly v některých studiích (především u nemocných s CKD NDD) zaznamenány (14). Nutno však podotknout, že zvýšený výskyt těchto příhod byl zaznamenán hlavně u subpopulace jedinců mimo USA, kteří byli již iniciálně více polymorbidní a hůře či neadekvátně léčeni s ohledem na svůj KV status. Jedna z posledních metaanalýz na toto téma, která zahrnovala 4 studie s roxadustatem (PYRENEES, SIERRAS, HIMALAYAS, ROCKIES) u nemocných podstupujících dialýzu, toto zvýšené riziko nepotvrdila (21). Bezpečnostní data týkající se možného vlivu HIF‑stabilizátorů na pokles renální funkce jsou zatím kontroverzní a bude nutné si počkat na další studie.
Další molekuly ovlivňující anémii
Sotatercept je fúzní protein Fc fragmentu IgG1 a receptoru typu IIA pro aktivin (22). Působí jako ligand pro některé proteiny z TGF‑β superrodiny a reguluje pozdní fáze diferenciace a maturace erytrocytů. To vede ke zvýšení erytropoézy, nárůstu erytrocytární řady a k vzestupu Hb. Sotatercept také vede ke zvýšené expresi angiotensinu II, který stimuluje erytropoézu zvýšením produkce EPO jak přímo, tak nepřímými mechanismy. Současně snižuje expresi VEGF (který působí jako inhibitor erytropoézy) a snižuje transkripci hepcidinu v játrech, čímž zlepšuje utilizaci železa u anemických nemocných. Je zajímavé, že má vliv nejen na anémii, ale zejména pak na minerálovou a kostní nemoc při chronickém onemocnění ledvin (CKD‑MBD) díky tomu, že váže BMP (bone morphogenic protein) 10 a BMP 11, čímž dochází ke snížení ztráty kostní hmoty a k redukci osteoporózy. Tyto jeho účinky byly potvrzeny i ve studiích REN-001 a REN-002 (23).
Shrnutí
• Terapie ESA by neměla být zahajována u nemocných s CKD ND, kteří mají Hb ≥ 100 g/l
• U nemocných s CKD 5D by léčba měla být zahájena, je‑li Hb mezi 90–100 g/l tak, aby se zabránilo poklesu Hb < 90 g/l
• Individualizace léčby ESA je opodstatněná, jelikož u některých nemocných je potřeba mít Hb ≥ 100 g/l pro zlepšení jejich kvality života
• Nedoporučuje se, aby při podávání ESA v udržovací léčbě byl Hb > 115 g/l
• Hb > 120 g/l není doporučován u nemocných s ICHS (NYHA III a IV) a u diabetiků
• Při léčbě ESA se nedoporučuje úmyslně zvyšovat Hb nad > 130 g/l v jakékoli fázi léčby
• ESA zůstávají klíčovými preparáty v léčbě anémie spojené s CKD
• Není vhodné překračovat doporučené dávky ESA preparátů schválené pro iniciální a udržovací léčbu
• Při nedostatečném efektu léčby ESA je vhodné vždy zvážit jiné příčiny hyporesponzivity na léčbu: Nedostatek železa, krevní ztráty, sekundární hyperparathyreózu, infekci či inflamaci, vliv medikace a další
• HIF‑stabilizátory zvyšují koncentraci Hb u nemocných s CKD ND i CKD 5D srovnatelně s ESA preparáty
• Pro své další vlastnosti se léčba HIF‑stabilizátory jeví jako vhodná zejména pro:
• Nemocné s CKD ND a na PD – perorální léčba
• Nemocné se současnou hyperlipidémií
• Pro nemocné s infekcí/inflamací a vysokými hodnotami hepcidinu
KORESPONDENČNÍ ADRESA AUTORKY:
prof. MUDr. Romana Ryšavá, CSc.
Klinika nefrologie, 1. LF UK a VFN Praha
U Nemocnice 2, 128 08 Praha 2
Cit. zkr: Vnitř Lék. 2022;68(7):438-443
Článek přijat redakcí: 3. 8. 2022
Článek přijat po recenzích: 12. 9. 2022
Sources
1. McClellan W, Aronoff SL, Bolton WK et al. The prevalence of anemia in patients with chronic kidney disease. Curr Med Res Opin. 2004;20 : 1501-1510.
2. Stauffer ME, Fan T. Prevalence of anemia in chronic kidney disease in the United States. PLoS One. 2014;9:e84943.
3. KDOQI Clinical Practice Guidelines and Clinical Practice Recommendations for Anemia in Chronic Kideny Disease. AJKD 2006; 47(Suppl 3):S1-S146.
4. KDIGO Clinical Practice Guideline for Anemia in Chronic Kidney Disease. Kidney Int Suppl 2012;2 : 283-287.
5. Singh AK, Szczech L, Tang KL et al. Correction of anemia with epoetin alfa in chronic kidney disease (CHOIR). N Engl J Med. 2006;355 : 2085-2098.
6. Drüeke TB, Locatelli F, Clyne N et al. Normalization of hemoglobin level in patients with chronic kidney disease and anemia. N Engl J med. 2006;355 : 2071-2084. (CREATE study).
7. Pfeffer MA, Burdmann EA, Chen ChY et al. A Trial of Darbepoetin Alfa in Type 2 Diabetes and Chronic Kidney Disease (TREAT). N Engl J Med. 2009;361 : 2019-2032.
8. Besarab A, Bollon WK, Browne JK et al. The effects of normal as compared with low hematocrit values in patients with cardiac disease who are receiving hemodialysis and epoetin. N Engl J Med. 1998;27;339(9):584-590.
9. Coyne DW, Goldsmith D, Macdougall IC. New options for the anemia of chronic kidney disease. Kidney Int Suppl. 2017;7 : 157-163.
10. Fishbane S, Besarab A. Mechanism of increased mortality risk with erythropoietin treatment to higher hemoglobin targets. Clin J Am Soc Nephrol. 2007;2 : 1274-1282.
11. Fishbane S, Schiller B, Locatelli F et al. Peginesatide in patients with anemia undergoing hemodialysis. N Engl J Med. 2013;368(4):307-19.
12. Macdougall IC, Provenzano R, Sharma A et al. Peginesatide for anemia in patients with chronic kidney disease not receiving dialysis. N Engl J Med. 2013; 368(4):320-32.
13. Jelkmann W. Regulation of erythropoietin production. J Physiol. 2011;589 : 1251-1258.
14. Haase VH. Hypoxia‑inducible factor)prolyl hydroxylase inhibitors in the treatment of anemia of chronic kidney disease. Kideny Int Suppl. 2021;11 : 8-25.
15. Sanghani NS, Haase VH. HIF‑prolyl hydroxylase inhibitors in renal anemia: current clinical experience. Adv Chronic Kidney Dis. 2019;26(4):253-266.
16. Wagner M, Alam A, Zimmermann J et al. Endogenous erythropoietin and the association with inflammation and mortality in diabetic chronic kidney disease. Clin J Am Soc Nephrol. 2011;6 : 1573-1579.
17. Bernhardt WM, Wiesener MS, Scigalla P et al. Inhibition of prolylhydroxylases increases erythropoietin production in ESRD. J Am Soc Nephrol. 2010;21 : 2151-2156.
18. Agarwal AK. Iron metabolism and management: focus on chronic kidney disease. Kidney Int Suppl. 2021;11 : 46-57.
19. Besarab A, Chernyavskaya E, Motylev I et al. Roxadustat (FG-4592): correction of anemia in incident dialysis patients. J Am Soc Nephrol. 2016;27 : 1225-1233.
20. Taylor CT, Doherty G, Fallon PG et al. Hypoxia‑dependent regulation of inflammatory pathways in immune cells. J Clin Invest. 2016;126 : 3716-3724.
21. Barrat J, Sulowitcz W, Schömig M et al. Efficacy and cardiovascular safety of roxadustat in dialysis‑dependent chronic kidney disease: pooled analysis of four phase 3 studies. Adv Ther. 2021;38 : 5345-5360.
22. Jelkmann W. The ESA scenario gets complex: from biosimilar epoetins to activin traps. Nephrol Dial Transplant. 2015;30(4):553-559.
23. Coyne DW, Singh HN, Smith WT et al. Sotatercept safety and effects oh hemoglobin, bone, and vascular calcification. Kidney Int Reports. 2019;4 : 1585-1597.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2022 Issue 7-
All articles in this issue
- Hlavní téma – Nefrologie
- Current options for slowing the progression of chronic kidney disease
- Expert opinion on the cooperation of diabetologists and internists with nephrologists in the care of patients with chronic kidney diseases
- Glomerulonephritides associated with infections
- New developments in anaemia treatment – erythropoietin versus prolyl hydroxylase inhibitors?
- Covid-19 in kidney transplant recipients
- Reactive, infectious, or post‑infectious arthritis?
- Effect of SGLT2 inhibitor empagliflozin on the stabilization of heart failure progress with the possibility of further interventions in a patient with HFrEF – a case report
- New technology in the hypolipidemic drugs development. Inclisiran (LEQVIO)
- Therapy of hypertension in elderly population and its potential risks
- Thyroid incidentalomas
- Můžeme novou léčbou ovlivnit dosavadní terapií neřešený zánět a fibrózu u pacientů s DM2 a CKD?
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Reactive, infectious, or post‑infectious arthritis?
- Thyroid incidentalomas
- New developments in anaemia treatment – erythropoietin versus prolyl hydroxylase inhibitors?
- Current options for slowing the progression of chronic kidney disease
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

