-
Medical journals
- Career
Time in range: nový parametr v diabetologii
Authors: MUDr. Milan Flekač, Ph.D.
Authors‘ workplace: 3. interní klinika VFN a 1. LF UK v Praze
Published in: Vnitř Lék 2022; 68(5): 315-323
Category: Review Articles
doi: https://doi.org/10.36290/vnl.2022.066Overview
S rozvojem moderních senzorových technologií v diabetologii v posledních cca 10 letech, kdy se nové možnosti monitorace glykemie dostávají stále častěji do každodenní klinické praxe, se vytvořily nové parametry, které se stávají standardem hodnocení míry kompenzace osob s diabetem a dokáží v některých aspektech doplnit klasické laboratorní parametry užívané dosud, zejména glykovaný hemoglobin. Nový parametr time in range představuje významný přínos nejen pro diabetology, ale také významný nástroj pomáhající pacientům v každodenním životě s diabetem.
Klíčová slova:
kompenzace diabetu – cílové hodnoty – hodnocení záznamů – kontinuální monitorace glukózy – time in range
Zlatý standard v hodnocení kompenzace diabetu a úspěšnosti léčby představoval doposud glykovaný hemoglobin. Glykovaný hemoglobin (HbA1c) byl tradiční parametr hodnocení kvality kompenzace diabetu všech typů, neboť vztah mezi HbA1c a rizikem rozvoje chronických komplikací je dokumentován řadou klinických studií.HbA1c reflektuje průměrnou glykemii za poslední cca 2–3 měsíce, absolutně však neposkytuje informace o variabilitě glykemií v průběhu dne a mezi jednotlivými dny (1).
Pomocí HbA1c nedokážeme popsat, do jaké míry glykemie u pacientů kolísá mimo průměrnou hodnotu, tzn. nepopisuje variabilitu glykemií. Obě velké studie DCCT a UKPDS ukázaly, že stav kompenzace diabetu stanovený glykovaným hemoglobinem ovlivňuje riziko rozvoje cévních komplikací. Glykovaný hemoglobin se tak stal prognostickým markerem těchto změn. Studie DCCT prokázala exponenciální nárůst mikrovaskulárních komplikací u diabetu 1. typu při zvyšující se hodnotě HbA1c nad 53 mmol/mol. Podobnou závislost ukázala i studie UKPDS u DM 2. typu, kdežto makrovaskulární komplikace vykazovaly u těchto pacientů méně výrazný vzestup s narůstající hodnotou HbA1c (2–4). Vedle absolutní hodnoty měla výrazný efekt i dlouhodobá variabilita glykemií promítající se do hodnot HbA1c, takže jeho vyšší variabilita podmínila větší rozvoj komplikací. Pacient s výkyvy glykemie směrem k hyperglykemickým a hypoglykemickým hodnotám tedy může dosahovat stejného HbA1c jako pacient, který má glykemie stabilní a na stejných průměrných hodnotách (5). Variabilita glykemií je dalším faktorem ovlivňujícím rozvoj dlouhodobých komplikací diabetu (6).
Víme, že stejnou hladinu HbA1c mohou mít osoby s naprosto odlišnou variabilitou (Obr. 1). Určité stavy, jako je anémie, hemoglobinopatie, nedostatek železa, těhotenství a další, mohou ovlivnit měření HbA1c (7–9). Přes tato omezení je A1C jediným prospektivně hodnoceným nástrojem pro hodnocení rizika komplikací diabetu a jeho význam v klinickém rozhodování by neměl být podceňován. Význam HbA1c narůstá při použití jako doplňku k datům měřeným pomocí kontinuální monitorace glykemie senzory. Kontinuální monitorace glykemie (CGM) je proto v tomto ohledu přelomovým monitoračním nástrojem, s jehož použitím se stále častěji setkáváme a každodenně pracujeme (10).
Image 1. Převzato a upraveno podle Kovatchev et al., Diabetes Care 2016;39(4):502-510 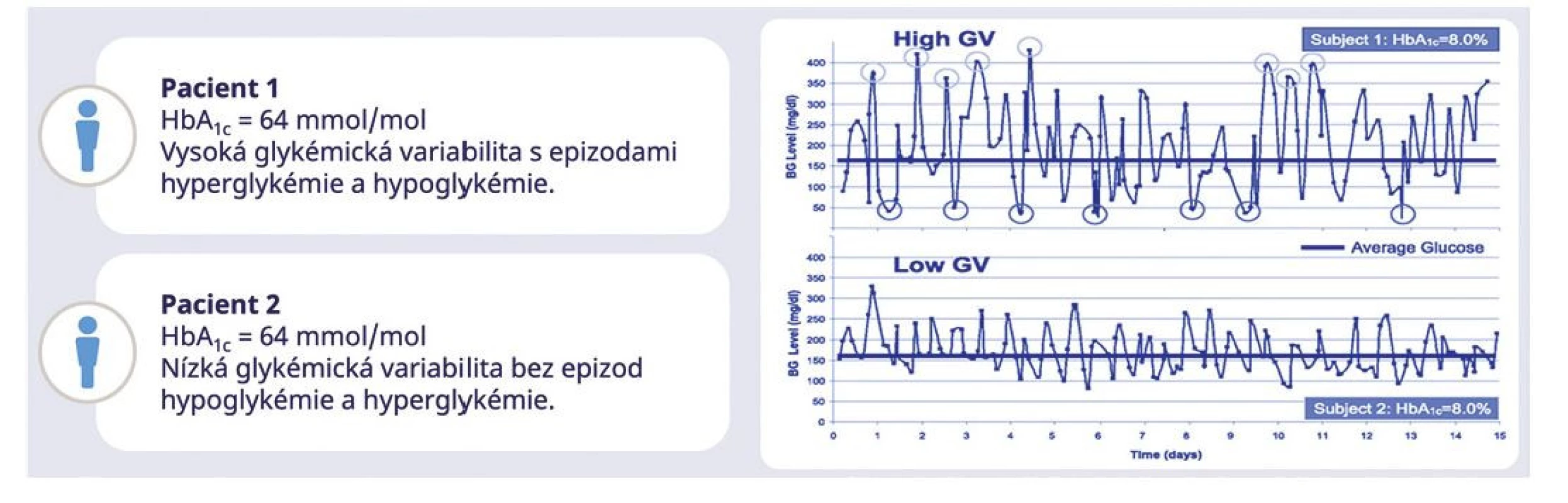
Time in range (TIR, čas strávený v cílových hodnotách) je parametr získaný z dat CGM, který vyjadřuje, kolik času strávil pacient využívající CGM za dané sledované období v cílovém glykemickém pásmu. Toto rozmezí bylo u diabetiků 1. a 2. typu vymezené hodnotou 3,9–10,0 mmol/l. TIR je udáván jako procentuálníi podíl hodnot anebo konkrétní čas strávený v tomto glykemickém pásmu. Kromě TIR byl definován také „čas pod cílovým pásmem“ (time below range – TBR) a „nad tímto pásmem“ (time above range – TAR). Podle mezinárodního konsenzu expertů je TBR i TAR rozdělen do tří úrovní (11). Časy v rozmezí tedy informují o tom, do jaké míry pacient dosahoval konkrétních cílových hodnot glykemie a o jejím kolísání okolo těchto hodnot, čili výkyvech do hyperglykemie i hypoglykemie. Mnohem reálněji tak vystihuje skutečnou úroveň dosahované glykemické kontroly u konkrétního pacienta. Limitaci výpovědní hodnoty izolovaného stanovení HbA1c ukazuje obrázek 2. Kompenzaci diabetu navíc umožňuje hodnotit v kratším časovém horizontu nežli HbA1c. Dokáže tedy časněji reflektovat změny, které se udály, např. po revizi zavedené antidiabetické terapie.
Image 2. Limitace HbA1c. Modelové situace ukazují klinicky významné rozdíly v „in range“ parametrech při stejné hladině HbA1c. Převzato a upraveno podle https://diatribe.org 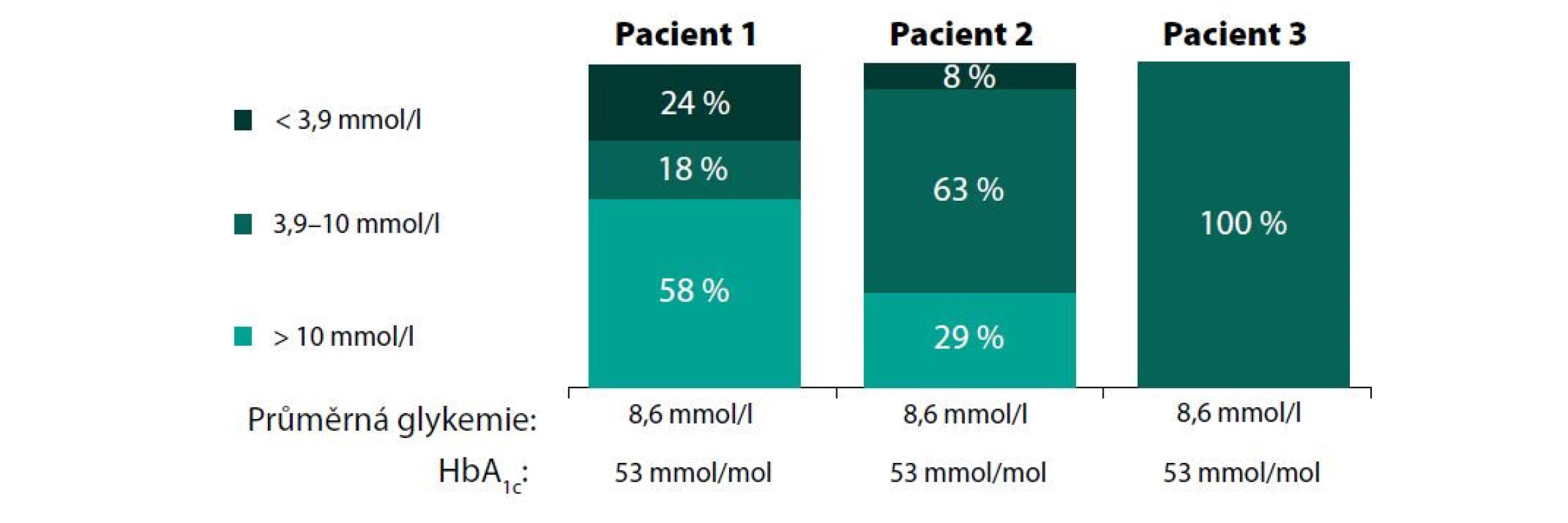
Podle aktuálního mezinárodního konsenzu je pacientům s diabetem doporučeno strávit co možná nejvíce času v cílovém rozmezí, alespoň 70 % času (tj. cca 17 hod/den), a současně minimalizovat vznik hypoglykemie, tzn. dosáhnout TBR do 4 % času (tj. cca 1 hod/den). U rizikových či křehkých pacientů je podle aktuálních doporučení cílem dosáhnout TIR alespoň nad 50 %. U pacientek s diabetem v době těhotenství je TIR vymezený hodnotami 3,5–7,8 mmol/l, s cílem dosažení a udržení TIR nad 70 % času (Obr. 3) (11). Korelaci mezi hodnotou laboratorního HbA1cc a hodnotou TIR ukázala analýza 18 studií na široké populaci osob s DM 1. a 2. typu (12). Podle této analýzy znamená každá změna TIR o 10 % změnu HbA1c o přibližně 9 mmol/mol, jak ukazuje tabulka 1. Využití glukózového senzoru pro kontinuální monitoraci glykemie CGM u diabetiků vedlo k diskuzi o stanovení tzv. odhadovaného HHbA1c (estimated HHbA1c). Průměrná glykemie z CGM poskytuje přesnou informaci u daného pacienta, na jejímž základě komise expertů navrhla nový pojem místo eHbA1c označený jako „glucose management indicator“ (GMI). Hodnoty GMI jsou zpřesněním vyjádřené kompenzace diabetu u daného pacienta a jsou určeny k vedení léčby. To vysvětluje i název tohoto parametru. Analýzy ukázaly, že jeho hodnota je buď vyšší, nebo nižší než naměřená hodnota HbA1c, nicméně rozdíl mezi laboratorně změřeným HbA1c a GMI u daného pacienta zůstává poměrně stabilní. GMI umožňuje více individualizovat cíle léčby (13). Nové vyjadřování kompenzace platí hlavně pro diabetiky 1. typu, případně 2. typu léčené inzulinem.
Image 3. Doporučené cílové hodnoty, resp. čas strávený v jednotlivých rozmezích u různých subpopulací pacientů s DM dle mezinárodního konsenzu. Převzato a upraveno podle Battelino et al. Diabetes Care. 2019;42:1593-1603 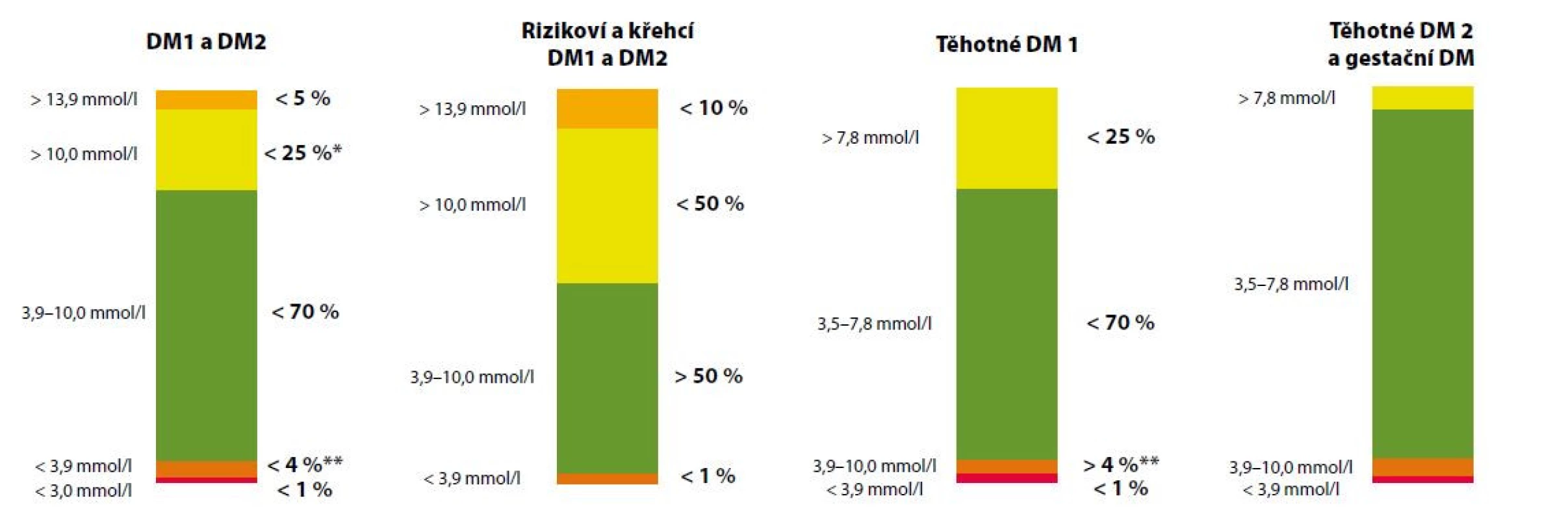
Table 1. Korelace mezi HbA1c a TIR. Převzato a upraveno podle Vigersky et al. Diabetes Tech & Ther, 2019;21:2:81-85 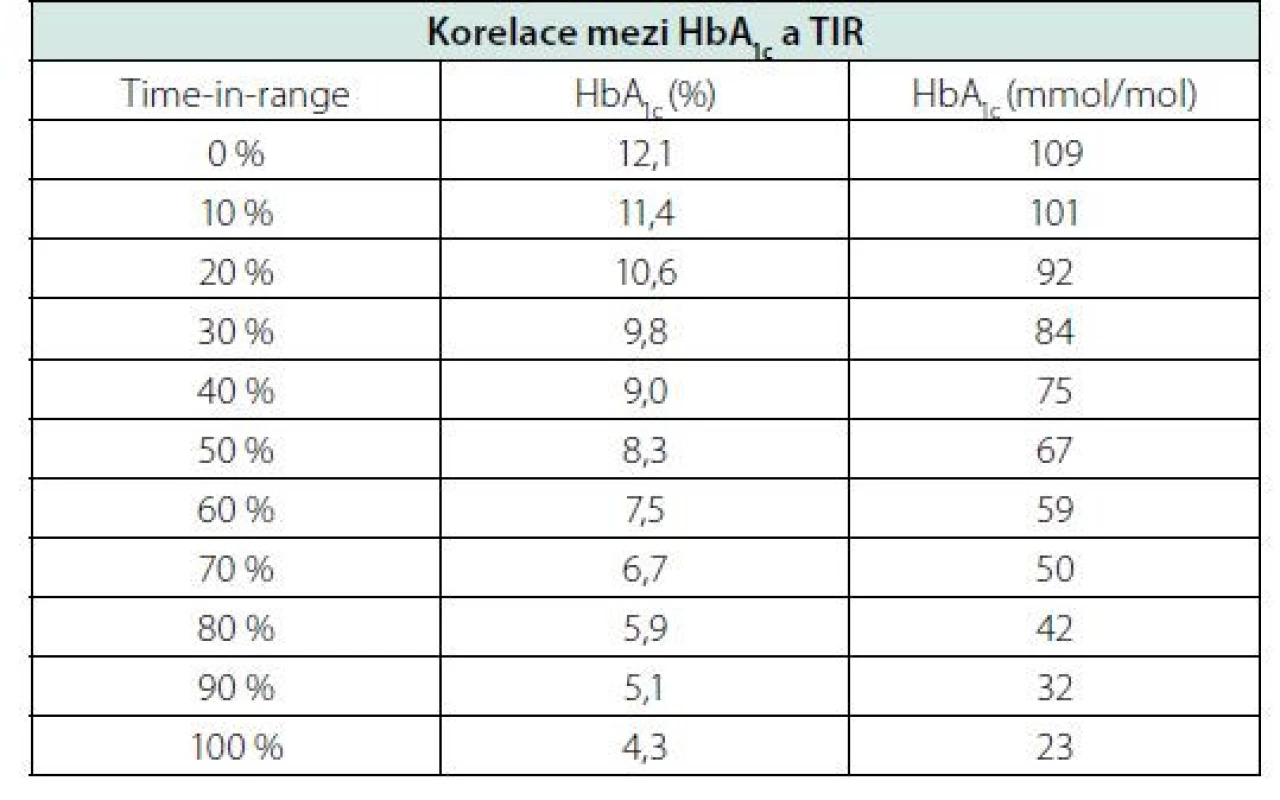
Stejně jako pro laboratorní HbA1c ve vztahu ke vzniku a rozvoji specifických komplikací diabetu je v současné době i evidence pro parametr TIR. TIR může být osobním, kalkulovaný z dat selfmonitoringu glykemií glukometrem (takto byl počítán při analýze ze studie DCCT) (14), ale i z dat záznamů CGM jak u pacientů s DM 1. typu, tak i u osob s DM 2. typu. TIR je parametr významný nejen pro pacienty (jak ukázala nedávno publikovaná rozsáhlá dotazníková studie, ve které měl TIR pro dotazované diabetiky 1. i 2. typu na rozdíl od HbA1c „velký význam“ pro denní život s diabetem, zahrnující širokou škálu faktorů, jako je dieta, pohybová aktivita, úprava terapie, riziko hypoglykemií, kvalita života, ale také pro diabetology (15). TIR byl totiž recentně validován jako možný výstup klinických studií, neboť velmi dobře koreloval s rizikem mikrovaskulárních komplikací u obou typů diabetu. U DM 1. typu byl 10–12% rozdíl v TIR (tj. 2,5 – 3 h/den) mezi skupinou pacientů, u kterých se vyvinuly mikrovaskulární komplikace jako albuminurie a retinopatie (16), a skupinou bez těchto komplikací spojen s cca 60% nárůstem rizika retinopatie a 40% nárůstem rizika albuminurie. U pacientů s DM 2. typu byla obdobně prokázána negativní asociace TIR s diabetickou retinopatií a neuropatií (Obr. 4) (17).
Image 4. A. TIR a mikrovaskulární komplikace. Hodnota TIR není kalkulována z CGM, ale ze 7bodového selfmonitoringu glykemií osobním glukometrem během studie DCCT. Převzato a upraveno podle Beck et al. Diabetes Care. 2019 Mar;42(3):400-405 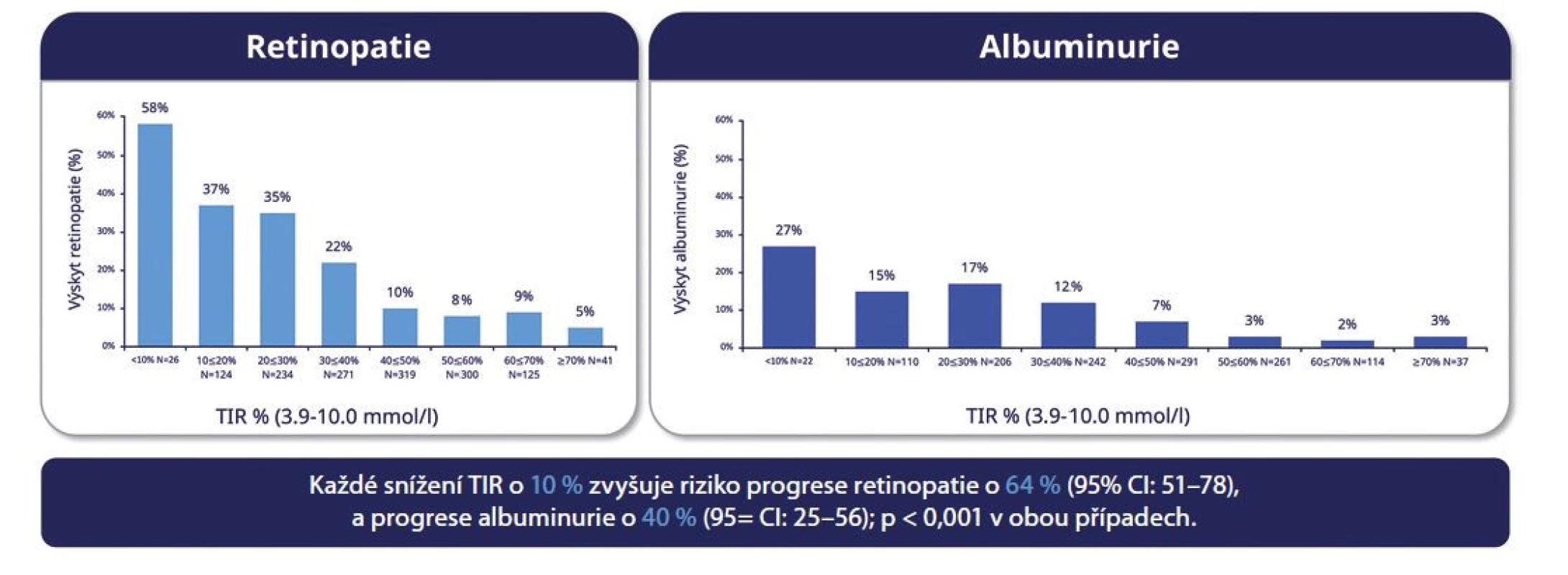
Obr. 4B. TIR a mikrovaskulární komplikace u pacientů s DM 2. typu. TIR byl kalkulován z CGM. Převzato a upraveno podle Lu et al. Diabetes Care 2018;41:2370-2376 
Přestože se někdy setkáváme s parametrem TIR kalkulovaným z měření glukometrem (některé softwarové nástroje běžně používané v diabetologii umožnují kalkulovat „in range“ parametry), je potřeba k těmto výstupům přistupovat s opatrností, neboť při měření glukometrem zůstane řada hodnot „skryta“ mezi jednotlivými body, zejména v průběhu noci či mezi jídly. Hodnocení „in range“ parametrů pak může být výrazně zkresleno a neodhalí klinicky významný problém, jak ukazuje obrázek 5. Na základě nevalidních dat z glukometru pak nemusí být revize antidiabetické léčby vedená správným směrem. Validita dat je tedy zásadní podmínkou k dosažení spolehlivých záznamů a statistických hodnocení (18). Prvním klíčovým ukazatelem je tedy čas strávený na CGM. Základem je přesvědčit pacienta, aby strávil na CGM minimálně 80 % a více času, jinak se TIR stává pro hodnocení irelevantním. Z pohledu lékaře je vždy potřeba při hodnocení záznamů CGM nejprve zhodnotit validitu dat (Obr. 6). Podle mezinárodního konsenzu data ze CGM za posledních 14 dní silně korelují s průměrnou glykemií za poslední 3 měsíce, s TIR a časy strávenými v hyperglykemii (11). Hůř ovšem korelují s časem stráveným v hypoglykemickém pásmu (TBR) (19).
Image 5. Srovnání hodnocení TIR kalkulovaného z glukometru a profesionální zaslepené CGM u pacientky s DM léčené intenzifikovaným inzulinovým režimem. Vyjádření „in range“ parametrů kalkulovaných z měření glukometrem je klinicky významně zkresleno chybějícími záznamy měření. Záznam CGM odhaluje zásadní problém – vysokou variabilitu ranní glykemie a zejména výskyt nočních hypoglykemií
Obr. 5A. Points in range z glukometru. Záznam tzv. modálního dne (Diasend) z období 1 měsíce před kontrolou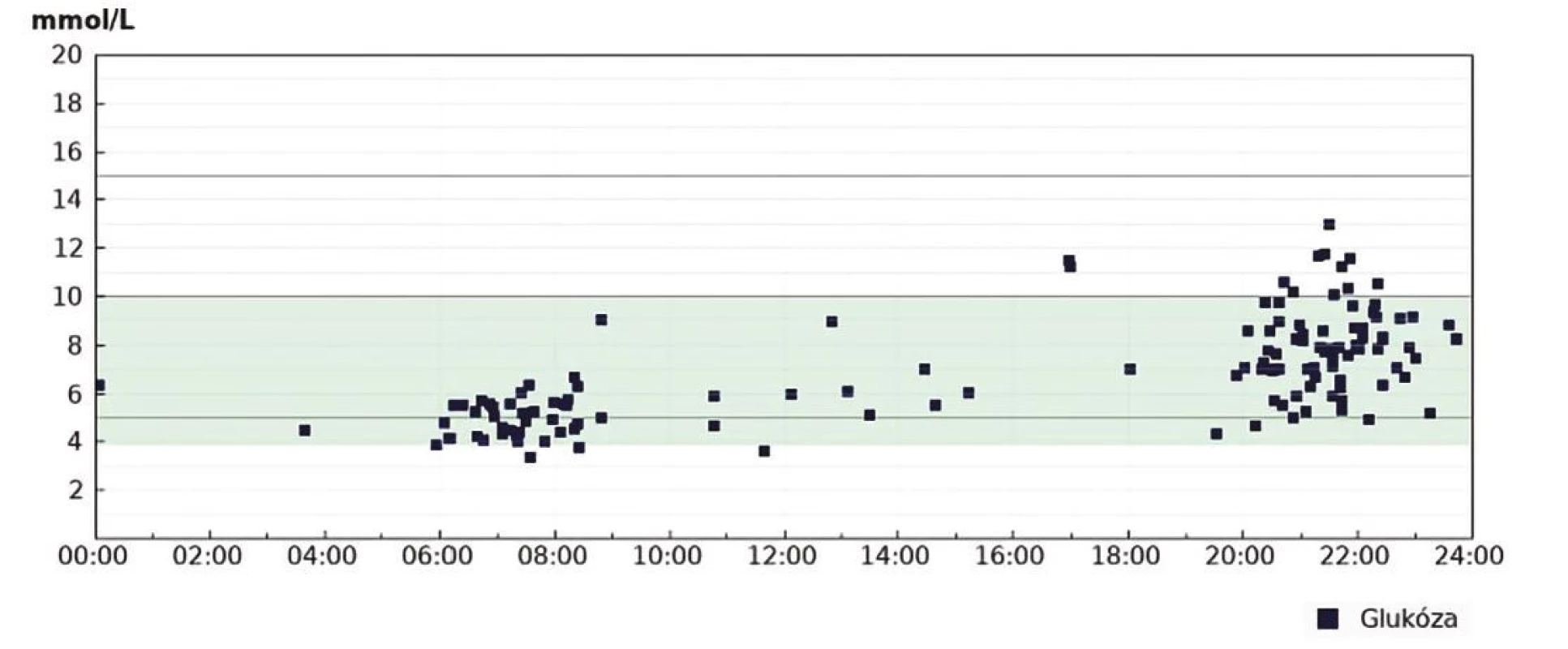
Obr. 5B. Vyjádření výše uvedeného záznamu pomocí „in range“ parametrů a základní statistické hodnocení, včetně směrodatné odchylky jako parametru popisujícího variabilitu glykemií. Kalkulace variability glykemií z měření glukometrem je ještě méně spolehlivé než vyjádření „in range“ parametrů 
Obr. 5C. Záznam zaslepené profesionální CGM (Dexcom Clarity, systém Dexcom G6) u téže pacientky odhaluje zásadní problém zavedené terapie premixovanými humánními inzuliny – nebezpečný průběh glykemie v noci a výskyt občasných hypoglykemií nad ránem a velmi neuspokojivou kontrolu postprandiální glykemie po obědě a večeři 
Image 6. Záznam CGM. Analýza záznamů dat z rt-CGM Dexcom G6 (Dexcom Clarity). Hodnocení validity dat – základním posouzením je doba, která je vyhodnocována, a doba strávená v tomto období pacientem „na senzoru“. V tomto případě jsou analyzována data 14 dní zpětně a v tomto období používal pacient senzor 100 % času 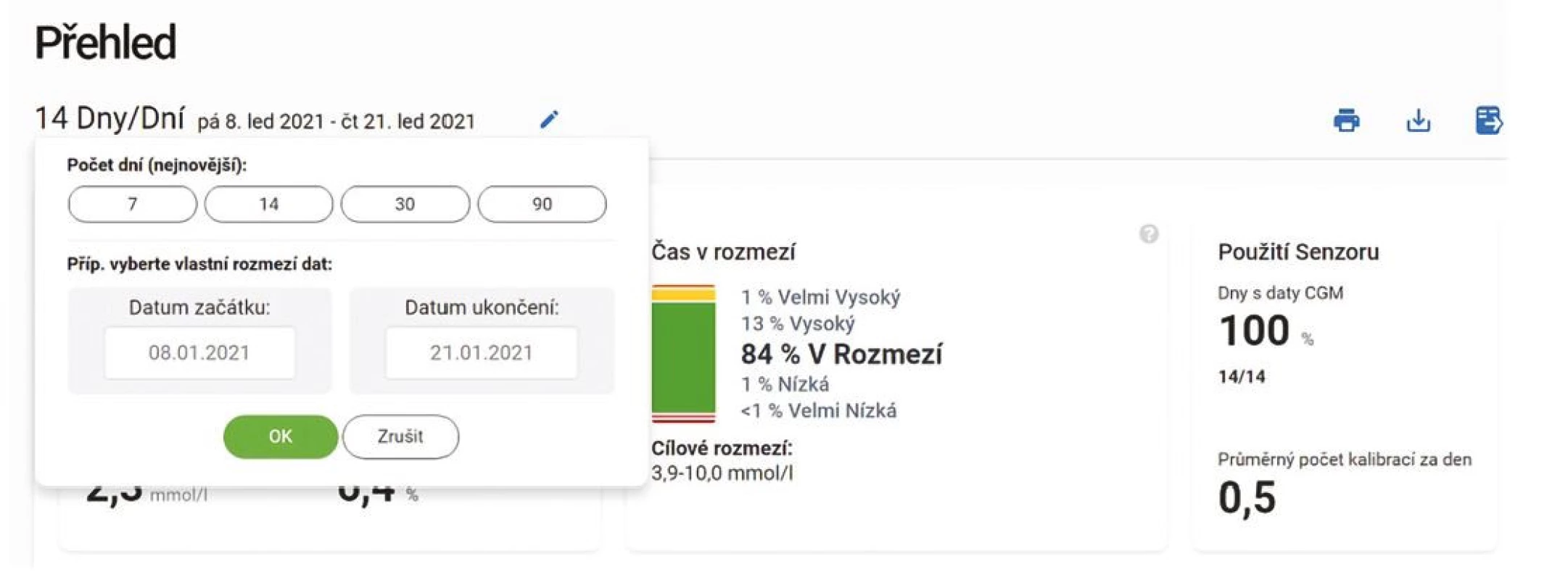
Dobrou kompenzaci diabetu můžeme v klinické praxi efektivně a bezpečně dosáhnout snahou o co nejvyšší TIR a redukcí času stráveného mimo doporučené rozmezí glykemií. Cest k dosažení co nejvyššího TIR je prakticky mnoho, principiálně však optimalizujeme glykemie. Jednak glykemie měřené nalačno, kdy preferenčně využíváme bazální inzulinová analoga 2. generace, která oproti první generaci inzulinů poskytují zejména větší předvídatelnost účinku, bezpečnost ve smyslu rizika výskytu hypoglykemie, což nám dovolí, zejména u osob s DM 2. typu, mířit k ambicióznějším cílům (v případě bazálního inzulinu tedy nižším glykemiím nalačno, které nejsou vykoupeny vyšším výskytem hypoglykemií, zejména v noci). Srovnáním bazálního inzulinu 2. generace degludeku a inzulinu glarginu U100 se zabývala studie SWITCH PRO, která měla primární cíl parametr TIR (20). TIR byl získán pomocí profesionální CGM (s využitím systému Free Style Libre Pro). Studie byla uspořádána jako studie se zkříženým designem. V průběhu aktivní fáze byla provedena na konci obou léčebných period 14denní profesionální CGM, z jejíchž dat byl kalkulován TIR. Průměrný TIR (3,9–10,0 mmol/l) byl 72,1 % v případě použití inzulinu degludeku a 70,7 % při použití inzulinu glarginu U100. Rozdíl v TIR byl 1,4 %, resp. 20,6 minut za den [95 % CI 0,12; 2,74], p = 0,032. Superiorita degludeku oproti glarginu U100 tak byla potvrzena. Prostá výměna bazálního inzulinu byla tedy spojena s klinicky významnou změnou TIR. Post hoc analýza ukázala, že současně existoval i rozdíl v TBR v průběhu noci (hypoglykemická pásma úrovně 1 a 2) ve prospěch inzulinu degludeku.
Vzhledem k tomu, že většinu aktivního dne stráví průměrný pacient s DM v postprandiálním stavu, pak samozřejmě ovlivněním postprandiální glykemie (preferencí ultrarychlých inzulinových analog, event. v případě obézních osob u DM 2. typu použitím GLP-1 receptorových agonistů) zvýšíme TIR redukcí doby strávené v hyperglykemii (TAR). GoBolus byla první studie z reálné praxe, která se zaměřila na posouzení účinnosti inzulinu FIAsp a prokázala, že převedení na inzulin FIAsp z původních inzulinových analog 1. generace vyústí ve statisticky významné zvýšení času TIR (hodnocené ve 24. týdnu sledování) při současné redukci času v hyperglykemii, bez navýšení doby strávené v hypoglykemii. Tohoto bylo dosaženo bez změny bazálního inzulinu (21). Ve 24. týdnu se průměrný čas v cílovém rozmezí zvýšil o cca 46 min/den a byl doprovázen poklesem času stráveného v hyperglykemii (o cca 44 min pro pásmo glykemie > 10,0 mmol/l), zatímco doba strávená v hypoglykemii zůstala ve srovnání s výchozí hodnotou prakticky nezměněna. Kombinací těchto změn lze dosáhnout v praxi klinicky významného zvýšení TIR, jak demonstruje případ na obrázku 7.
Image 7. Záznamy z ambulatního glukózového profilu CGM (systém Free Style Libre) demonstrující efekt změn obou inzulinů u pacientky léčené MDI analogy. Jednoduchá záměna inzulinových analog první generace (glargin U100 a glulisin) za inzulinová analoga druhé generace (inzulin degludek a inzulin FIAsp) vedla k významnému zlepšení kontroly diabetu, jak je vidět na „in range“ parametrech. Došlo ke zvýšení TIR o 18 % redukcí hyperglykemií (zejména postprandiálních), tedy TAR, při nezměněné době strávené v hypoglykemii (a zejména bezpečnějším – předvídatelným průběhem glykemie v noci
Obr. 7A. Původní terapie MDI analogy glargin U100 a glulisinem, záznamy CGM Free Style Libre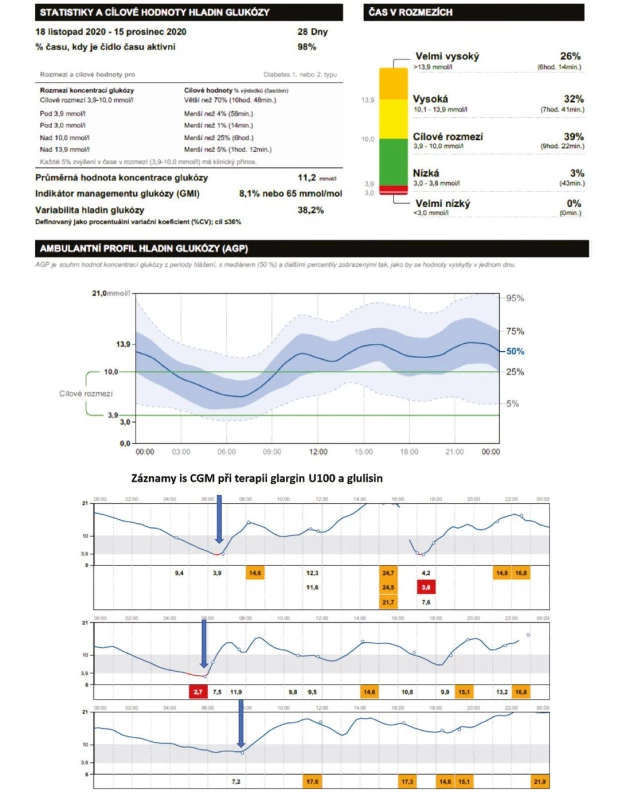
Obr. 7B. Změna MDI terapie na inzulin degludek a FIAsp, záznamy CGM Free Style Libre 
Cílem správně vedené terapie DM je pohybovat se v doporučených rozmezích TIR co nejdelší období dne. TIR je pro pacienta i lékaře parametrem, který mohou vedle parametrů tradičních (HbA1c, glykemie nalačno a postprandiální) velmi dobře použít k monitoraci úspěšnosti léčby, která se promítá do ovlivnění rizika vzniku a rozvoje chronických komplikací DM. Vedle výše uvedené možnosti zvýšení TIR využitím moderních inzulinových analog druhé generace, event. jiných antidiabetik (GLP - 1 receptorových agonistů v kombinaci s bazálním inzulinem místo klasické intenzifikované inzulinové léčby u některých pacientů s DM 2. typu), je to samozřejmě samotná monitorace glykemie pomocí real time CGM, resp. co nejvíce času „na senzoru“, dále správné nastavení alarmů systému CGM, správné načasování aplikace inzulinu k jídlu, používání korekčních bolusů rychle působících inzulinů, počítání sacharidů a tuko‑proteinových jednotek, použití bolus kalkulátoru, u některých využití systémů AHCL (pokročilé hybridní close loop systémy, tzn. chytré inzulinové pumpy), chytrá inzulinová pera a další.
Závěr
Trvalé používání CGM by mělo být v současné době standardní součástí managementu DM 1. typu. U pacientů léčených intenzifikovanou inzulinovou léčbou (vč. osob s DM 2. typu) poskytuje real time CGM možnost získat okamžitou informaci o aktuální hladině glykemie a zejména o trendu změny a rychlosti změny glykemie. Tyto informace umožňují lidem s diabetem optimalizovat nejen dietní příjem, pohybovou aktivitu, ale také činit adekvátní a včasná rozhodnutí týkající se úpravy dávkování inzulinu, a tak redukovat riziko výskytu akutních hyperglykemických i hypoglykemických epizod. Retrospektivní analýza záznamů CGM umožňuje lékařům a pacientům identifikovat problémy, navrhnout přiléhavější léčebná opatření a stanovit individuální reálné cíle léčby DM. Používání TIR, resp. „in range“ parametrů kalkulovaných ze CGM, je v běžné klinické praxi velmi výhodné a užitečné. Umožňuje si stanovit pro pacienty hmatatelnější klinické cíle a v řadě situací popisuje realitu kompenzace, resp. kontroly DM, lépe než HbA1c, neboť TIR kombinuje průměrnou glykemii (ze senzoru) a glykemickou variabilitu. V rámci interpretace těchto nových parametrů je vždy nutné verifikovat validitu dat, ze kterých jsou tyto parametry kalkulovány (CGM versus glukometr, doba používání CGM a délka období, které je analyzováno). Obecně se dá shrnout, že společným cílem je snaha o zvýšení TIR. Nástrojů ke zvýšení doby strávené v cílových hodnotách je v současné době celá řada, režimových i farmakoterapeutických.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Milan Flekač, Ph.D.
3. interní klinika VFN a 1. LF UK v Praze
U Nemocnice 504, 128 00 Praha – Nové Město
Cit. zkr: Vnitř Lék. 2022;68(5):315-323
Článek přijat redakcí: 30. 5. 2022
Článek přijat po recenzích: 1. 7. 2022
Sources
1. American Diabetes Association. 7. Diabetes technology: Standards of Medical Care in Diabetes 2019. Diabetes Care. 2019;42(Suppl.1):S71-S80.
2. Nathan DM, Genuth S, Lachin J et al. Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long‑term complications in insulin‑dependent diabetes mellitus. N Engl J Med. 1993;329 : 977–986.
3. UK Prospective Diabetes Study (UKPDS) Group. Intensive blood‑glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet. 1998;352 : 837-853.
4. Holman RR, Paul SK, Bethel MA, Matthews DR, Neil HAW. 10-year follow‑up of intensive glucose control in type 2 diabetes. N Engl J Med. 2008;359 : 1577-1589.
5. Beck RW, Connor CG, Mullen DM et al. The fallacy of average: how using HbA1c alone to assess glycemic control can be misleading. Diabetes Care. 2017;40 : 994-999.
6. Rodbard D. Glucose variability: a review of clinical applications and research developments. Diabetes technology & therapeutics. 2018 Jun 1;20(S2):S2-5.
7. National Institute of Diabetes and Digestive and Kidney Diseases Health Information Center. Sickle cell trait & other hemoglobinopathies & diabetes (for providers) [Internet]. Available from https://www.niddk.nih.gov/health‑information/ diagnostic‑tests/sickle‑cell‑trait‑hemoglobinopathies in diabetes. Accessed 12 January 201838. Bry L, Chen PC, Sacks DB. Effects of hemoglobin variants and chemically modified derivatives on assays for glycohemoglobin. Clin Chem. 2001;47 : 153-163.
8. Ford ES, Cowie CC, Li C, Handelsman Y et al. Iron‑deficiency anemia, non iron‑deficiency anemia and HbA1c among adults in the US. J Diabetes. 2011;3 : 67-73.
9. Nielsen LR, Ekbom P, Damm P et al. HbA1c levels are significantly lower in early and late pregnancy. Diabetes Care. 2004;27 : 1200-1201.
10. Petrie JR, Peters AL, Bergenstal RM et al. Improving the clinical value and utility of CGM Systems: issues and recommendations: a joint statement of the European Association for the Study of Diabetes and the American Diabetes Association Diabetes Technology Working Group. Diabetes Care. 2017;40 : 1614-1621.
11. Battelino T, Danne T, Bergenstal RM et al. Clinical Targets for Continuous Glucose Monitoring Data Interpretation: Recommendations From the International Consensus on Time in Range. Diabetes Care. 2019 Aug;42(8):1593-1603.
12. Vigersky RA, McMahon C. The Relationship of Hemoglobin A1C to Time‑in‑Range in Patients with Diabetes. Diabetes Technol Ther. 2019 Feb;21(2):81-85.
13. Bergenstal RM, Beck RW, Close KL et al. Glucose Management Indicator (GMI): A New Term for Estimating A1C From Continuous Glucose Monitoring. Diabetes Care. 2018 Nov;41(11):2275-2280.
14. Beck RW, Bergenstal RM, Riddlesworth TD, et al. Validation of Time in Range as an Outcome Measure for Diabetes Clinical Trials. Diabetes Care. 2019 Mar;42(3):400-405.
15. Polonsky WH, Hessler D. What are the quality of life‑related benefits and losses associated with real‑time continuous glucose monitoring? A survey of current users. Diabetes Technol Ther. 2013 Apr;15(4):295-301.
16. El Malahi A, Van Elsen M, Charleer S et al. Relationship Between Time in Range, Glycemic Variability, HbA1c, and Complications in Adults With Type 1 Diabetes Mellitus. J Clin Endocrinol Metab. 2022 Jan 18;107(2):e570-e581.
17. Lu J, Ma X, Zhou J et al. Association of Time in Range, as Assessed by Continuous Glucose Monitoring, With Diabetic Retinopathy in Type 2 Diabetes. Diabetes Care. 2018 Nov;41(11):2370-2376.
18. Johnson ML, Martens TW, Criego AB, Carlson AL, Simonson GD, Bergenstal RM. Utilizing the Ambulatory Glucose Profile to Standardize and Implement Continuous Glucose Monitoring in Clinical Practice. Diabetes Technol Ther. 2019 Jun;21(S2):S217-S225.
19. Riddlesworth TD, Beck RW, Gal RL et al. Optimal Sampling Duration for Continuous Glucose Monitoring to Determine Long‑Term Glycemic Control. Diabetes Technol Ther. 2018 Apr;20(4):314-316.
20. Goldenberg RM, Aroda VR, Billings LK et al. Effect of insulin degludec versus insulin glargine U100 on time in range: SWITCH PRO, a crossover study of basal insulin‑treated adults with type 2 diabetes and risk factors for hypoglycaemia. Diabetes Obes Metab. 2021 Nov;23(11):2572-2581.
21. Danne T, Axel Schweitzer M, Keuthage W et al. Impact of Fast‑Acting Insulin Aspart on Glycemic Control in Patients with Type 1 Diabetes Using Intermittent‑Scanning Continuous Glucose Monitoring Within a Real‑World Setting: The GoBolus Study. Diabetes Technol Ther. 2021 Mar;23(3):203-212.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2022 Issue 5-
All articles in this issue
- Hlavní téma – Aktuality v revmatologii
- Léčba obrovskobuněčné arteriitidy – současnost a otevírající se možnosti
- Co nového v léčbě systémového lupus erytematodes?
- Novinky v léčbě axiálních spondyloartritid
- Časná diagnostika systémové sklerodermie
- Difuzní alveolární hemoragie jako život ohrožující manifestace nově diagnostikované granulomatózy s polyangiitidou navazující na infekci covid-19 – kazuistika
- Co je nového v doporučeních ESC 2021 pro kardiovaskulární prevenci?
- Proč brát vážně orgánové poškození u hypertenze?
- Zánět a vaskulární onemocnění
- Time in range: nový parametr v diabetologii
- Co je nového v Doporučených postupech ESC 2020 pro diagnostiku a léčbu akutních koronárních syndromů bez ST elevací?
- Diferenciální diagnostika bolestí zad
- Entresto (sakubitril-valsartan) získalo prestižní mezinárodní Galénovu cenu za nejlepší farmaceutický produkt pro rok 2022
- XXXIX. dny mladých internistů v Martině
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diferenciální diagnostika bolestí zad
- Časná diagnostika systémové sklerodermie
- Co je nového v doporučeních ESC 2021 pro kardiovaskulární prevenci?
- Co nového v léčbě systémového lupus erytematodes?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

