-
Medical journals
- Career
FDG-PET/CT dokumentované vymizení nekrobiotického xantogranulomu při potlačení tvorby monoklonálního imunoglobulinu bortezomibem, lenalidomidem a dexametazonem Popis případu a přehled literatury o léčbě nekrobiotického xantogranulomu
Authors: Zdeněk Adam 1; Luděk Pour 1; Zdeněk Řehák 2; Klára Dvořáková 3; Renata Koukalová 2; Josef Feit 3; Petr Kameník 4; Marta Krejčí 1; Martin Štork 1; Martin Krejčí 1; Viera Sandecká 1; Ivanna Boichuk 1; Zdeněk Král 1
Authors‘ workplace: Interní hematologická a onkologická klinika LF MU a FN Brno 1; Oddělení nukleární medicíny Masarykův onkologický ústav Brno 2; Patologicko-anatomické oddělení, Nemocnice Jihlava 3; Interní oddělení Nemocnice Jihlava 4
Published in: Vnitř Lék 2021; 67(6): 352-356
Category: Case reports
Overview
Nekrobiotický xantogranulom je vzácné chronické onemocnění, řazené do skupiny non-Langerhans cell histiocytóz. Může mít závažné mimokožní příznaky. Obvykle je asociováno s monoklonální gamapatií typu MGUS nebo s mnohočetným myelomem. V textu popisovaný případ nekrobiotického xantogranulomu byl diagnostikován rok po stanovení diagnózy asymptomatického myelomu. Po léčbě složené z bortezomibu, lenalidomidu a dexametazonu bylo dosaženo kompletní remise mnohočetného myelomu, což znamená, že byla potlačena tvorba monoklonálního imunoglobulinu, takže nebyl detekovatelný ani imunofixační elektroforézou a v téže době vymizela kožní i jaterní ložiska nekrobiotického xantogranulomu na FDG-PET/CT zobrazení. Tento případ dokumentuje kauzální souvislost mezi monoklonálním imunoglobulinem a nekrobiotickým xantogranulomem.
Klíčová slova:
mnohočetný myelom – monoklonální gamapatie – nekrobiotický xantogranulom
Úvod
Nekrobiotický xantogranulom (NXG) je vzácným, velmi pravděpodobně reaktivním histiocytárním onemocněním. Přítomnost monoklonálního imunoglobulinu (M-Ig) je popsána u velké většiny nemocných, ale přesná etiopatogenetická souvislost M-Ig s tímto nálezem není známa. Nicméně souvislost mezi NXG a M-Ig potvrzuje tento případ mnohočetných kožních, ale i hepatálních ložisek NXG, která vymizela při léčbě, vedoucí k poklesu M-Ig pod měřitelné hodnoty. Vývoj ložisek NXG byl sledován pomocí opakovaných FDG-PET/CT vyšetření. Tento popis případu může být stimulem pro vyvinutí maximální snahy o dosažení kompletní remise monoklonální gamapatie u pacientů s NXG. Nekrobiotický xantogranulom je uveden v histologické klasifikaci krevních chorob ve skupině histiocytárních onemocnění. V roce 2020 se poprvé objevila v odborné literatuře (1) kritéria této nemoci, která uvádí tabulka 1.
Table 1. Diagnostická kritéria nekrobiotického xantogranulomu z roku 2020 (1) 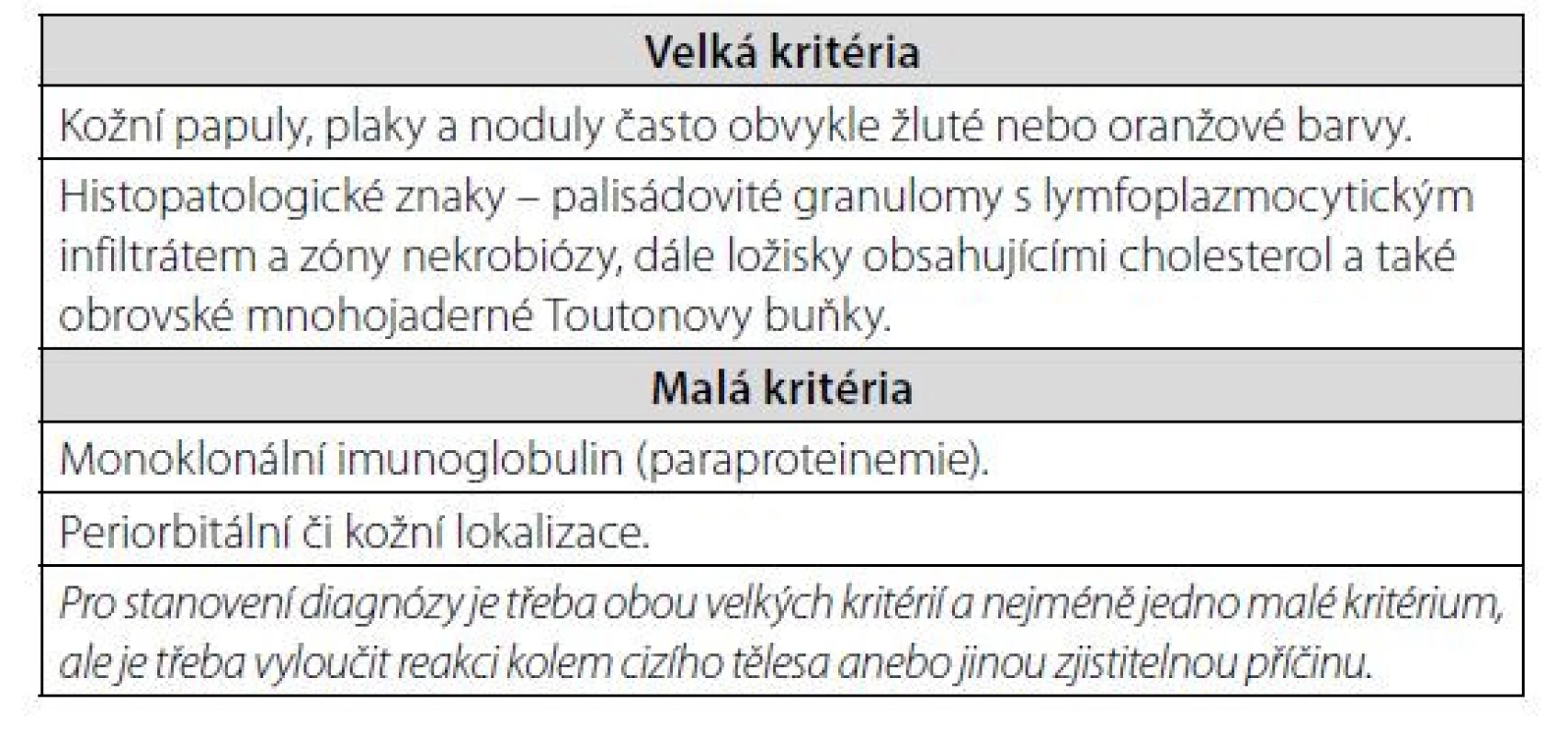
Popis případu
Muž, narozený 1957, byl do naší ambulance odeslán v dubnu roku 2019 z Hematologického oddělení nemocnice Jihlava, kam se dostal pro vysokou hodnotu celkové bílkoviny, která vždy budí podezření na zvýšenou koncentraci imunoglobulinů, ať již polyklonálních, nebo monoklonálního imunoglobulinu. V tomto případě se jednalo o vysokou koncentraci M-Ig typu IgG kappa v séru, dosahující hodnoty 32 g/l. V trepanobiopsii bylo popsáno 2–20 % klonálních plazmocytů. Vstupní rentgenové vyšetření skeletu neprokázalo žádné osteolytické změny, typické pro mnohočetný myelom. Koncentrace hemoglobinu byla 141 g/l a hodnoty kreatininu a kalcia v séru byly v normě. Diagnóza byla uzavřena jako asymptomatický myelom.
V rámci kompletnosti pohledu bylo v červnu 2019 provedeno první FDG-PET/CT vyšetření, které se na první pohled jevilo být bez patologického nálezu. Byla popsána mírně zvýšená akumulace fluorodeoxyglukózy (FDG) v retromandibulární uzlině vpravo a zvýšená akumulace FDG v podkoží pravého stehna, ale průměr ložiska byl menší než 1 cm. Kožní ložisko bylo považováno za drobnou kožní zánětlivou reakci a nijak jsme jej nekontrolovali. Ale jak se při dalším vyšetření ukázalo, šlo zřejmě o počínající nekrobiotický xantogranulom. Zobrazená retromandibulární uzlina nebyla ale tak velká, aby byla dobře hmatná.
Druhé FDG-PET/CT vyšetření bylo provedeno skoro o rok později, v květnu 2020, a toto vyšetření již přineslo překvapivý patologický nález několika ložisek zvýšené akumulace, ale ne v kostech. Byla popsána zvětšená jugulární uzlina vpravo velikosti 15 mm zvýšeně akumulující FDG (SUVmax 3,73). Dále pak byla v low-dose CT vyšetření popsána zvětšená játra. Pravý lalok kraniokaudálně měřil 16 cm a měl nehomogenní strukturu. Slezina se oproti přechozímu vyšetření také zvětšila. Na skeletu byla zřetelná osteoporóza a prolomená horní krycí ploška těla obratle L2. V kůži a podkoží femorální oblasti vpravo laterálně byl již na low-dose CT zřetelný infiltrát 24 x 24 x 12 mm. V PET obraze tohoto vyšetření bylo překvapivě více ložisek s patologickou akumulací FDG v obou lalocích jater s maximem kaudálně (SUVmax do výše 6,5). Izolovaně aktivní ložisko povrchově laterálně na pravém stehně intenzivně akumulovalo FDG, takže hodnotaSUVmax dosáhla 12,15. Biochemické vyšetření v té době dokumentovalo normální bilirubin, z jaterních enzymů pouze AST bylo zcela nepatrně vyšší 1,01 μkat/l.
Domluvili jsme přešetření těchto ložisek na Interním oddělení Nemocnice Jihlava. V plánu bylo odebrat histologii z podkožního ložiska a případně provést biopsii ložiska v játrech. Odběr histologie proběl v nemocnici Jihlava a stejně tak i první histologické hodnocení podkožního ložiska.
Patoložka v excizi z kožního ložiska popsala rozsáhlý granulomatózní zánět, zasahující do tukové tkáně, s četnými velkými mnohojadernými histiocyty, se septy místy fibrotizujícími, místy se znakem nekrobiózy, ale bez pěnitých buněk. Plazmocyty byly jen místy a byly dle barvení kappa a lambda řetězců polyklonální. Histologický závěr: nekrobiotický xantogranulom bez pěnitých buněk.
Tenkojehlová biopsie z jater nepřinesla diagnostický závěr. Ve FN Brno se zvažoval operační odběr vzorků z jater na histologii, ale chirurgové jej vyhodnotili jako extrémně rizikový a jeho provedení nedoporučili.
V listopadu 2020 se pacient i přes všechny tyto nálezy cítil stále zdráv, neměl pocit, že by byl svoji nemocí nějak omezován, jedinou novinkou byla přítomnost tlaku v pravém podžebří, když ležel v posteli, což dříve nemíval.
Třetí FDG-PET/CT vyšetření, jehož cílem bylo dokumentovat dynamiku procesu vzhledem ke zcela nejasnému vývoji, bylo provedeno v listopadu 2020. Toto vyšetření zjistilo, že akumulace v jugulární uzlině na krku vpravo se zvýšila, oproti předchozí hodnotě 3,73 SUVmax dosáhla hodnoty 7,72. V játrech se objevila nehomogenní struktura, byla patrna progrese hypodenzních ložisek a velké ložisko v segmentu S6 mělo nyní i centrální nekrózu. Průměr ložiska v S6 segmentu byl 5 cm, na předchozím vyšetření byl průměr jen 3,5 cm. Hepatosplenomegalie byla stacionární, pankreas a ledviny bez expanze. Na povrchu těla v kůži a podkoží byla nalezena vícečetná patologická ložiska ve shodě s PET zobrazením největší na proximálním předloktí, vpravo, laterálně na paži vpravo dále v polovině levé paže a další ložisko na DKK laterálně na pravém stehně a distální třetině pravého lýtka mediálně, všechna do průměru 1 cm. V PET obraze byla zřetelná splývající ložiska v játrech, největší v segmentu S6, toto ložisko bylo aktivní v povrchovém lemu a neaktivní centrálně (nejspíše nekrotizace).
Při porovnání s předchozím vyšetřením v květnu 2020 se míra akumulace FDG zvýšila v absolutních hodnotách SUVmax. Dále v játrech přibyly nehomogenity v rozložení farmaka, ale bez přesvědčivých ložisek. Povrchově v kůži a podkoží bylo popsáno 5 hypermetabolických ložisek, na proximálním předloktíSUVmax10,03, laterálně na paži vpravo SUVmax 20,64, v polovině levé paže SUVmax15,7, dorsálně na hrudníku SUVmax 4,48 a další ložiska na dolních končetinách. Tedy oproti květnu se zvětšila četnost kožních a podkožních ložisek a zvýšila se akumulace FDG v nich. Tato zřetelná progrese si vyžádala zahájení léčby. Překvapivě, i když byl patologický nález na FDG-PET/CT v játrech, bilirubin i jaterní enzymy byly v mezích normy. A taktéž cholesterol a triglyceridy byly v normě.
Vzhledem k etiologické vazbě mezi NXG a monoklonální gamapatií byla koncem listopadu 2020 zahájena léčba kombinací lenalidomidu, bortezomibu a dexametazonu. Bortezomib a dexametazon dostával klasicky 1x týdně a lenalidomid 25 mg vždy 21 dní s následující týdenní pauzou.
Čtvrtý cyklus byl ukončen v březnu 2021. Pátý cyklus měl být zahájen koncem března 2021, jenže i přes všechna preventivní opatření ochořel onemocněním covid-19 způsobeným virem SARS-CoV-2, který se do ČR dostal v rámci globální pandemie z Číny. Na kovidovém oddělení nemocnice Jihlava dostal remdesivir a rekonvalescentní plazmu. Po této léčbě se zlepšil, byl propuštěn a pokračoval v započaté léčbě. Vzhledem k dosažení kompletní remise mnohočetného myelomu byla po sedmi cyklech ukončena léčba bortezomibem a dále pokračuje jen dlouhodobá perorální léčba lenalidomidem a dexametazonem. Vývoj monoklonálního imunoglobulinu ilustruje graf 1.
Graph 1. Vývoj koncentrace monoklonálního imunoglobulinu; koncem listopadu 2020 zahájena léčba, které vedla k rychlému poklesu jeko koncentrace 
Kontrolní FDG-PET/CT bylo provedeno v únoru počátkem čtvrtého cyklu (měsíce) léčby. Při srovnání s vyšetřením z listopadu 2020 je vidět parciální regrese ložiska v játrech, prakticky úplná morfometabolická regrese minule aktivní jugulární uzliny a úplná morfometabolická regrese všech patologických infiltrátů kůže a podkoží. Tedy velmi rychlá léčebná odpověď, podobně jak rychlý byl pokles monoklonálního imunoglobulinu, jehož vývoj uvádí graf 1.
Diskuze
Předložený článek navazuje na předchozí publikace věnované této tematice (2–6). Jde o histiocytární onemocnění, které je ve většině případů diagnostikováno u pacientů s M-Ig, z čehož plyne, že M-Ig zde má něco společného s etiologií a patofyziologií vzniku NXG. Etiopatogenezi zkoumal Raphael Szalat a své výzkumy zveřejnil ve dvou publikacích. Dospěl k závěru, že příčinou je tvorba imunokomplexů a interakce mezi M-Ig a lipoproteiny, Ve svých publikacích uvádí jako důkaz etiopatogenetické souvislosti NXG a monoklonální gamapatie ústup NXG při potlačení tvorby M-Ig (7, 8).
Souvislost NXG a monoklonální gamapatií potvrzuje i naše pozorování, protože když M-Ig vymizel, tak vymizela současné i ložiska NXG. Podobný, poměrně rychlý ústup kožní patologie u pacienta po vymizení M-Ig po léčbě jsme pozorovali u jiné kožní patologie, související s M-Ig, u skleromyxedému. Vymizení M-Ig vedlo k vymizení skleromyxedému a recidiva gamapatie vedla k jeho obnovení. A stejně tak u pacientky s IgA-pemphigem a mnohočetným myelomem typu IgA vymizely kožní morfy po dosažení kompletní remise po léčbě a vrátily se v době recidivy. M-Ig může zřejmě dle zaměření své antigenní determinanty indukovat různá kožní, případně i jiná onemocnění.
Léčba NXG nemá vlastní pravidla charakteru léčebných doporučení, k dispozici je pouze několik přehledových prací, které vyšly v posledních pěti letech (1, 9–13). V poslední přehledové publikaci z roku 2020 je analyzováno celkem 235 pacientů s NXG z několika velkých nemocnic v USA (1).
Z těchto 235 pacientů mělo 193 (82,1 %) monoklonální imunoglobulin, nejčastější byl IgG-κ, a to u 117 z 235 pacientů (50,0 %), ale i ostatní typy M-Ig byly pozorovány. Není jasné, zda u případů bez monoklonálního imunoglobulinu byla prováděna imunoelektroforéza, protože tyto případy byly publikovány dermatology, kteří s monoklonálními gamapatiemi a jejich diagnostickými metodami nemají praxi.
Image 1. Rozsah nemoci před léčbou a po 4 měsících léčby 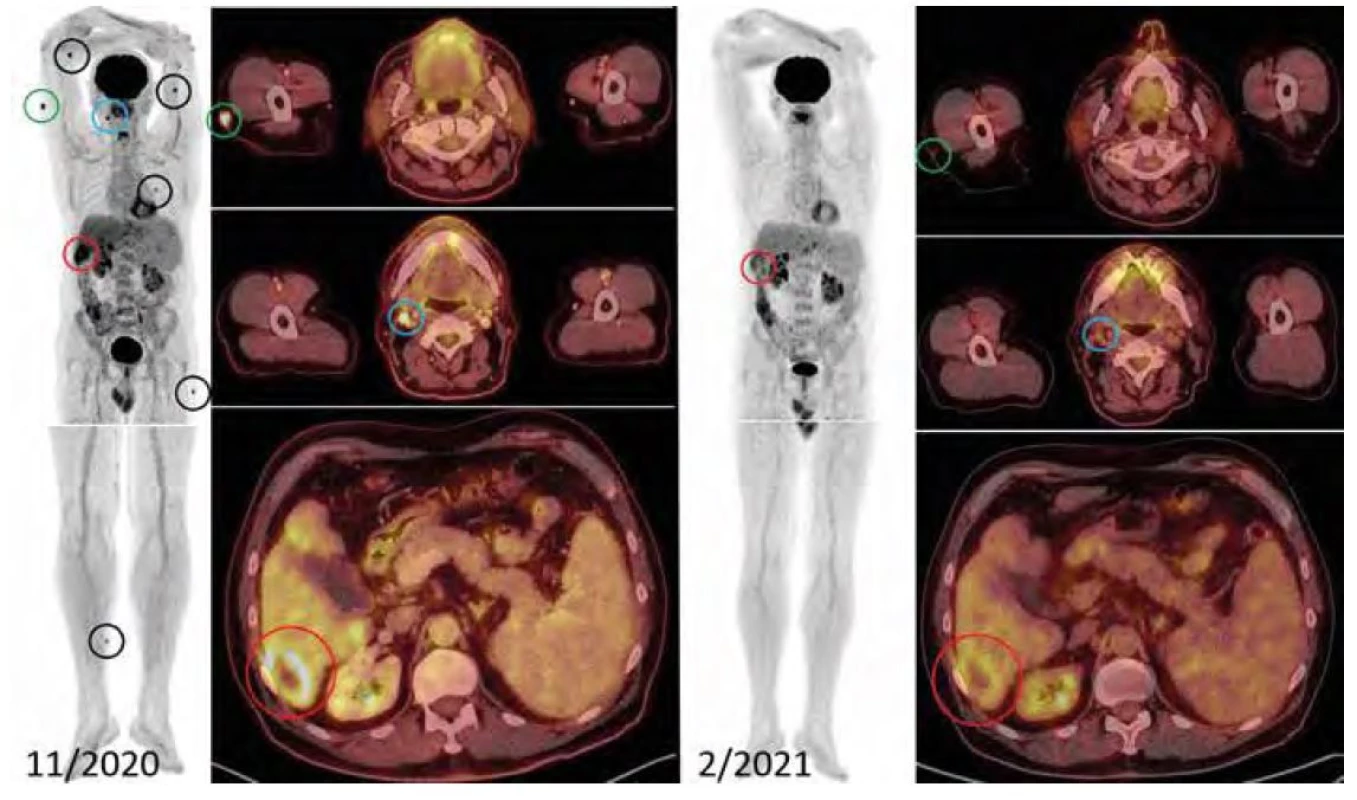
Z celého souboru 235 pacientů mělo 59 (25,1 %) maligní onemocnění typu mnohočetného myelomu. Solidní tumory byly vzácné a vždy byly provázeny přítomností M-Ig. U některých pacientů s NTX byl pozorován postupný vývoj MGUS do mnohočetného myelomu. Morfy nabývaly různých forem. Nejčastější byly NXG morfy periorbitálně (u 60 %), v další části obličeje (22,8 %), na trupu (53 %), na končetinách (56 %). Naopak mezi výjimečné lokalizace pak patřil mozek, gastrointestinální trakt, srdce, játra, plíce, svaly a příušní žláza (1).
V odborné literatuře za posledních 10 let jsme nalezli pouze 2 popisy lokalizace NTX v játrech (14, 15). Přehledová práce z roku 2020 cituje jen ty terapeutické postupy, které vedly k léčebné odpovědi alespoň u tří pacientů. Léčba pomocí intravenózních imunoglobulinů dosáhla léčebné odpovědi u 9 z 9 léčených osob, antimalarika u 4 z 5 pacientů (80 %), nitroložisková léčba triamcinolonem acetátem u 6 z 8 léčených (75 %), chirurgický zákrok u 3 ze 4 operovaných (75 %), chemoterapie u 8 z 12 léčených (67 %) a léky ze skupiny IMIDs lenalidomid a thalidomid u 5 z 8 léčených (63 %). V literatuře jsme nalezli ještě další publikace, popisující léčebný účinek léků ze skupiny IMIDs, a to jak léčbu starším thalidomidem, tak novějším lenalidomidem (16–20). Pomalidomid zatím čeká na otestování v této indikaci. O něco více případů bylo léčeno nitrožilními imunoglobuliny (21–27). Nelze ale říci, co je účinnější léčba. Domníváme se, že existuje analogie s léčbou skleromyxedému, neboť u obou těchto chorob (NXG a skleromyxedému) je možné léčbu cílit na klonální plazmatické buňky s nadějí, že při senzitivitě monoklonální gamapatie poklesne koncentrace M-Ig a tedy ustoupí projevy NXG anebo skleromyxedému, které monoklonální imunoglobulin zřejmě vyvolává. Záleží ale na senzitivitě plazmocelulární dyskrazie k léčbě, zda je tato léčba účinná či není. V případě, kdy nelze cílenou léčbou odstranit tvorbu M-Ig, pomáhá léčba pomocí nitrožilních imunoglobulinů (IVIGů). IVIGy narušují vazbu M-Ig na cílové struktury, které tuto nemoc spouští. V případě NXG tedy zřejmě vazbu M-Ig na lipoproteiny a tvorbu imunokomplexů (5–8). A proto i u nekrobiotického xantogranulomu lze léčbu cílit oběma směry. Schéma léčby, které publikoval Haber v roce 2020 pro skleromyxedému, je vlastně shodné s léčebných schématem nekrobiotického xantogranulomu, protože v obou případech je vyvolávajícím momentem reakce monoklonálního imunoglobulinu s některými tělu vlastními autoantigeny, viz graf 2 (28).
Graph 2. Léčebné schéma, které v roce 2020 publikoval Haber (28) na základě systematického přehledu literatury pro léčbu skleromyxedému je vlastně použitelné i pro léčbu NXG, protože v obou případech jsou změny způsobené reakcí monoklonálního imunoglobulinu s tělu vlastními autoantigeny, v jednom případně to způsobí skleromyxedém a v druhém nekrobiotický xantogranulom 
Náš případ dokumentuje, že léčba úspěšně potlačující tvorbu M-Ig je spojena s regresí morf NTX, jak dokumentuje FDG-PET/CT, které je vhodné pro sledování této nemoci (29–31).
Závěr
Na etiopatogenezi nekrobiotického xantogranulomu se podílí M-Ig vazbou na lipoproteiny a tvorbou imunokomplexů, případně dalšími zatím neznámými mechanismy. Námi popsaný případ dokumentuje s pomocí FDG-PET/CT zobrazení, že vymizení monoklonálního imunoglobulinu vede k ústupu ložisek nekrobiotického xantogranulomu. Obáváme se však, že případná recidiva myelomu bude spojena s recidivou xantogranulomu. Proto jsou oprávněné léčebné postupy zaměřené na potlačení tvorby monoklonálního imunoglobulinu. Nepodaří-li se potlačit tvorbu M-Ig, přicházejí do úvahy další v textu zmíněné léčebné postupy.
Vypracováno v rámci Institucionální podpory MOÚ:
MZ ČR – RVO (MOÚ, 00209805).
KORESPONDENČNÍ ADRESA AUTORA:
prof. MUDr. Zdeněk Adam, CSc.
Interní hematologická a onkologická klinika, LF MU a FN Brno, Jihlavská 20, 625 00 Brno
Cit. zkr: Vnitř Lék 2021; 67(6): 352–356
Článek přijat redakcí: 21. 4. 2021
Článek přijat po recenzích: 26. 8. 2021
Sources
1. Nelson CA, Zhong CS, Hashemi DA et al. A Multicenter Cross-Sectional Study and Systematic Review of Necrobiotic Xanthogranuloma With Proposed Diagnostic Criteria. JAMA Dermatol. 2020; 156(3): 270–279.
2. Král Z, Krejčí M, Kynclová J et al. Nekrobiotický xantogranulom asociovaný s monoklonální gamapatií: popis případu a přehled léčebných možností. Transfuze a hematologie dnes. 2020; 26(4): 310–319.
3. Zahradová L, Adam Z, Fait J et al. Nekrobiotický xantogranulom – vzácná kožní komplikace u nemocného s mnohočetným myelomem. Vnitřní lékařství. 2010; 56(suppl. 2): 2S179–2S182.
4. Sýkorová T. Histiocytózy z non-Langerhansových buněk. Klinická dermatovenerologie. první vydání. Praha: Mladá fronta. 2019. 2019 : 1027–1036.
5. Adam Z, Zahradová L,https://www.medvik.cz/bmc/refine.do?author=547627 Krejčí M. Difuzní plošná normolipemická xantomatóza a nekrobiotický xantogranulom, asociované s monoklonální gamapatií – přínos PET – CT pro stanovení rozsahu nemoci a zkušenosti s léčbou. Popis dvou případů a přehled literatury. Vnitřní lékařství. 2010; 56(11): 1158–1159.
6. Adam Z, Veselý K, Motyčková I et al. Oční víčka se žlutými granulomy a kašel – periokulární xantogranulom dospělých spojený s astmatem. Popis případu a přehled klinických forem juvenilního xantogranulomu a terapie Vnitřní lékařství. 2012; 58(5): 365–377.
7. Szalat R, Pirault J, Fermand JP et al. Physiopathology of necrobiotic xanthogranuloma with monoclonal gammopathy. J Intern Med. 2014; 276(3): 269–284.
8. Szalat R, Arnulf B, Karlin L et al. Pathogenesis and treatment of xanthomatosis associated with monoclonal gammopathy. Blood. 2011; 118(14): 3777–3784.
9. Miguel D, Lukacs J, Illing T et al. Treatment of necrobiotic xanthogranuloma – a systematic review. J Eur Acad Dermatol Venereol. 2017; 31(2): 221–235.
10. : Wick MR, Patterson JW. Cutaneous paraneoplastic syndromes. Semin Diagn Pathol. 2019; 36(4): 211–228.
11. Hilal T, DiCaudo DJ, Connolly SM et al. Necrobiotic xanthogranuloma: a 30-year single - -center experience. Ann Hematol.2018; 97(8): 1471–1479.
12. Khoschbin T, Löser C, Dippel E. Paraneoplastische Hauterkrankungen. Internist (Berl). 2019; 60(8): 775–782.
13. Weidenthaler-Barth B. Klinisches und histologisches Spektrum der Palisadengranulome: Granuloma anulare, Necrobiosis lipoidica, Rheumaknoten und nekrobiotisches Xanthogranulom Hautarzt. 2017; 68(7): 541s.
14. Nguyen BD. Hepatobiliary and Pancreatic: Hepatic necrobiotic xanthogranuloma. J Gastroenterol Hepatol 2017; 32(10): 1667. doi: 10.1111/jgh.13858.
15. Santosaputri E, Ellis EJ, Nagiah S et al. A multisystem granulomatous disease: necrobiotic xanthogranuloma with hepatic involvement. Med J Aust. 2014; 200(8): 490–4903.
16. Mello RB, Vale ECSD. Necrobiotic xanthogranuloma associated with smoldering multiple myeloma: satisfactory response to cyclophosphamide, dexamethasone, and thalidomide. An Bras Dermatol. 2019; 94(3): 337–340.
17. Efebera Y, Blanchard E, Allam C et al. Complete response to thalidomide and dexamethasone in a patient with necrobiotic xanthogranuloma associated with monoclonal gammopathy: a case report and review of the literature. Clin Lymphoma Myeloma Leuk. 2011; 11(3): 298–302.
18. Mahendran P, Wee J, Chong H et al. Necrobiotic xanthogranuloma treated with lenalidomide. Clin Exp Dermatol. 2018; 43(3): 345–347.
19. Dholaria BR, Cappel M, Roy V. Necrobiotic xanthogranuloma associated with monoclonal gammopathy: successful treatment with lenalidomide and dexamethasone. Ann Hematol. 2016; 95(4): 671–672.
20. Ghani S, Al Ustwani O, Khalid B et al. Periorbital necrobiotic xanthogranuloma treated successfully with novel multiple myeloma therapy. Clin Adv Hematol Oncol. 2013; 11(10): 678–680. PMID.
21. Olson RM, Harrison AR, Maltry A et al. Periorbital Necrobiotic Xanthogranuloma Successfully Treated with Intravenous Immunoglobulin. Case Rep Ophthalmol. 2018; 9(1): 70–75.
22. Goyal A, O'Leary D, Vercellotti G et al. Intravenous immunoglobulin for treatment of necrobiotic xanthogranuloma. Dermatol Ther. 2019; 32(1): e12744. doi: 10.1111/dth.12744.
23. Lukács J, Goetze S, Elsner P. Periocular Necrobiotic Xanthogranuloma Successfully Treated with Intravenous Immunoglobulin. Acta Derm Venereol.2017; 97(6): 754–755.
24. Rubinstein A, Wolf DJ, Granstein RD. Successful treatment of necrobiotic xanthogranuloma with intravenous immunoglobulin. J Cutan Med Surg. 2013; 17(5): 347–350.
25. Liszewski W, Wisniewski JD, Safah H et al. Treatment of refraktory necrobiotic xanthogranulomas with extracorporeal photopheresis and intravenous immunoglobulin. Dermatol Ther. 2014; 27(5): 268–271.
26. Nambudiri VE, McLaughlin C, Lo TC et al. Successful multimodality treatment of recalcitrant necrobiotic xanthogranuloma using electron beam radiation and intravenous immunoglobulin. Clin Exp Dermatol. 2016; 41(2): 179–182.
27. Pedrosa AF, Ferreira O, Calistru A et al. Necrobiotic xanthogranuloma with giant cell hepatitis, successfully treated with intravenous immunoglobulins. Dermatol Ther. 2015; 28(2): 68–70.
28. Haber R, Bachour, Gemayel ME. Scleromyxedema treatment: systemic reviewand update. Intern. J Dermatol 2020; 59(10): 1191–1201.
29. Eltilib M, Fenner J, Saramago I et al. Necrobiotic Xanthogranuloma on 18F-FDG PET/ CT. Clin Nucl Med.2020; 45(12): 967–969.
30. Hou J, Long T, Hu S. Application of F-FDG-PET/CT in necrobiotic xanthogranuloma involving multiple organs. Eur J Nucl Med Mol Imaging. 2021; 48(1): 321–322.
31. Koukalová R, Selingerová I, Řehák Z et al. FDG-PET/CT v diagnostice a hodnocení léčebné odpovědi Castlemanovy choroby – retrospektivní studie 29 případů z jednoho centra. Klin. Onkol. 2021; 34(2): 1–
8.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2021 Issue 6-
All articles in this issue
- HLAVNÍ TÉMA – PNEUMOLOGIE
- Respirační insuficience, chronická hyperkapnie a domácí neinvazivní ventilace z pohledu pneumologa
- Inhalační glukokortikoidy v terapii covidu-19
- Nintedanib v terapii intersticiálních plicních procesů u systémových onemocnění pojiva
- Metabolický syndrom u pacientů po prodělané protinádorové terapii
- Hereditární hemoragická teleangiektázie (syndrom Osler-Weber-Rendu) Díl I. Patofyziologie, klinické příznaky a doporučený skrínink cévních malformací
- Špičkové technologie v medicíně – vliv nastavení hodnot alarmů u systémů pro kontinuální monitoraci glykemie na metabolickou kompenzaci u diabetiků 1. typu: systematické review
- FDG-PET/CT dokumentované vymizení nekrobiotického xantogranulomu při potlačení tvorby monoklonálního imunoglobulinu bortezomibem, lenalidomidem a dexametazonem Popis případu a přehled literatury o léčbě nekrobiotického xantogranulomu
- Lokalizované formy plicní amyloidózy
- Screening gestačního diabetes mellitus
- Proč stále nedosahujeme cílových hodnot krevního tlaku
- Aktuální témata kardiovaskulární prevence
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Lokalizované formy plicní amyloidózy
- Respirační insuficience, chronická hyperkapnie a domácí neinvazivní ventilace z pohledu pneumologa
- Hereditární hemoragická teleangiektázie (syndrom Osler-Weber-Rendu) Díl I. Patofyziologie, klinické příznaky a doporučený skrínink cévních malformací
- Screening gestačního diabetes mellitus
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

