-
Medical journals
- Career
Metformin -asociovaná laktátová acidóza
Authors: Martina Lášticová; Jakub Víšek; Ondřej Zima; Alena Šmahelová; Vladimír Bláha
Authors‘ workplace: III. interní gerontometabolická klinika Fakultní nemocnice Hradec Králové
Published in: Vnitř Lék 2020; 66(7): 438-442
Category: Case Report
Overview
Laktátová acidóza je obávanou komplikací léčby metforminem. V článku předkládáme kazuistiku dvou pacientek léčených metforminem, u kterých se tato závažná komplikace vyskytla. V prvním případě došlo ke kumulaci laktátu v důsledku rozvoje akutního renálního selhání při průjmovém onemocnění a skončilo úmrtím pacientky. U další pacientky se rozvinula laktátová acidóza v terénu preexistujícího chronického onemocnění ledvin, kde dyspeptické potíže a nepříjem tekutin vedly k progresi do akutního renálního selhání. V tomto případě se laktátovou acidózu podařilo zvládnout s dobrým výsledkem. Důvodem úmrtí první pacientky byla zřejmě přítomnost závažných komorbidit již před vznikem metformin -asociované laktátové acidózy a další komplikující okolnosti vzniklé v časném průběhu hospitalizace. Prevencí laktátové acidózy je důsledné dodržování kontraindikací užívání metforminu a přerušení léčby v případě interkurentního onemocnění.
Klíčová slova:
diabetes mellitus 2. typu – laktátová acidóza – renální selhání
Úvod
Metformin je jedním z nejpoužívanějších antidiabetik v léčbě diabetes mellitus 2. typu. Může být podáván v monoterapii nebo v kombinaci s jinými antidiabetiky. K výhodám jeho použití patří nízké riziko hypoglykemie. Snižuje inzulinovou rezistenci, snižuje tvorbu glukózy v játrech a zvyšuje vychytávání glukózy v periferních tkáních (1).
Předpokládaný mechanismus účinku je suprese glukoneogeneze inzulinem, snížení glukagonem stimulované glukoneogeneze a zvýšené vychytávání glukózy svalem a tukovou tkání (1). Výsledkem je snížení lačné a postprandiální glykemie o 20–40 %, snížení glykovaného hemoglobinu, snížení LDL a zvýšení HDL (2). Po absorpci má metformin zanedbatelnou vazbu na sérové proteiny a eliminační poločas je v případě zachovalých renálních funkcí přibližně 5 hodin (3). Metformin se vylučuje aktivně, nemetabolizovaný, přes transportéry v proximálním tubulu ledvin, a v případě renálního selhání může dojít k jeho akumulaci (4).
Laktátová acidóza je nejzávažnějším nežádoucím účinkem léčby metforminem. V splanchnickém řečišti tenkého střeva podporuje metformin konverzi glukózy na laktát (5). Nejdůležitějším mechanismem, kterým metformin zvyšuje hladinu laktátu, je zřejmě inhibice mitochondriálního respiračního řetězce, která vede ke snížení jaterní glukoneogeneze z laktátu, pyruvátu a alaninu (6, Obr. 1). Ke klinicky signifikantní akumulaci laktátu dochází téměř vždy za přítomnosti komorbidit, jako je renální nebo jaterní insuficience, aktivní abúzus alkoholu, nestabilní akutní srdeční selhání, anamnéza laktátové acidózy při léčbě metforminem, snížení tkáňové perfuze nebo hemodynamická nestabilita, hypoxické stavy anebo vážné akutní onemocnění. Metformin -asociovaná laktátová acidóza (MALA) se vyskytuje vzácně (v literatuře se uvádí celková incidence ≤ 10 na 100 000 paciento - roků (7, 11), ale má vysokou mortalitu – podle různých zdrojů až téměř 50% (8, 9).
Image 1. Rozvoj metformin-asociované laktátové acidózy v terénu hypovolemie a akutního poškození ledvin (AKI). Zvýšené hladiny metforminu vedou k (A) inhibici enzymů glukoneogeneze, snížení konverze pyruvátu na glukózu a (B) inhibici mitochondriálního elektronového transportního mechanismu. Následkem je zvýšená konverze pyruvátu na laktát 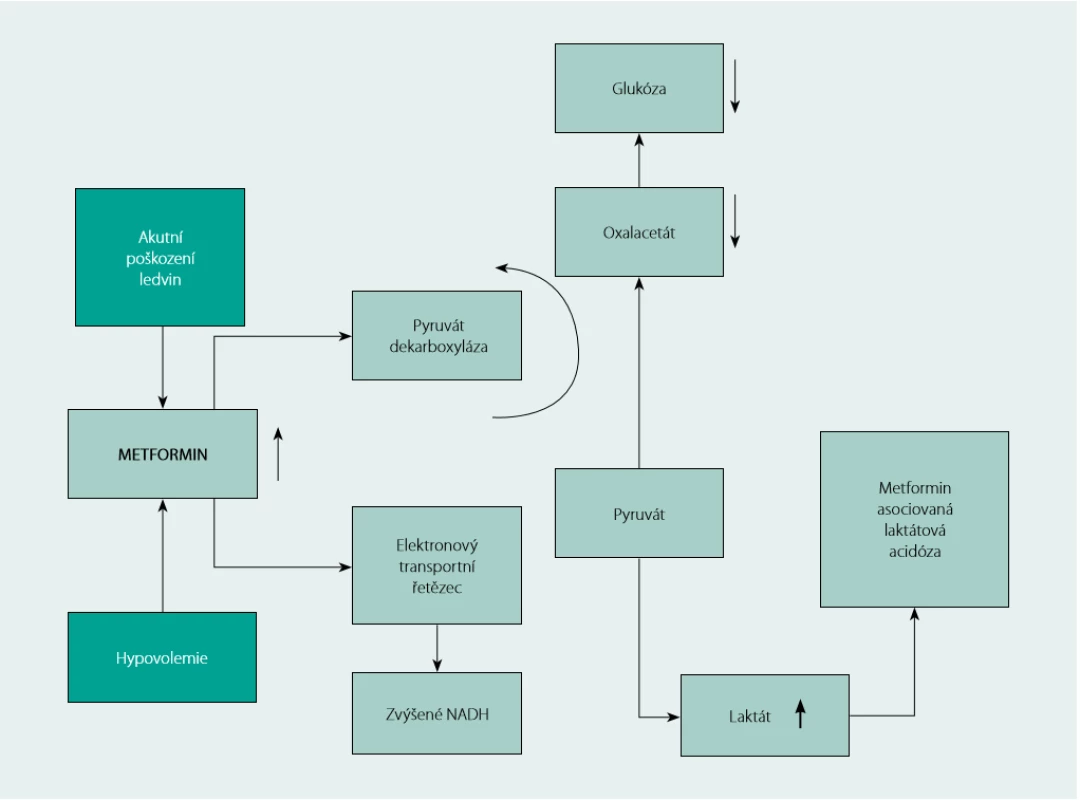
Nejčastějšími symptomy, s kterými pacient přichází, jsou gastrointestinální obtíže – nauzea, zvracení, průjem, porucha vědomí, dušnost, hypotenze. Při fyzikálním vyšetření může být v případě závažné laktátové acidózy přítomna tachykardie a tachypnoe. Laboratorní vyšetření při podezření na laktátovou acidózu by mělo zahrnovat vyšetření acidobaze, základní biochemii včetně renálních parametrů a hladinu sérového laktátu k potvrzení, že se jedná o laktátovou acidózu. Vyšetření koncentrace metforminu není nezbytné, hladina metforminu nekoreluje se závažností postižení ani s prognózou pacienta (8). Nedetekovatelný metformin ale vyloučí metformin jako příčinu laktátové acidózy. Na druhé straně, u pacienta užívajícího metformin je nutné myslet i na jinou příčinu laktátové acidózy, jako je sepse či střevní ischemie.
Léčba spočívá v zajištění oběhu podáním intravenózních tekutin a případně vazopresorů, a v případě potřeby i zajištění dýchacích cest. Pokud se jedná o akutní předávkování metforminem, je indikováno podávání aktivního uhlí. Při těžké metabolické acidóze (pH pod 7,1) je doporučeno podání bikarbonátu a extrakorporální eliminace pomocí hemodialýzy. Při hemodialýze by měl být použit bikarbonátový pufr ke korekci metabolické acidózy. Hemodialýza může být ukončena v případě, že dojde k poklesu laktátu pod 3,0 mmol/l a vzestupu pH nad 7,35 (4). K odstranění metforminu je účinnější konvenční hemodialýza než CVVH (kontinuální venovenózní hemofiltrace). CVVH by proto měla být zvažována jenom u pacientů, kteří v důsledku těžké hemodynamické nestability netolerují hemodialýzu (10).
Kazuistika 1
Do nemocnice byla přivezena 75letá žena pro týden trvající zvracení, s údajem o průjmovitém onemocnění, které ustoupilo po léčbě loperamidem. V osobní anamnéze má diabetes mellitus 2. typu, ischemickou chorobu srdeční s významným neřešitelným koronárním postižením, chronické srdeční selhání NYHA II, těžkou systolickou dysfunkci levé komory (ejekční frakce 20–25 %), středně významnou mitrální insuficienci, ischemickou chorobu dolních končetin, je po opakovaných intervencích na tepnách dolních končetin.
Při vstupním vyšetření byla dehydratována, somnolentní, jednoslovně komunikující. V chronické medikaci užívala levotyroxin, metformin 3 g denně, pantoprazol, kyselinu acetylsalicylovou, bisoprolol, furosemid, atorvastatin, trandolapril, gliklazid 90 mg denně, hydrochlorothiazid, betahistin. Při fyzikálním vyšetření byla nemocná hemodynamicky stabilní, vstupní hodnota krevního tlaku byla 161/77, pulz 84/min. Ve vstupním laboratorním vyšetření byla prokázána hypoglykemie 2,0 mmol/l, hyperkalemie 5,9 mmol/l a obraz renálního poškození (urea 27,8 mmol/l, kreatinin 763 μmol/l). Dále byla detekována výrazná elevace hladiny laktátu 14,8 mmol/l, a metabolická acidóza s pH 6,85, deficitem bazí 28 mmol/l, HCO3 – 5,2 mmol/l, aniontovou mezerou 43,7 mmol/l. Poslední známá hodnota kreatininu byla 1,5 roku stará – 78 µmol/l a aktuální nárůst byl pravděpodobně způsoben průjmem a následným zvracením (které ale také mohlo být až důsledkem acidózy). Nemocná měla dále leukocytózu 15,33 × 109/l, CRP 8,2 mg/l. Stav byl hodnocen jako těžká laktátová acidóza při metforminové toxicitě v terénu akutního renálního poškození při dehydrataci.
Po přijetí byla zahájena opatrná tekutinová léčba s ohledem na kardiální limitaci nemocné, a protrahovaná konvenční hemodialýza. Laboratorně byla potvrzena toxická vstupní hladina metforminu 9 500 ng/ml (terapeutické hladiny do 1 300 ng/ml) a jeho trendový pokles po hemodialýze (3975 ng/ml po 6 h od zahájení hemodialýzy, Graf 1). Rovněž hladina laktátu pozvolna klesala (Graf 2). Pro respirační insuficienci I. typu byla pacientka napojena na vysokoprůtokovou nasální oxygenoterapii, nicméně po několika hodinách pro další progresi respirační insuficience byla nemocná orotracheálně intubována a napojena na umělou plicní ventilaci. Současně došlo i k rozvoji oběhové nestability s nutností podpory oběhu noradrenalinem. V rámci diferenciální diagnostiky laktátové acidózy bylo doplněno nativní CT břicha, kde nález nesvědčil pro střevní ischemii (i fyzikální vyšetření bylo s klidným nálezem na břiše). Příčina respirační insuficience byla kombinovaná – komunitní pneumonie (na rtg plic byl obraz bilaterálních plicních infiltrátů) a srdeční selhání při tekutinové léčbě (výrazná elevace NT - proBNP). Proto byla zahájena empirická antibiotická terapie (cefotaxim + clarithromycin) a zastaveno podávání tekutin.
Graph 1. Hladina metforminu v čase – kazuistika 1 
Graph 2. Hladina laktátu v čase (čas v hodinách od přijetí) – kazuistika 1 
Následující den bylo pokračováno v konvenční hemodialýze. Progredovala ale oběhová nestabilita s nutností podávání kombinované vasopresorické podpory – noradrenalin, argipresin a dobutamin. Progredovaly známky zánětu, došlo k rozvoji koagulopatie a hepatopatie při v.s. hypoxickém postižení jater. Antibiotická terapie byla eskalována (cefotaxim nahrazen meropenemem) a pro progresi šokového stavu s výraznou oběhovou nestabilitou byla konvenční hemodialýza konvertována na CVVH s citrátovou antikoagulací.
Třetí den hospitalizace došlo k přechodnému zlepšení oběhu a ventilace, objevily se ale běhy širokokomplexové tachykardie, hemodynamicky významné, proto bylo zahájeno podávání amiodaronu. Bylo pomýšleno na možnost probíhajícího sekundárního koronárního syndromu v kritickém šokovém stavu při difuzním neřešitelném postižení koronárních tepen, známém již z minulosti, a stav byl hodnocen jako kombinace septického a kardiogenního šoku v terénu těžké metforminem indukované laktátové acidózy. I přes uvedenou léčbu progredoval šok do refrakterní fáze a ve 4. den hospitalizace došlo k zástavě oběhu a úmrtí pacientky.
Kazuistika 2
80letá žena, taktéž s diabetes mellitus 2. typu, anamnézou paroxysmální fibrilace síní, arteriální hypertenze a hyperurikemie, byla vyšetřena ambulantně na pohotovosti 5 dní před přijetím do nemocnice pro bolest v levém podbřišku. Stav byl hodnocen jako akutní divertikulitida (na UZ vyšetření byly patrné četné divertikly) a k léčbě dostala metronidazol a ciprofloxacin. V chronické medikaci užívala linagliptin 5 mg denně, metformin 2000 mg denně, glimepirid 3 mg denně, rivaroxaban, trandolapril, hydrochlorothiazid, amilorid, verapamil, alopurinol a monoxidin.
Za 2 dny přišla na kontrolu do chirurgické ambulance, kde si stěžovala na trvající bolesti v levém podbřišku, bez teplot, bez zvracení. Při fyzikálním vyšetřením jevila známky hypohydratace, ale byla dobře spolupracující, bez celkové alterace stavu, břicho bylo měkké, palpačně citlivé v levém dolním kvadrantu, bez vyjádřených známek peritoneálního dráždění, se zachovalou peristaltikou. Při laboratorním vyšetření byla přítomna mírná hyperkalemie 5,6 mmol/l a elevace dusíkatých látek – urea 15,9 mmol/l, kreatinin 254 μmol/l (poslední známá hodnota kreatininu asi 9 měsíců stará, 130 µmol/l, odhadovaná glomerulární filtrace eGFR 0,56 ml/s), středně zvýšené CRP 35,6, bez leukocytózy. V krevním obraze byla přítomna normocytární anémie (hemoglobin 94 g/l, hematokrit 0,28, střední objem erytrocytu 87,4 fl). Na UZ byly popisovány divertikly colon sigmoideum, bez přítomnosti volné tekutiny. Pacientce byla podána analgetika a infuzní hydratace; metronidazol a ciprofloxacin byl vysazen, doporučena analgetika a zvýšený příjem tekutin a opět byla propuštěna domů s plánem ambulantní kontroly za 3 dny.
Při další kontrole již byla bez bolestí břicha, ale uváděla slabost, manželem inzerovány i stavy zmatenosti a nízký příjem tekutin. Při fyzikálním vyšetření byla pacientka hemodynamicky stabilní, TK 114/89, pulz 94/min, ale byla dušná, dehydratována. V laboratoři byla progrese hyperkalemie na 6,8 mmol/l a další progrese azotemie – urea 22,7 mmol/l, kreatinin 817 μmol/l. Dušnost byla hodnocena jako metabolická, při suspektní metabolické acidóze při renálním selhání a s tímto nálezem byla přijata na jednotku intenzivní péče, kde bylo doplněno vyšetření acidobaze – pH 6,98, HCO3 – 6,8 mmol/l, deficit bazí 24,3 mmol/l, aniontová mezera 34 mmol/l a hyperlaktatemie 9,6 mmol/l. Současně vyšetřena hladina metforminu – 9472 ng/ml. Byla zahájena parenterální hydratace a nemocná byla napojena na konvenční hemodialýzu.
V průběhu několika hodin došlo k obnovení diurézy a postupně k rozvoji polyurické fáze akutního renálního selhání s nutností infuzního hrazení tekutinových ztrát. Hladina metforminu po 12 hodinách hemodialýzy klesla na 3650 ng/l /(Graf 3). Druhý den hospitalizace bylo možné ukončit konvenční hemodialýzu (pH 7,44, laktát v průběhu 2. dne klesal postupně na 5,3…3,6…1,4 mmol/l, Graf 4). Přechodně byla podávána parenterální nutrice, ale postupně byl obnoven perorální příjem a glykemie byly korigovány intenzifikovaným inzulinovým režimem. Do terapie byla navrácena antihypertenzní medikace.
Graph 3. Hladina metforminu v čase – kazuistika 2 
Graph 4. Hladina laktátu v čase (čas v hodinách od přijetí) – kazuistika 2 
Hospitalizace pak pokračovala na standardním oddělení, kde při došetřování příčiny normocytární anémie byl zjištěn deficit kyseliny listové, vitaminu B12 a sideropenie. Při endoskopickém vyšetření gastrointestinálního traktu byla zjištěna hiátová hernie, atrofická gastritida a klidné divertikly colon descendens a colon sigmoideum. Zahájili jsme substituci vitaminu B12 a kyseliny listové. Parametry renálních funkcí se dostaly na hodnoty v předchorobí – kreatinin se pohyboval v rozmezí 105–127 µmol/l, eGFR 0,57–0,7 ml/s.
Za hospitalizace byl dále na EKG zaznamenán náhodný asymptomatický nález nespecifických repolarizačních změn anterolaterálně s elevací troponinu. Na echokardiografii pak detekována těžká hypokineze hrotu a apikální třetiny anterolaterální části levé komory a systolická dysfunkce levé komory s ejekční frakcí 40 %. Doplněna diagnostická koronarografie s nálezem 90% stenózy ramus diagonalis, 60% stenózy ramus ventricularis anterior 2 a 80% ramus marginalis sinister. Kardiologem byl doporučen konzervativní postup – do medikace byla přidána kyselina acetylsalicylová a statin. Před provedením koronarografie byla podána parenterální hydratace pro obavu z ovlivnění renálních funkcí při podání kontrastní látky. Při laboratorní kontrole zůstaly hodnoty kreatininu stacionární. Nemocná byla následně propuštěna domů mobilní, na konvenčním inzulinovém režimu s premixovaným inzulinovým analogem ve 2 denních dávkách.
Diskuze
Obavy z laktátové acidózy při léčbě biguanidů oddálily uvedení metforminu na trh v USA až do roku 1995. Tehdy na základě rozsáhlých studií a metaanalýzy Salpetera a kol. zahrnující více než 70 000 pacientů byl zaznamenán nižší výskyt laktátové acidózy u diabetiků léčených metforminem než u těch, kteří metformin neužívali, a to zejména tehdy, pokud měli normální renální funkce (11, 12).
Zkušenosti v reálném světě jsou ale jiné. K rozvoji metformin-asociované laktátové acidózy dochází v situacích, kdy dehydratace, zvracení nebo průjem, operační výkon atd. způsobí akutní poškození ledvin. Vulnerabilní jsou zejména starší pacienti se sníženou glomerulární filtrací (13). K akutnímu renálnímu selhání a snížení clearance metforminu může dojít tehdy, pokud je metformin nadále podáván. Podezření na rozvoj laktátové acidózy související s toxicitou metforminu by mělo být vysloveno v případě, že pacient splňuje tato kritéria: 1) anamnézu podávání metforminu; 2) významně zvýšenou hladinu laktátu v krvi; 3) těžkou acidózu s velkou aniontovou mezerou; 4) velmi nízkou sérovou hladinu bikarbonátu; 5) anamnézu renální insuficience.
Komorbidity mohou ovlivnit přežití pacientů, ale v některých studiích nebyla tato souvislost prokázána. MALA může být fatální nezávisle na komorbiditách, a existuje málo informací, které by predikovaly vývoj stavu (14).
Mnohým případům je možné zabránit přerušením podávání metforminu při výskytu predisponujících stavů, anebo volumové depleci, která sníží GFR a zvýší hladiny laktátu. V naprosté většině případů, kdy se v klinické praxi vyskytne laktátová acidóza, je metformin užíván i za těchto okolností. K snížení jejich výskytu by přispělo větší povědomí pacientů, ale také předepisujících lékařů a farmaceutů o tom, kdy je nutné léčbu metforminem přerušit. Obě naše pacientky pokračovaly v užívání metforminu v průběhu akutního onemocnění a přerušení léčby mohlo v obou případech předejít vzniku této komplikace. V případě druhé pacientky mohla být léčba metforminem přerušena lékařem pohotovosti.
Metformin může být podáván i u pacientů s renální insuficiencí; kontraindikován je při poklesu eGFR pod 0,5 ml/s/1,73 m2. Při poklesu eGFR pod 1,0 ml/s není vhodné zahajovat léčbu metforminem, a pokud je pacient metforminem léčen, má být dávka snížena na polovinu. Předepisující lékař musí znát renální funkce pacienta a kontrolovat je alespoň jednou ročně a při eGFR pod 1,0 ml/s nejméně 4× za rok. Další kontraindikace léčby metforminem jsou jaterní insuficience, aktivní abúzus alkoholu, nestabilní akutní srdeční selhání, anamnéza laktátové acidózy při léčbě metforminem, snížení tkáňové perfuze nebo hemodynamická nestabilita, hypoxické stavy anebo vážné akutní onemocnění.
Závěr
V obou případech námi prezentovaných kazuistik nebyla zjištěna jiná příčina těžké laktátové acidózy než metformin. U obou pacientek došlo k rozvoji laktátové acidózy v důsledku dehydratace, která
vedla k rozvoji akutního renálního selhání. Vzhledem k tomu, že jde o komplikaci spojenou s vysokou mortalitou, je zásadní prevence. Ta spočívá zejména v znalosti kontraindikací a rizikových faktorů užívání metforminu.KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Martina Lášticová,
III. interní gerontometabolická klinika,
Fakultní nemocnice Hradec Králové,
Sokolská 581,
500 05 Hradec Králové
Cit. zkr: Vnitř Lék 2020; 66(7): 438–442 Článek přijat redakcí: 24. 1. 2020 Článek přijat po recenzích k publikaci: 17. 9. 2020
Sources
1. Bailey CJ, Turner RC. Metformin. N Engl J Med 1996; 334–574.
2. Howlett HC, Bailey CJ. A risk - benefit assessment of metformin in type 2 diabetes mellitus. Drug Saf 1999; 20 : 489.
3. Graham GG, Punt J, Arora M, et al. Clinical Pharmacokinetics of metformin. Clin Pharmacokinet 2011; 50 : 81.
4. Duong JK, Furlong TJ, Roberts DM, et al. The Role of Metformin in Metformin -Associated Lactic Acidosis (MALA): Case Series and Formulation of a Model of Pathogenesis. Drug Saf 2013; 36 : 733.
5. Bailey CJ, Wilcock C, Day C. Effect of metformin on glucose metabolism in the splanchnic bed. Br J Pharmacol 1992; 105 : 1009.
6. Vecchio S, Giampreti A, Petrolini VM, et al. Metformin accumulation: lactic acidosis and high plasmatic metformin levels in a retrospective case series of 66 patients on chronic therapy. Clin Toxicol (Phila) 2014; 52 : 129
7. DeFronzo R, Fleming GA, Chen K, et al. Metformin - associated lactic acidosis: current perspectives on causes and risk. Metabolism 2016; 65(2): 20–29.
8. Lalau JD, Race JM. Lactic acidosis in metformin - treated patients. Prognostic value of arterial lactate levels and plasma metformin concentrations. Drug Saf 1999; 20 : 377.
9. Seidowsky A, Nseir S, Houdret N, Fourrier F. Metformin -associated lactic acidosis: a prognostic and therapeutic study. Crit Care Med 2009; 37 : 2191.
10. Lalau JD, Andrejak M, Morinière P, et al. Hemodialysis in the treatment of lactic acidosis in diabetics treated by metformin: a study of metformin elimination. Int J Clin Pharmacol Ther Toxicol 1989; 27 : 285.
11. Van Berlo - van de Laar IR, Vermeij CG, Doorenbos CJ. Metformin associated lactic acidosis: incidence and clinical correlation with metformin serum concentration meassurements. J Clin Pharm Ther. 2011;36(3): 376–382.
12. Salpeter SR, Greyber E, Pasternak GA, et al. Risk of fatal and nonfatal lactic acidosis with metformin use in type 2 diabetes mellitus. Cochrane Database Syst. Rev. 2010;1: CD002967.
13. Lalau JD, Race JM. Lactic acidosis in metformin therapy: searching for a link with metformin in reports of „metformin - associated lactic acidosis“. Diabetes Obes Metab 2001; 3 : 195–201.
14. Lalau JD Arnouts P, Sharif A, et. al. Metformin and other antidiabetic agents in renal failure patients. Kidney Int. 2015; 87(2): 308–322.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2020 Issue 7-
All articles in this issue
- Coagulopathy associated with COVID-19
- Current diagnosis and therapy in sarcoidosis
- Obstructive sleep apnea and hypertension: the role of gut microbiome
- CAR T-cells: hot news in cancer therapy
- Renal failure in multiple myeloma and its treatment
- Bone Metabolism in Inflammatory Bowel Diseases 2
- Metformin -associated lactic acidosis
- Tangier disease in family with the phenotype of familial hypercholesterolemia
- Hypoglycemia in non -diabetic patients
- Screening and brief intervention in illicit drug users
- Bone metabolism in inflammatory bowel diseases 1
- Ethical connotations of the treatment of COVID-19 disease
- Biomarkers for non-endoscopic examination of esophageal mucosa
- Risk of cardiovascular complications related to blood glucose concentration: from diabetes to prediabetes
- ERCP in patients after choledochodenoanastomosis
- Rationed nursing care as one of the indicators of the occurrence of medication errors
- A rare coincidence of a chylothorax and a hydrothorax caused by gastric adenocarcinoma – a case report
- A man with dysthymia (with negative evaluation of allmost all through his live) induced depression in his sensitive spouse
- Small bowel adenocarcinoma diagnosed by video capsule endoscopy in a patient with celiac disease: a case report and review of literature
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hypoglycemia in non -diabetic patients
- Metformin -associated lactic acidosis
- Coagulopathy associated with COVID-19
- CAR T-cells: hot news in cancer therapy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

