-
Medical journals
- Career
Koagulopatie asociovaná s onemocněním COVID-19
Authors: Simona Bílková; Jana Hirmerová
Authors‘ workplace: II. interní klinika LF UK a FN Plzeň
Published in: Vnitř Lék 2020; 66(7): 402-408
Category:
Overview
Infekce novým typem koronaviru překvapila rozmanitostí svých klinických příznaků. Onemocnění může probíhat zcela asymptomaticky, mohou být přítomny pouze mírné symptomy v podobě ztráty čichu, celkové slabosti, či příznaky podobné chřipkovému onemocnění. U některých pacientů může mít ale infekce COVID-19 vážný průběh, u kterého je běžným nálezem stav hyperkoagulace s poškozením endotelu cév a následným rizikem vzniku žilních i arteriálních trombotických komplikací. Koagulopatie následně výrazně zhoršuje prognózu nemocných a zvyšuje celkovou mortalitu. V poslední době se zavedl nový termín označující přítomnost aktivované hemostázy při infekci SARS - CoV-2 – koagulopatie asociovaná s onemocněním COVID-19 (CAC). Nynější celosvětová pandemie onemocnění COVID-19 spustila intenzivní výzkum tohoto onemocnění, který objasnil řadu poznatků o této infekci, nicméně i nadále máme mnoho nezodpovězených otázek, především co se týká případné léčby.
Klíčová slova:
COVID-19 – D -dimery – Heparin – imuno-trombóza – koagulopatie
Úvod
Nový typ koronaviru s označením SARS - CoV-2 byl objeven na konci roku 2019. Jeho genom kóduje celkem 25 proteinů, které tento virus potřebuje pro infekci lidského organismu a pro svoji následnou replikaci. Virus vstupuje do lidských buněk pomocí receptoru pro angiotenzin-konvertující enzym 2 (ACE2 receptor). Tento enzym se nachází na řadě míst lidského organismu, například v oblasti vaskulárního endotelu, respiračního epitelu, v alveolárních monocytech, makrofázích, v oblasti srdce, ledvin a v neposlední řadě i v gastrointestinálním systému. Právě tato rozmanitá přítomnost ACE2 receptoru v lidském organismu podmiňuje pestrost klinických příznaků onemocnění COVID-19.
Koronavirus se naváže na ACE2-receptor pomocí svých spike-proteinů, které tvoří jakousi korónu viru. Zásadní pro následnou replikaci viru uvnitř hostitelské buňky je tzv. Main -proteáza viru.
Virus po vstupu do lidského organismu může vyvolat mírné symptomy, jako jsou únava a celková slabost, středně těžké projevy infekce, jako jsou symptomy podobné chřipkovému onemocnění s horečkami, s přítomností kašle, svalovými bolestmi. V případě těžkého průběhu tohoto onemocnění dochází u nemocných k infiltraci plic a v nejtěžším případě až ke vzniku akutního respiračního selhání s rozvojem sepse a koagulopatie. U závažného průběhu infekce COVID-19 hrozí tedy riziko rozvoje tromboembolických komplikací. V některých případech byly u pacientů zaznamenány také atypické symptomy, jako je ztráta čichu, chuti, gastrointestinální symptomy. Dalším poměrně častým laboratorním nálezem je lymfopenie, jejíž závažnost může sloužit i jako prognostický faktor. Byly zaznamenány také poměrně výrazné trombocytopenie, které vídáme u nemocných s těžkým průběhem infekce.
Je všeobecně známo, že v průběhu řady infekcí dochází k rozvoji zánětlivé odpovědi s elevací zánětlivých parametrů a k nastartování koagulace. Jako ukazatelé probíhajícího infektu slouží především reaktanty akutní fáze, například C - reaktivní protein (CRP), fibrinogen, interleukin 6 (IL-6), interleukin 1β a prokalcitonin. Dále je vhodné sledování ferritinu, jehož zvýšená hladina byla zaznamenána u pacientů s těžkým průběhem infekce COVID-19 a může sloužit jako prediktor úmrtí.
Přítomnost hyperkoagulačního stavu odráží vzestup degradačních produktů fibrinu (FDP), včetně D - dimerů, tedy degradačních produktů zesíťovaného fibrinu. Je tomu tak i v případě infekce COVID-19, kdy laboratorní sledování D - dimerů se ukázalo jako efektivní prediktor závažnosti stavu nemocných.
Tromboembolické komplikace
Žilní tromboembolická nemoc (TEN) při infekci COVID-19 je přítomna u čtvrtiny až třetiny hospitalizovaných osob, s výraznou převahou plicní embolie (PE). Tromboembolické příhody v tepenném řečišti (kam patří infarkt myokardu – IM, ischemické cévní mozkové příhody – CMP, systémové embolizace či trombózy periferních tepen) se objevují u nemocných s těžším průběhem také, avšak ve výrazně menším počtu (1). První zmínky o trombotických komplikacích referovali lékaři přímo z Wu - chanu. Jimi provedená studie prokázala vysoký výskyt TEN u nemocných s pneumonií způsobenou infekcí COVID-19 hospitalizovaných na jednotce intenzivní péče (JIP), a to 25 %, resp. 20 z 81 pacientů, 8 z nich zemřelo. Ukazatelem vysokého rizika TEN byl výrazný vzestup D -dimeru (2). Nizozemští autoři hodnotili výskyt žilních i tepenných tromboembolických příhod v souboru 184 pacientů hospitalizovaných na JIP s pneumonií způsobenou COVID-19, a to během hospitalizace i při následném sledování (follow - up) po 7–14 dnů. Z tohoto souboru 22 % nemocných zemřelo. Výskyt tromboembolických komplikací byl vysoký (49 %) a jejich nezávislými prediktory byl věk a koagulopatie, definovaná spontánním prodloužením protrombinového času (PT) o více než 3 sekundy nebo aktivovaného parciálního tromboplastinového času (APTT) o více než 5 sekund. Nejčastějším typem tromboembolických komplikací byla PE (87 %). CMP utrpělo 6,6 %, hlubokou žilní trombózu (HŽT) 4 %, trombózu periferních tepen 2,6 % pacientů. Pacienti s tromboembolickou příhodu měli více než pětinásobně zvýšené riziko úmrtí (3, 4).
Na vzniku tromboembolických komplikací při onemocnění COVID-19 se podílí rozvoj zánětu s následným uvolněním řady zánětlivých mediátorů, přičemž některé z nich vykazují zároveň prokoagulační účinky. Dále dochází k aktivaci trombocytů a v neposlední řadě také vlivem virové infekce k přímému poškození cévního endotelu. Jako další faktory, které hrají roli při vzniku trombotických komplikací, jsou možné invazivní cévní přístupy u těžce nemocných spolu se stagnujícím krevním tokem při dlouhodobém pobytu na lůžku (převážně u pacientů dlouhodobě hospitalizovaných s těžkým průběhem onemocnění).
Arteriální tromboembolické příhody (CMP, IM, akutní končetinová ischemie, event. další projevy) jsou referovány ve sledovaných souborech výrazně méně často než žilní, případně jsou publikovány jen formou kazuistik (5). Za vznik těchto onemocnění je pravděpodobně nejvíce zodpovědné poškození cévního endotelu a hlubších vrstev stěny tepny. Spekuluje se také o možné asociaci arteriálních příhod s antifosfolipidovými protilátkami (6).
Z dosavadních údajů víme, že pacienti, u kterých se vyskytnou trombotické komplikace, ať už žilní nebo arteriální, mají horší prognózu onemocnění. Je třeba ale znovu zdůraznit, že tyto komplikace se vyskytují hlavně u nemocných se závažným průběhem onemocnění COVID-19, nikoliv u nemocných s lehkým průběhem onemocnění léčených v ambulantním režimu. Vzhledem k tomu, že u pacientů se zjištěnou koagulopatií je vyšší riziko tromboembolických komplikací i vyšší mortalita, odborné společnosti doporučují tromboprofylaxi u všech hospitalizovaných pacientů, a to podáváním nízkomolekulárních heparinů (LMWH), eventuálně nefrakcionovaného heparinu (v případě kontraindikace pak alespoň mechanickou tromboprofylaxi) (7).
Jak uvedeno výše, z tromboembolických komplikací byla nejčastějším nálezem PE. Často se jedná o embolii in situ, jelikož trombus může vzniknout přímo v plicích, nikoliv v periferních žilách dolních končetin s následnou embolizací do plic, jak je to běžné ve většině případů klasické plicní embolizace.
Koagulopatie asociovaná s těžkým průběhem onemocněním COVID-19 (CAC) a patofyziologický mechanismus jejího vzniku
V jedné z prvních zpráv o souvislosti koagulopatie s prognózou nemocných porovnávali čínští autoři koagulační parametry u 183 pacientů s koronarovirovou pneumonií. Mortalita v souboru byla 11,5 %. Bylo zjištěno, že u 71 % zemřelých pacientů byly přítomné známky diseminované intravaskulární koagulace (DIC) oproti 0,6 % přeživších (8).
Vznik tromboembolických komplikací u infekce COVID-19 je komplexní proces, na kterém se podílí kombinace řady faktorů.
V průběhu infekce dochází ke spuštění systémové zánětlivé odpovědi organismu (SIRS), která má za následek nerovnováhu mezi přirozenými systémy antikoagulace a prokoagulačními faktory.
Dochází k tzv. „cytokinové bouři‘‘. Virem indukovaná cytokinová aktivita spouští koagulační kaskádu pomocí prozánětlivých mediátorů, jako jsou IL-6 a IL1β. Následuje zvýšená exprese tkáňového faktoru s aktivací vnější koagulační kaskády. Mluvíme o takzvaném modelu imuno - trombózy.
Rozpoznáním antigenů viru dochází k aktivaci krevních destiček, které následně interagují s leukocyty ve snaze odstranit patogen.
Dále při infekci COVID-19 dochází k přímému poškození endotelu cév a k endoteliální dysfunkci. Endoteliální dysfunkce je podpořena také sníženou regulací trombomodulinu (který za normálních okolností svojí vazbou na trombin snižuje jeho koagulační aktivitu) a zvýšenou expresí vaskulárních buněčných adhezivních molekul (vascular cells adhesion molecules, VCAMs). Dalším významným faktorem rozvoje koagulopatie asociované s onemocněním COVID-19 je utlumení fibrinolýzy díky zvýšené aktivaci inhibitoru aktivátoru plazminogenu 1 (PAI1). Následná kumulace trombinu zvyšuje nejen riziko vzniku trombu, ale dochází díky ní i k akceleraci zánětlivé odpovědi. Epicentrem poškození při infekci koronavirem jsou plíce. Virus zde způsobuje přímé poškození alveolárního epitelu i endotelu. V přítomnosti viru v plicním parenchymu dochází k aktivaci makrofágů, apoptóze neutrofilů a lymfocytů, což má za následek generalizovanou vaskulitidu malých cév s mikro - trombotizací. Virus také indukuje vaskulární endoteliální poškození aktivací komplementu, následuje zvýšení permeability plicních kapilár s tvorbou zánětlivého trombu. Tento mechanismus je pravděpodobně příčinou vzniku plicní embolie in situ.
Mezi laboratorní ukazatele hyperkoagulačního stavu u infekce COVID-19 patří vzestup koncentrace von Willebrandova faktoru, vzestup faktoru VIII, zvýšená hladina fibrinogenu, aktivace tkáňového faktoru.
Koagulopatie asociovaná s onemocněním COVID-19 (CAC) má určité odlišné rysy od DIC či její iniciální fáze, tzv. sepsí indukované koagulopatie – SIC (skórovací systémy DIC a SIC hodnotí počet trombocytů, hodnotu FDP či D - dimerů, hladinu fibrinogenu, PT a orgánovou dysfunkci – blíže viz tabulka 1) (9). U CAC se neobjevují typické krvácivé komplikace, které vídáme u dekompenzovaného průběhu DIC, nýbrž komplikace trombotického charakteru. Oproti klasickému syndromu DIC jsou přítomné i laboratorní odlišnosti v podobě vysoké koncentrace koagulačního faktoru VIII a zvýšené hladiny fibrinogenu. Dále zde není přítomna tak výrazná trombocytopenie, jak tomu bývá v případě DIC.
Table 1. SIC a DIC – definice (9) 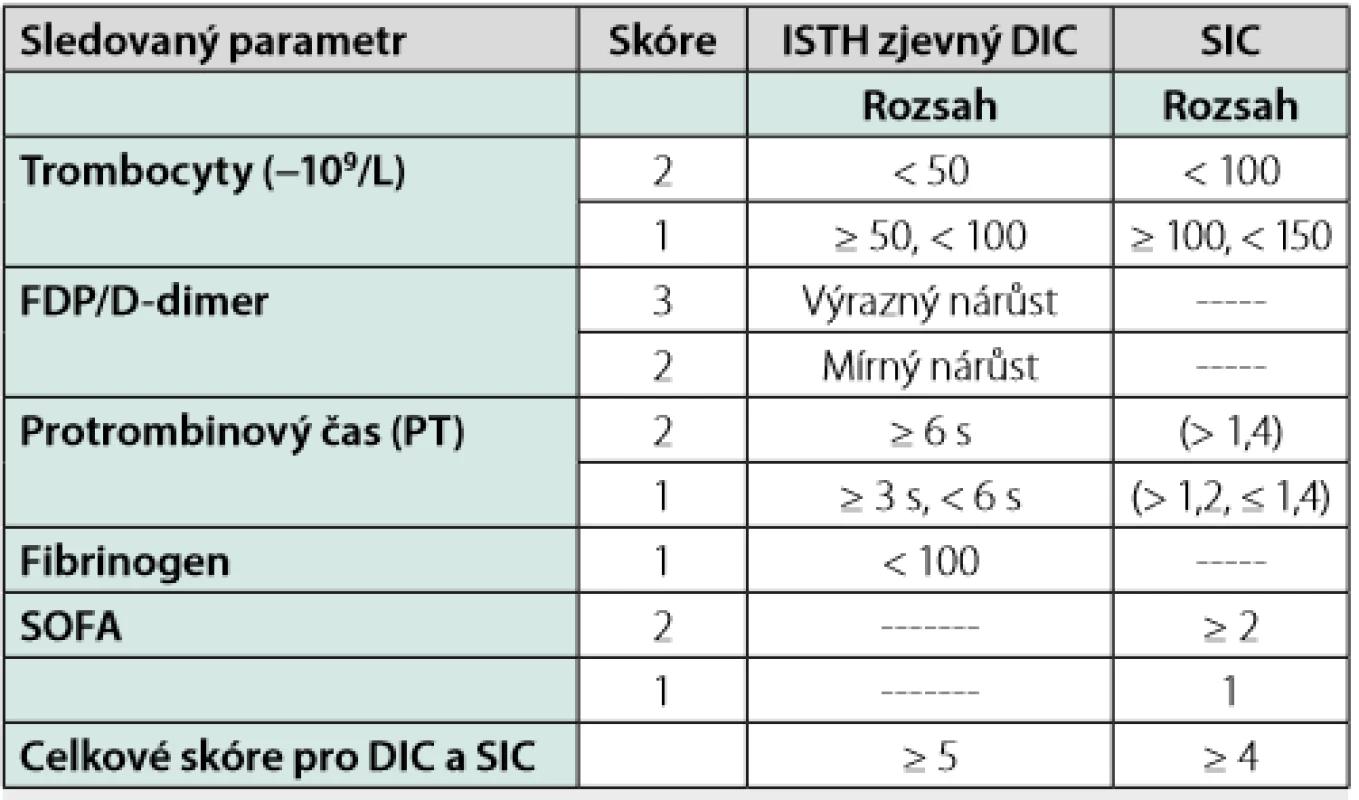
ISTH, Mezinárodní společnost pro trombózu a hemostázu; DIC, diseminová intravaskulární koagulace, SIC, sepsí indukovaná koagulopatie; SOFA skóre – “sequential organ failure assessment score“ Trombotické komplikace, angiogeneze a endotelitida v plicním řečišti u pacientů s infekcí COVID-19
Z pitevních nálezů zemřelých pacientů byla zjištěna unikátní patofyziologie, kterou virus způsobuje trombotické komplikace.
Byly porovnány výsledky pitev u pacientů, kteří zemřeli na onemocnění COVID-19, s pacienty, kteří zemřeli na syndrom akutní dechové tísně v rámci chřipky typu A. Z těchto pitevních nálezů je zřejmé, že pacienti, kteří zemřeli na onemocnění COVID-19, měli výrazné difuzní alveolární poškození plic s perivaskulární infiltrací T -lymfocyty. Dále bylo přítomno závažné endoteliální poškození s intracelulárně přítomným virem a s disrupcí buněčných membrán. Výrazným nálezem byla rozsáhlá trombóza plicních cév s mikroangiopatií. Alveolární kapilární mikrotromby byly u nemocných zemřelých na onemocnění COVID-19 až 9× častější než u pacientů, kteří zemřeli na chřipku typu A (10). Z pitevních nálezů byla patrná nejen přítomnost mikrotrombů v interalveolárních septech plic, ale také vrstva fibrinových depozit v oblasti alveolů. Bylo rovněž objeveno velké množství novotvořených cév – až 2,7× více než u pacientů zemřelých na chřipku A (10). Jako hlavní mechanismus novotvorby cév byla popsána intususceptivní angiogeneze, kdy rozštěpením existující cévy vznikají dvě nové cévy.
Trombocytopenie
Různý stupeň trombocytopenie je častým nálezem u pacientů s infekcí COVID-19. Těžká trombocytopenie je asociována se závažným průběhem infekce COVID-19 (11). Byla provedena studie, kde byli sledováni pacienti se závažným průběhem koronavirové infekce, jejich počáteční hodnota krevních destiček a dynamický vývoj počtu trombocytů během hospitalizace. Dále se sledovala úloha trombocytů v progresi onemocnění a souvislost s mortalitou. V retrospektivní studii, která proběhla ve Wuchanu, byli pacienti rozděleni do několika skupin dle vážnosti trombocytopenie. Bylo zjištěno, že výrazná trombocytopenie 31 × 109/l se vyskytovala u pacientů se závažným průběhem infekce a byla asociována až s 3× vyšší mortalitou (11, 12). Počet trombocytů je tedy nezávislý faktor predikce mortality u nemocných. V případě, že došlo ke zvýšení počtu trombocytů u nemocných nad 50 × 109/l, klesla mortalita nemocných až o 40 % (11). Lze tedy konstatovat, že čím je závažnější trombocytopenie, tím je vyšší mortalita. Příčina trombocytopenie je multifaktoriální, ale její přesný mechanismus není znám. Předpokládá se, že virus přímo snižuje produkci trombocytů, nebo způsobuje zvýšenou destrukci trombocytů pomocí imunitního systému. U pacientů s přítomností DIC může také docházet ke konsumpci trombocytů. Laboratorní sledování trombocytů může sloužit jako prediktor průběhu onemocnění COVID-19. Výhodou monitorace počtu trombocytů je snadná a rychlá dostupnost vyšetření. U pacientů s onemocněním COVID-19 s trombocytopenií dosud nebyly zaznamenány závažné krvácivé projevy.
Role D -dimerů
Během nynější koronavirové pandemie byla celosvětová snaha najít efektivní a dobře dostupné prediktory klinického průběhu u nemocných a objasnit jejich vliv na mortalitu. D -dimery, jakožto degradační produkty zesíťovaného fibrinogenu, vypovídají o aktivaci koagulace a fibrinolýze. Z klinického hlediska mohou tedy dobře posloužit k predikci klinického průběhu a mortality u nemocných s infekcí COVID-19. Na základě retrospektivní studie ve Wuchanu, do které bylo zařazeno 343 pacientů, byla stanovena cutt -off hodnota D -dimerů 2,0 mcg/ml. Bylo zjištěno, že mortalita byla signifikantně větší u těch pacientů, kteří měli hodnotu D -dimerů nad 2 mcg/ml, než u těch pacientů, kteří měli hodnotu D - dimerů pod 2 mcg/ml (13). D - dimery jsou tedy efektivní, snadno stanovitelné markery, které mohou pomoci k predikci vážnosti onemocnění a usnadnit management u pacientů s koagulopatií při onemocnění COVID-19. Hodnota D - dimerů také klesá při podávání antikoagulační terapie. Můžeme tedy díky nim sledovat i efektivitu antikoagulační léčby.
Laboratorní parametry u infekce COVID-19
U uvedeného vyplývá, že koagulopatie je marker nepříznivého vývoje onemocnění. Hlavními koagulačními parametry, které mají souvislost s mortalitou pacientů, jsou prodloužený PT, zvýšená hodnota D - dimerů, snížená hladina antitrombinu (AT) a trombocytopenie. Komplexní sledování koagulačních parametrů a zánětlivých mediátorů nám může pomoci ve zlepšení managementu péče o hospitalizované pacienty.
U všech hospitalizovaných pacientů s onemocněním COVID-19 bychom měli pravidelně sledovat následující laboratorní parametry: krevní obraz včetně počtu trombocytů a lymfocytů, PT, aPTT, laboratorní parametry odrážející poruchu fibrinolýzy (fibrinogen, D - dimery), dále zánětlivé parametry – ferritin a CRP (14).
V četných probíhajících studiích jsou sledovány také další ukazatele, např. aktivita von Willebrandova faktoru, PAI1, hladina antitrombinu, eventuálně i proteinu C a S, IL-1β, IL-6.
Antikoagulační léčba při koagulopatii asociované s infekcí COVID-19
Bylo prokázáno, že podávání nízkomolekulárního heparinu (LMWH) snížilo mortalitu u pacientů s CAC. Výrazné snížení mortality při podávání LMWH bylo popsáno především u těch nemocných, kteří měli SIC skóre vyšší než 4, nebo měli signifikantně zvýšené D -dimery (15). Kromě antikoagulačního účinku v sobě nízkomolekulární heparin skrývá také řadu dalších funkcí, které mohou být ku prospěchu při podávání LMWH u koagulopatie. Heparin vykazuje také protizánětlivé účinky díky své vazbě na trombin, kdy dojde následně k blokování účinku trombinu a tím k utlumení zánětlivé reakce a zabránění vzniku trombu. Mezi další funkce heparinu patří ochrana vaskulárního endotelu, který představuje stěžejní místo poškození při infekci koronavirem. Z poškozených buněk se při infekci uvolňují histony, které samy o sobě mohou vést k dalšímu poškození endotelu cév. Heparin může antagonizovat účinky histonů a ochránit tak cévní endotel. Na experimentálním modelu se také studoval antivirový účinek heparinu, kdy se předpokládá, že heparin je schopný vázat se na různé proteiny a tím inhibuje virové připojení. V recentně publikované studii se uvádí, že spike proteiny nového typu koronaviru mohou také interagovat s heparinem (16).
Pokud je hospitalizován nemocný bez prokázané tromboembolické komplikace, podáváme profylaktickou (ev. zvýšenou profylaktickou) dávku nízkomolekulárního heparinu.
Diagnostický postup k potvrzení eventuální přítomnosti TEN u pacientů s COVID-19 využívá stejné zobrazovací metody jako u ostatních pacientů, vyšetření samozřejmě musí probíhat v izolačním režimu. Nedoporučuje se screeningové vyšetření (např. screeningové provádění ultrazvukového vyšetření žilní dolních končetin), avšak vzhledem ke známému vysokému riziku TEN musí být práh podezření na tuto diagnózu nízký.
Při suspektní či již potvrzené tromboembolické příhodě u pacientů s COVID-19 je indikována plná léčebná dávka LMWH dle hmotnosti a stavu renálních funkcí, se současným posouzením rizika krvácení.
Po propuštění pacienta do ambulantní péče jsou pak lékem volby přímá orální antikoagulancia (DOAC), neboť nevyžadují pravidelnou laboratorní monitoraci a adjustaci dávek, tedy snižují nutnost pravidelného kontaktu pacienta se zdravotnickým personálem. Je však nutno vzít v úvahu riziko interakcí DOAC s protivirovými léky, případně s další konkomitantní medikací (17).
Pokud je pacient léčen v ambulantním režimu (tedy s mírným průběhem onemocnění), podáváme profylaktickou antikoagulační léčbu v případě, že se v anamnéze pacienta již v minulosti vyskytla tromboembolická nemoc. Profylaktická antikoagulační léčba je také indikována u nemocných s rizikovými faktory tromboembolie (obezita, užívání kontraceptiv, dlouhodobá imobilizace, stav po recentním operačním výkonu apod.).
U pacientů léčených v ambulantním režimu s lehčím průběhem onemocnění je třeba dbát také na nefarmakologickou tromboprofylaxi v podobě mobilizace a dostatečné hydratace (1, 7).
Témata pro budoucí výzkum
V poslední době se intenzivně diskutuje o dalších faktorech, které mohou mít významný vliv na rozvoj koagulopatie u onemocnění COVID-19 (viz obrázky 1 a 2) (18, 19).
Image 1. Mechanismus rozvoje koagulopatie při onemocnění COVID-19 a témata pro budoucí výzkum (18). Překresleno MUDr. Simona Bílková 
Image 2. Interakce endotelu a koagulačního systému indukovaná onemocněním SARS-CoV-2 (19). Překresleno MUDr. Simona Bílková 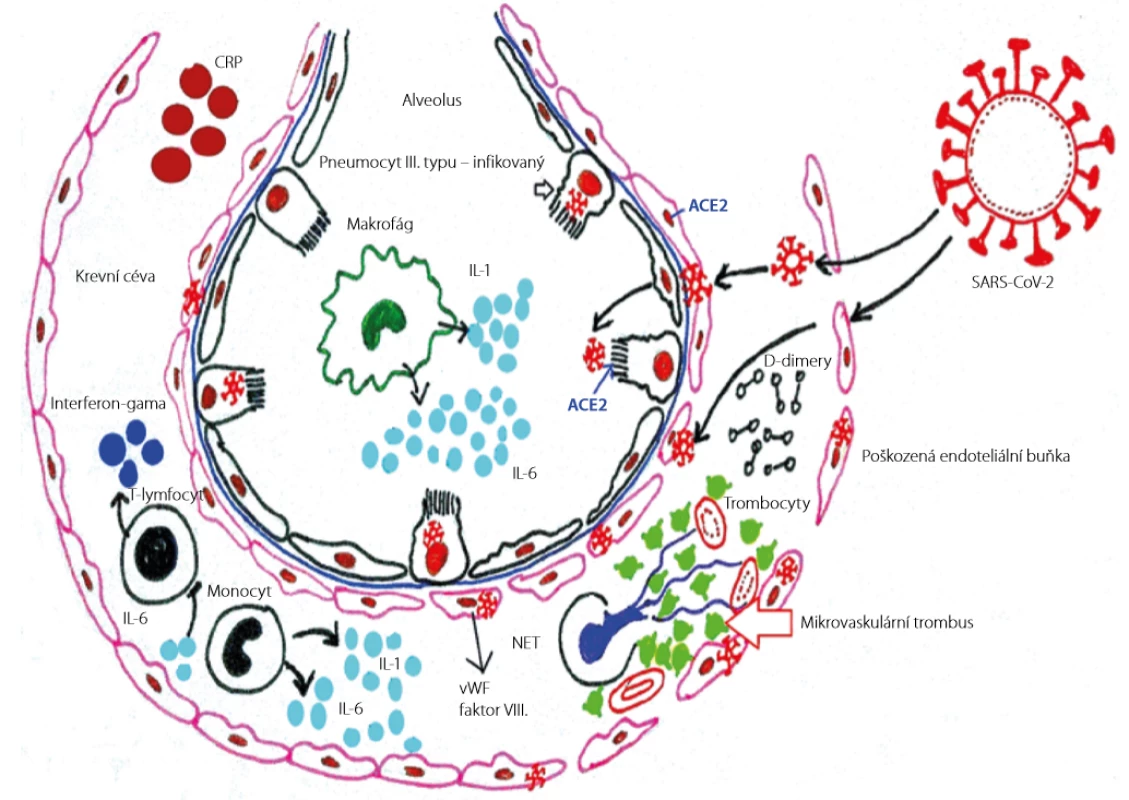
CRP (C-reaktivní protein), IL-6 (interleukin 6), IL-1 (interleukin 1), vWF (von Willebrandův faktor), faktor VIII (VIII. koagulační faktor), NET (neutrofilní extracelulární past), ACE2 (angiotenzin-konvertující enzym 2), SARS-CoV-2 (novel severe acute respiratory syndrome coronavirus 2 – nový typ koronaviru 2) Role obezity
Obezita je v poslední době stále více považována za významný rizikový faktor závažného průběhu onemocnění COVID-19 (18). Tuková tkáň plní řadu funkcí, slouží k ukládání energie, je zdrojem řady hormonů a cytokinů. Adipokiny jsou cytokiny v tukové tkáni, které slouží jako jakýsi rezervoár ACE2. Tuková tkáň se významnou měrou podílí na regulaci zánětlivých procesů pomocí řady prozánětlivých faktorů (TNFalfa, IL-6) a na vzniku trombotických komplikací. Obezita a metabolický syndrom si v budoucnu zaslouží jistě naši pozornost díky své úzké souvislosti s koagulopatií při onemocnění COVID-19 (18).
Role mikročástic
Během infekce COVID-19 dochází k cytokinové bouři a k aktivaci cirkulujících krevních buněk včetně krevních destiček, leukocytů a endoteliálních buněk. Při aktivaci těchto buněk dochází k následnému uvolnění mikročástic do krevního oběhu. Aktivace buněk a cirkulující mikročástice vedou ke koagulační odpovědi v důsledku expozice tkáňového faktoru a fyziologického aktivátoru koagulační kaskády spolu s negativně nabitými fosfolipidy. V konečném důsledku dochází k tvorbě trombinu a vzniku prokoagulačního stavu.
Zvýšené hladiny prokoagulačních mikročástic byly již dříve popsány u pacientů s arteriální hypertenzí, diabetem, dyslipidemií, obezitou, plicní embolií, dále u pacientů s akutním koronárním syndromem a srdečním selháním. Hladiny cirkulujících endoteliálních mikročástic byly spojeny s přítomností kardiometabolického rizika jakožto predisponujícího faktoru vážné infekce COVID-19.
Stimulační účinek mikročástic zahrnuje zvýšenou regulaci ACE, která podporuje prooxidační odpověď v endoteliálních buňkách (18).
Antifosfolipidové protilátky
Význam antifosfolipidových (aPL) protilátek ve vývoji COVID-19 koagulopatie byla zdůrazněna nedávným popisem multi - cerebrálních infarktů u 3 pacientů s antifosfolipidovými protilátkami – antikardiolipinové IgA, anti beta2 glykoprotein I IgA a IgG. Pravděpodobný mechanismus vzniku trombózy u antifosfolipidového syndromu je multifaktoriální a zahrnuje endoteliální buněčnou dysfunkci, aktivaci krevních destiček, aktivaci komplementového systému, ovlivnění přirozených antikoagulačních mechanismů (TFPI – tissue factor pathway inhibitor, inhibice dráhy proteinu C, interference s účinkem antitrombinu) a sníženou fibrinolýzu (zvýšená hladina PAI-1, inhibice vazby plazminogenu).
Aktivace komplementu
Nejnovější poznatky o infekci COVID-19 naznačují, že trombotická mikroangiopatie souvisí s patologickou aktivací komplementu. Komplexy protilátky -antigenu vyvolají produkci zánětlivých markerů C3a a C5a, které jsou zároveň složkami komplementového systému. Inhibice komplementu byla navržena jako slibná léčba těžké infekce COVID-19 (18).
Shrnutí na závěr
Koagulopatie je běžným nálezem u pacientů s těžkým průběhem koronavirové infekce. Přítomnost koagulopatie přitom výrazně zhoršuje prognózu nemocných a zvyšuje celkovou mortalitu. Odborníky bylo doporučeno podávání antikoagulační léčby u všech hospitalizovaných nemocných, přičemž musíme být více obezřetní u pacientů, kteří mají vyšší SIC skóre nebo mají laboratorně elevované D - dimery.
D -dimery a počet trombocytů mohou sloužit jako jednoduše zjistitelné prediktory klinického průběhu onemocnění. Heparin kromě antikoagulačního účinku vykazuje také protizánětlivé účinky, pomáhá k ochraně endotelu cév a v poslední době se studují i jeho možné antivirové účinky. Častým laboratorním nálezem u pacientů je také lymfopenie a trombocytopenie. V průběhu infekce novým typem koronaviru nebyly zaznamenány významné krvácivé projevy způsobené trombocytopenií. Onemocnění SARS -CoV-2 způsobuje převážně žilní trombotické komplikace, nejčastěji se vyskytující komplikací je plicní embolizace. Plicní embolizace může vzniknout in situ. Méně často se vyskytují i arteriální cévní příhody, u kterých se spekuluje o asociaci s antifosfolipidovými protilátkami. V patofyziologii vzniku trombotických komplikací se uplatňuje jak porucha koagulace, tak extenzivní produkce zánětlivých parametrů, hovoříme o takzvané imuno -trombóze.
Podpořeno Programem rozvoje vědních oborů
Univerzity Karlovy (Progres Q39) This study was supported by the
Charles University Research Fund (Progres Q39).
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Simona Bílková,
II. interní klinika LF UK a FN Plzeň
Cit. zkr: Vnitř Lék 2020; 66(7): 402–408
Článek přijat redakcí: 9. 8. 2020
Článek přijat po recenzích k publikaci: 29. 9. 2020
Sources
1. Karetová D, Bultas J. Koagulopatie provázející těžší formy koronavirové infekce (COVID-19) - incidence trombotických komplikací, jak jim předcházet a jak je léčit. Cor Vasa.
2. Cui S, Chen S, Li X, Liu S, Wang F. Prevalence of venous thromboembolism in patients with severe novel coronavirus pneumonia. J Thromb Haemost. 2020; 18(6): 1421–1424.
3. Klok FA, Kruip MJHA, van der Meer NJM, et al. Incidence of thrombotic complications in critically ill ICU patients with COVID-19. Thromb Res. 2020; 191 : 145–147.
4. Klok FA, Kruip MJHA, van der Meer NJM, et al. Confirmation of the high cumulative incidence of thrombotic complications in critically ill ICU patients with COVID-19: An updated analysis. Thromb Res. 2020; 191 : 148–150.
5. Levolger S, Bokkers RPH, Wille J, Kropman RHJ, de Vries JPPM. Arterial thrombotic complications in COVID-19 patients [published online ahead of print, 2020 Jul 17]. J Vasc Surg Cases Innov Tech. 2020;doi:10.1016/j.jvscit.2020. 06. 012
6. Zhang Y, Xiao M, Zhang S, et al. Coagulopathy and Antiphospholipid Antibodies in Patients with Covid-19. N Engl J Med. 2020; 382(17): e38.
7. Spyropoulos AC, Levy JH, Ageno W, et al. Scientific and Standardization Committee Communication: Clinical Guidance on the Diagnosis, Prevention and Treatment of Venous Thromboembolism in Hospitalized Patients with COVID-19 [published online ahead of print, 2020 May 27]. J Thromb Haemost. 2020;10.1111/jth.14929. doi:10.1111/jth.14929
8. Tang N, Li D, Wang X, Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost. 2020; 18(4): 844–847.
9. Iba T, Levy JH, Warkentin TE, et al. Diagnosis and management of sepsis - induced coagulopathy and disseminated intravascular coagulation. J Thromb Haemost. 2019; 17(11): 1989–1994.
10. Ackermann M, Verleden SE, Kuehnel M, et al. Pulmonary Vascular Endothelialitis, Thrombosis, and Angiogenesis in Covid-19 [published online ahead of print, 2020 May 21]. N Engl J Med. 2020;10.1056/NEJMoa2015432. doi:10.1056/NEJMoa2015432.
11. Liu Y, Sun W, Guo Y, et al. Association between platelet parameters and mortality in coronavirus disease 2019: Retrospective cohort study. Platelets. 2020; 31(4): 490–496. doi :10.1080/09537104.2020.1754383.
12. Lippi G, Plebani M, Henry BM. Thrombocytopenia is associated with severe coronavirus disease 2019 (COVID-19) infections: A meta - analysis. Clin Chim Acta. 2020; 506 : 145–148. doi:10.1016/j.cca 2020. 03. 022
13. Zhang L, Yan X, Fan Q, et al. D - dimer levels on admission to predict in - hospital mortality in patients with Covid-19. J Thromb Haemost. 2020; 18(6): 1324–1329. doi:10.1111/ jth.14859.
14. Thachil J, Tang N, Gando S, et al. ISTH interim guidance on recognition and management of coagulopathy in COVID-19. J Thromb Haemost. 2020; 18(5): 1023–1026.
15. Tang N, Bai H, Chen X, Gong J, Li D, Sun Z. Anticoagulant treatment is associated with decreased mortality in severe coronavirus disease 2019 patients with coagulopathy. J Thromb Haemost. 2020; 18(5): 1094–1099. doi:10.1111/jth.14817.
16. Thachil J. The versatile heparin in COVID-19. J Thromb Haemost.2020;18(5):1020-1022. doi:10.1111/jth.14821.
17. Moores LK, Tritschler T, Brosnahan S, Carrier M, Collen JF, Doerschug K, Holley AB, Jimenez D, Le Gal G, Rali P, Wells P. Prevention, Diagnosis, and Treatment of VTE in Patients With Coronavirus Disease 2019: CHEST Guideline and Expert Panel Report. Chest. 2020 Sep; 158(3): 1143–1163. doi: 10.1016/j.chest.2020. 05. 559. Epub 2020 Jun 2. PMID: 32502594; PMCID: PMC7265858.
18. Marchandot B, Sattler L, Jesel L, et al. COVID-19 Related Coagulopathy: A Distinct.
19. Entity?. J Clin Med. 2020; 9(6): 1651. Published 2020 May 31. doi:10.3390/jcm9061651.
20. Chen LYC, Hoiland RL, Stukas S, Wellington CL, Sekhon MS. Confronting the controversy: Interleukin-6 and the COVID-19 cytokine storm syndrome. Eur Respir J. 2020 Sep 3 : 2003006. doi: 10.1183/13993003.03006-2020. Epub ahead of print. PMID: 32883678; PMCID: PMC7474149.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2020 Issue 7-
All articles in this issue
- Coagulopathy associated with COVID-19
- Current diagnosis and therapy in sarcoidosis
- Obstructive sleep apnea and hypertension: the role of gut microbiome
- CAR T-cells: hot news in cancer therapy
- Renal failure in multiple myeloma and its treatment
- Bone Metabolism in Inflammatory Bowel Diseases 2
- Metformin -associated lactic acidosis
- Tangier disease in family with the phenotype of familial hypercholesterolemia
- Hypoglycemia in non -diabetic patients
- Screening and brief intervention in illicit drug users
- Bone metabolism in inflammatory bowel diseases 1
- Ethical connotations of the treatment of COVID-19 disease
- Biomarkers for non-endoscopic examination of esophageal mucosa
- Risk of cardiovascular complications related to blood glucose concentration: from diabetes to prediabetes
- ERCP in patients after choledochodenoanastomosis
- Rationed nursing care as one of the indicators of the occurrence of medication errors
- A rare coincidence of a chylothorax and a hydrothorax caused by gastric adenocarcinoma – a case report
- A man with dysthymia (with negative evaluation of allmost all through his live) induced depression in his sensitive spouse
- Small bowel adenocarcinoma diagnosed by video capsule endoscopy in a patient with celiac disease: a case report and review of literature
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hypoglycemia in non -diabetic patients
- Metformin -associated lactic acidosis
- Coagulopathy associated with COVID-19
- CAR T-cells: hot news in cancer therapy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

