-
Medical journals
- Career
Maligní mezoteliom pleury – dosud nepokořený nádor
Authors: Vítězslav Kolek
Authors‘ workplace: Klinika plicních nemocí a tuberkulózy LF UP a FN Olomouc
Published in: Vnitř Lék 2017; 63(11): 884-888
Category: Reviews
Overview
Maligní mezoteliom pleury je nejčastější primární nádor pohrudnice a jeho agresivita je vysoká. Nejčastější příčinou je kontakt s asbestem a výskyt zatím stoupá, přestože je práce s asbestem v rozvinutých zemích již zakázána. Diagnostika se opírá především o anamnézu, klinické příznaky a imunohistochemické vyšetření vzorku nádoru. Základní léčbou je v posledních 10 letech chemoterapie kombinací cisplatina – pemetrexed. Probíhá celá řada studií s jinou biologicky cílenou léčbou, imunoterapií a dalšími léky, které mohou zlepšit prognózu nemocných. Operační přístup je limitován vhodným výběrem nemocných a dostatečnými zkušenostmi pracoviště. Provádí se extrapleurální pneumonektomie nebo rozšířená pleurektomie. Ani kombinovaná léčba s adjuvantní nebo neoadjuvantní chemoterapií či radioterapií však zásadně neprodloužila přežití.
Klíčová slova:
diagnostika – epidemiologie – maligní mezoteliom pleury – terapieCharakteristika
Mezoteliomy vznikají ze serózních blan pleury, peritonea, perikardu, tunica vaginalis testis a ovariálního epitelu. Asi 80 % z nich vzniká v pleurální dutině a jsou nejčastějšími primárními nádory pleury [1]. Maligní mezoteliom pleury (MMP) patří mezi nejzhoubnější nádory vůbec s mediánem celkového přežití méně než 13 měsíců [2]. Nejčastějším histologickým typem je forma epiteloidní, méně častá je forma sarkomatoidní nebo smíšená (bifázická). Od 60. let minulého století byla doložena etiologická souvislost mezoteliomu s expozicí azbestu, která je převážně profesionální [3]. O neprofesionální expozici přírodnímu azbestu se uvažuje více u žen a osob mladších 60 let [1]. U nemocných, u nichž není expozice azbestu průkazná, se předpokládá genetická predispozice, role některých virů (SV 40), keramických vláken, erionitu nebo záření [4,5]. Dlouhá a odolná azbestová vlákna se dostávají s vdechovaným vzduchem do plicních sklípků a odtud mohou cestovat až k pleuře, pronikají do pleurálního prostoru, kde vyvolávají místní reakci, která může vést ke vzniku onemocnění. Nádor vzniká po dlouhé době od prvního kontaktu s azbestem. Může se projevit i v době, kdy dotyčný s azbestem již řadu let nepracuje, což bývá až 30–40 let od expozice [1].
Epidemiologie
MMP se nejvíce vyskytuje u pracovníků s modrým azbestem (krocidolit). Jsou to horníci, zaměstnanci loděnic či továren přímo zpracovávajících azbest, elektrikáři izolatéři, demoliční pracovníci, údržbáři, opraváři, instalatéři nebo hasiči. Ohroženi jsou i jejich rodinní příslušníci nebo obyvatelé bydlící v blízkosti dolů na azbest či továren zpracovávajících azbest [6]. Roční incidence MMP je u žen odhadována na 1–2,5/1 000 000 a u mužů na 6–66/1 000 000. Azbest se již v České republice přestal průmyslově používat, ale v příštích desetiletích bude incidence MMP u nás ještě stoupat [7]. Ročně vzniká asi 40 nových onemocnění ročně, výskyt stoupá hlavně u mužů (graf).
Graf. Incidence MMP v České republice 
* pro hodnocení trendu jsou z důvodu vyhlazení možných fluktuací započítány pro rok 2001 hodnoty let 1999–2001 a obdobně pro rok 2011 hodnoty z let 2009–2011 Některé země, např. Čína a Rusko, stále azbest produkují a prodávají ho jiným státům. Pracovně je v současnosti exponováno azbestu asi 125 milionů lidí [8]. Vysoký výskyt nádoru je zaznamenáván v Turecku, významný vzestup hlásí Dánsko. Maximum výskytu v evropských zemích se očekává kolem roku 2020. Nejvýznamnějším zdrojem expozice azbestu v současnosti je azbestocementová krytina na střechách, žáruvzdorné izolace v budovách, vysokotlaké desky, těsnění k součástem strojů pracujících za vysokých teplot, brzdové obložení, těsnění a izolace v dopravních prostředcích, vodovodní a kanalizační potrubí [1].
Diagnostika
Anamnesticky je vždy důležitý údaj o expozici azbestu. Typickými klinickými symptomy jsou dušnost, lateralizovaná krutá pleurální bolest a dráždivý zhoršující se kašel. Později to jsou subfebrilie, zmenšování postiženého hemitoraxu, celková únava a hmotnostní úbytek. Symptomy se stupňují a bolest bývá krutá a velmi těžko snesitelná. Diagnózu upřesňují zobrazovací metody (skiagram, CT, magnetická rezonance a pozitronová emisní tomografie CT – PET/CT), kterými se ověřuje pleurální výpotek s nepravidelným ztluštěním pleury, popřípadě prorůstání do okolních struktur a metastatický rozsev [1]. Provádí se diagnostická punkce výpotku, ale převážně je nutná histologická verifikace diagnózy optimálně pomocí torakoskopie (video-assisted thoracoscopic surgery – VATS nebo klinická torakoskopie) [2]. Perkutánní biopsie pleury speciální jehlou je uznávanou metodou, pokud se provádí při CT nebo sonografické navigaci [1]. Zatím není k dispozici ideální sérový biomarker s diferenciálně diagnostickým nebo prognostickým významem [9]. V poslední době se používají solubilní peptidy podobné mezotelinu (soluble mesothelin related peptides – SMRP), kromě mezotelinu je to osteopontin nebo solubilní megakaryocyty potencující faktor (MPF). Senzitivita se udává od 16 do 80 %, korelace s klinickým průběhem zatím není jednoznačná [10,12].
Ke spolehlivé diagnóze je nutné imunohistochemické posouzení vzorku k odlišení jiných tumorů, především karcinomu plic a metastatických adenokarcinomů. Pozitivní markery jsou např. calretinin, cytokeratiny CK 5/6, WT-1, D2-40, za negativní markery se považují CEA, MOC-31, B72.3, Bg8, BerEP4, TTF-1, CD 15 nebo p63 [2,13].
K hodnocení rozsahu mezoteliomu se používá několik klasifikací. Důležité je rozdělení na lokalizovaný a difuzní typ. Poslední úprava histologické klasifikace WHO je z roku 2015 [14]. Kromě 3 základních histologických typů (epiteloidní, sarkomatoidní a bifázický) se vyčleňují podtypy jako desmoplastický, papilární, adenomatoidní nebo trabekulární (obr. 1 a 2).
Image 1. Epiteloidní mezoteliom pleury (Slide show Cesar A. Moran, MD) 
Image 2. Sarkomatoidní mezoteliom pleury (Slide show Cesar A. Moran, MD) 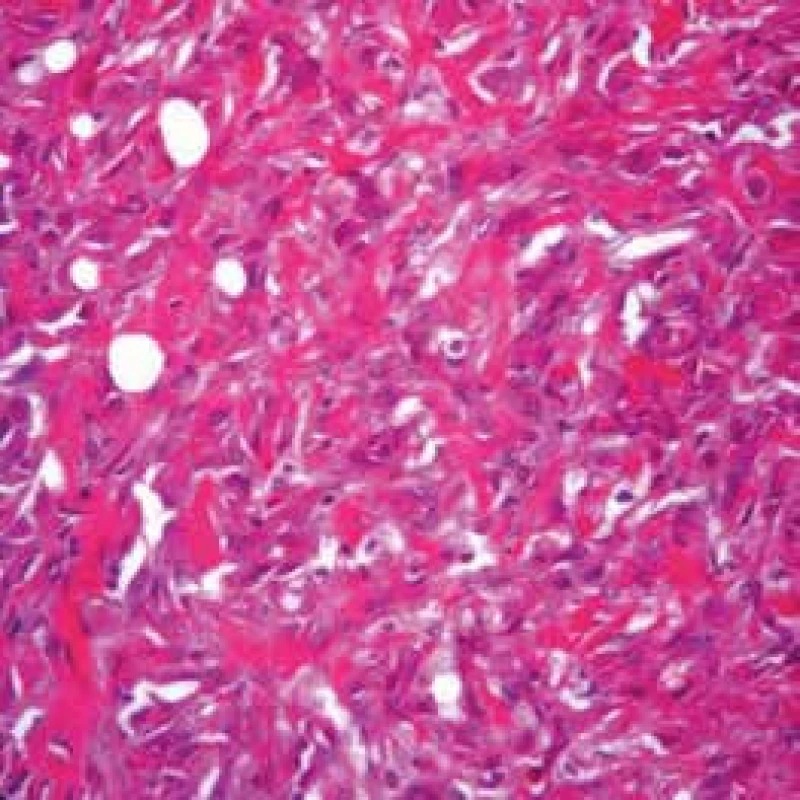
Klasifikace má prognostický význam, v příští verzi se připravuje upřesnění dle genetických charakteristik. Při hodnocení rozsahu nádoru se od roku 2017 používá 8. TNM klasifikace. Studují se genetické změny a bylo zjištěno, že důležitá je inaktivační mutace genu BAP1 (proteinu 1 asociovaného s BRCA1), což je i potenciální cíl epigenetické terapie [15,16]. Vyskytuje se u 60 % MMP, včetně jeho dědičného výskytu. Delece P16 je spojena se špatnou prognózou a je přítomna pouze u MMP, ale ne u pleurální hyperplazie. Jsou zkoumány signalizační dráhy např. YAP1 nebo Merlin a jejich interakce [17].
Léčba
Chemoterapie
Základním léčebným postupem je chemoterapie. Za standardní chemoterapii se v posledních 10 letech považuje kombinace cisplatina (v některých zemích také karboplatina) s pemetrexedem. V registrační studii fáze III byl dosažen medián celkového přežití (mOS) 12,3 měsíce [18]. Lze použít i gemcitabin nebo vinorelbin. Druhá linie chemoterapie zatím nemá doporučený standardní postup. Pokud byl v první linii účinný pemetrexed, doporučuje se jeho podání i v druhé linii. Podávají se i jiné režimy s vinorelbinem nebo gemcitabinem. Medián přežití bývá poměrně krátký, a to 4,6 měsíců u gemcitabinu nebo 5,4 měsíců u vinorelbinu [19].
Chirurgická léčba
Úkolem chirurgické léčby je maximální cytoredukce nádoru. Operují se pouze epiteliální a omezeně smíšené mezoteliomy, sarkomatoidní varianta se považuje za kontraindikaci operačního řešení. Před operací se doporučuje provést PET/CT vyšetření, funkční vyšetření plic včetně difuzní kapacity (diffusing capacity of the lungs for carbon monoxide – DLCO) a vyšetření nitrohrudních uzlin (mediastinoskopie nebo endobronchiální ultrasonografie/endobronchial ultrasound – EBUS). V některých specializovaných centrech se provádí extrapleurální pneumonektomie (EPP), která spočívá v resekci plíce spolu s resekcí perikardu, bránice a parietální pleury [20]. Operace se doplňuje chemoterapií nebo chemoradioterapií adjuvantně i neoadjuvantně. Dalším standardním výkonem je rozšířená pleurektomie/dekortikace, která má menší morbiditu a vedlejší účinky. U přísně selektovaných nemocných převážně v retrospektivních souborech bylo dosaženo lepších výsledků, než jsou udávány při chemoterapii (mOS i přes 30 měsíců), ale v prospektivních studiích se tento benefit nepotvrdil, ať už byla prováděna neoadjuvantní nebo adjuvantní kombinovaná léčba [21,22]. V ojedinělých randomizovaných studiích bylo u časných fází MMP dosaženo kolem 19 měsíců při kombinaci neoadjuvantní chemoterapie, EPP a pooperační radioterapie za cenu poměrně větších vedlejších účinků, a podobné výsledky byly zjištěny s lokálním podáváním hypertermické cisplatiny nebo u rozšířené pleurektomie [23,24]. Neradikální chirurgické výkony typu pleurektomie se doporučují, pouze pokud nelze provést pleurodézu.
Radioterapie
Radioterapie má především paliativní význam s analgetickým efektem. Pooperační adjuvantní radioterapie je doporučována spíše v rámci studií u pacientů v dobrém celkovém stavu v dávkách 40–54 Gy. Provádí se také předoperační radioterapie v dávce 21 Gy [1,2,20].
Paliativní metody
Používají se paliativní zákroky jako pleurodéza (nejlépe talek nebo bleomycin intrapleurálně), pleuroperitoneální shunt, intrapleurální brachyterapie, promývání zahřívanými roztoky cytostatik nebo intrapleurální fotodynamická terapie.
Biologická cílená léčba
Biologicky cílená léčba u MMP dlouho neprokazovala efekt včetně mnoha studií s inhibitory tyrozinkinázových receptorů. Jedna z posledních negativních studií fáze III proběhla s vorinostatem (inhibitor histonové deacetylázy) [25]. V roce 2015 byla prezentována studie MAPS – randomizovná multicentrická studie fáze II/III s bevacizumabem, který byl přidáván k chemoterapii pemetrexed 200 mg/m2 s cisplatinou 75 mg/m2 [26]. Ze sledovaných 448 pacientů dostalo 223 pacientů bevacizumab a tito nemocní měli medián celkového přežití signifikantně delší než pacienti na standardní chemoterapii (18,8 měsíců vs 16,7 měsíců, HR 0,76, 95% CI: 061–0,94, p < 0,015). Signifikantní rozdíl byl také u mPFS (9,59 měsíců vs 7,49 měsíců, HR 0,62, 95% CI: 0,50–0,75, p < 0,0001). Vysoká koncentrace VEGF v krvi byla nepříznivým prognostických faktorem. Léčba bevacizumabem byla sice spojena s vyšším výskytem vedlejších reakcí stupně 3–4 (71,2 % vs 62,1 %), ale přinesla zlepšení kvality života a signifikantní snížení únavy. Po 10 letech jde o prakticky jediný pozitivní výsledek studií fáze III u MMP, ale ani tato studie nebyla vyhodnocena jako studie měnící klinickou praxi. Další látky studované v klinických studiích jsou např. HSP90 inhibitory, COX2 inhibitory nebo dafactinib. Zcela nové látky užívané v preklinických studiích jsou epigenetické inhibitory EZH2 u mezoteliomů s BAP1 mutací [27]. Jako nadějné se jeví studie fáze II/III s nintedanibem, který se podává jako udržovací léčba po chemoterapii pemetrexedem s cisplatinou [28]. V ukončené studii fáze II byl signifikantně prodloužen medián času do progrese (9,4 měsíců vs 5,7 měsíců u placeba) i medián celkového přežití, který byl 18,3 měsíců vs 14,2 měsíců u placeba (u epiteloidního typu to bylo 20,6 měsíců vs 15,2 měsíců).
Imunoterapie
Imunoterapie, ať již intrapleurální aplikací interferonu α nebo interferonu γ, popř. interleukinu-2, nepřevyšuje efekt chemoterapie [29,30]. Stejně jsou zatím nejasné výsledky používání vakcín se zaměřením např. na mezotelin [31,32]. Z nových léků prokázal klinickou aktivitu pembrolizumab (check point inhibitor PD-1). Zatím se však byly prezentovány jen výsledky studie fáze IB/II: Keynote – 028 [33]. Pembrolizumab byl podáván v monoterapii v dávce 10 mg/kg každé 2 týdny po první linii chemoterapie platinovým dubletem do plánované doby 2 roky. Z 84 screenovaných pacientů bylo zařazeno 25, z nichž u 28 % bylo dosaženo odpovědi, u 76 % kontroly nemoci. Byl hodnocen medián času do progrese, který byl 5,8 (95% CI, 3,4–8,2) měsíců. Exprese PD-L1 (nad 1 % imunitních buněk) byla u 45 % nemocných. Je hodnocena jako nepříznivý prognostický ukazatel u MMP, ve studii však neměla vliv na léčebnou odpověď (P = 0,284). V léčbě se také ověřuje tremelimumab – humánní protilátka proti CTLA-4 [34], ale i jiné léky z této kategorie.
České zkušenosti s léčbou MMP
Z dosavadních studií lze vyhodnotit následující výsledky: bez chemoterapie dosahoval medián celkového přežití MMP asi 5–8 měsíců, v registrační studii s pemetrexedem a cisplatinou bylo při chemoterapii dosaženo přežití 12,3 měsíců [18]. Přidáním bevacizumabu k chemoterapii bylo dosaženo mediánu přežití 18,8 měsíců [26]. Výsledky jsou ovlivněny výběrem pacientů, stadiem a histologickými typy. V České republice probíhá dlouhodobě vyhodnocování dat nemocných léčených pemetrexedem a cisplatinou. Do souboru bylo do konce roku 2015 zařazeno 181 nemocných, jejichž data zpracovává Institut statistiky a bioanalýz Brno. Soubor tvořilo 47 žen a 134 mužů, průměrný věk byl 63 let. Nejčastějším typem byl epiteloidní MMP u 119 nemocných. Kompletní remise byla prokázána u 2,8 %, parciální remise u 28,0 %, stabilizace u 47 % nemocných. Medián celkového přežití byl 19,8 (95% CI 16,2–23,4) měsíců a PFS 9,1 (95% CI, 7,6–10,7) měsíců, 2leté přežití 21,9 % [35]. Lepší prognóza byla zjištěna u epiteloidního typu, časného stadia dle TNM a dobrého celkového stavu. Horší prognózu měli nemocní s profesionální expozicí azbestu. U epiteloidní formy byl medián přežití 22,5 (95% CI 10,7–34,3) měsíců, u bifázické a sarkomatoidní formy 14,9 (95% CI 10,5–19,2) měsíců. Léčba byla dobře tolerována, vedlejší účinky byly zjištěny u 25,4 % léčených nemocných, nejčastější byla neutropenie.
Závěr
MMP je jedním z nevyřešených problémů současné medicíny. Přes zákaz práce s azbestem v civilizovaných zemích jeho výskyt bude nadále stoupat. Časná diagnostika zatím postrádá vhodný biomarker a nově zkoumané formy terapie v posledních letech doposud nezaznamenaly zásadní prodloužení celkového přežití. Přesto lze očekávat, že stále se rozrůstající imunogenetický výzkum bude nadějí pro skutečně účinnou cílenou léčbu, která osud nemocných změní.
prof. MUDr. Vítězslav Kolek, DrSc.
vitezstav.kolek@fnol.cz
Klinika plicních nemocí a tuberkulózy LF UP a
FN Olomouc
www.fnol.cz
Doručeno do redakce 16. 8. 2017
Přijato po recenzi 26. 9. 2017
Sources
1. Robinson BWS, Musk AW, Lake RA. Malignant mesothelioma. Lancet 2005; 366(9483): 397–408.
2. Scherpereel A, Astoul P, Baas P et al. Guidelines of the European Respiratory Society and the European Society of Thoracic Surgeons for the management of malignant pleural mesothelioma. Eur Respir J, 2010; 35(3): 479–495. Dostupné z DOI: <http://dx.doi.org/10.1183/09031936.00063109>.
3. WAGNER JC et al. Asbestos Dust and Malignancy. Proceedings of the XIV International Conference of Occupational Health, Madrid, 1963. Excerpta Medica: 1066–1067.
4. Sahin AA, Coplu L, Selcuk ZT et al. Malignant pleural mesothelioma caused by environmental exposure to asbestos or erionite in rural Turkey: cT findings in 84 patients. AJR Am J Roentgenol 1993; 161(3): 533–537.
5. Jasani B, Gibbs A. Mesothelioma not associated with asbestos exposure. Arch Pathol Lab Med 2012; 136(3): 262–267. Dostupné z DOI: <http://dx.doi.org/10.5858/arpa.2011–0039-RA>.
6. Kolek V, Fialová J, Petřek M et al. Význam sledování alveolárních změn u pracovníků s azbestem. Prac Lék 1996; 48(2): 79–84.
7. Palatka K, Kolek V, Tichý T et al. Zkušenosti s diagnostikou a léčbou maligního mezoteliomu, srovnání období 1990–1999 a 2000–2004. Stud Pneumol Phthiseol 2007; 67(5): 188–193.
8. Nishikawa K, Takahashi K, Karjalainen A et al. Recent mortality from pleural mesothelioma, historical patterns of asbestos use, and adoption of bans: a global assessment. Environ Health Perspect 2008; 116(12): 1675–1680. Dostupné z DOI: <http://dx.doi.org/10.1289/ehp.11272>.
9. Maeda M, Hino O. Molecular tumor markers for asbestos-related mesothelioma: Serum diagnostic markers. Pathol Int 2006; 56(11): 649–654.
10. Jakubec P, Pelclova D, Smolkova P et al. Significance of serum mesothelin in an asbestos-exposed population in the Czech Republic. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2015; 159(3): 472–479.
11. Cui A, Jin XG, Zhai K et al. Diagnostic values of soluble mesothelin-related peptides for malignant pleural mesothelioma: updated meta-analysis. BMJ Open 2014; 4(2): e004145. Dostupné z DOI: <http://dx.doi.org/10.1136/bmjopen-2013–004145>.
12. Van der Bij S, Schaake E, Koffijberg H et al. Markers for the non-invasive diagnosis of mesothelioma: a systematic review. Br J Cancer 2011; 104(8): 1325–1333. Dostupné z DOI: <http://dx.doi.org/10.1038/bjc.2011.104>.
13. Mossman BT, Shukla A, Heintz NH et al. New Insights into Understanding the Mechanisms, Pathogenesis, and Management of Malignant Mesotheliomas. Am J Pathol 2013; 182(4): 1065–1077. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ajpath.2012.12.028>.
14. Galateau-Salle F, Churg A, Roggli V et al. [World Health Organization Committee for Tumors of the Pleura[. The 2015 World Health Organization Classification of Tumors of the Pleura: Advances since the 2004 Classification. J Thorac Oncol 2015; 11(2): 142–154. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jtho.2015.11.005>.
15. Goto Y, Shinjo K, Kondo Y et al. Epigenetic profiles distinguish malignant pleural mesothelioma from lung adenocarcinoma. Cancer Res 2009; 69(23): 9073–9082. Dostupné z DOI: <http://dx.doi.org/10.1158/0008–5472.CAN-09–1595>.
16. Testa JR, Cheung M, Pei J et al. BAP1 mutations predispose to malignant mesothelioma. Nat Genet 2011; 43(10): 1022–1025. <http://dx.doi.org/10.1038/ng.912>.
17. Yokoyama T, Osada H, Murakami H et al. YAP1 is involved in mesothelioma development and negatively regulated by Merlin through phosphorylation. Cancerogenesis 2008; 29(11): 2045–2052. Dostupné z DOI: <http://dx.doi.org/10.1093/carcin/bgn184>.
18. Vogelzang NJ, Rusthoven J, Symanowski J et al. A phase III study of pemetrexed in combination with cisplatin versus cisplatin alone in patients with malignant pleural mesothelioma. J Clin Oncol 2003; 21(14): 2636–2644.
19. Zauderer MG, Kass SL, Woo K el al. Vinorelbine and gemcitabine as second - or third-line therapy for malignant pleural mesothelioma Lung Cancer 2014; 84(3): 271–274. Dostupné z DOI: <http://dx.doi.org/10.1016/j.lungcan.2014.03.006>.
20. Sugarbaker DJ, Flores RM, Jaklitsch MT et al. Resection margins, extrapleural nodal status, and cell type determine postoperative long-term survival in trimodality therapy of malignant pleural mesothelioma: results in 183 patients. Thorac Cardiovasc Surg 1999; 117(1): 54–63.
21. Cao CQ, Yan TD, Bannon PG et al. A systematic review of extrapleural pneumonectomy for malignant pleural mesothelioma. J Thorac Oncol 2010; 5(10): 1692–1703. Dostupné z DOI: <http://dx.doi.org/10.1097/JTO.0b013e3181ed0489>.
22. Opitz I. Management of malignant pleural mesothelioma – The European experience. J Thorac Dis 2014; 6(Suppl 2): S238-S252. <http://dx.doi.org/10.3978/j.issn.2072–1439.2014.05.03>.
23. Tilleman TR, Richards WG, Zellos L et al. Extrapleural pneumonectomy followed by intracavitary intraoperative hyperthermic cisplatin with pharmacologic cytoprotection for treatment of malignant pleural mesothelioma: a phase II prospective study. J Thorac Cardiovasc Surg 2009; 138(2): 405–441. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jtcvs.2009.02.046>.
24. de Perrot M, Feld R, Cho BC et al. Trimodality therapy with induction chemotherapy followed by extrapleural pneumonectomy and adjuvant high-dose hemithoracic radiation for malignant pleural mesothelioma. J Clin Oncol 2009; 27(9): 1413–1418. <http://dx.doi.org/10.1200/JCO.2008.17.5604>.
25. Krug LM, Kindler H, Calvert H et al. VANTAGE 014: vorinostat (V) in patients with advanced malignant pleural mesothelioma (MPM) who have failed prior pemetrexed and either cisplatin or carboplatin therapy: a phase III, randomized, double-blind, placebo-controlled trial [abstract 3BA]. Eur J Cancer 2011; 47(Suppl 2): 2–3. Dostupné z DOI: <http://dx.doi.org/10.1016/S0959–8049(11)70098–3>.
26. Zalcman G, Mazières J, Margery J et al. Bevacizumab 15 mg/kg plus cisplatin-pemetrexed (CP) triplet versus CP doublet in Malignant Pleural Mesothelioma (MPM): Results of the IFCT-GFPC-0701 MAPS randomized phase 3 trial. ASCO Annual Meeting. Journal of Clinical Oncology 2015; 33(15 Suppl): 7500. Dostupné z DOI: <http://dx.doi.org/10.1200/jco.2015.33.15_suppl.7500>.
27. Ramalingam SS, Belani CP, Ruel C et al. Phase II study of belinostat (PXD101), a histone deacetylase inhibitor, for second line therapy of advanced malignant pleural mesothelioma. J Thorac Oncol 2009; 4(1): 97–101. Dostupné z DOI: <http://dx.doi.org/10.1097/JTO.0b013e318191520c>.
28. Scagliotti GV, Gaafar RM, Nowak AK et al. Lume-meso: A double-blind, randomized, phase II/III study of nintedanib (N) + pemetrexed (P)/cisplatin (C) followed by maintenance N versus placebo + P/C followed by maintenance placebo for patients with unresectable malignant pleural mesothelioma (MPM). J Clin Oncol 2016; 34(15 Suppl): abstr. TS8574. Dostupné z DOI: <http://dx.doi.org/10.1200/JCO.2016.34.15_suppl.TPS8574>.
29. Christmas TI, Manning LS, Garlepp MJ et al. Effect of interferon alfa 2a on malignant mesothelioma. J Interferon Res 1993; 13(1): 9–12.
30. Astoul P, Picat-Joossen D, Viallat JR et al. Intrapleural administration of interleukin-2 for the treatment of patients with malignant pleural mesothelioma: a phase II study. Cancer 1998; 83(10): 2099–2104.
31. Schwarzenberger P, Harrison L, Weinacker A et al. The treatment of malignant pleural mesothelioma with gene modified cancer cells: a phase I study. Hum Gene Ther 1998; 9(17): 2641–2649.
32. Hassan R, Bera T, Pastan I. Mesothelin: a new target for immunotherapy. Clin Cancer Res 2004; 10(12 Pt 1): 3937–3942.
33. Alley EW, Schellens JH, Santoro A et al. Single-Agent Pembrolizumab for Patients with Malignant Pleural Mesothelioma (MPM). International Association for the Study of Lung Cancer, 2015. 16th World Conference on Lung Cancer. ORAL 11.03.
34. Remon J, Reguart N, Corral J et al. Malignant pleural mesothelioma: New hope in the horizon with novel therapeutic strategies. Cancer Treat Rev 2015; 41(1): 27–34. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ctrv.2014.10.007>.
35. Kolek V, Havel L, Pešek M et al. Pemetrexed and Cisplatin in Malignant Pleural Mesothelioma – Czech Experience. J Thorac Oncol 2015; 9(Suppl 2): 747. (P3.08–010).
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2017 Issue 11-
All articles in this issue
- Cílené vyhledávání nemocných s chronickou obstrukční plicní nemocí: stručný přehled
- Asthma bronchiale v kontextu vnitřního lékařství
- Diagnostika a léčba komunitní pneumonie – v jednoduchosti je klíč k úspěchu
- Nozokomiální pneumonie
- Pneumonie u imunokompromitovaných
- Idiopatická plicní fibróza. Umíme ji vždy správně diagnostikovat a léčit?
- Exogenní alergické alveolitidy: minimum pro praxi
- Sarkoidóza – nadále záhadné onemocnění
- Současný přístup k diagnostice, léčbě a prevenci tuberkulózy
-
Non-CF bronchiektázie dospělých: stručný přehled pro praxi
Dokument Sekce chorob s bronchiální obstrukcí České pneumologické a ftizeologické společnosti České lékařské společnosti J. E. Purkyně - Cystická fibróza dospělých
- Kardiovaskulární riziko spánkové apnoe a kazuistika
- Komplikace po transplantaci plic
- Nemalobuněčný karcinom plic
- Malobuněčný karcinom plic: epidemiologie, diagnostika a léčba
- Maligní mezoteliom pleury – dosud nepokořený nádor
- Spirometrie – základní vyšetření funkce plic
- Postavení bronchologie v pneumologické diagnostice
- Ultrasonografické vyšetření hrudníku v rukou lékaře klinika
- Neinvazivní ventilace
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Spirometrie – základní vyšetření funkce plic
- Neinvazivní ventilace
- Pneumonie u imunokompromitovaných
- Malobuněčný karcinom plic: epidemiologie, diagnostika a léčba
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

