-
Medical journals
- Career
Léčba pacientů infikovaných virem hepatitidy C genotypu 2
Authors: Petr Husa; Petr Husa Jr
Authors‘ workplace: Klinika infekčních chorob LF MU a FN Brno, pracoviště Bohunice
Published in: Vnitř Lék 2017; 63(1): 37-40
Category: Original Contributions
Overview
Úvod:
Infekce virem hepatitidy C (HCV) je celosvětově jednou z hlavních příčin chronického onemocnění jater.Cíl:
Retrospektivně zhodnotit výsledky léčby pacientů s infekcí HCV genotypu 2 na Klinice infekčních chorob LF MU a FN Brno během uplynulých 15 let.Pacienti a metodika:
V průběhu 15 let bylo na naší klinice léčeno 15 pacientů (9 mužů, 6 žen, průměrný věk 54,73 ± 13,83 roku, medián 54 let) chronicky infikovaných HCV genotypu 2. Jedná se o největší soubor pacientů s touto diagnózou léčených v České republice. Zastoupení jednotlivých subtypů genotypu 2 HCV bylo následující: 1krát subtyp 2a, 2krát subtypy 2a/2c, 5krát subtyp 2b, ve zbylých 7 případech byl stanoven jen genotyp 2 bez možnosti určit subtyp.Výsledky:
V letech 2002–2015 bylo 9 pacientů léčeno kombinací peginterferonu α-2a (180 µg 1krát týdně podkožně) a ribavirinu (800 mg denně) po dobu 24 týdnů, setrvalé virologické odpovědi (SVR) dosáhlo 6 z nich, tedy 67 %. Ve 2 případech došlo po skončení léčby k relapsu, v jednom případě byl zaznamenán breakthrough fenomén. V letech 2015–2016 bylo 7 pacientů léčeno kombinací sofosbuviru (400 mg) a ribavirinu (1 000 nebo 1 200 mg denně podle hmotnosti) – 6krát se jednalo o první léčbu infekce HCV, 1krát o léčbu po breakthrough fenoménu vzniklého při předchozí léčbě. Všech 7 pacientů dosáhlo SVR (100 %).Závěr:
Léčba infekce HCV genotypu 2 zatím nepředstavuje závažný terapeutický problém. V řadě rozvinutých zemí světa v posledních letech přibývá pacientů obtížně léčitelných, zejména cirhotiků. Léčebné možnosti se však rychle rozvíjejí.Klíčová slova:
chronická hepatitida C – genotyp 2 – pegylovaný interferon (IFN) – ribavirin – sofosbuvirÚvod
Infekce virem hepatitidy C (HCV) je celosvětově jednou z hlavních příčin chronického onemocnění jater. Dlouhodobý efekt infekce HCV je velmi variabilní, kolísá od minimálních histologických změn až po extenzivní fibrózu a cirhózu s/bez hepatocelulárního karcinomu (HCC). Odhaduje se, že na světě žije okolo 180 milionů osob s chronickou infekcí HCV, ale většina z nich o této infekci neví. Péče o pacienty infikované HCV se za posledních 20 let významně zlepšila díky lepšímu porozumění patofyziologii onemocnění, zdokonalení diagnostiky, terapeutických a preventivních možností.
Primárním cílem léčby chronické hepatitidy C je vyléčení infekce, tady dosažení setrvalé virologické odpovědi (SVR) definované jako nedetekovatelná nukleová kyselina viru (HCV RNA) v periferní krvi 12 nebo 24 týdnů po skončení antivirové léčby. Dosažení SVR je obecně spojeno s normalizací aktivity alaninaminotransferázy (ALT) a aspartátaminotransferázy (AST), ústupem nebo úplným vymizením jaterních nekroticko-zánětlivých změn a fibrózy. Pacienti s pokročilou jaterní fibrózou (F3 dle klasifikace METAVIR) nebo jaterní cirhózou (F4) zůstávají i po dosažení SVR v riziku vzniku závažných jaterních komplikací, i když fibróza většinou regreduje a nebezpečí vzniku jaterního selhání a portální hypertenze je sníženo. Podle výsledků recentních klinických studií je u úspěšně léčených osob riziko vzniku HCC signifikantně redukováno oproti neléčeným pacientům a pacientům, kteří nedosáhli SVR, ale není zcela eliminováno. Chronická infekce HCV je spojena s výskytem celé řady extrahepatálních manifestací (zejména se smíšenou kryoglobulinemií, řadou ledvinných chorob, non-hodgkinským B buněčným lymfomem). Antivirová léčba s velkou pravděpodobností zlepší nejen jaterní onemocnění a sníží riziko progrese choroby do jaterní cirhózy nebo hepatocelulárního karcinomu, ale u významné části alespoň přechodně sníží intenzitu projevů základní choroby [1].
Infekce HCV genotypu 2
Virus HCV je geneticky mimořádně polymorfní. Vyskytuje se v 6 základních genotypech (podle některých autorů je genotypů 7), označovaných číslicemi 1–6, resp. 7, a více než 50 subtypech, které se označují malými písmeny [2]. Jednotlivé genotypy HCV se navzájem liší v 31–33 % nukleotidových sekvencí, subtypy v 20–29 % sekvencí [3]. Celosvětově, ale i v České republice je zatím nejrozšířenější subtyp 1b. Proporcionální zastoupení infekce subtypy 1a a 3a však rychle narůstá [4]. Infekce genotypem 2, většinou se jedná o subtypy 2a a 2c, je v celosvětovém i tuzemském měřítku minoritní, historicky se popisuje zvýšený výskyt infekce genotypem 2 ve Středozemí [5].
Každý pacient s chronickou infekcí HCV je infikován směsí geneticky rozdílných, ale blízce příbuzných virionů o různé velikosti – anglický termín je quasispecies. Jejich proporcionální zastoupení závisí na jejich replikační kapacitě (anglicky fitness). Populace HCV je v dynamické rovnováze – každá změna životního prostředí viru však vede k poruše rovnováhy v distribuci virových quasispecies. Tyto virové částice se navzájem liší polymorfizmem v zastoupení aminokyselin, který je podmíněn vznikem mutací během replikačního cyklu. Následně selekční tlak vede k převaze mutant, které jsou replikačně zdatné.
Výše uvedený polymorfizmus je přítomen již v majoritní (divoké) populaci viru, léčba antivirovými léky potencuje selekci virových variant se sníženou senzitivitou k podávaným lékům. Úplná inhibice divokých variant viru, citlivých na přímo působící antivirotika (Direct-Acting-Antivirals – DAA), vytváří prostor pro rezistentní kmeny, aby rychle zaujaly jejich místo. Pokud dojde k sekundární (kompenzatorní) substituci aminokyselin, buď přirozeně existujícími, nebo vzniklými mutacemi během replikace rezistentní mutanty viru, může se tím zvýšit replikační aktivita (fitness) rezistentního viru a jeho zastoupení ve virové populaci rychle převládne. To se projeví buď jako návrat pozitivity HCV RNA v plazmě během antivirové léčby (breakthrough), nebo jako relaps virové infekce po skončení léčby.
Substituce aminokyselin, které podmiňují vznik rezistence, se označují jako resistance-associated substitutions (RAS), tedy substituce spojené s rezistencí. Virové varianty, které obsahují tyto RAS, a proto mají sníženou citlivost vůči DAA, se označují jako resistant variants (rezistentní varianty) [6].
Léčba pacientů infikovaných HCV genotypu 2
Infekce genotypy 2 a 3 se vždy považovala za snadněji léčitelnou než infekce jinými genotypy HCV. V éře pegylovaného interferonu (PEG-IFN) a ribavirinu (RBV) se při infekci genotypy 2 a 3 doporučovala nižší denní dávka RBV (800 mg), než tomu bylo u infekcí genotypy 1 a 4–6 (15 mg/kg) – v praxi to bylo většinou 1 000 nebo 1 200 mg denně. V případě přítomnosti nepříznivých vstupních parametrů (inzulinová rezistence, metabolický syndrom, závažná fibróza nebo cirhóza jaterní, vyšší věk) však byla určena dávka RBV 15 mg/kg/den. Délka léčby nemocných infikovaných genotypy 2 nebo 3 byla 24 týdnů s možností zkrácení na 16 týdnů, pokud byla nízká vstupní viremie a bylo dosaženo rychlé virologické odpovědi (RVR), tedy negativity HCV RNA v plazmě po 4 týdnech léčby. Léčba se neměla zkracovat v případě pokročilé fibrózy nebo jaterní cirhózy nebo přítomnosti komorbidit, které snižovaly pravděpodobnost dosažení SVR (inzulinová rezistence, metabolický syndrom, výrazná jaterní steatóza). Naproti tomu délka léčby infekce genotypy 1, 4–6 byla 48 týdnů, s možností zkrácení na 24 týdnů při nízké vstupní virémii a dosažení RVR [5].
Proteázové inhibitory 1. generace (boceprevir a telaprevir) byly prvními představiteli přímo působících virostatik DAA. Do praxe byly zavedeny v roce 2011 a Doporučený postup Evropské asociace pro studium jater (EASL) z roku 2013 doporučuje jejich kombinaci s PEG-IFN a RBV u naprosté většiny pacientů infikovaných genotypem 1. Pro nemocné infikované genotypy 2–6 se situace nezměnila, jiná léčba než dvojkombinace PEG-IFN a RBV nebyla možná [4].
V doporučeném postupu EASL z roku 2014 se objevují další 3 DAA (sofosbuvir – SOF, daklatasvir – DCV a simeprevir – SIM) a poprvé dochází k výrazné diverzifikaci terapeutických doporučení podle různých genotypů HCV. Pacienti infikovaní genotypem 2 by měli být léčeni kombinací SOF (400 mg denně) + RBV (1 000 nebo 1 200 mg denně podle hmotnosti) po dobu 12 týdnů. Jedná se tedy o první bezinterferonový režim určený pro nemocné infikované genotypem 2 [7].
Kombinace SOF + RBV (12 týdnů) je součástí i evropských doporučení z roku 2015. Je však patrno, že se už nejedná o optimální režim, protože u pacientů s jaterní cirhózou se doporučuje prodloužení podávání této dvojkombinace na 16 nebo 20 týdnů. Objevují se i další dvě možnosti léčby genotypu 2 – SOF (400 mg) + PEG-IFN + RBV a SOF + DCV (60 mg), v obou případech po dobu 12 týdnů, a to pro cirhotiky a pacienty v minulosti neúspěšně léčené [8].
Nejnovější doporučený postup EASL byl vydán 22. 9. 2016 a obsahuje již pouze bezinterferonové metody léčby infekce HCV. Pro léčbu osob infikovaných genotypem 2 stanovuje fixní kombinaci SOF (400 mg) + velpatasviru (VEP – 100 mg) v 1 tabletě podávané 1krát denně nebo kombinaci SOF (400 mg) a DCV (60 mg), a to v obou případech pro pacienty dosud neléčené i neúspěšně léčené v minulosti, bez jaterní cirhózy i cirhotiky [1].
Pacienti a metodika
Retrospektivně byla zhodnocena data od pacientů léčených na Klinice infekčních chorob LF MU a FN Brno v letech 2002–2016. V průběhu 15 let bylo léčeno 15 pacientů chronicky infikovaných HCV genotypu 2. Podle dostupných informací se jedná o největší soubor pacientů s touto diagnózou léčený v České republice.
Z uvedených 15 pacientů bylo 9 mužů a 6 žen, průměrný věk v době zahájení léčby byl 54,73 ± 13,83 roku, medián 54 let. Zastoupení jednotlivých subtypů genotypu 2 HCV bylo následující: 1krát subtyp 2a, 2krát subtypy 2a/2c, 5krát subtyp 2b, ve zbylých 7 případech byl stanoven jen genotyp 2 bez možnosti určit subtyp. Z hlediska pravděpodobného přenosu infekce HCV bylo nejčastější darování plazmy (6 pacientů) – v roce 1973 byla na transfuzním oddělení v Brně epidemie hepatitidy v té době nejasného původu, po více než 20 letech byla prokázána u několika dárců plazmy chronická hepatitida C, infekce genotypem 2, který je v České republice vzácný. Další 4 pacienti ze souboru dostali krevní transfuze před rokem 1992 (začátek testování krevních dárců v České republice), jeden je hemofilik (ročník narození 1971), který dostal v dětství množství antivirově neošetřených antihemofilických globulinů, jedna bývalá zdravotní sestra, která pracovala na chirurgii, jedna pacientka po transplantaci ledviny, která selhala a následně byla hemodialyzovaná. Poslední 2 pacienti se infikovali velmi pravděpodobně při sdílení injekčního instrumentaria při intravenózní aplikaci drog – žena ročník 1980 užívala drogy ve Velké Británii, muž, ročník 1990, je ve výkonu trestu a je bohatě tetován. Pokročilost jaterního procesu byla stanovena metodou sonografické elastografie (Shear Wave Elastography) u 6 pacientů – 3krát F0 (absence fibrózy), 1krát F3 (pokročilá, přemosťující fibróza), 2krát F4 (jaterní cirhóza) – byla použita klasifikace stupně fibrózy METAVIR. U zbylých 9 pacientů není pokročilost jaterního procesu známa, především pro odmítnutí či kontraindikaci jaterní biopsie před zavedením neinvazivních metod do klinické praxe.
Výsledky
Pacienti byli léčeni 2 různými terapeutickými způsoby, které odrážejí vývoj léčebných doporučení a lokálních možností pro nemocné infikované HCV genotypu 2. Výsledky jsou uvedeny v tab.
Table 1. Výsledky léčby pacientů infikovaných HCV genotypu 2 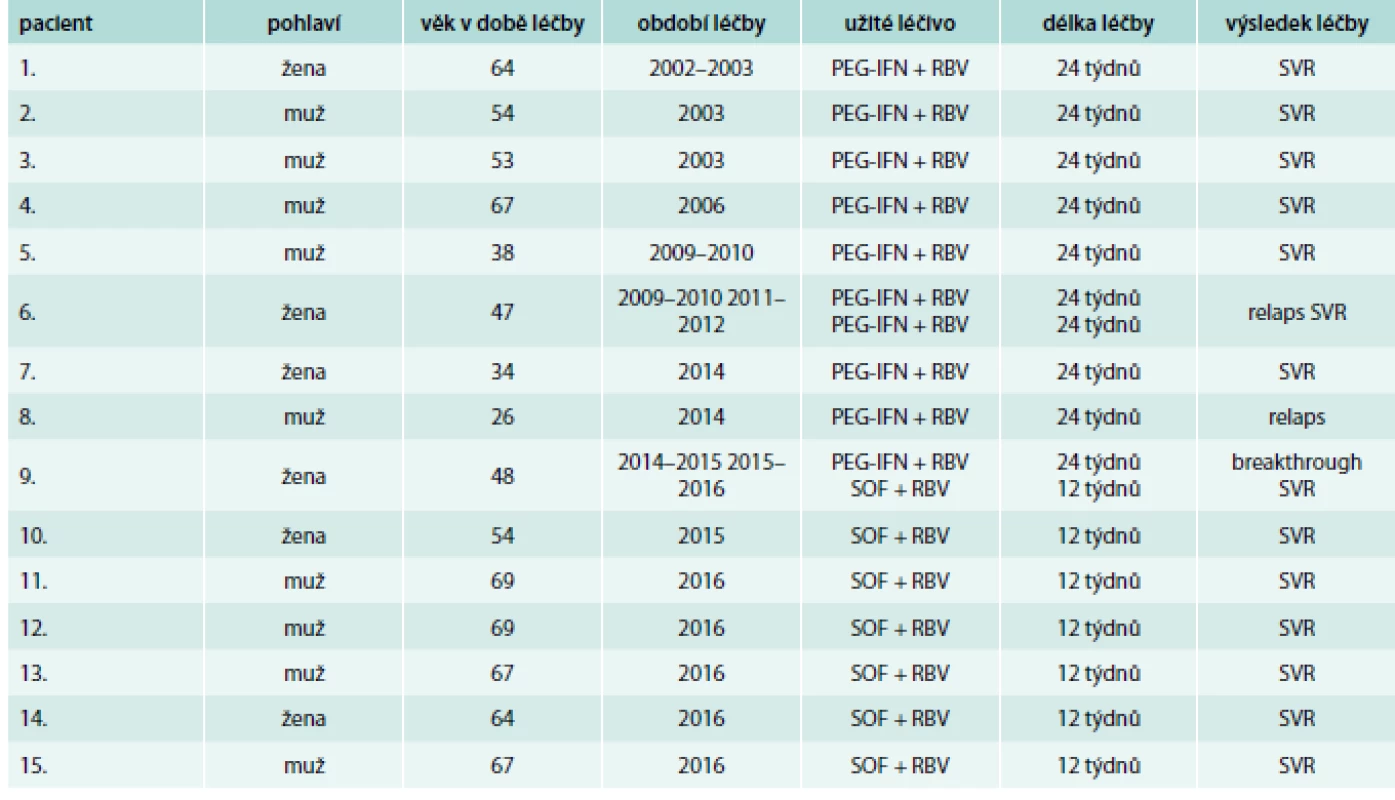
PEG-IFN – pegylovaný interferon α RBV – ribavirin SVR – setrvalá virologická odpověď (vysvětlení pojmu v textu) Kombinací PEG-IFN (peginterferon α-2a 180 µg 1krát týdně podkožně) a RBV (1 000 nebo 1 200 mg denně podle hmotnosti pacienta) bylo léčeno 9 pacientů po dobu 24 týdnů, přičemž SVR dosáhlo 6 z nich, tedy 67 %. Ve 2 případech došlo po skončení léčby k relapsu, tedy znovuobjevení pozitivity HCV RNA v plazmě po skončení léčby. V 1 případě byl zaznamenán breakthrough fenomén, tedy pozitivita HCV RNA v plazmě po předchozí negativitě ještě v průběhu léčby. Opakovaná kúra PEG-IFN a RBV po dobu 24 týdnů vedla k dosažení SVR u pacientky po předchozím relapsu (pacientka pod číslem 6 v tab), u pacientky číslo 9 bylo dosaženo SVR kombinací SOF + RBV podávanou 12 týdnů po předchozím breakthrough fenoménu při léčbě PEG-IFN a RBV. Dalších 6 pacientů léčených v letech 2015–2016 kombinací SOF (400 mg denně) a RBV (1 000 nebo 1 200 mg denně podle hmotnosti pacienta) dosáhlo SVR. Celkem tedy bylo trvale vyléčeno 14 z 15 pacientů (93 %), poslední pacient (číslo 8, po relapsu při léčbě PEG-IFN a RBV) zatím neabsolvoval bezinterferonovou léčbu.
Diskuse
V pilotních studiích zabývajících se léčbou nemocných infikovaných genotypy 2 a 3 kombinací PEG-IFN a RBV bylo dosaženo SVR v 76 a 82 % případů [5]. Metaanalýza prokázala vyšší pravděpodobnost dosažení SVR při infekci genotypem 2 než 3 (74 % vs 69 %) [9]. Výsledky prezentovaného souboru pacientů je obtížné srovnávat s výsledky klinických studií či metaanalýzy, protože se jedná o nesrovnatelně menší počet léčených pacientů, přesto se jeví jako podobné.
Ve studii FISSION bylo léčeno 12 týdnů kombinací PEG-IFN a RBV 73 dosud neléčených pacientů infikovaných genotypem 2. SVR bylo dosaženo u 69 z nich (95 %) [10]. Úspěšnost byla vyšší u pacientů bez cirhózy (97 %) než u cirhotiků (83 %) [10]. Ve studii POSITRON bylo léčeno stejnou kombinací 109 pacientů nevhodných pro léčbu PEG-IFN nebo s touto léčbou nesouhlasících, SVR dosáhlo 101 z nich, tedy 93 %. Ve studii FUSION se srovnával efekt 12 a 16 týdnů léčby kombinací SOF + RBV. Studie prokázala, že cirhotici by měli být léčeni delší dobu (78 % vs 60 % SVR) [11]. Studie VALENCE porovnávala vliv předchozí léčby na pravděpodobnost dosažení SVR. Kombinace SOF a RBV podávaná 12 týdnů vedla k dosažení SVR častěji u dosud neléčených pacientů než těch v minulosti neúspěšně léčených PEG-IFN a RBV – u pacientů bez cirhózy to bylo 97 % vs 91 %, u cirhotiků 100 % vs 88 % [12]. Z výsledků těchto studií vyplynulo doporučení prodloužit léčbu pacientů s cirhózou a/nebo v minulosti neúspěšně léčených na 16–20 týdnů [8]. V našem souboru bylo léčeno kombinací SOF (400 mg) a RBV (1 000 nebo 1 200 mg denně podle hmotnosti) 7 pacientů (6krát se jednalo o první léčbu infekce HCV, 1krát o léčbu breakthrough fenoménu vzniklého při předchozí léčbě PEG-IFN a RBV. Všech 7 pacientů dosáhlo SVR (100 %).
Závěr
Infekce genotypem 2 HCV není v České republice častá. Představuje asi 1–2 % všech případů chronické infekce HCV. Léčba infekce tímto genotypem zatím nepředstavuje závažný terapeutický problém. Jak ukazuje neustálý vývoj terapeutických doporučení EASL, v řadě rozvinutých zemí světa přibývá pacientů obtížně léčitelných, zejména cirhotiků. V současnosti se proto účinnost kombinace sofosbuviru s ribavirinem považuje za suboptimální a doporučuje se používat kombinaci sofosbuviru s velpatasvirem nebo s daklatasvirem. Velmi pravděpodobně ani tato doporučení nebudou definitivní, protože komerční dostupnost nových perorálních virostatik účinných proti HCV velmi rychle progreduje.
prof. MUDr. Petr Husa, CSc.
husa.petr@fnbrno.cz
Klinika infekčních chorob LF MU a FN Brno, pracoviště Bohunice
www.fnbrno.cz
Doručeno do redakce 26. 10. 2016
Přijato po recenzi 7. 12. 2016
Sources
1. [European Association for the Study of Liver]. EASL recommendations on treatment of hepatitis C 2015. J Hepatol 2015; 63(1): 199–236. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jhep.2015.03.025>. Dostupné z WWW:
. [30.9.2016]. 2. Murphy D, Chamberland J, Dandavino R et al. A new genotype of hepatitis C virus originating from Central Africa. Hepatology 2007; 46(4 Suppl 1): S623A.
3. Tillmann HL, McHutchison JG. Hepatitis C. In: Boyer TD, Manns MP, Sanyal. A Zakim and Boyer´s Hepatology: A Textbook of Liver Disease – Expert Consult. 6th ed. Elsevier Saunders: Philadelphia 2012 : 574–576. ISBN 978–1437708813.
4. [European Association for the Study of Liver]. EASL Clinical Practice Guidelines: Management of hepatitis C virus infection. J Hepatol 2014; 60(2): 392–420. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jhep.2013.11.003>.
5. [European Association for the Study of Liver]. EASL Clinical Practice Guidelines: Management of hepatitis C virus infection. J Hepatol 2011; 55(2): 245–264. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jhep.2011.02.023>.
6. Pawlotsky JM. Hepatitis C virus resistance to Direct-Acting Antiviral drugs in interferon-free regimens. Gastroenterology 2016; 151(1): 70–86. Dostupné z DOI: <http://dx.doi.org/10.1053/j.gastro.2016.04.003>.
7. [European Association for the Study of Liver]. EASL recommendations on treatment of hepatitis C 2014. J Hepatol 2014; 61(2): 373–395. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jhep.2014.05.001>.
8. [European Association for the Study of Liver]. EASL recommendations on treatment of hepatitis C 2015. J Hepatol 2015; 63(1): 199–236.
9. Kershenobich D, Muñoz L, Malé R et al. Proceed with caution peginterferon alpha-2a versus peginterferon-alpha-2b in chronic hepatitis C. A systematic review of randomized trials reply. Hepatology 2010; 52(6): 2240–2241. Author reply: Awad T et al. Hepatology 2010; 52(6): 2241–2.
10. Lawitz E, Mangia A, Wyles D et al. Sofosbuvir for previously untreated chronic hepatitis C infection. N Engl J Med 2013; 368(20): 1878–1887. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1214853>.
11. Jacobsson IM, Gordon SC, Kowdley KV et al. Sofosbuvir for hepatitis C genotype2 and 3 patients without treatment options. N Engl J Med 2013; 368 : 1867–1877. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1214854>.
12. Zeuzem S, Dusheioko GM, Salupere R et al. Sofosbuvir and ribavirin in HCV genotypes 2 and 3. N Engl J Med 2014; 370(21): 1993–2001. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1316145>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2017 Issue 1-
All articles in this issue
- Predátorské časopisy: praktiky jejich vydavatelů a jak se jim bránit
- Uzávěr ouška levé síně systémem AtriClip
- Léčba pacientů infikovaných virem hepatitidy C genotypu 2
- Příspěvek k diferenciální diagnostice sklerozujících cholangitid
- Význam hodnocení ventilační efektivity VE/VCO2 slope u pacientů se srdečním selháním
- 2nd Prague European Days of Internal Medicine
- ScreenPro FH – projekt v oblasti screeningu zaměřený na familiární hypercholesterolemii ve střední, jižní a východní Evropě: základní epidemiologie
- ScreenPro FH – projekt v oblasti screeningu zaměřený na familiární hypercholesterolemii ve střední, jižní a východní Evropě: odůvodnění a záměr
- Appendix diagnostica – Familial hypercholesterolemia diagnostic criteria
- Progresívna multifokálna leukoencefalopatia spojená s rituximabom
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Uzávěr ouška levé síně systémem AtriClip
- Význam hodnocení ventilační efektivity VE/VCO2 slope u pacientů se srdečním selháním
- Progresívna multifokálna leukoencefalopatia spojená s rituximabom
- Příspěvek k diferenciální diagnostice sklerozujících cholangitid
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

