-
Medical journals
- Career
Volí diabetologové terapii racionálně?
Základní výsledky projektu PROROK (Prospektivní observační projekt významu diference glykemie nalačno a postprandiální glykemie pro odhad úspěšnosti terapie diabetu 2. typu)
Authors: Denisa Janíčková Žďárská 1; Pavlína Piťhová 1; Tomáš Pavlík 2; Milan Kvapil 1
Authors‘ workplace: Interní klinika 2. LF UK a FN Motol Praha, přednosta prof. MUDr. Milan Kvapil, CSc., MBA 1; Institut biostatistiky a analýz LF MU Brno, ředitel doc. RNDr. Ladislav Dušek, Ph. D. 2
Published in: Vnitř Lék 2015; 61(4): 295-300
Category: Original Contributions
Overview
Úvod:
Projekt PROROK (Prospektivní observační projekt významu diference glykemie nalačno a postprandiální glykemie pro odhad úspěšnosti terapie diabetu 2. typu) měl charakter neintervenčního, prospektivního, multicentrického observačního projektu s délkou trvání 6 měsíců, jehož cílem byla kvantifikace významu rozdílu mezi glykemií nalačno a postprandiálně pro úspěšnost léčby agonisty pro GLP1 resp. léčby inzulinem bazálním, premixovaným, nebo kombinací bazálního a bolusového inzulinu. Lékaři vybírali léčbu pro neuspokojivě kompenzované pacienty dle vlastního uvážení, zařazeno bylo celkem 4 972 pacientů.Cíl:
Cílem práce bylo zhodnocení rozdílů v základních antropometrických a biochemických parametrech mezi skupinami pacientů zařazených do projektu PROROK se zřetelem k volbě terapie ošetřujícím diabetologem.Metodika a výsledky:
Pacienti léčení agonisty receptoru GLP1 byli významně mladší, trpí diabetem kratší dobu a zároveň byli obéznější a měli nejvyšší koncentraci triacylglycerolů. Pacienti, u nichž byla volena terapie bazálním inzulinem, měli nejvyšší glykemii nalačno. Pacienti, u nichž byla volena terapie premixovaným inzulinem nebo režimem bazálního a bolusového inzulinu, měli nejvyšší glykemii postprandiálně, pacienti s režimem bazálního a bolusového inzulinu měli nejvyšší vstupní glykovaný hemoglobin. Rozdíl mezi glykemií nalačno a postprandiálně byl nejmenší ve skupině, u níž byla volena terapie bazálním inzulinem a nejvyšší ve skupině vybrané k terapii premixovaným inzulinem resp. kombinací bazálního a bolusového inzulinu. Průměrné zlepšení glykovaného hemoglobinu bylo v celém souboru 1,6 %, medián výsledného glykovaného hemoglobinu byl 5,9 % resp. 5,8 % (léčení agonisty receptoru pro GLP1). Všechny rozdíly p < 0,001.Závěr:
Při vědomí skutečnosti, že rozdíly nalezené v parametrech popisujících soubory jsou sice statisticky významné, ale klinicky jsou méně relevantní, považujeme za důležitou skutečnost, že výběr terapie je v konkordanci se základními poznatky o patofyziologii diabetu 2. typu a možnostmi individuálně volené cílené intervence antidiabetickou terapií. Lékaři účastnící se v projektu PROROK tedy volí většinou terapii racionálně.Klíčová slova:
agonisté receptoru pro GLP1 – bazální inzulin – intenzifikovaný inzulinový režim – inzulin – premixovaný inzulin – terapie diabetes mellitus 2. typuÚvod
Základními patofyziologickými poruchami, které způsobují diabetes mellitus (DM), jsou inzulinová rezistence a kvalitativní a kvantitativní porucha sekreci inzulinu [1]. U významné části pacientů se připojuje relativní insuficience inkretinové osy [2]. Hyperglykemie nalačno je obvykle korelátem inzulinové rezistence jaterních buněk, která způsobuje zvýšenou produkci glukózy hepatocyty v důsledku nedostatečné inhibice glykogenolýzy a glukoneogeneze [1]. Postprandiální hyperglykemie je při standardní diabetické dietě způsobena insuficiencí sekrece inzulinu [3].
Třídy antidiabetik, které jsou v současnosti k dispozici, ovlivňují různě intenzivně jednotlivé defekty přítomné u diabetu 2. typu (DM2T), v důsledku pak zlepšují odlišně glykemii nalačno či exkurze postprandiální glykemie [4]. Bazální inzulinová analoga snižují primárně glykemii nalačno [5–7]. Agonisté receptoru pro GLP1 (agonisté GLP1R) snižují primárně postprandiální vzestup glykemie (exenatid, lixisenatid) [7–10], agonisté GLP1R s delším poločasem účinku snižují významně také glykemii nalačno (liraglutid) [11]. Agonisté GLP1R snižují také tělesnou hmotnost [12]. Premixované inzuliny snižují glykemii nalačno i postprandiální exkurze glykemie [13]. Podobně účinkuje režim bazálního inzulinu s prandiálními bolusy, jehož výhodou je jistá možnost individuálního nastavení jednotlivých dávek inzulinu [14].
Cílem práce bylo zhodnocení rozdílů v základních antropometrických a biochemických parametrech mezi skupinami pacientů zařazených do observačního projektu PROROK se zřetelem k volbě terapie ošetřujícím diabetologem.
Metody
Popis projektu
Projekt PROROK (Prospektivní observační projekt významu diference glykemie nalačno a postprandiální glykemie pro odhad úspěšnosti terapie diabetu 2. typu) měl charakter neintervenčního, prospektivního, multicentrického observačního projektu s délkou trvání 6 měsíců, jehož cílem byla kvantifikace významu rozdílu mezi glykemií nalačno a postprandiálně pro úspěšnost léčby agonisty GLP1R (skupina EG) resp. léčby inzulinem bazálním (skupina EB), premixovaným (skupina EP) nebo kombinací bazálního a bolusového inzulinu (skupina EIIT).
Projektu se účastnilo 77 diabetologických ambulancí. Do projektu byli zařazeni pacienti, jejichž glykovaný hemoglobin byl vyšší než 6 % (IFCC) a u nichž se ošetřující lékař rozhodl pro intenzifikaci jedním z výše uvedených způsobů. Zaznamenána byla základní antropometrická a laboratorní data, glykemie nalačno (FG) a postprandiálně (PPG), glykovaný hemoglobin (HbA1c) a způsob léčby. Kontrolní data byla zaznamenána po 3 a 6 měsících.
Soubor pacientů
Do projektu PROROK bylo zařazeno celkem 4 972 pacientů. Na základě vyplněných údajů o typu diabetu, glykemii nalačno a po jídle při vstupní návštěvě a hodnotách glykovaného hemoglobinu při vstupní návštěvě i při kontrolních návštěvách po 3 a 6 měsících byla provedena validace.
Do analýzy byli zařazeni pouze pacienti splňující tato 4 kritéria:
- pacienti s DM2T
- pacienti s hodnotou glykemie na lačno i po jídle v rozmezí 2–40 mmol/l
- pacienti s hodnotou HbA1c při vstupní návštěvě ≥ 6 % a < 20 %
- pacienti s hodnotou HbA1c při kontrolní návštěvě po 3 a 6 měsících < 20 %
Těmto kritériím vyhovovalo a do analýzy tedy bylo zařazeno celkem 4 561 pacientů.
Zbylých 411 pacientů nebylo zařazeno do analýzy z následujících důvodů, přičemž u jednoho pacienta mohlo být nesplněno více než jedno kritérium: 68 pacientů bez DM2T, nebo typ DM není uveden, 70 pacientů bez zaznamenané glykemie nalačno nebo po jídle při vstupní návštěvě, 15 pacientů s hodnotou glykemie nalačno nebo po jídle < 2 mmol/l nebo > 40 mmol/l, 122 pacientů bez vstupní hodnoty HbA1c, nebo HbA1c ≤ 6 %, nebo HbA1c ≥ 20 %, 163 pacientů bez uvedeného glykovaného hemoglobinu při kontrolní návštěvě po 3 nebo 6 měsících.
Statistické metody
Data nasbíraná v projektu PROROK byla nejprve podrobena validaci s ohledem na klíčové údaje pro hodnocení primárního cíle studie. Na základě validace dat byl následně definován soubor pacientů pro analýzu. Popis souboru byl proveden s pomocí základních popisných statistik: četnosti, průměru, směrodatné odchylky, mediánu, minima a maxima. Rozdíly v demografických charakteristikách a laboratorních parametrech mezi sledovanými skupinami pacientů byly hodnoceny pomocí neparametrických testů – χ2 testu pro kategoriální data a Kruskalova-Wallisova testu pro spojitá data. Jako hladina pro statistickou významnost byla uvažována hodnota 0,05.
Výsledky
Tab. 1 ukazuje rozdělení pacientů dle podané léčby – nejméně pacientů bylo zařazeno do větve s premixovanými inzuliny. Tab. 2 sumarizuje pacienty bez dělení dle podávané léčby. Tab. 3 a 4 ukazují rozdíly v charakteristice podskupin pacientů dle podané léčby.
Table 1. Počty pacientů v jednotlivých větvích dle nasazené léčby 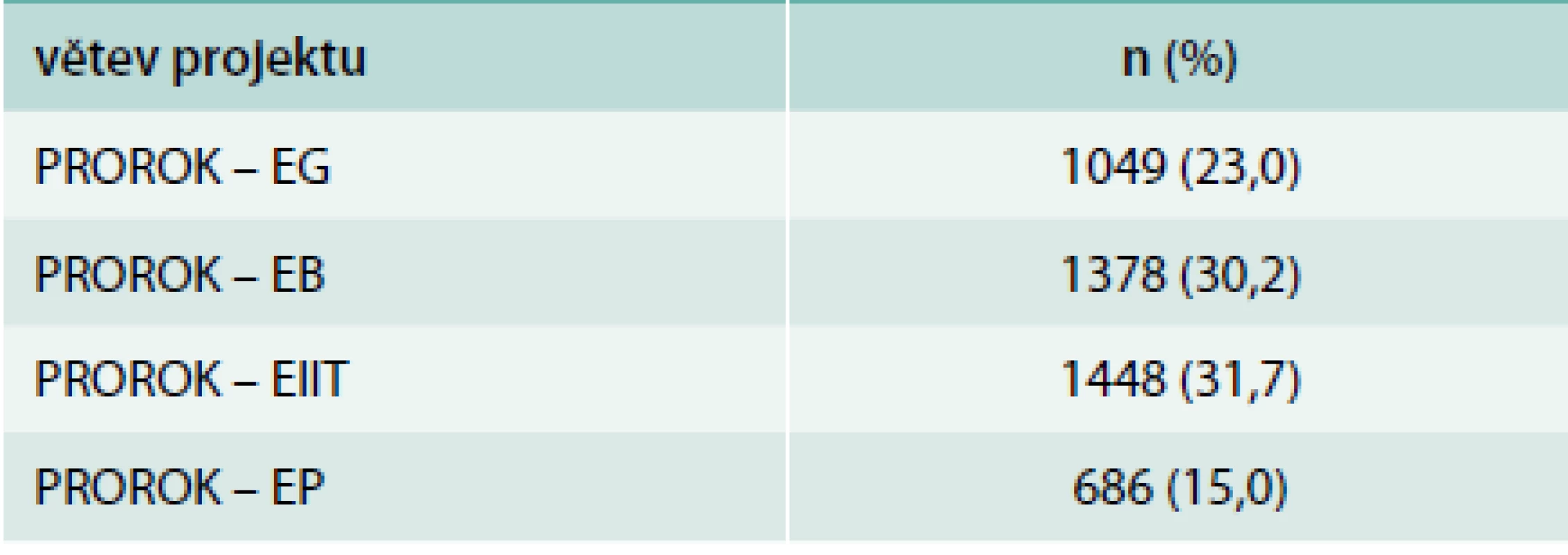
EG – léčba agonisty receptoru pro GLP1 EB – léčba inzulinem bazálním EP – léčba inzulinem premixovaným EIIT – léčba kombinací bazálního a bolusového inzulinu Table 2. Základní charakteristika celého souboru 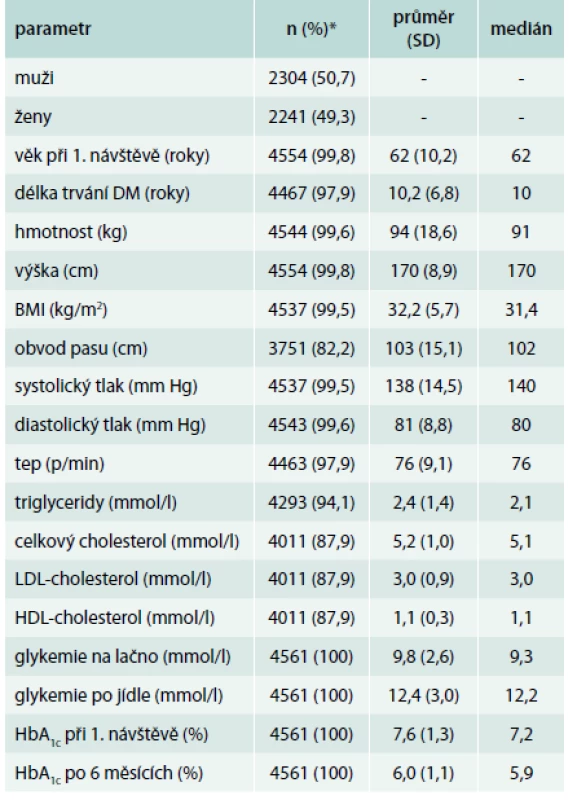
* Vyjma pohlaví (uveden počet a procentuální zastoupení mužů) je vždy uveden počet a procento pacientů, u kterých je daná hodnota známa. Table 3. Základní charakteristika souborů podle zvolené terapie 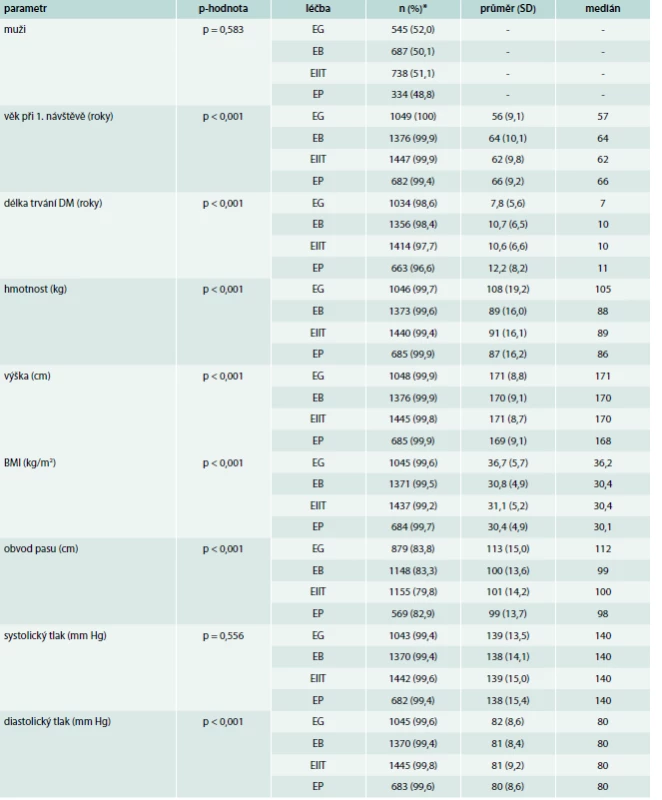
* Vyjma pohlaví (uveden počet a procentuální zastoupení mužů) je vždy uveden počet a procento pacientů, u kterých je daná hodnota známa. EG – léčba agonisty receptoru pro GLP1 EB – léčba inzulinem bazálním EP – léčba inzulinem premixovaným EIIT – léčba kombinací bazálního a bolusového inzulinu Table 4. Základní charakteristiky pacientů dle nasazené léčby 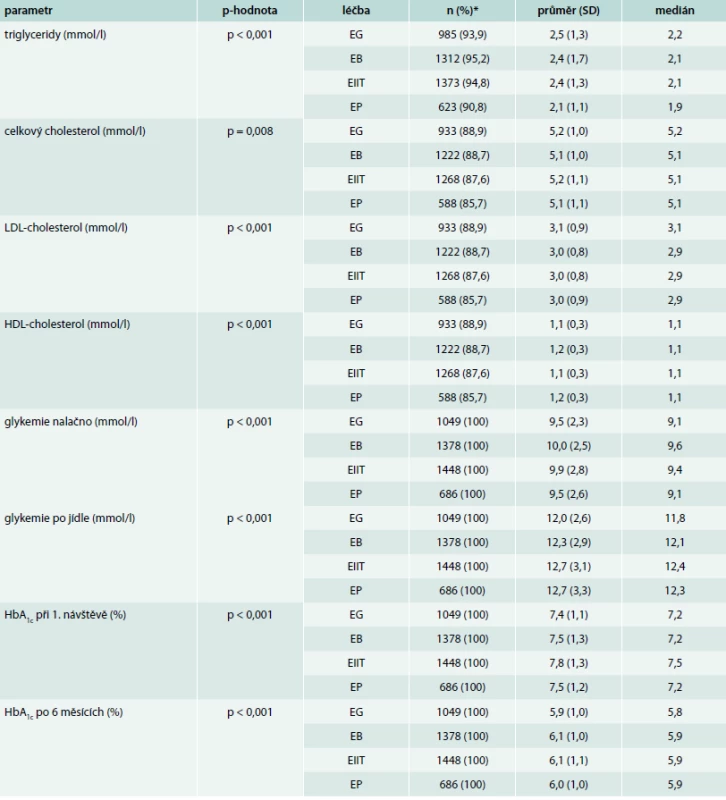
*Počet a procento pacientů, u kterých je daná hodnota známa. EG – léčba agonisty receptoru pro GLP1 EB – léčba inzulinem bazálním EP – léčba inzulinem premixovaným EIIT – léčba kombinací bazálního a bolusového inzulinu Z výsledků je vidět, že pacienti léčení agonisty GLP1R (větev EG) jsou významně mladší, trpí diabetem kratší dobu a zároveň jsou obéznější. Další statisticky významné rozdíly v základních charakteristikách jsou zřejmě způsobeny velkým počtem hodnocených pacientů, neboť nejsou klinicky relevantní.
Tab. 4 ukazuje rozdíly v základních biochemických parametrech ve skupinách dle podané léčby. Z výsledků je vidět, že u všech parametrů je statisticky významný rozdíl mezi skupinami. Pacienti skupiny EG mají nejvyšší koncentraci triacylglycerolů, pacienti ve skupině EB mají nejvyšší glykemii nalačno, pacienti ve skupinách EIIT a EP mají nejvyšší glykemii postprandiálně a pacienti ve skupině EIIT mají nejvyšší vstupní glykovaný hemoglobin. Rozdíl mezi glykemií nalačno byl nejmenší ve skupině EB a nejvyšší ve skupině EP resp. EIIT.
Průměrné zlepšení glykovaného hemoglobinu bylo v celém souboru 1,6 %, medián výsledného glykovaného hemoglobinu byl 5,9 % resp. 5,8 % (EG).
Diskuse
Projekt PROROK (Prospektivní observační projekt významu diference glykemie nalačno a postprandiální glykemie pro odhad úspěšnosti terapie diabetu 2. typu) měl charakter neintervenčního, prospektivního, multicentrického observačního projektu s délkou trvání 6 měsíců, jehož cílem byla kvantifikace významu rozdílu mezi glykemií nalačno a postprandiálně pro úspěšnost léčby agonisty GLP1R (skupina EG) resp. léčby inzulinem bazálním (skupina EB), premixovaným (skupina EP) nebo kombinací bazálního a bolusového inzulinu (skupina EIIT). Lékaři vybírali léčbu pro neuspokojivě kompenzované pacienty dle vlastního uvážení. Projekt se tak blíží reálné praxi, ve které může lékař volit terapii podle individuálního profilu pacienta na rozdíl od randomizovaných klinických studií. Observační studie se dostávají do popředí zájmu právě proto, že se do doporučených postupů pro terapii dostávají aspekty individuálního výběru antidiabetika [15].
Bazální inzulin sníží zejména glykemii nalačno [5–7]. Tuto terapii volili lékaři pro pacienty s nejvyšší glykemií nalačno, nejmenším vzestupem glykemie postprandiálně.
Agonisté GLP1R jsou v České republice hrazeny z prostředků veřejného zdravotního pojištění podle tzv. indikačního omezení „P“. Limitem je krom jiných podmínek index tělesné hmotnosti (BMI) > 35 kg/m2. Tato podmínka samozřejmě ovlivňuje výběr pacientů, koreluje s nejvyšším BMI v této skupině. Proto ve skupině EG byla významně vyšší hmotnost i BMI. Obezita indukuje inzulinovou rezistenci [16], triycylglycerolemie koreluje se stupněm inzulinové rezistence [1,16], což může být vysvětlením skutečnosti, že v této skupině byla nejvyšší sérová hladina triacylglycerolů.
S postupnou progresí DM2T se snižuje zejména postprandiální sekrece inzulinu [1]. Korelátem je vyšší exkurze glykemie postprandiálně [17]. V této fázi je nejúčinnější intervencí prandiální inzulin. Tuto terapii (EIIT a EP) volili lékaři právě u osob s nejvyšším rozdílem mezi glykemií nalačno a postprandiálně.
Při vědomí skutečnosti, že rozdíly nalezené v parametrech popisujících soubory jsou sice statisticky významné, ale klinicky jsou méně relevantní, považujeme za důležitou skutečnost, že výběr terapie je v konkordanci se základními poznatky o patofyziologii DM2T a možnostmi individuálně volené cílené intervence antidiabetickou terapií. Lékaři účastnící se v projektu PROROK tedy volí většinou terapii racionálně.
Poznámka: hodnoty glykovaného hemoglobinu HbA1c jsou uváděny v procentech (IFCC), protože projekt vznikal v době, kdy laboratoře udávaly výsledek v těchto jednotkách (hodnoty v mmol/mol získáme vynásobením 10).
Práce byla podpořena Diabetickou asociací ČR.
prof. MUDr. Milan Kvapil, CSc., MBA
milan.kvapil@fnmotol.cz
Interní klinika 2. LF UK a FN Motol, Praha
www.fnmotol.cz
Doručeno do redakce 24. 2. 2015
Přijato po recenzi 13. 3. 2015
Sources
1. DeFronzo RA. Lilly lecture 1987. The triumvirate: beta-cell, muscle, liver. A collusion responsible for NIDDM. Diabetes 1988; 37(6): 667–687.
2. Calanna S, Christensen M, Holst JJ et al. Secretion of glucagon-like peptide-1 in patients with type 2 diabetes mellitus: systematic review and meta-analyses of clinical studies. Diabetologia 2013; 56(5): 965–972.
3. Kvapil M, Perušičová J. Postprandiální glykémie. Triton: Praha 2006. ISBN 80–7254–785–2.
4. DeFronzo RA. Current issues in the treatment of type 2 diabetes. Overview of newer agents: where treatment is going. Am J Med 2010; 123(3 Suppl): S38-S48.
5. Niswender KD. Basal insulin: physiology, pharmacology, and clinical implications. Postgrad Med 2011; 123(4): 17–26.
6. Philis-Tsimikas A. Initiating basal insulin therapy in type 2 diabetes: practical steps to optimize glycemic control. Am J Med 2013; 126(9 Suppl 1): S21-S27.
7. Heine RJ, Van Gaal LF, Johns D et al. GWAA Study Group. Exenatide versus insulin glargine in patients with suboptimally controlled type 2 diabetes: a randomized trial. Ann Intern Med 2005; 143(8): 559–569.
8. Roubícek T, Mráz M, Bártlová M et al. The influence of 6-months treatment with exenatide on type 2 diabetes mellitus compensation, anthropometric and biochemical parameters. Vnitř Lék 2010; 56(1): 15–20.
9. Drucker DJ, Buse JB, Taylor K et al. DURATION-1 Study Group. Exenatide once weekly versus twice daily for the treatment of type 2 diabetes: a randomised, open-label, non-inferiority study. Lancet 2008; 372(9645): 1240–1250.
10. Riddle MC, Aronson R, Home P et al. Adding once-daily lixisenatide for type 2 diabetes inadequately controlled by established basal insulin: a 24-week, randomized, placebo-controlled comparison (GetGoal-L). Diabetes Care 2013; 36(9): 2489–2496.
11. Degn KB, Juhl CB, Sturis J et al. One week’s treatment with the long-acting glucagon-like peptide 1 derivative liraglutide (NN2211) markedly improves 24-h glycaemia and alpha - and beta-cell function and reduces endogenous glucose release in patients with type 2 diabetes. Diabetes 2004; 53(5): 1187–1194.
12. Sun F, Chai S, Li L et al. Effects of Glucagon-Like Peptide-1 Receptor Agonists on Weight Loss in Patients with Type 2 Diabetes: A Systematic Review and Network Meta-Analysis. J Diabetes Res 2015; 2015 : 157201. Dostupné z WWW: <http://dx.doi.org/10.1155/2015/157201>.
13. Kvapil M. Premixované inzuliny v léčbě diabetu. Remedia 2013; 23(5): 2–8.
14. Moghissi E, King AB. Individualizing insulin therapy in the management of type 2 diabetes. Am J Med 2014; 127(10 Suppl): S3-S10.
15. Inzucchi SE, Bergenstal RM, Buse JB et al. Management of hyperglycemia in type 2 diabetes, 2015: a patient-centered approach: update to a position statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2015; 38(1): 140–149.
16. Ferrannini E, Camastra S, Gastaldelli A et al. Beta-cell function in obesity: effects of weight loss. Diabetes 2004; 53(Suppl 3): S26-S33.
17. Kvapil M. Klinický význam postprandiální glykemie u diabetu 2. typu. Remedia 2011; 21(5): 14–18.
Labels
Anaesthesiology, Resuscitation and Inten Angiology Clinical biochemistry Paediatric gastroenterology Paediatric cardiology Paediatric nephrology Paediatric neurology Paediatric clinical oncology Paediatric pneumology Paediatric rheumatology Diabetology Endocrinology Pharmacy Clinical pharmacology Gastroenterology and hepatology Geriatrics Haematology Hygiene and epidemiology Medical virology Intensive Care Medicine Internal medicine Cardiology Nephrology Neurology Obesitology Clinical oncology Anatomical pathology Pneumology and ftiseology Medical assessment Occupational medicine General practitioner for children and adolescents General practitioner for adults Radiotherapy Rheumatology Nurse Sexuology Forensic medical examiner Toxicology Trauma surgery Home nurse Medical student
Article was published inInternal Medicine

2015 Issue 4-
All articles in this issue
- Biosimilární inzuliny – nové možnosti v léčbě diabetu
- Léčba diabetu u pacientů s onemocněním jater a ledvin
- Možnosti terapie agonisty receptoru pro GLP1 u diabetiků s nefropatií
- Léčba agonisty receptoru pro GLP1 a kontrola hmotnosti
- Léčba diabetu u osob vyššího věku
- Problematika infekce při syndromu diabetické nohy
- Léčba hypertenze u diabetes mellitus
- Pohybová aktivita u pacientů s mikrovaskulárními komplikacemi diabetu
- Glykace proteinů oční čočky u diabetiků a její neinvazivní měření – první zkušenosti v České republice
- miRNA-192, miRNA-21 a miRNA-200: nové markery karcinomu pankreatu u diabetiků?
- Pokroky ve vývoji inzulinových pump a jejich pokročilých automatických funkcí
- Mikrobiální flóra trávicího traktu a diabetes
- Myokiny – hormony svalové tkáně
- Postavení nových antidiabetik v klinické praxi: SGLT2 vs DPP4 inhibitory
-
Volí diabetologové terapii racionálně?
Základní výsledky projektu PROROK (Prospektivní observační projekt významu diference glykemie nalačno a postprandiální glykemie pro odhad úspěšnosti terapie diabetu 2. typu)
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Myokiny – hormony svalové tkáně
- Léčba diabetu u pacientů s onemocněním jater a ledvin
- Léčba agonisty receptoru pro GLP1 a kontrola hmotnosti
- Léčba hypertenze u diabetes mellitus
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

