-
Medical journals
- Career
Léčba agonisty receptoru pro GLP1 a kontrola hmotnosti
: Petr Žák; Jindřich Olšovský
: Diabetologické centrum II. interní kliniky LF MU a FN u sv. Anny Brno, přednosta prof. MUDr. Miroslav Souček, CSc.
: Vnitř Lék 2015; 61(4): 316-319
: Reviews
Prevalence obezity narůstá ve všech věkových skupinách ve většině zemí Evropské unie. Mnoho pacientů s obezitou má již v anamnéze několik úspěšných pokusů o redukci hmotnosti, ale velmi málo pacientů si je schopno následně pokles váhy udržet po delší časové období. Zahájení léčby agonisty receptoru pro GLP1 (GLP1 RA) během váhového poklesu snižuje zvýšenou hladinu solubilních leptinových receptorů, zvyšuje hladinu volného leptinu, a tímto mechanizmem snižuje riziko následného vzestupu váhy. Oproti tomu zahájení inzulinové terapie u pacientů s diabetem 2. typu je často provázeno váhovým přírůstkem. Léčba GLP1 RA vede k redukci HbA1c a současně k poklesu váhy, představuje proto nadějnou alternativu k léčbě bazálním inzulinem. Až budoucnost nám ukáže, zda nebudeme častěji indikovat GLP1 RA spíše jako antiobezitika než antidiabetika.
Klíčová slova:
agonisté receptoru pro GLP1 – diabetes mellitus – obezitaÚvod
Prevalence obezity stoupá ve všech věkových skupinách ve většině zemí Evropské unie (EU). Obezita zvyšuje riziko vzniku diabetu 2. typu, kardiovaskulárních onemocnění, snižuje očekávanou délku života a komorbidity spojené s obezitou jsou v zemích EU zodpovědné za 5–10 % celkových nákladů na zdravotní péči [1]. Obezita je definována nadměrným uložením tuku v organizmu, podíl tuku v organizmu tvoří normálně u žen 25–30 % a u mužů 20–25 %. Již před více než 100 lety byl pro klasifikaci hmotnosti zaveden Queteletův index, který je dnes celosvětově označován jako body mass index (BMI = hmotnost v kg/m2, tab. 1.
1. Klasifikace tělesné hmotnosti podle body mass indexu (BMI) 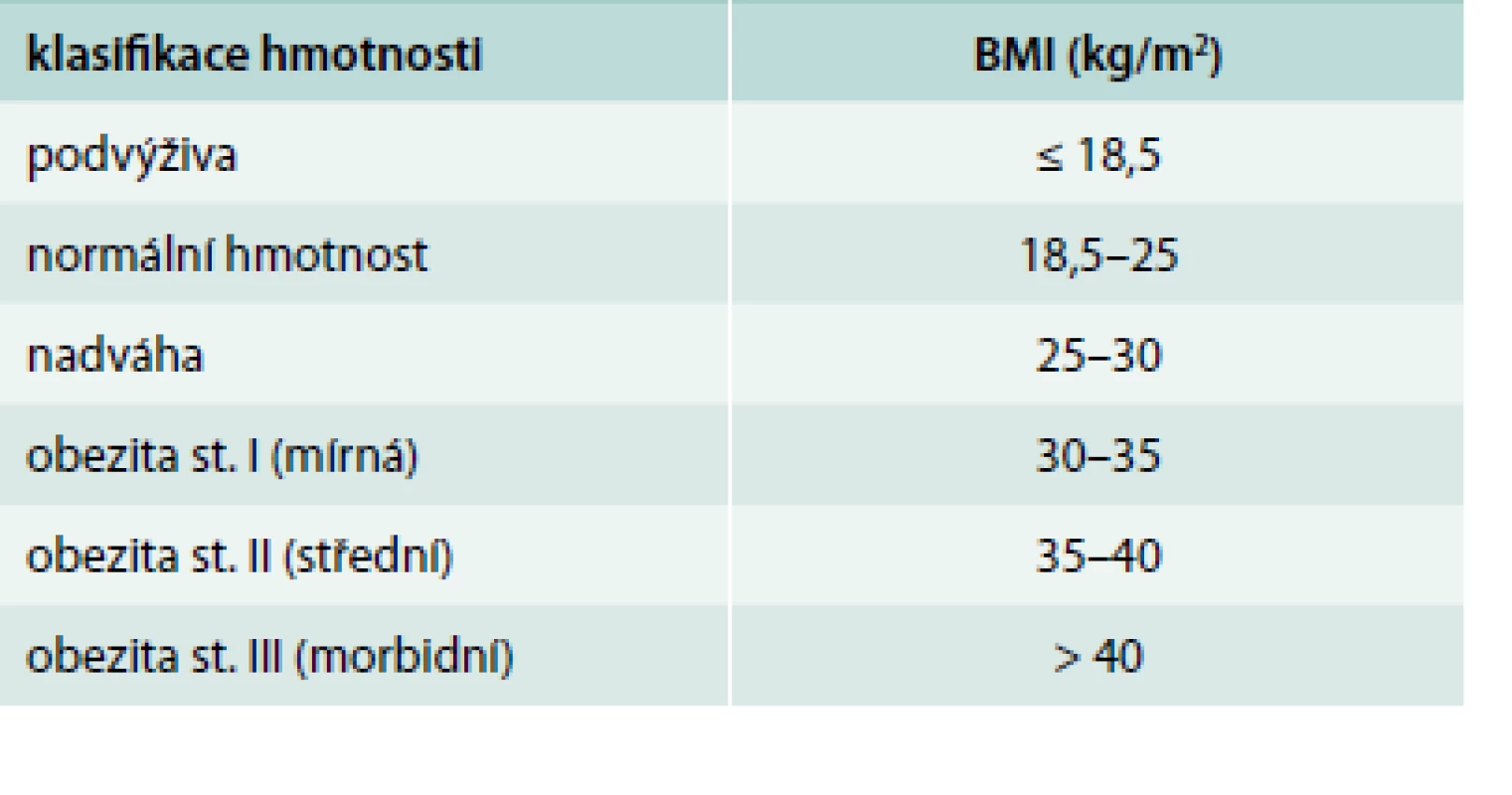
Nadváha je předstupeň obezity, zdravotní rizika stoupají již od BMI 25 kg/m2 a riziko poté prudce stoupá od hodnoty BMI 27 kg/m2 [2]. Dosažení a následné dlouhodobé udržení si normální hmotnosti je základem prevence vzniku onemocnění asociovaných s obezitou [3]. Mnoho pacientů s obezitou má již v anamnéze několik úspěšných pokusů o redukci hmotnosti, ale velmi málo pacientů si je schopno následně pokles váhy udržet po delší časové období. Po úspěšné váhové redukci je aktivováno několik fyziologických mechanizmů: snížení energetického výdeje, zvýšený hlad a snížení pocitu sytosti během jídla [4].
Renesance úlohy leptinu v současné obezitologii
Proteinový hormon leptin, který byl identifikován již v roce 1994, zažívá v současné obezitologii určité období renesance. Leptin je hormon produkovaný tukovou tkání a má apetit redukující účinek. Váže se na leptinové receptory, které existují ve 2 různých formách (cirkulující solubilní a na membrány vázaná forma). Solubilní leptinové receptory představují hlavní leptin vázající aktivitu v lidské krvi. Zvýšená hladina solubilních leptinových receptorů představuje mechanizmus, kterým je snížen apetit redukující účinek leptinu při snížení energetického příjmu [5]. Experimenty prokázaly, že suplementace leptinu po váhové redukci snižuje riziko a výši následného váhového přírůstku [6,7]. Obézní pacienti jsou leptin rezistentní s vysokou hladinou leptinu v plazmě, bez odpovídajícího apetit redukujícího účinku, což ukazuje, že leptin je spíše než apetit inhibující hormon určitým antilačnícím signálem. Pokud tedy dojde ke ztrátě masy tukové tkáně, pokles v hladině volného leptinu je signálem pro změnu chování směřující k hledání jídla (food seeking behavior) [6].
Vztah mezi obezitou a diabetem 2. typu
Zvětšení obsahu tukové tkáně v organizmu podmiňuje nižší účinnost inzulinu, tedy rozvoj inzulinové rezistence, i když mechanizmus těchto vztahů je složitější. Technikou hyperinzulinemického clampu bylo prokázáno, že účinnost inzulinu s narůstající hmotností tedy i s hmotnostním indexem BMI klesá. Vývoj mezi obezitou a diabetem postupuje od inzulinové rezistence přes dyslipidemii, arteriální hypertenzi a další složky metabolického syndromu. Tato cesta je jistě individuální a ne u každého musí vést až k diabetu. Diabetes 2. typu (DM2T) vzniká v okamžiku, kdy dochází i poruše sekrece inzulinu [8]. Farmakoterapie u DM2T využívá kombinace různých skupin antidiabetik, ale pozornost soudobé diabetologie se vedle gliflozinů upírá zejména ke skupině inkretinů.
Inkretinová antidiabetika
Inkretiny jsou hormony tenkého střeva, které stimulují sekreci inzulinu závisle na glukóze. Inkretinový efekt je zodpovědný za 50–70 % celkové inzulinové sekrece po perorálním příjmu glukózy a je definován jako rozdíl mezí sekrecí inzulinu po perorálním podání glukózy a jejím podáním i. v. Za fyziologických okolností jsou přítomny 2 inkretinové hormony: glukózodependentní inzulinotropní polypeptid (GIP) a glucagon like peptid 1 (GLP1). Oba dva mají krátký poločas v důsledku rychlého odbourávání dipeptidylpetidázou 4 (DPP4). U diabetiků 2. typu bylo prokázáno snížení postprandiálního vzestupu GLP, dochází k porušení „inkretinového efektu“ [9].
Inkretinová antidiabetika zahrnují agonisty receptorů pro GLP1 (GLP1 RA) a inhibitory dipeptidylpeptidázy 4 (DPP4 inhibitory). GLP1 RA jako skupina mají příznivý efekt na lačnou i postprandiální glykemii (PPG) a současně vedou k signifikantnímu poklesu váhy. Příčin poklesu váhy při léčbě GLP1 RA je více, již od počátku léčby GLP1 RA je znám jejich apetit redukující efekt. Na zvířecích modelech bylo prokázáno, že krysy s vyřazeným leptinovým receptorem neodpovídají na léčbu GLP1 RA v dávkách, při kterých divoce žijící krysy již vykazují prokazatelný anorektický účinek. Podávání malého množství leptinu vedlo k obnovení anorektického účinku GLP1, což ukazuje na leptin dependentní efekt léčby GLP1 [10]. I další práce ukázala, že léčba GLP1 receptorovými agonisty vede na zvířecím modelu obezity k obnovení fyziologické odpovědí na leptin [11]. Na základě uvedených skutečností Lepsen et al iniciovali studii k ověření pracovní hypotézy: zahájení léčby agonisty receptoru pro GLP1 (GLP1 RA) během váhového poklesu snižuje zvýšenou hladinu solubilních leptinových receptorů, zvyšuje hladinu volného leptinu a tímto mechanizmem snižuje riziko následného vzestupu váhy. Dlouze působící GLP1 RA liraglutid v tomto 52týdenním sledování inhiboval vzestup solubilních leptinových receptorů o 59 % v porovnání s kontrolní skupinou. Hladiny volného leptinu byly signifikantně vyšší u skupiny léčené GLP1 RA liraglutidem, a také byl prokázán signifikantně větší váhový úbytek (p < 0,005) během periody zaměřené na následné udržení poklesu váhy. Statistické zhodnocení ukázalo, že variace v hladině volného leptinu je zodpovědná až za 48 % efektu udržení získaného poklesu váhy [12]. Efekt léčby GLP1 RA na redukci váhy v proběhlých studiích u DM2T je natolik výrazný, že tato skupina původně vyvinutá na kontrolu glykemie je nyní podrobena klinickému zkoušení jako antiobezitikum s velmi příznivými výsledky. Na EASD 2014 ve Vídni byly prezentovány prof. Rouxem výsledky studie SCALE zaměřené na redukcí váhy při léčbě liraglutidem u pacientů s obezitou st. II, rozdíl v dosažené redukci váhy u skupiny léčené liraglutidem vs placebo představoval 5,4 % (p < 0,0001), léčba liraglutidem měla i velmi dobrý bezpečnostní profil, nejčastější nežádoucí účinek pozorovaný ve studii byla nauzea přechodného charakteru [13]. Na uvedené sdělení navázal dr. Bode, který prezentoval další data ze studie SCALE: srovnání efektu léčby liraglutidem v dávce 1,8 mg vs 3 mg na redukci váhy a kardiometabolické parametry. Po 56 týdnech léčby byl průměrný pokles váhy 5,9; 4,6 % pro liraglutid 3,0 mg; 1,8 mg (p < 0,0001). Léčba liraglutidem vedla v závislosti na dávce k signifikantnímu poklesu váhy a příznivému ovlivnění kardiometabolických rizikových faktorů. Souhrnný efekt léčby liraglutidem na parametry zánětu a endokrinní aktivitu tukové tkáně ve studii SCALE ukazuje graf [14].
1. Studie SCALE – efekt léčby liraglutidem v dávce 1,8 mg a 3 mg na kardiovaskulární biomarkery (EASD 2014 Vídeň) 
Benefity léčby GLP1 ve srovnání s léčbou bazálním inzulinem
Léčba bazálním inzulinem představuje efektivní možnost zahájení léčby inzulinem u DM2T a je provázena nižším rizikem hypoglykemie a váhového přírůstku než léčba premixovanými inzuliny v konvenčním režimu. Progresivní charakter DM2T a neschopnost bazálního inzulinu korigovat postprandiální glykemii (PPG) vede k nutnosti přidání prandiálního inzulinu před jídlem s největším vzestupem PPG, tento režim je v literatuře nazýván stepwise intensification. Intenzifikace léčby bazálním inzulinem přidáním prandiálního inzulinu je ale často provázena váhovým přírůstkem. Kvantifikaci váhového přírůstku u různých kombinací bazálních a prandiálních inzulinů ukazuje tab. 2 [15].
2. Přehled vybraných klinických studií, ve kterých byla sledována změna HbA<sub>1c</sub>, váhový přírůstek a riziko hypoglykemie po iniciaci prandiálního inzulinu k zavedené léčbě inzulinem bazálním 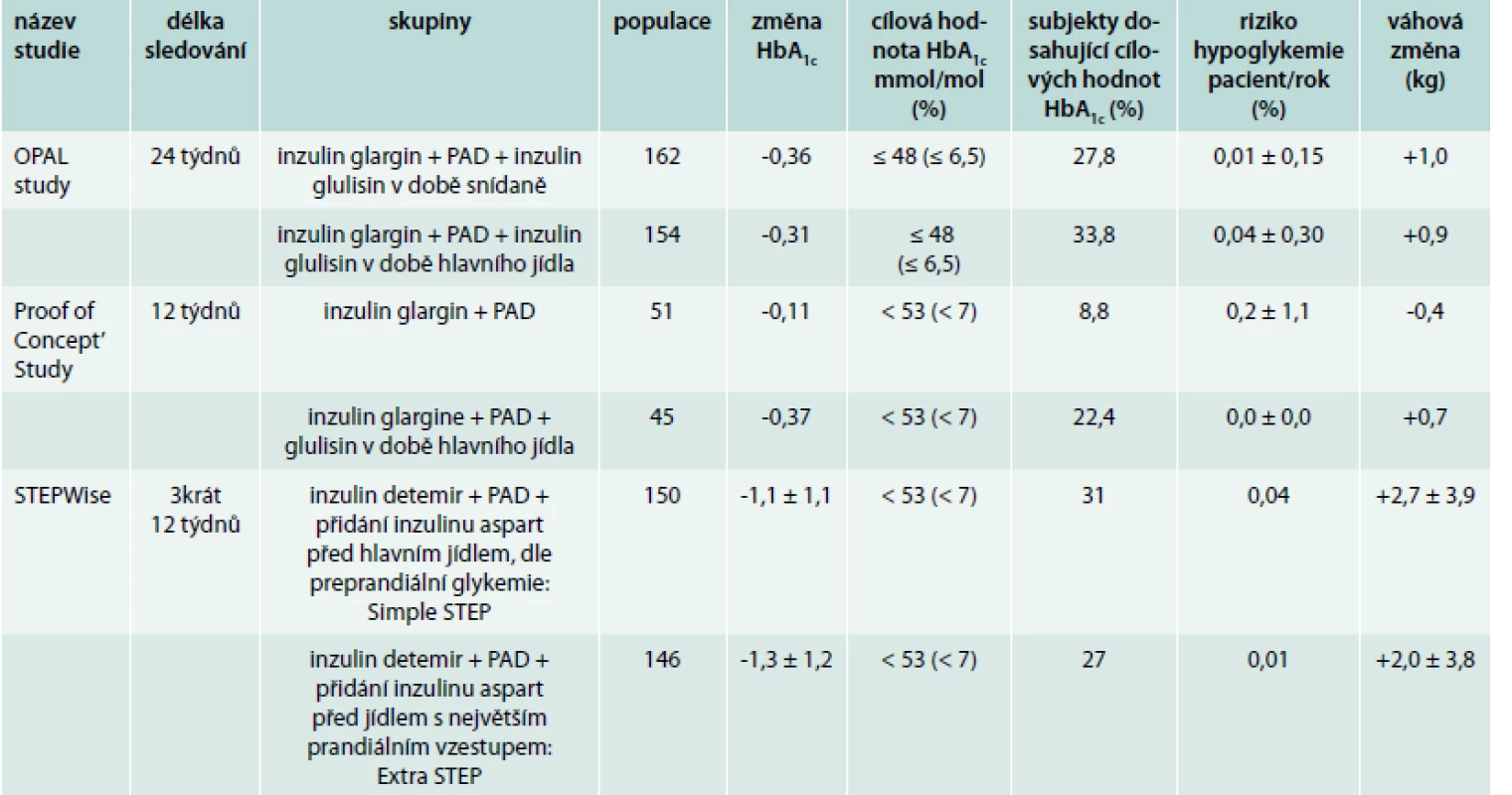
Pokud výsledky klinických studií ukazují na dobrou efektivitu zahájení léčby inzulinem na snížení hodnoty HbA1c a zároveň je dané snížení HbA1c často provázeno různě závažným váhovým přírůstkem, nabízí se otázka srovnání efektivity zahájení léčby bazálním inzulinem oproti léčbě GLP1 RA. Na kongresu EASD v roce 2014 byly prezentovány výsledky studie AWARD-2 [16], v této studii bylo srovnáváno přidání bazálního inzulinu glargine vs přidání rekombinantního GLP1 fúzního proteinu dulaglutidu aplikovaného 1krát týdně k zavedené léčbě u 807 pacientů s DM2T neuspokojivě kompenzovaným na PAD (metformin a glimepirid). Po 52 týdnech léčby byla léčba dulaglutidem v dávce 1,5 mg noninferiorní ke glarginu na snížení hodnoty HbA1c při současném váhovém poklesu o 3,4 kg v 78. týdnu léčby. Pozoruhodná byla nízká frekvence těžkých hypoglykemií, během 78 týdnů studie byly zaznamenány pouze 2 epizody těžké hypoglykemie u skupiny léčené glarginem při průměrné dávce 31,4 IU glarginu, ale i u skupiny léčené dulaglutidem proběhly 2 epizody těžké hypoglykemie. V rámci prezentace poté prof. Giorgino upozornil na poměrně vysokou dávku glimepiridu v pozadí u obou skupin, která zřejmě vysvětlovala přítomnost epizod těžké hypoglykemie u skupiny léčené GLP1 RA dulaglutidem.
Léčba bazálním inzulinem primárně snižuje hladinu lačné glykemie, nabízí se tedy velice výhodná kombinace bazálního inzulinu s krátce působícím GLP1 RA. Léčba uvedenou kombinací bazálního inzulinu a GLP1 RA je provázena nižší spotřebou inzulinu, menším rizikem hypoglykemie a v neposlední řadě i menším váhovým přírůstkem [17]. Velice zajímavé srovnání ukázala práce Raccah et al, retrospektivní analýza dat z 5 randomizovaných klinických studií, v níž bylo prokázáno, že kombinace bazálního inzulinu a krátce působícího GLP1 RA lixisenatidu vs kombinace bazálního inzulinu a krátce působícího inzulinového analoga vedla více než 2krát častěji k dosažení cílové hodnoty HbA1c < 7 % (DCCT), a to bez současného váhového přírůstku u skupiny léčené GLP1 RA – odds ratio (OD) 2,68. Tato kombinace byla také jednoznačně provázena nižším rizikem rozvoje závažné hypoglykemie – OD 1,97 [18].
Závěr
Léčba inkretiny u pacientů s DM2T se právem dostává do středu pozornosti odborné veřejnosti a dvojnásobně to můžeme říci o skupině GLP1 RA. V GLP1 RA máme nyní k dispozici skupinu s vynikajícím efektem na hladinu HbA1c při současné možnosti váhové redukce. Právě váhová redukce je hlavním benefitem GLP1 RA oproti léčbě bazálním inzulinem. Inzulinová terapie nachází svůj prostor u jiné podskupiny nemocných v rámci individualizované léčby DM2T, např. tam, kde problém s obezitou není a je inzulinovou léčbou možno řešit jiné problémy nemocného či cíle léčby. Jako zvláště výhodná se jeví kombinace krátce působícího GLP1 RA, umožňujícího těsnou kontrolu PPG, s bazálním inzulinem snižujícím lačnou glykemii u pacientů, u kterých je potřeba dosáhnout redukce hmotnosti.
Do budoucna se nabízí možnost využití léčby GLP1 RA i u prediabetu s problémem obezity a u obezity jako takové.
MUDr. Petr Žák
petr.zak@fnusa.cz
II. interní klinika LF MU a FN u sv. Anny Brno
www.fnusa.cz
Doručeno do redakce 17. 2. 2015
Přijato po recenzi 13. 3. 2015
Sources
1. Astrup A. Healthy lifestyles in Europe: prevention of obesity and type II diabetes by diet and physical activity. Public Health Nutr 2001; 4(2B): 499–515.
2. Svačina Š (ed). Klinická dietologie. Grada: Praha 2008. 978–80–247–2256–6.
3. Bantle JP, Wylie-Rosett, Albright A et al. Nutrition recommendations and interventions for diabetes: a position statement of the American Diabetes Association. Diabetes Care 2008; 31(Suppl 1): S61-S68.
4. Wadden TA. Treatment of obesity by moderate and severe caloric restriction. Results of clinical research trials. Ann Intern Medicine 1999; 119 (7 Pt 2): 688–693.
5. Owecki M, Nikisch E, Miczke E et al. Free leptin index as a marker for leptin action in diabetes and obesity: leptin and soluable leptin receptors relationship with HbA1c. Neuro Endocrinol Lett 2010; 31(5): 679–683.
6. Rosenbaum M, Pavlovich K, Leibel RL et al. Leptin reverses weight induced loss induced changes in regional neural activity responses to visual food stimuli. J Clin Invest 2008; 118(7): 2583–2591.
7. Rosenbaum M, Leibel RL. Adaptive thermogenesis in humans. Int J Obes (lond) 2010; 34(Suppl 1): S47-S55.
8. Škrha J (ed). Diabetologie. Galén: Praha 2009. ISBN 978–80–7262–607–6.
9. Alan J Garber. Long-Acting Glucagon-Like Peptide 1 Receptor Agonists A review of their efficacy and tolerability. Diabetes Care 2011; 34(Suppl 2): S279-S284.
10. Williams DL, Baskin DG, Schwartz MW. Leptin regulation of the anorexic response to glucagon like peptid-1 receptor stimulation. Diabetes 2006; 55(12): 3387–3393.
11. Clemmensen C, Chabenne J, Finan B et al. GLP-1-glucagon coagonism restores leptin responsiveness in obese mice chronically maintainde on an obesogenic diet. Diabetes 2014; 63(4): 1422–1427.
12. Iepsen EW, Lundgren J, Dirksen C et al. Treatment with a GLP-1 receptor agonist diminishes the decrease in free plasma leptin during maintenance of weight loss. Int J Obes (Lond) 2014. Dostupné z DOI: <http://dx.doi.org/10.1038/ijo.2014.177>.
13. le Roux C, Lau DCW, Astrup A. Safety and tolerability of liraglutide 3.0 mg in overweight and obese adults: the SCALE obesity and prediabetes randomised trial. Abstract n. 833. EASD 2014 Vienna.
14. Bode B, De Fronzo R, Bergensta R. Effect of liraglutide 3.0 mg and 1.8 mg on body weight and cardiometabolic risk factors in overwight/obese adults with T2D: SCALE Diabetes randomised double blind 56 week trial. Presented oral EASD 2014 and abstract n.181.
15. Owens DR Stepwise intensification of insulin therapy in Type 2 diabetes management – exploring the concept of the basal-plus approach in clinical practice. Diabet Med 2013; 30(3): 276–288.
16. Giorgino F. Efficacy and safety of once weekly dulaglutide vs insulin glargine in combination with metformin and glimepiride in type 2 diabetes patients (AWARD2). Oral presentation (38) EASD 2014 Vienna.
17. Vora J. Combining Incretin Based Therapies With Insulin Realizing the potential in type 2 diabetes. Diabetes Care 2013; 36(Suppl 2): S226-S232. Erratum in Diabetes Care 2013; 36(12): 4172.
18. Raccah D, Lin J, Wang E et al. Once-daily prandial lixisenatide versus once-daily rapid acting insulin in patients with type 2 diabetes mellitus insufficiently controlled with basal insulin: analysis data from five randomized, controlled trials. J Diabetes Complications 2014; 28(1): 40–44.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2015 Issue 4-
All articles in this issue
- Biosimilar insulines – new possibilities of diabetes treatment
- The treatment of diabetes in patients with liver and renal impairment
- Possibilities of therapy GLP1 RA for diabetics with nephropathy
- Treatment of GLP1 receptor agonists and body mass control
- Treatment of an elderly patients with diabetes
- Issues of infection related to diabetic foot syndrome
- Treatment of hypertension in diabetes mellitus
- Physical activity in patients with microvascular complications of diabetes
- Glycation of lens proteins in diabetes and its non-invasive assessment – first experience in the Czech Republic
- miRNA-192, miRNA-21 and miRNA-200: new pancreatic cancer markers in diabetic patients?
- Progress in the development of insulin pumps and their advanced automatic functions
- The microbial flora in the digestive tract and diabetes
- Myokines – muscle tissue hormones
- The position of new antidiabetics in clinical practice: SGLT2 vs DPP4 inhibitors
-
Do diabetologists choose a therapy rationally?
Basic results of the PROROK project (A prospective observation project to assess the relevance of the difference between fasting glycemia and postprandial glycemia to estimation of success of type 2 diabetes therapy)
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Myokines – muscle tissue hormones
- The treatment of diabetes in patients with liver and renal impairment
- Treatment of GLP1 receptor agonists and body mass control
- Treatment of hypertension in diabetes mellitus
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

