-
Medical journals
- Career
Akromegalie: současný pohled
Authors: Michal Kršek
Authors‘ workplace: III. interní klinika – klinika endokrinologie a metabolizmu 1. LF UK a VFN Praha, přednosta prof. MUDr. Štěpán Svačina, DrSc., MBA
Published in: Vnitř Lék 2015; 61(10): 900-904
Category: Reviews
Overview
Akromegalie je vzácné onemocnění způsobené autonomní nadprodukcí růstového hormonu, ve většině případů hypofyzárním adenomem. Neléčená akromegalie vede ke zvýšené morbiditě a mortalitě a také zhoršené kvalitě života pacientů. Pro prognózu pacientů je proto nezbytné včasné stanovení diagnózy a časná léčba a péče o pacienty s akromegalií by měla být koncentrována do specializovaných center. Článek shrnuje současný pohled na diagnostiku a léčbu akromegalie.
Klíčová slova:
akromegalie – diagnostika – léčba – projevyÚvod
Akromegalie je onemocnění poprvé popsané francouzským fyziologem Pierrem Marie v roce 1886 jako onemocnění charakterizované poruchou a disproporcionalitou somatického růstu [1]. Akromegalie je způsobena autonomní nadprodukcí růstového hormonu (growth hormon – GH) a jeho působením na buňky, tkáně a orgány lidského těla po ukončení růstu jedince. Pokud dojde k nadprodukci GH před dokončením růstu, dochází k urychlení longitudinálního růstu a k tzv. gigantizmu. Kombinaci obou situací nazýváme gigantoakromegalií. Jedná se o vzácné onemocnění, jehož incidence je odhadována na 3–4 nové případy na 1 000 000 obyvatel a 1 rok a prevalence na 40–70 případů na 1 000 000 obyvatel [2,3].
Etiologie a patogeneze
Akromegalie je v naprosté většině případů způsobena hypofyzární nadprodukcí GH. Extrapituitární nadprodukce GH je extrémně vzácná. Za nadprodukci GH je zodpovědný prakticky vždy GH produkující adenom hypofýzy (somatotropinom). Rozlišujeme několik druhů GH produkujících adenomů [4], tab. 1. Z extrémně vzácných ektopických příčin nadprodukce GH byl popsán tumor z Langerhansových ostrůvků pankreatu a tumory s nadprodukcí somatoliberinu (eutopickou – hypotalamické hamartomy, choristomy, ganglioneuromy, nebo ektopickou – bronchiální karcinoidy, tumory endokrinního pankreatu, malobuněčné plicní karcinomy, adenomy nadledvin, medulární karcinomy štítné žlázy, feochromocytomy).
Table 1. Hypofyzární příčiny akromegalie 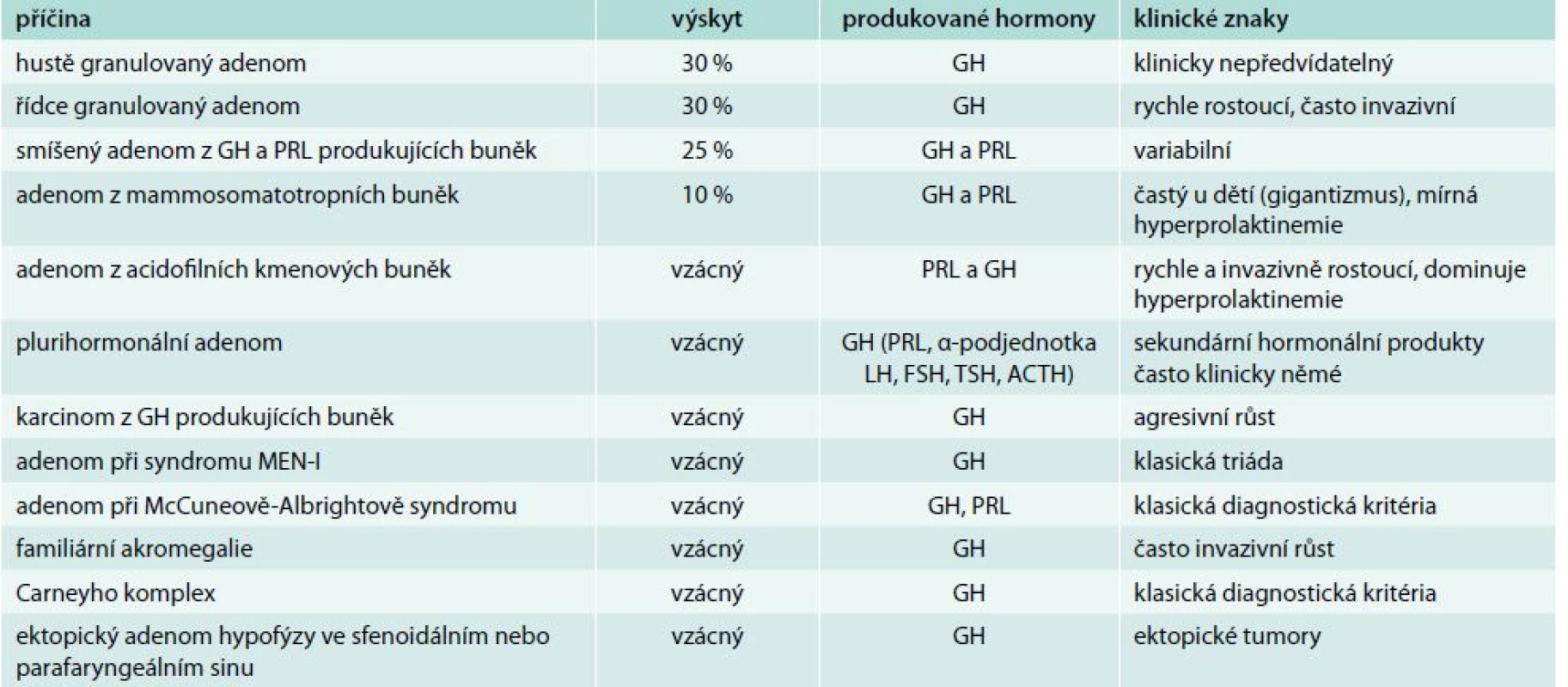
ACTH – adrenokortikotropní hormon FSH – folikulostimulační hormon GH – růstový hormon LH – luteinizační hormon MEN – mnohočetná endokrinní neoplazie PRL – prolaktin TSH – tyreostimulační hormon V patogenezi akromegalie je primární nadprodukce GH. GH stimuluje ve tkáních lidského těla produkci inzulinu-podobného růstového faktoru-I (insulin like growth factor I – IGF-I), jehož sérové koncentrace jsou určovány dominantní hepatální produkcí. Klinický obraz je pak dán kombinací biologických účinků GH a IGF-I.
Klinický obraz
Klinické příznaky akromegalie rozdělujeme na příznaky způsobené expanzivním chováním tumoru a příznaky endokrinologické dané kombinovaným účinkem nadprodukce GH a IGF-I. Příznaky jsou velmi komplexní a důležité je, že vedou k závažnému komplexnímu postižení celého organizmu s významným snížením kvality života a zvýšenou morbiditou a mortalitou, způsobenou dominantně kardiovaskulárními komplikacemi. Stručný přehled klinických příznaků akromegalie je uveden v tab. 2, [4]. Typický vzhled obličeje pacienta s akromegalií uvádí obr. 1 a vzhled ruky obr. 2.
Table 2. Klinické příznaky akromegalie 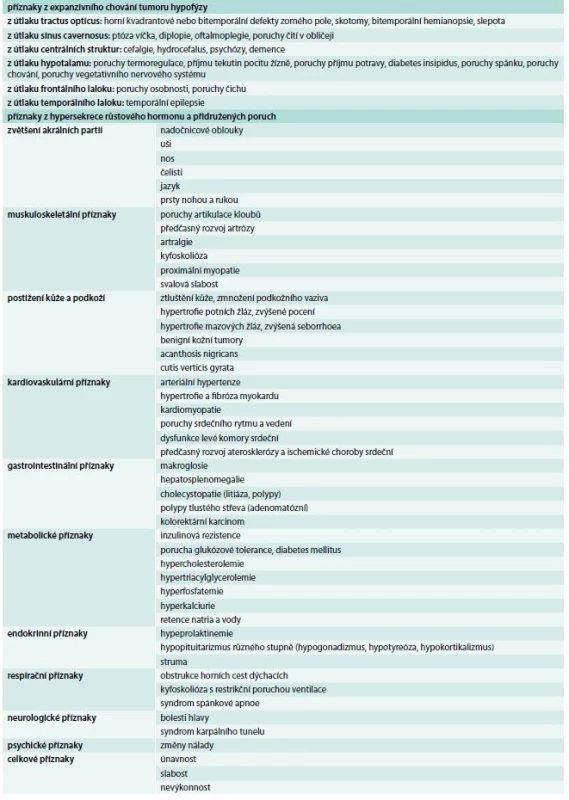
Image 1. Typický vzhled obličeje pacienta s akromegalií (z archivu autora) 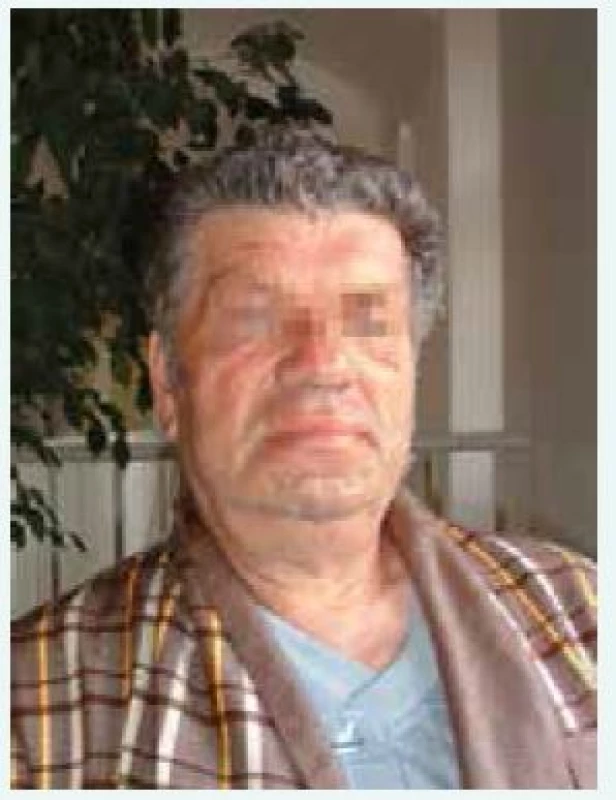
Image 2. Vzhled ruky pacienta s gigantoakromegalií v porovnání s rukou normální (z archivu autora) 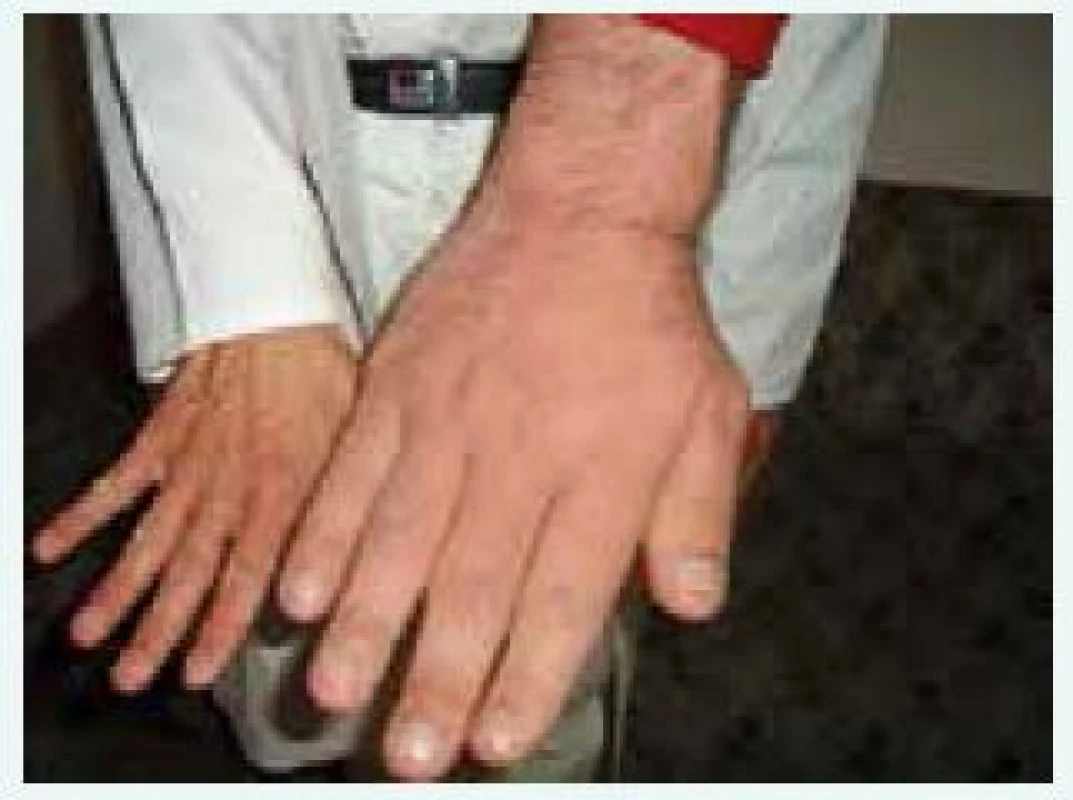
Diagnostika a diferenciální diagnostika
U pacientů s klinickým obrazem akromegalie musíme diagnózu potvrdit biochemicky. Jako iniciální vyšetření je doporučeno vyšetření sérových koncentrací IGF-I, které jsou během dne stabilní a které závisí na integrované denní produkci GH [5]. Koncentrace IGF-I musíme porovnávat s příslušnými normami pro dané pohlaví, věk a použitou metodu stanovení. Normální koncentrace IGF-I spolehlivě vylučují diagnózu akromegalie. Falešně pozitivní výsledky bývají přítomny v adolescenci a v graviditě. S falešně pozitivními či negativními výsledky musíme počítat v následujících situacích: jaterním selhání, renální insuficienci, hypotyreóze, malnutrici, těžké infekci a dekompenzaci diabetes mellitus.
Diagnózu akromegalie potvrdíme u pacientů se zvýšenými nebo hraničními koncentracemi IGF-I vyšetřením sérových koncentrací růstového hormonu v orálním glukózovém tolerančním testu, pokud po podání 75 g glukózy u pacientů s akromegalií nedochází k supresi GH pod 1 µg/l (pro některé metody stanovení pod 0,4 µg/l) [6].
Po biochemickém potvrzení diagnózy akromegalie následuje zobrazovací vyšetření hypofýzy. Metodou první volby je vyšetření zobrazením magnetickou rezonancí (magnetic resonance imaging – MRI).
Při nálezu tumoru hypofýzy, který je v kontaktu s nervus opticus nebo ho dislokuje, je indikováno vyšetření perimetru k posouzení ev. přítomnosti defektu zorného pole. V případě nálezu defektu zorného pole je indikováno urychlené neurochirurgické řešení. U tumorů s invazí kavernózního sinu může docházet k paréze okohybných nervů v něm procházejících [7].
Nedílnou součástí vyšetření pacientů s akromegalií je vyšetření funkce ostatních hypofyzárních os k vyšetření koprodukce dalších hypofyzárních hormonů, nebo naopak diagnostice deficitů vyplývajících z útlaku okolní hypofyzární tkáně.
U pacientů s akromegalií musíme aktivně pátrat po komorbiditách, především po arteriální hypertenzi, diabetes mellitus, kardiovaskulárním postižení, artróze a spánkové apnoe. V dalším průběhu je pak doporučen screening na přítomnost kolorektálního karcinomu a sonografické vyšetření k odhalení uzlů štítné žlázy [6].
Léčba
Cílem léčby akromegalie je odstranění GH produkujícího tumoru hypofýzy. Biochemickými cíli léčby akromegalie jsou dosažení normalizace koncentrací IGF-I a dosažení koncentrace GH při namátkovém vyšetření pod 1 µg/l. Doporučení americké Endocrine Society doporučují při sledování pacientů používání stále stejné metody stanovení koncentrací GH a IGF-I [6].
Neurochirurgická léčba je metodou první volby v léčbě akromegalie. Preferovaným chirurgickým přístupem je transsfenoidální přístup na pracovišti specializovaném na provádění operací hypofýzy. Chirurg specializovaný na operace hypofýzy by měl provést nejméně 50 operací hypofýzy za 1 rok [8]. V centrech specializovaných na operace hypofýzy je dosaženo vyléčení u asi 85 % mikroadenomů a 40–50 % makroadenomů hypofýzy [9,10]. Výhodou chirurgické léčby je kromě okamžitého efektu také možnost histologického a histochemického vyšetření, které může mít význam pro další průběh a sledování pacientů.
Medikamentózní léčba je indikována u pacientů s přetrvávající hormonální aktivitou po chirurgické léčbě.
Kabergolin je agonista dopaminu používaný primárně k léčbě prolaktinomů. Může být užitečný u malé části pacientů a akromegalií, obvykle s minimální reziduální aktivitou onemocnění. U takových pacientů s ním obvykle začínáme a používáme dávky od 1 mg do 14 mg týdně. Výhodou je nízká cena, nevýhodou malá účinnost a použití tzv. off-label (kabergolin není registrován v indikaci léčby akromegalie).
Analoga somatostatinu se váží na somatostatinové receptory a napodobují tak účinek nativního somatostatinu. V současné době běžně používáme dva superaktivní analogy somatostatinu s prodlouženým uvolňováním, oktreotid (Sandostatin) LAR a lanreodid (Somatuline) Autogel, které se váží preferenčně na 2. podtyp a s menší afinitou i na 5. podtyp receptorů pro somatostatin. Sandostatin LAR používáme v dávkách 20–40 mg 1krát za 4 týdny, Somatuline Autogel v dávkách 90–120 mg 1krát za 4 týdny, přípravek s dávkou 120 mg může být podáván v intervalu až 8 týdnů. Účinnost léčby posuzujeme podle koncentrace IGF-I na konci dávkovacího intervalu, těsně před aplikací další dávky. Normalizace koncentrací IGF-I jsme schopni dosáhnout u 17–35 %. Podstatného snížení objemu tumoru (> 50 % výchozího objemu) jsme schopni dosáhnout až u 60 % pacientů [11–13]. Mezi nežádoucí vedlejší účinky terapie analogy somatostatinu patří bolesti břicha, plynatost a průjem, které jsou běžné na počátku léčby, ale obvykle s pokračující léčbou ustupují. Až ve 25 % vede terapie analogy somatostatinu ke vzniku cholecystolitiázy, je proto indikováno sledování pomocí ultrazvukového vyšetření. Nově máme k dispozici pasireotid, multiligandový analog somatostatinu, který se váže na všechny podtypy somatostatinových receptorů s výjimkou podtypu 4 a s nejvyšší afinitou k podtypu 5. Pasireotid je účinnější v léčbě akromegalie u části pacientů rezistentních na léčbu konvenčnímu analogy somatostatinu, jeho použití je však spojeno s častějším výskytem nežádoucích účinků, především se vznikem či prohloubením poruchy glukózové tolerance a vznikem diabetes mellitus. Bude proto vhodnou alternativou pravděpodobně jen u malé části pacientů s farmakorezistentní akromegalií [14].
Pegvisomant je antagonistou GH receptoru. Podáváme ho obvykle v dávkách 10–20 mg denně s. c., ale u části pacientů může být ke kontrole hormonální aktivity nutné použití dávek až 40 mg denně. V závislosti na dávce jsme schopni dávkami do 40 mg denně dosáhnout normalizace koncentrací IGF-I až u 95 % pacientů. Léčbu je nutno monitorovat pomocí stanovení koncentrací IGF-I [15,16]. V začátcích používání pegvisomantu bylo obavou možné zvětšení tumorů hypofýzy při léčbě, podle dostupných dat k němu však dochází vzácně, maximálně u 3–5 % pacientů, přičemž ale může jít o přirozené chování tumoru a ne o vliv léčby pegvisomantem. Nežádoucí vedlejší účinky léčby pegvisomantem nejsou časté a zahrnují lokální bolest či diskomfort, reverzibilní lipohypertrofii nebo lipoatrofii. Významným nežádoucím účinkem je elevace jaterních enzymů, jejichž aktivitu je doporučováno monitorovat jednou za 6 měsíců a léčbu pegvisomantem přerušit při více než trojnásobném zvýšení [16].
S výhodou používáme léčbu kombinační, především kombinaci somatostatinového analoga s pegvisomantem. Kombinujeme tak léčbu cílenou na tumor hypofýzy s blokádou GH receptoru. Tato léčba je často účinnější, umožňuje snížit dávky jednotlivých léků a může být i levnější, především v porovnání s monoterapií pegvisomantem [17].
Radioterapie je další metodou léčby, na jejíž použití jsou velmi rozdílné názory. Někteří její odpůrci argumentují jejími možnými nežádoucími účinky (vznik hypopituitarizmu, zvýšená cerebrovaskulární morbidita). Podle našich zkušeností však optimalizace dávek podaných na jednotlivé struktury tyto nežádoucí účinky eliminuje. Použít můžeme stereotaktickou radiochirurgickou léčbu Leksellovým gamanožem nebo konformní stereotaktickou radioterapii lineárním urychlovačem. Podle našich zkušeností je radioterapie indikována při pooperačním reziduu tumoru hypofýzy, zřídka jako primární léčba. Do uplatnění efektu radioterapie (medián asi 3 roky) musíme k normalizaci hormonální aktivity používat léčbu medikamentózní. Domníváme se, že stereotaktická radioterapie má své nezastupitelné místo v léčbě akromegalie, je bezpečná, a umožňuje zkrátit jinak dlouhodobou resp. celoživotní léčbu medikamentózní [18].
Závěr
Akromegalie je onemocnění vzácné, ale je spojené s významně zvýšenou morbiditou a mortalitou. Ke zlepšení osudu pacientů je nezbytné časné stanovení diagnózy a časná a účinná léčba, nejlépe do doby, než dojde ke vzniku ireverzibilních změn. Při podezření na akromegalii je indikováno odeslání do specializovaného centra schopného poskytnout komplexní a účinnou léčbu akromegalie. Nezbytná je nejen včasná a účinná léčba akromegalie samotné, ale stejně tak i časná intervence a léčba přidružených poruch a komorbidit, a to nejen po dobu aktivního onemocnění, ale celoživotně.
Doručeno do redakce 16. 8. 2015
Přijato po recenzi 25. 9. 2015
prof. MUDr. Michal Kršek, CSc.
michal.krsek@lf1.cuni.cz
III. interní klinika – klinika endokrinologie a metabolismu 1. LF UK a VFN, Praha
www.vfn.cz
Sources
1. Marie P. On two case of acromegaly: marked hypertrophy of the upper and Loir limbs and the head. Rev Med 1886; 6 : 297–333.
2. Alexander L, Appleton D, Hall R et al. Epidemiology of acromegaly in the Newcastle region. Clin Endocrinol (Oxf) 1980; 12(1): 71–79.
3. Begtsson BA, Eden S, Ernest I et al. Epidemiology and long-term survival in acromegaly. A study of 166 cases diagnosed between 1955–1984. Acta Medica Scand 1988; 223(4): 327–335.
4. Melmed S, Kleinberg D. Anterior Pituitary. In: Kronenberg HM, Melmed S, Polonsky KS et al. Williams textbook of endocrinology. Philadelphia: Saunders Elsevier 200 : 155–261. ISBN: 9781416029113.
5. Barkan AL, Beitins IZ, Kelch RP. Plasma insulin-like growth factor-I/somatomedin-C in acromegaly: correlation with the degree of growth hormone hypersecretion. J Clin Endocrinol Metab 1988; 67(1): 69–73.
6. Katznelson L, Laws ER Jr, Melmed S et al. Acromegaly: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 2014; 99(11): 3933–3951.
7. Kan E, Kan EK, Atmaca A et al. Visual field defects in 23 acromegalic patients. Int Ophthalmol 2013; 33(5): 521–525.
8. McLaughlin N, Laws ER, Oyesiku NM et al. Pituitary centers of excellence. Neurosurgery 2012; 71(5): 916–924.
9. Jane jr. JA, Starke RM, Elzoghby MA et al. Endoscopic transsphenoidal surgery for acromegaly: remission using modern criteria, complications and predictors of outcome. J Clin Endocrinol Metab 2011; 96(9): 2732–2740.
10. Starke RM, Raper DM, Payne SC et al. Endoscopic vs microsurgical transsphenoidal surgery for acromegaly: outcomes in a concurrent series of patients using modern criteria for remission. J Clin Endocrinol Metab 2013; 98(8): 3190–3198.
11. Caron PJ, Bevan JS, Petersenn S et al. Tumor shrinkagewith lanreotide autogel 120 mg as primary therapy in acromegaly: results of a prospective multicenter clinical trial. J Clin Endocrinol Metab 2014; 99(4): 1282–1290.
12. Giustina A, Mazziotti G, Torri V et al. Meta-analysis on the effects of octreotide on tumor mass in acromegaly. PLoS One 2012; 7(5): e36411. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0036411>.
13. Giustina A, Bonadonna S, Bugari G et al. High-dose intramuscular octreotide in patients with acromegaly inadequately controlled on convenctional somatostatin analogue therapy: a randomised controlled trial. Eur J Endocrinol 2009; 161(2): 331–338.
14. Gadelha MR, Bronstein MD, Brue T et al. Pasireotide versus continued treatment with octreotide or lanreotide in patients with inadequately controlled acromegaly (PAOLA): a randomised, phase 3 trial. Lancet Diabetes Endocrinol 2014; 2(11): 875–84.
15. van der Lely AJ, Hutson RK, Trainer PJ et al. Long-term treatment of acromegaly with pegvisomant, a growth hormone receptor antagonist. Lancet 2001; 358(9295): 1754–1759.
16. Schreiber I, Buchfelder M, Droste M et al. Treatment of acromegaly with the GH receptor antagonist pegvisomant in clinical practice: safety and efficacy evaluation from the German Pegvisomant Observational Study. Eur J Endocrinol 2007; 156(1): 75–82.
17. Neggers SJ, de Herder WW, Feelders RA et al. Conversion of daily pegvisomant to weekly pegvisomant combined with long-acting somatostatin analogs, in controlled acromegaly patients. Pituitary 2011; 14(3): 253–258.
18. Ježková J, Marek J, Hána V et al. Gamma knife radiosurgery for acromegaly – long-term experience. Clin Endocrinol (Oxf) 2006; 64(5): 588–595.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2015 Issue 10-
All articles in this issue
- Incidentalom nadledviny
- Adrenální insuficience
- Štítná žláza a gravidita – souhrn důležitých poznatků
- Léčba hypotyreózy a hypertyreózy
- Subklinické tyreopatie
- Chronická lymfocytární tyreoiditida a karcinom štítné žlázy
- Funkční hypotalamická amenorea
- Syndrom polycystických ovarií
- Novinky v diagnostice a léčbě MEN1
- Akromegalie: současný pohled
- Systémová léčba glukokortikoidy: praktický pohled
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Funkční hypotalamická amenorea
- Systémová léčba glukokortikoidy: praktický pohled
- Incidentalom nadledviny
- Adrenální insuficience
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

