-
Medical journals
- Career
Distribuce s lipoproteiny asociované fosfolipázy A2 v české populaci a její interakce s konvenčním kardiovaskulárním rizikem
Authors: O. Mayer jr. 1; J. Seidlerová 1; P. Wohlfart 2; L. Trefil 3; J. Bruthans 4; J. Filipovský 1; R. Cífková 2
Authors‘ workplace: II. interní klinika Lékařské fakulty UK a FN Plzeň, přednosta prof. MU Dr. Jan Filipovský, CSc. 1; Centrum kardiovaskulární prevence Thomayerovy nemocnice Praha, přednostka prof. MU Dr. Renata Cífková, CSc. 2; Ústav klinické biochemie a hematologie Lékařské fakulty UK a FN Plzeň, přednosta prof. MU Dr. Jaroslav Racek, DrSc. 3; Pracoviště preventivní kardiologie IKEM Praha, přednostka doc. MU Dr. Věra Adámková, CSc. 4
Published in: Vnitř Lék 2013; 59(5): 344-351
Category: Original Contributions
Overview
Východisko:
Fosfolipáza A2 asociovaná s lipoproteiny (Lp ‑ PLA2) představuje nový rizikový faktor kardiovaskulárních chorob a potenciálně i léčebný cíl. Cílem naší studie bylo posoudit epidemiologickou situaci tohoto faktoru v české populaci.Metoda a výsledky:
Analyzovány byly náhodné vzorky obecné populace (studie postMONICA) a pacientů s manifestní vaskulární chorobou (česká část studie EUROASPIRE III) zahrnující celkem 1 962 subjektů. Aktivita Lp ‑ PLA2 byla stanovena ze zamražených vzorků pomocí komerčních kitů firmy diaDexus. Zvýšená aktivita Lp ‑ PLA2 (tj. > 195 nmol/ min/ ml) byla nalezena asi u 21 % subjektů a tato prevalence se významněji neliší mezi osobami s a bez již manifestované kardiovaskulární choroby. Muži vykazují vyšší aktivitu Lp ‑ PLA2 než ženy (179,6 vs 146, resp., p < 0,0001), zatímco pozorován nebyl žádný zřetelnější nárůst s věkem. Pokud použijeme aktivitu Lp ‑ PLA2 > 195 nmol/ min/ ml jako závislou proměnnou, následující nezávislé proměnné vstoupily významně do mnohočetné logistické regrese: mužské pohlaví [s odds ratio 4,26 (3,26 – 5,58)], nízký HDL‑cholesterol (tj. < 1,0 mmol/ l u mužů či < 1,2 mmol/ l u žen) [3,49 (2,62 – 4,64)], LDL‑cholesterol > 2,5 mmol/ l [6,95 (4,79 – 10,07)] a hypolipidemická léčba [0,59 (0,44 – 0,79)]. U osob bez předcházející manifestace vaskulární choroby 6,3 % subjektů vykazovalo koincidenci výrazně zvýšené aktivity Lp ‑ PLA2 se zvýšeným konvenčním kardiovaskulárním rizikem (SCORE > 10 %). Pokud rozšíříme tuto skupinu i o subjekty se středně zvýšeným rizikem (tj. aktivita Lp ‑ PLA2 152 – 194 a/ nebo SCORE 5 – 9,9 %), stoupne jejich zastoupení na 28,9 % osob v primární prevenci.Závěr:
Zvýšená aktivita Lp ‑ PLA2 je v České populace vysoce prevalentní a s výjimkou lipidových parametrů nezávislá na konvenčních rizikových faktorech. Nicméně až u asi 29 % osob v primární prevenci zvýšená aktivita Lp ‑ PLA2 interferuje se zvýšeným konvenčním rizikem.Klíčová slova:
fosfolipáza A2 asociovaná s lipoproteiny – primární prevence – sekundární prevence – epidemiologieÚvod
Mechanizmem účinku lze s lipoproteiny asociovanou fosfolipázu A2 (Lp ‑ PLA2) umístit asi nejlépe mezi faktory tzv. subklinického zánětu, i když její patofyziologie souvisí též úzce s oblastí lipidů. Lp ‑ PLA2 je enzym produkovaný celou řadou zánětlivých i nezánětlivých buněk, v kontextu aterogeneze však zejména makrofágy uvnitř sklerotického plátu. V krevním oběhu, kam je ze sklerotického plátu uvolňován, zase cirkuluje navázán především na lipoproteiny obsahující apoB (relativně nejsilněji je tedy exprimována na velmi aterogenních malých LDL částicích), se kterými se zase dostává zpět dovnitř sklerotického plátu. Lp ‑ PLA2 působí prozánětlivě zejména cestou prekurzorů kyseliny arachidonové vznikajících štěpením fosfolipidové membrány. Hydrolyzuje oxidované fosfolipidy LDL částice, čímž vzniká velké množství lyzofosfolipidů (lyzofosfatidylcholin) a oxidovaných volných mastných kyselin. Ty podporují expresi adhezivních molekul, atrahují monocyty a aktivují je na makrofágy. Aktivované makrofágy fagocytují oxidované LDL a posléze zanikají a transformují se na pěnové buňky (objem sklerotického plátu tak narůstá). Lp ‑ PLA2 kromě toho zároveň stimuluje produkci zánětlivých cytosinů, jako je TNF-α či IL‑6 (čímž celkově stoupá zánětlivá aktivita uvnitř sklerotického plátu) a zároveň je tím v dalším kroku podporována i apoptóza makrofágu (narůstá tak podíl nekrotického jádra sklerotického plátu) [1]. Předpokládaný patofyziologický mechanizmus zvýšené aktivity Lp ‑ PLA2 lze tedy klinicky charakterizovat jako nárůst nestability sklerotického plátu a tím i rizika akutní manifestace (ruptury plátu) aterovaskulární choroby (tj. infarktu myokardu nebo CMP).
Potenciální klinický význam Lp ‑ PLA2 vyplývá zejména z faktu, že pro tento faktor byla vyvinuta specifická cílená léčba (což je u nekonvenčních rizikových faktorů spíše neobvyklé), nicméně k uvedení do klinické praxe je bezpodmínečně nutné nejprve znát epidemiologickou situaci u potenciálních uživatelů. Cílem naší analýzy bylo tedy zhodnotit prevalenci zvýšené aktivity Lp ‑ PLA2 v obecné české populaci (tedy v primární prevenci) a u pacientů s manifestní vaskulární chorobou (tedy v sekundární prevenci) a posoudit, nakolik zde dochází k interakci s konvenčním kardiovaskulárním rizikovým profilem příslušného jedince (tj. rizikem zprostředkovaným základními rizikovými faktory aterosklerózy, jako je věk, pohlaví, hypertenze, hyperlipidémie, porucha glukózového metabolizmu, kouření a dalšími).
Metoda
Studovaný soubor je tvořen spojením definovaných náhodných vzorků, tj. obecnou populací, pacienty s manifestní ischemickou chorobou srdeční a pacienty po první ischemické cévní mozkové příhodě. Vzorek obecné populace byl získán jako plzeňská část studie postMONICA (Multinational MONItoring of trends and determinants in CArdiovascular disease) provedené v letech 2008 – 2009. Na základě databáze Všeobecné zdravotní pojišťovny (která ze zákona skladuje databázi všech českých pojištěnců) byl balancovaně s ohledem na věk a pohlaví selektován 1% vzorek obyvatel města Plzně ve věku 25 – 65 let. Druhou část souboru představují pacienti s manifestní ischemickou chorobou srdeční (tj. v rozmezí 6 měsíců až 3 roky po proběhlém akutním koronárním syndromu a/ nebo urgentní či elektivní koronární revaskularizaci) mladší než 80 let, vyšetření v letech 2007 – 2008 jako český vzorek mezinárodní studie EUROASPIRE III (EUROpean Action on Secondary Prevention through Intervention to Reduce Events III). Třetí část souboru představují pacienti v rozmezí 6 měsíců až 3 roky po proběhlé verifikované první ischemické cévní mozkové příhodě, vyšetření v letech 2007 – 2008 jako český soubor mezinárodní studie EUROASPIRE – strokesurvey. Detaily metodiky výběru studijní populace a podrobnosti standardních vyšetřovacích protokolů jsou vesměs uvedeny jinde [2 – 4]. Přestože se jednalo o navzájem nezávislé studie, z hlediska realizace vyšetřovacího protokolu byly takřka identické či velmi podobné. Ve zkratce, anamnestická data zahrnovala kromě jiného osobní a rodinnou anamnézu vaskulárních a metabolických chorob, aktuální léčbu, údaje o kouření a příjmu alkoholu. Antropometrická vyšetření zahrnovala měření tělesné výšky s přesností na 0,5 cm a hmotnosti v lehkém oblečení s přesností na 0,1 kg, použito bylo váhy DETECTO 20 (Webb City, USA) v případě vzorku obecné populace či váhy SECA 220 u pacientů s vaskulárními chorobami, s připojeným měřidlem výšky. Obvod v pase a přes boky byl měřen krejčovskou mírou s přesností na 1 cm. Krevní tlak byl měřen rtuťovým sfygmomanometrem s přesností na 2 mm Hg, při obvodu paže širším 35 cm bylo použito široké manžety; pro hodnocení bylo použito průměru ze 3 měření.
Vzorky krve byly odebrány venepunkcí po minimálně 12hodinovém lačnění. Všechna laboratorní stanovení byla provedena rutinními metodikami, pokud není dále uvedeno jinak, na analyzátoru ARCHITECT c800 (Abbott Laboratoires, Wiesbaden, Německo) pomocí komerčně dostupných kitů. Celkový cholesterol (CCHOL) byl stanovován enzymaticky pomocí kitů firmy DOT Diagnostics (ČR), zatímco triglyceridy (TG) a glukóza pomocí kitů firmy Abbott Laboratoires (USA). High‑density lipoprotein cholesterol (HDL) byl stanoven pomocí kitů BioSystems SA (Barcelona, Španělsko), zatímco low ‑ density lipoprotein cholesterol (LDL) byl v souladu s doporučením České společnosti klinické biochemie buď vypočítán modifikovanou Friedewaldovou rovnicí (tj. CCHOL ‑ HDL‑TG/ 2,22), nebo při triglyceridech > 4,0 mmol/ l stanoven direktně pomocí kitů BioSystems. Aktivita Lp ‑ PLA2 byla stanovena enzymovou metodou (CAM turbidimetrie) pomocí komerčně dostupných kitů firmy diaDexus Inc. (San Francisco, USA) na platformě Olympus AU 400., variační koeficient tohoto stanovení činil méně než 2,1 %.
Celkové kardiovaskulární riziko bylo kalkulováno jako individuální pravděpodobnost úmrtí z jakékoliv příčiny v příštích 10 letech pomocí metodiky SCORE (Systematic COronary Risk Evaluation) [5]. Pro výpočet bylo použito logistické funkce zahrnující bazální riziko úmrtí vycházející z věku a pohlaví jedince, upravené podle aktuální výše systolického krevního tlaku, kuřáckého habitu a poměru celkového/ HDL‑cholesterolu, přičemž rizikové koeficienty jsou lokalizovány pro českou populaci. Kardiovaskulární riziko SCORE bylo kalkulováno pouze u subjektů dosud bez manifestní vaskulární choroby. Jednotlivé rizikové faktory byly kategorizovány s ohledem na cílové hodnoty definované 4. Společnými evropskými doporučeními pro prevenci kardiovaskulárních chorob [6], tj. zvýšený obvod pasu jako > 102 cm u mužů či > 88 cm u žen; zvýšený krevní tlak jako systolický krevní tlak (STK) > 140 mm Hg a/ nebo diastolický krevní tlak (DTK) > 90 mm Hg; nízké HDL jako < 1,0 mmol/ l u mužů či < 1,2 mmol/ l u žen; diabetes jako glykemie nalačno > 7 mmol/ l či antidiabetická léčba či anamnesticky udávaný diabetes mellitus 2. typu. Metabolický syndrom byl určen podle modifikované definice Českého institutu metabolického syndromu (ČIMS), tj. v případě přítomnosti alespoň 3 z následujících faktorů: obvod pasu > 102 cm u mužů či > 88 cm u žen; STK > 130 mm Hg a/ nebo diastolický krevní tlak (DTK) > 85 mm Hg a/ nebo antihypertezní léčba; HDL < 1,0 mmol/ l u mužů či < 1,3 mmol/ l u žen; TG > 1,7 mmol/ l; glykemie > 5,6 mmol/ l a/ nebo diabetes mellitus 2. typu.
Studie představuje převážně deskriptivní analýzu, detaily o jednotlivých veličinách a použitém statistickém hodnocení jsou uvedeny vždy v příslušných sekcích – pro porovnávání hodnot kontinuálních proměnných bylo použito Mann‑Whitney U testu, u kategorických χ2 testu. Relativní rizika byla kalkulována pomocí mnohočetné logistické regrese.
Všechny procedury byly realizovány podle principů správné klinické praxe, protokol studie byl schválen etickou komisi a všichni probandi vyjádřili svůj souhlas s účastí v projektu podpisem informovaného souhlasu. Všechna data jsou skladována s ohledem na zákon o ochraně osobních údajů a zpracována ve formě znemožňující identifikaci jednotlivce.
Výsledky
Celkem bylo ve studii analyzováno 1 962 subjektů, 1 080 mužů a 882 žen o průměrném věku 59,0 let. Základní údaje o souboru shrnuje tab. 1, a to i zvláště pro obecnou populaci (studie postMONICA), a pro pacienty s manifestní vaskulární chorobou (studie EUROASPIRE III a EUROASPIRE – stroke survey). Celkem 21,1 % osob vykazovalo zvýšenou hodnotu aktivity Lp ‑ PLA2 (podle použité definice, tj. > 195 nmol/ min/ ml), přičemž rozdíl mezi obecnou populací a pacienty s již manifestovanou vaskulární chorobou byl fakticky minimální a statisticky nesignifikatní (a to přesto, že jinak se oba soubory mezi sebou lišily prakticky ve všech parametrech).
Table 1. Základní parametry použitých souborů obecné populace a pacientů s klinicky manifestní aterovaskulární chorobou. 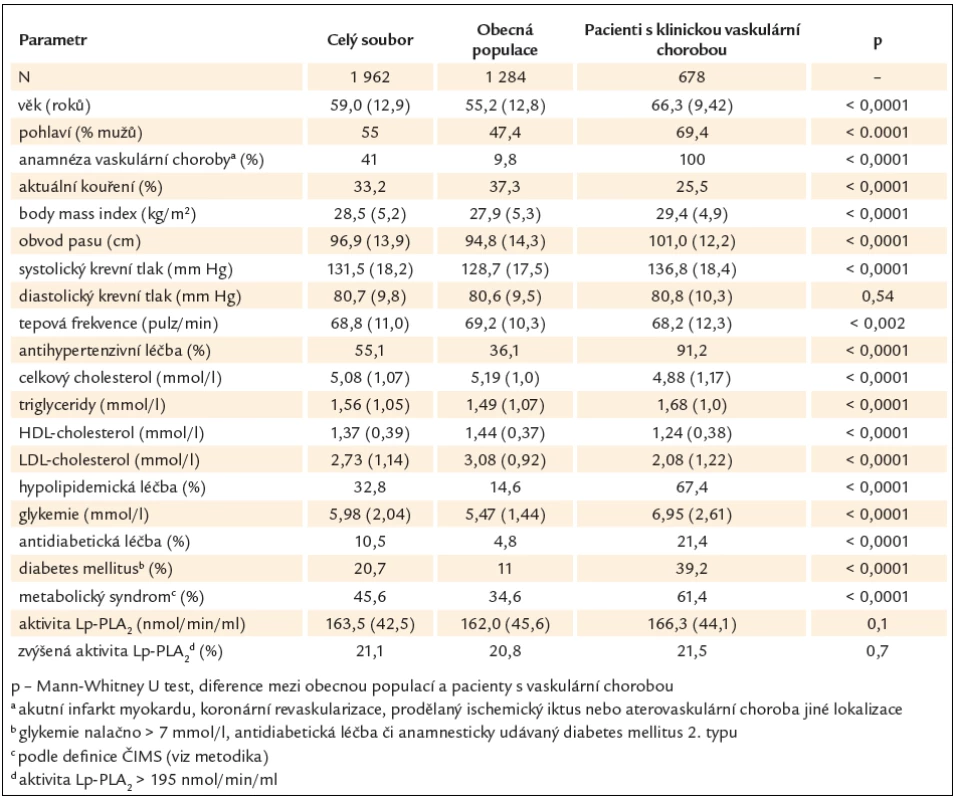
Distribuce hodnot aktivity Lp ‑ PLA2 je uvedena na grafu 1, a to zvláště pro osoby bez a s manifestní vaskulární chorobou (9,8 % osob s anamnesticky udávanou jakoukoliv aterovaskulární chorobou ze souboru obecné populace je v tomto případě zahrnuta do 2. skupiny). Hodnoty aktivity Lp ‑ PLA2 mají typicky gaussovskou distribuci s pouze mírným protažením směrem k vyšším hodnotám a opět není prakticky žádný rozdíl v této distribuci mezi subjekty s a bez vaskulární choroby. Arbitrárně určená hranice nadnormálních hodnot (tj. > 195 nmol/ min/ ml) odpovídala zhruba hornímu kvintilu (přesněji 79. percentil), zatímco dolní hranice středního rizika (tj. > 152 nmol/ min/ ml) 43. percentilu našeho souboru.
Graph 1. Distribuce aktivity Lp-PLA<sub>2</sub> u osob s a bez anamnézy klinické manifestace aterovaskulární choroby. 
Vztah mezi věkem, pohlavím a hodnotami aktivity Lp ‑ PLA2 udává graf 2. Muži vykazují ve všech věkových kategoriích významně vyšší hodnoty (zhruba o 20 – 40 nmol/ min/ ml). Věkové trendy nejsou jednoznačné, ženy vykazují mírný vzestup s věkem (ve vyšších věkových skupinách již oploštěný), zatímco muži měli nejvyšší hodnoty ve věku 35 – 45 let, a poté dochází opět k jejich poklesu.
Graph 2. Aktivita Lp-PLA<sub>2</sub> podle věkových skupin a pohlaví. (Mann-Whitney U test pro diferenci mezi pohlavími; Kruskal-Wallis ANOVA pro trend). 
Multifaktoriální asociaci mezi aktivitou Lp ‑ PLA2 a konvenčními rizikovými faktory udává tab. 2, přičemž jako závislá proměnná v mnohočetné logistické regresi byla použita individuální aktivita Lp ‑ PLA2 > 195 nmol/ min/ ml. Jako nejsilnější prediktor takto zvýšené aktivity Lp ‑ PLA2 do regrese vstoupil zejména zvýšený LDL‑cholesterol, významnými faktory byly dále mužské pohlaví, snížený HDL‑cholesterol a užívaná hypolipidemická léčba.
Table 2. Multifaktoriální asociace mezi zvýšenou aktivitou Lp-PLA<sub>2</sub> a konvenčním rizikovým profilem. 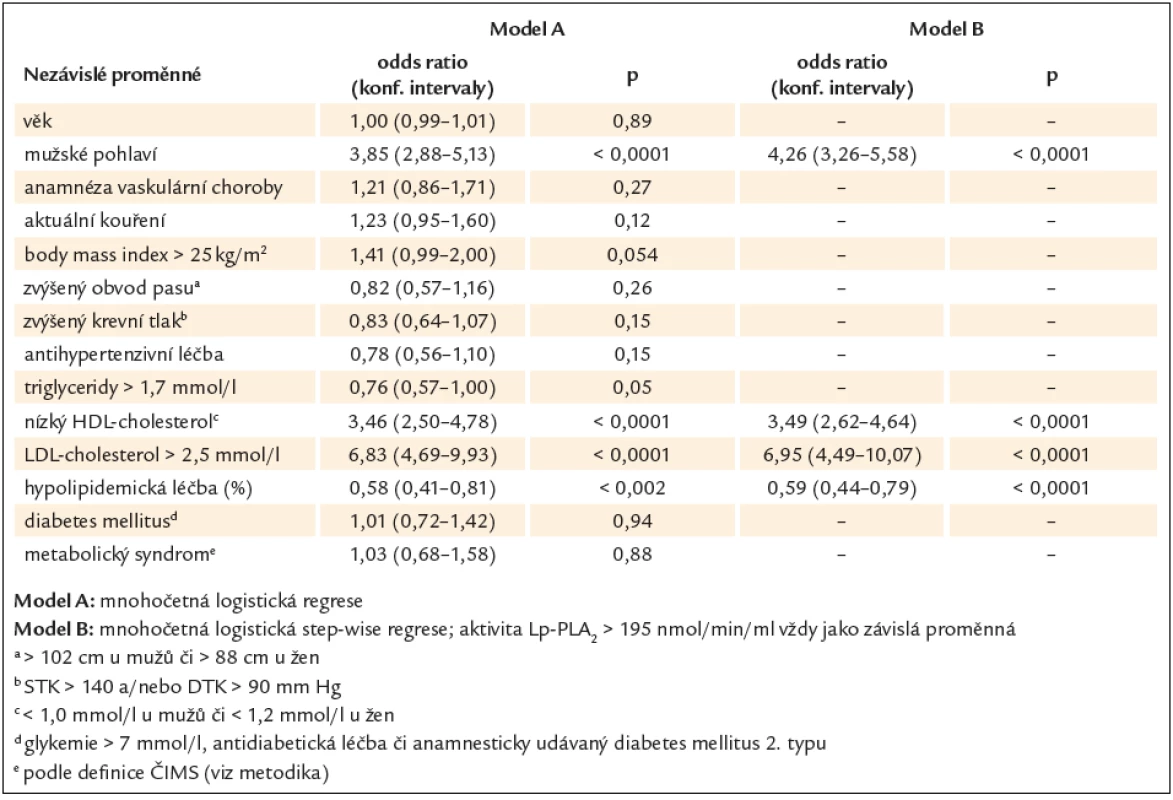
U podsouboru celkem 1 158 subjektů doposud s negativní anamnézou vaskulární choroby (tj. v primární prevenci) byla navíc stanovena interakce s celkovým kardiovaskulárním rizikem představovaným konvenčními rizikovými faktory podle metodiky SCORE (tj. percentuálně riziko fatální vaskulární příhody v příštích 10 letech) (graf 3). Celkem 6,3 % osob v primární prevenci se pohybovalo v pásmu výrazného rizika fatální vaskulární příhody daného konvenčním rizikovým profilem (SCORE > 10 %) a zároveň vykazovalo zvýšenou aktivitu Lp ‑ PLA2 (černý sloupec). Pokud připočteme osoby s kombinací buď střední riziko podle SCORE (5 – 9,9 %) + vysoká aktivita Lp ‑ PLA2, či naopak pouze středně zvýšená aktivita Lp‑PLA2 + nejvyšší riziko podle SCORE, prevalence takto definované skupiny stoupne až na 19,1 %.
Graph 3. Proporcionální zastoupení osob bez anamnézy manifestace vaskulární choroby (primární prevence) v podskupinách podle kategorií aktivity Lp-PLA<sub>2</sub> a individuálního rizika daného konvenčními rizikovými faktory podle metodiky SCORE. 
Diskuze
Předkládaná studie představuje především epidemiologickou deskriptivní analýzu, zaměřenou na stanovení distribuce aktivity Lp ‑ PLA2 v obecné české populaci a u dobře definovaného souboru pacientů s manifestní aterovaskulární chorobou. Kromě toho jsme se pokusili stanovit asociaci s konvenčními rizikovými faktory a to, jak frekventně vstupuje zvýšená aktivita Lp ‑ PLA2 do interakce se zvýšeným konvenčním rizikem podle modelu SCORE.
Zvýšená hodnota aktivity Lp ‑ PLA2 byla nalezena asi u 1/ 5 studovaných subjektů, přičemž jako horní limit tzv. normální hodnoty byla použita arbitrární hodnota udávaná výrobcem. Nutno však zdůraznit, že podobně jako u většiny ostatních kvantitativních rizikových faktorů, kardiovaskulární riziko dané aktivitou Lp ‑ PLA2 má spíše kontinuální charakter a tzv. normální rozmezí je (alespoň zpočátku) obvykle pouze odvozeno od distribuce daného parametru, event. spíše věcí dohody (ani u tak zavedených rizikových faktorů, jako je LDL‑cholesterol či krevní tlak, není debata o normální hodnotě či léčebném cíli dodnes ukončena). Převážná většina důkazů, kterou máme k dispozici ve věci kardiovaskulárního rizika spojeného s aktivitou Lp ‑ PLA2, pochází se subanalýz již existujících studií. Komplexní pohled nám dává metaanalýza [7] 32 prospektivních studií na celkem 79 036 subjektech, věnujících se vztahu aktivity a/ nebo koncentrace Lp ‑ PLA2 ke kardiovaskulární morbiditě a mortalitě u v různých uspořádáních (populační registry, kohortové či intervenční studie – obvykle statinové studie a další), při různých charakteristikách participantů (obecná populace, vysokorizikové subjekty, pacienti s manifestní vaskulární chorobou). Souhrnně, vzestup aktivity Lp ‑ PLA2 o 1 SD byl v těchto studiích spojen s vzestupem relativního standardizovaného rizika kardiovaskulární příhody asi o 10 % a přetrvává to i po adjustaci na konvenční rizikový profil (systolický krevní tlak, kouření, HDL ‑ a non HDL‑cholesterol, body mass index, triglyceridy). Velmi podobná relativní rizika (asi 10 – 16 %) jsou nacházena, pokud srovnáme fatální či nefatální koronární příhody a dále i pro aktivitu či koncentraci Lp ‑ PLA2. Relativní riziko dané aktivitou Lp ‑ PLA2 se též významně neliší mezi vstupně zdravými osobami a pacienty se stabilní vaskulární chorobou (primární vs sekundární prevence), což koreluje s námi zjištěnou velmi podobnou distribucí aktivity Lp ‑ PLA2 v těchto skupinách v našem souboru. Naopak méně jednoznačná je v této metaanalýze asociace mezi cévními mozkovými příhodami a aktivitou Lp ‑ PLA2, kde významnost po adjustaci (na již výše uvedené faktory) klesla pod hladinu statistické signifikance.
Aktivita Lp ‑ PLA2 významně koreluje zejména s lipidovými parametry, což je bezpochyby dáno jejich velmi provázaným patofyziologickým mechanizmem (a v určitých fázích v podstatě fyzickým spojením cestou apoB). Přestože hladina statistické významnosti vztahu mezi kardiovaskulárním rizikem a Lp ‑ PLA2 v této metaanalýze klesala po adjustaci na konvenční lipidové parametry a apoB (dohromady asi o 5 procentních bodů relativního rizika), i poté se ještě pohybovala v pásmu statistické signifikance. Zvýšená aktivita či koncentrace Lp ‑ PLA2 tedy zřejmě představuje aditivní riziko nad rámec lipidových faktorů. Na druhé straně pro úplnost nutno konstatovat, že pokud se podíváme na některé jednotlivé studie zařazené do této metaanalýzy, právě adjustace na lipidové parametry byla důvodem, proč asociace mezi Lp ‑ PLA2 a kardiovaskulárním rizikem v těchto studiích klesla pod hladinu statistické signifikance. Problém také může činit vzájemná blízkost Lp ‑ PLA2 a apoB, kde zvýšená hodnota apoB (resp. nízký poměr LDL/ apoB) představuje asi nejdostupnější ukazatel zastoupení malých LDL částic, tj. samo o sobě poměrně významného činitele kardiovaskulárního rizika. Asociace mezi aktivitou Lp ‑ PLA2 a kardiovaskulárními endpointy byla nejsilnější právě u subjektů v nejnižším tercilu apoB (23% nárůst relativního rizika) a naopak výrazně klesala při vyšších koncentrací (nicméně statistickou signifikanci si ponechávala i tak) – pro budoucí interpretaci zejména intervenčních studií aktivity Lp ‑ PLA2 je nutno toto brát v úvahu.
Pokud chceme atributovatelné riziko Lp ‑ PLA2 kategorizovat (což je pro klinickou praxi nezbytné), je situace komplikována značnou variabilitou, jakou dávají různé metodiky (průměrně hodnoty aktivity Lp ‑ PLA2 v jednotlivých studiích se podle metodiky stanovení pohybují od 26 do 629 nmol/ min/ ml!). Výše zmíněná metaanalýza se tento problém pokusila překonat tak, že soubor je rozdělen do kvintilů, které zohledňují použitou metodiku stanovení. Pokud vezmeme riziko v nejnižším kvintilu aktivity Lp ‑ PLA2 rovno 1, subjekty v 2. a 3. kvintilu vykazovaly asi 45% nárůst relativního rizika fatální či nefatální koronární příhody, zatímco subjekty v nejvyšším kvintilu až 75% nárůst; relativní rizika pro kardiovaskulární mortalitu (tj. pouze fatální vaskulární příhody) ve stejných kategoriích činila asi 30 % a 48 %, resp. V našem souboru jsme pro zařazení do jednotlivých rizikových kategorií aktivity Lp ‑ PLA2 (tj. střední a vysoké riziko) použili hranice udávané výrobcem (152 – 194 a > 195 nmol/ min/ ml). Tato výrobcem udávaná arbitrární hodnota byla stanovena jako horní tercil souboru 1 536 mužů či žen o průměrném věku 63 let s klinicky relevantní vaskulární chorobou (viz produktová informace výrobce, např. na www.plactest.com). Samozřejmě o validitě takto předložené normální hodnoty lze s úspěchem pochybovat a diskuze v této oblasti jistě není ukončena. Nicméně pokud vezmeme v potaz distribuci aktivity Lp ‑ PLA2 v populaci naší studie, tyto hranice rizikových kategorií se velmi blíží dolní hranici 3. a nejvyššího kvintilu (přesněji 43. percentil a 79. percentil) spojených již s výše popsaným 75% vzestupem mortalitního rizika – použití arbitrárních hodnot výrobce tedy i v české populaci dává pro klinickou praxi smysl.
Přestože je Lp ‑ PLA2 vnímána vzhledem k mechanizmu svého účinku jako tzv. prozánětlivý rizikový faktor aterosklerózy, v předkládané metaanalýze jeho kardiovaskulární riziko zůstává prakticky nezměněné i po adjustaci na C ‑ reaktivní protein (CRP) a navíc aktivita Lp ‑ PLA2 a hladina CRP spolu navzájem ani nekorelují. Z toho lze usuzovat, že mechanizmy obou těchto prozánětlivých faktorů spolu fyziologicky nesouvisejí a bylo by zřejmě zajímavé do budoucna naopak stanovit, jak spolu budou tyto 2 faktory interagovat.
Muži v našem souboru vykazovali asi o 21 % vyšší aktivitu Lp ‑ PLA2 než ženy a nepozorovali jsme u nich ani vzestup toho parametru s věkem (u žen takovýto mírný vzestup s oploštěním nad 55 rokem věku pozorovatelný je), naopak paradoxně nejvyšší aktivitu Lp ‑ PLA2 měli muži mezi 35. a 45. rokem života. Statistická významnost trendu však vymizí po adjustaci na koncentraci LDL‑cholesterolu a/ nebo hypolipidemickou léčbou (oba tyto parametry si zachovávají statistickou významnost) – příčinu tohoto jevu můžeme tedy hledat ve vyšší frekvenci hypolipidemické léčby převážně statiny u osob vyššího věku a současně s tím souvisejícími relativně příznivějšími hladinami LDL‑cholesterolu.
Vztah mezi hypolipidemickou léčbou statiny (které v našem souboru představovaly 93 % této léčby) a Lp ‑ PLA2 není jednoznačně vyřešen, a to zejména v otázce, zda pozorované snížení po léčbě jde na vrub poklesu LDL‑cholesterolu či pleiotropnímu účinku statinu; výsledky studií navíc nejsou jednoznačné. Schaefer et al [8] pozorovali pokles koncentrace Lp ‑ PLA2 po léčbě atorvastatinem, ale nikoliv již po léčbě simvastatinem, fluvastatinem či lovastatinem (které však vykazovaly i nižší hypolipidemický účinek). Saugos et al pozorovali [9] pokles aktivity Lp ‑ PLA2 po rosuvastatinu, fenofibrátu i po ezetimibu, tedy nezávisle na hypolipidemické třídě. Lee et al [10] srovnávali efekt kombinace nízkodávkovaného atorvastatinu s ezetimibem (5/ 5 mg) se standardně dávkovaným atorvastatinem (20 mg). Oba režimy měly velmi podobný hypolipidemický účinek z hlediska LDL‑cholesterolu, nicméně pokles koncentrace Lp ‑ PLA2 byl výraznější u vyšší dávky atorvastatinu (42 % vs 9 % oproti hodnotě před léčbou). Z této studie by tedy vyplývalo, že z hlediska účinku na Lp ‑ PLA2 vykazují statiny ještě aditivní účinek jdoucí za pouhý pokles LDL‑cholesterolu. Tomu nepřímo odpovídají i naše data, kdy aktivita Lp ‑ PLA2 přetrvává významně asociována s LDL‑cholesterolem a léčbou hypolipidemiky (statiny) i po vzájemně adjustaci.
Základní otázkou každého „nového“ rizikového faktoru je jeho léčebná ovlivnitelnost a benefit z této intervence vyplývající. Subanalýza Nurses Health Study prokázala, že nutriční změna charakterizovaná náhradou karbohydrátů proteiny vede k poklesu aktivity Lp ‑ PLA2 [11]. Na druhé straně, zase v jiné studii vegetariáni vykazovali nižší aktivitu Lp ‑ PLA2 než omnivoriáni [12]. Kromě již diskutovaného účinku hypolidemik byl pokles aktivity Lp ‑ PLA2 pozorován také u antiobezitika orlistatu (asi 14 %), resp. zejména pokud byl tento kombinován s fenofibrátem (asi 35% redukce) [13]. Základním problémem všech těchto nálezů ale zůstává, že u nich lze jen velmi těžko odlišit specifický efekt na aktivitu Lp ‑ PLA2 od efektu konkomitantní změny v koncentraci, složení a velikosti lipoproteinů právě na tuto aktivitu.
Na rozdíl od většiny ostatních nekonvenčních rizikových faktorů lze aktivitu Lp ‑ PLA2 tentokrát ovlivňovat i přímo za tímto účelem vyvinutou léčebnou látkou. Darapladib představuje extrémně potentní a reverzibilní, orální inhibitor aktivity Lp ‑ PLA2. Z preklinických studií byla inhibice aktivity Lp ‑ PLA2 darapladibem během in vitro oxidace LDL spojena s redukcí chemotaxe monocytů, aktivací leukocytů a buněčné smrti makrofágů (tj. mechanizmů vedoucích k nestabilitě sklerotického plátu) [14]. Z klinických studií nutno zmínit práci Mohlera et al [15], kde podávání darapladibu po dobu 12 týdnů vedlo asi k 54% poklesu aktivity Lp ‑ PLA2, a to přes konkomitantní léčbu atorvastatinem v dávce až 80 mg. Z klinického hlediska je velmi důležité, že darapladib je schopen inhibovat aktivitu Lp ‑ PLA2 i na pozadí léčby statinem, která představuje v podstatě paušální opatření sekundární prevence. V jedné studii byl také srovnáván efekt 160 mg darapladibu oproti placebu za pomoci intrakoronárního ultrazvuku [16]. Zatímco u pacientů na placebu objem nekrotického jádra sklerotického plátů významně narůstal, u pacientů na darapladibu byl tento proces zastaven. Nicméně na definitivní důkazy přínosu této léčby v podobě intervenčních studií s „tvrdými“ výstupy si musíme ještě počkat. Studie STABILITY (STabilization of of Atherosclerotic plaque by Initiation of DarapLadIb TherapY) již randomizovala více než 15 000 pacientů s chronickou stabilizovanou ischemickou chorobou srdeční (alespoň 1 měsíc po akutním koronárním syndromu a/ nebo koronární angioplastice či alespoň 3 měsíce po koronárním bypassu) buď na 160 mg darapladibu, či na placebo, výsledky (resp. ukončení studie) jsou očekávány předběžně na podzim roku 2013 [17]. Studie SOLID ‑ TIMI 52 (Stabilisation Of pLaques usIng Darapladib ‑ Thrombolysis In Myocardial Infarction 52 trial) [18] randomizovala obdobným způsobem více než 13 000 pacientů, tentokrát však maximálně do 30 dnů po prodělaném akutním infarktu myokardu a ukončení je předběžně očekáváno na jaro roku 2014.
Poslední otázkou zůstává, na koho by eventuální intervence vlastně měla být zaměřena. Výše zmíněné probíhající intervenční studie jsou (jako obvykle) realizovány výhradně v sekundární prevenci. Pokud vezmeme v potaz naše výsledky, přítomnost zvýšené aktivity Lp ‑ PLA2 již v poměrně mladém věku a naopak nepřítomnost rozdílu mezi tzv. zdravou populací a pacienty s již manifestovanou vaskulární chorobou může naznačovat, že těžiště toho rizikového faktoru může být tentokrát spíše v primární než v sekundární prevenci. V našem souboru vykazovalo asi 6 % subjektů v primární prevenci kombinaci nejvyššího rizika z hlediska konvenčních faktorů (podle SCORE) a zároveň nejvyšší aktivitu Lp ‑ PLA2, nicméně při kombinaci středních rizikových kategorií stoupne zastoupení až na 19 – 29 %. Pokud se potvrdí přínos intervence Lp ‑ PLA2, měla by být otázka intervence v primární prevenci u těchto skupin řešena jako další v pořadí.
Závěr
Závěrem lze tedy konstatovat, že zvýšená aktivita Lp ‑ PLA2 představuje potenciální nezávislý rizikový faktor kardiovaskulárních chorob s nezanedbatelnou prevalencí v naší populaci a se značným stupněm interakce se zvýšeným konvenčním rizikovým profilem. Zda má toto prozatím pouze epidemiologické zjištění nějaký klinický význam ve smyslu potenciálu k intervenci reziduálního rizika, však bude muset být ještě doloženo, v první řadě již brzy očekávanými výsledky intervenčních studií s darapladibem.
Poděkování
Studie byla podpořena firmou diaDexus Inc (zastoupená firmou Medista s. r. o., Praha), která poskytla zdarma kity ke stanovení aktivity Lp ‑ PLA2. Autoři děkují zejména dr. M. Hroudovi za organizaci a realizaci tohoto daru. Klinická část byla podpořena Interní grantovou agenturou Ministerstva Zdravotnictví ČR (granty NT 13186 a NT12102) a dále pak Programem rozvoje vědních oborů Karlovy Univerzity (projekt P36). V této analýze byla použita data ze studií postMONICA, EUROASPIRE III a EUROASPIRE III ‑ stroke survey. Autoři děkují všem spolupracujícím lékařům a sestrám, kteří realizovali rozsáhlý vyšetřovací program v těchto projektech. A v neposlední řadě rovněž děkují paní Rubešové a Schejbalové za excelentní technickou spolupráci při stanovování aktivity Lp ‑ PLA2.
doc. MU Dr. Otto Mayer jr., CSc.
www.fnplzen.cz
e‑mail: mayero@fnplzen.cz
Doručeno do redakce: 4. 11. 2012
Přijato po recenzi: 1. 3. 2013
Sources
1. Silva IT, Mello AP, Damasceno NR. Antioxidant and inflammatory aspects of lipoprotein‑associated phospholipase A2 (Lp ‑ PLA2): a review. Lipids Health Dis 2011; 10 : 170.
2. Cífková R, Skodová Z, Bruthans J et al.. Longitudinal trends in cardiovascular mortality and blood pressure levels, prevalence, awareness, treatment, and control of hypertension in the Czech population from 1985 to 2007/ 2008. J Hypertens 2010; 28 : 2196 – 2203.
3. Mayer jr. O, Šimon J, Galovcová M et al. The quality of secondary prevention of coronary heart disease in Czech patients in the EUROASPIRE III survey. Cor Vasa 2008; 50 : 156 – 162.
4. Bruthans J, Mayer jr. O, Šimon J et al. Úroveň sekudární prevence cevních mozkových příhod u českých pacietů ve studii EUROASPIRE III ‑ stroke specific module. Cor Vasa 2008; 50 : 446 – 454.
5. Conroy RM, Pyörälä K, Fitzgerald AP et al. SCORE project group. Estimation of ten‑year risk of fatal cardiovascular disease in Europe: the SCORE project. Eur Heart J 2003; 24 : 987 – 1003.
6. Graham I, Atar D, Borch ‑ Johnsen K et al. European guidelines on cardiovascular disease prevention in clinical practice: executive summary. Fourth Joint Task Force of the European Society of Cardiology and other societies on cardiovascular disease prevention in clinical practice (constituted by representatives of nine societies and by invited experts). Eur J Cardiovasc Prev Rehabil 2007; 14: (Suppl. 2): E1 – E113.
7. The Lp ‑ PLA2 Studies Collaboration. Lipoprotein‑associated phospholipase A2 and risk of coronary disease, stroke, and mortality: collaborative analysis of 32 prospective studies. Lancet 2010; 375 : 1536 – 1544.
8. Schaefer EJ, McNamara JR, Asztalos BF et al. Effects of atorvastatin versus other statins on fasting and postprandial C ‑ reactive protein and lipoprotein‑associated phospholipase A2 in patients with coronary heart disease versus control subjects. Am J Cardiol 2005; 95 : 1025 – 1032.
9. Saougos VG, Tambaki AP, Kalogirou M et al. Differential effect of hypolipidemic drugs on lipoprotein‑associated phospholipase A2. Arterioscler Thromb Vasc Biol 2007; 27 : 2236 – 2243.
10. Lee SH, Kang SM, Park S et al. The effects of statin monotherapy and low‑dose statin/ ezetimibe on lipoprotein‑associated phospholipase A2. Clin Cardiol 2011; 34 : 108 – 112.
11. Hatoum IJ, Nelson JJ, Cook NR et al. Dietary, lifestyle, and clinical predictors of lipoprotein‑associated phospholipase A2 activity in individuals without coronary artery disease. Am J Clin Nutr 2010; 91 : 786 – 793.
12. Chen CW, Lin CT, Lin YL et al. Taiwanese female vegetarians have lower lipoprotein‑associated phospholipase A2 compared with omnivores. Yonsei Med J 2011; 52 : 13 – 19.
13. Filippatos TD, Gazi IF, Liberopoulos EN et al. The effect of orlistat and fenofibrate, alone or in combination, on small dense LDL and lipoprotein‑associated phospholipase A2 in obese patients with metabolic syndrome. Atherosclerosis 2007; 193 : 428 – 437.
14. Carpenter KL, Dennis IF, Challis IR et al. Inhibition of lipoproteinassociated phospholipase A2 diminishes the death ‑ inducing effects of oxidized LDL on human monocyte ‑ macrophages. FEBS Lett 2001; 505 : 357 – 363.
15. Mohler ER, Ballantyne CM, Davidson MH et al. Darapladib Investigators. The effect of darapladib on plasma lipoprotein‑associated phospholipase A2 activity and cardiovascular biomarkers in patients with stable coronary heart disease or coronary heart disease risk equivalent: the results of a multicenter, randomized, double‑blind, placebo ‑ controlled study. J Am Coll Cardiol 2008; 51 : 1632 – 1641.
16. Serruys PW, García ‑ García HM, Buszman P et al. Integrated Biomarker and Imaging Study ‑ 2 Investigators. Effects of the direct lipoprotein‑associated phospholipase A(2) inhibitor darapladib on human coronary atherosclerotic plaque. Circulation 2008; 118 : 1172 – 1182.
17. White H, Held C, Stewart R et al. Study design and rationale for the clinical outcomes of the STABILITY Trial (STabilization of Atherosclerotic plaque By Initiation of darapLadIb TherapY) comparing darapladib versus placebo in patients with coronary heart disease. Am Heart J 2010; 160 : 655 – 661.
18. O‘Donoghue ML, Braunwald E, White HD et al. Study design and rationale for the Stabilization of pLaques usIng Darapladib ‑ Thrombolysis in Myocardial Infarction (SOLID ‑ TIMI 52) trial in patients after an acute coronary syndrome. Am Heart J 2011; 162 : 613 – 619.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2013 Issue 5-
All articles in this issue
- Spondyloartritidy: aktuální pohled na diagnostiku a klasifikaci
- Diastolická dysfunkce levé komory ve vyšším věku. Nemoc, nebo fyziologický projev stárnutí?
- Fixní kombinace telmisartanu a thiazidového diuretika v léčbě hypertenze
- Paraneoplastická hypoglykémia – popis prípadu a prehľad problematiky
- Malígnym melanómom imitovaný akútny koronárny syndróm alebo reálny akútny koronárny syndróm?
- Spondylodiscitida, epidurální empyém jako komplikace syndromu diabetické nohy
- Distribuce s lipoproteiny asociované fosfolipázy A2 v české populaci a její interakce s konvenčním kardiovaskulárním rizikem
- Možný vplyv génového polymorfizmu v oblasti GSTs génov na sérovú hladinu polychlorovaných bifenylov (PCB)
- Srovnání MRCP a ERCP v diagnostice choledocholitiázy
- Poruchy srdcového rytmu u pacientov s diabetes mellitus
- Kombinovaná terapie arteriální hypertenze
- Prevence náhlé srdeční smrti při sportu ve světle nových doporučení
- Choroby způsobené lepkem
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diastolická dysfunkce levé komory ve vyšším věku. Nemoc, nebo fyziologický projev stárnutí?
- Spondyloartritidy: aktuální pohled na diagnostiku a klasifikaci
- Srovnání MRCP a ERCP v diagnostice choledocholitiázy
- Choroby způsobené lepkem
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

