-
Medical journals
- Career
Recidivujúca protetická endokarditída u 21-ročného pacienta s transplantovanou obličkou riešená alogénnym homograftom
Authors: F. Sabol 3; M. Jakubová 1; A. Kolesár 3; B. Stančák 2; M. Beňa 3; J. Podracký 2; Ľ. Podracká 4; P. Čadník 1; J. Špatenka 5
Authors‘ workplace: Klinika anestéziológie a intenzívnej medicíny VÚSCH, a. s., Košice, Slovenská republika, prednosta doc. MUDr. Pavol Török, CSc. 1; Klinika kardiológie VÚSCH, a. s., Košice, Slovenská republika, prednosta doc. MUDr. Branislav Stančák, CSc. 2; Klinika srdcovej chirurgie VÚSCH, a. s., Košice, Slovenská republika, prednosta MUDr. František Sabol, PhD. 3; I. klinika detí a dorastu DFN Košice, Slovenská republika, prednosta prof. MUDr. Ľudmila Podracká, CSc. 4; Transplantační centrum FN Motol Praha, Česká republika, přednosta prim. MUDr. Jaroslav Špatenka, CSc. 5
Published in: Vnitř Lék 2012; 58(6): 494-498
Category: Case Reports
Overview
Protetická infekčná endokarditída je možnou komplikáciou implantovanej chlopňovej náhrady. Ak sa včas a účinne nelieči, môže mať fatálne následky. Jednou z liečebných alternatív je použitie alogénneho kryoprezervovaného homograftu. V kazuistike prezentujeme prípad 21-ročného pacienta po transplantácii obličky pre hereditárny nefrotický syndróm a náhradu aortálnej chlopne aortálnym konduitom, u ktorého bola echokardiograficky diagnostikovaná protetická infekčná endokarditída, potvrdená aj CT-3D vyšetrením. Pacientovi bol na Klinike srdcovej chirurgie implantovaný aortálny kryoprezervovaný homograft. Po operácii boli prechodne zaznamenané subfebrility s pozitívnym kultivačným nálezom, infekciu sa po konzervatívnom postupe podarilo zvládnuť. Na základe literárnych údajov, ako aj vlastnej skúsenosti, sa domnievame, že liečba protetickej endokarditídy po náhrade aortálnej chlopne kryoprezervovaným homograftom môže byť metódou voľby.
Kľúčové slová:
alogénny homograft – infekčná endokarditída – transplantácia obličkyÚvod
Infekčná endokarditída (IE) je mikrobiálne zápalové ochorenie endokardiálnej výstelky, s priemernou incidenciou 1,7–6,2 prípadov na 100 000 obyvateľov/rok [1]. Ide o závažný, život ohrozujúci klinický stav s vysokou morbiditou a mortalitou. Počiatočná liečba IE je zvyčajne konzervatívna, chirurgické riešenie sa indikuje prísne individuálne, pri rozhodovaní vždy treba zohľadniť celkový klinický stav pacienta, kultivačné a echokardiografické nálezy [2]. Ak sa IE nelieči cielene a promptne, môže končiť fatálne [3]. Priaznivejšie chirurgické výsledky sú spravidla vtedy, keď sa operuje skôr, než dôjde k výraznému postihnutiu srdca či k rozvoju sepsy a/alebo zhoršeniu celkového stavu [4]. Protetická infekčná endokarditída môže byť včasná, ak vzniká do jedného roku po operácii srdca, a neskorá. Najväčšie riziko vzniku je počas prvých dvoch mesiacov po kardiochirurgickej operácii, s postupnou epitelizáciou protézy sa riziko vzniku infekcie znižuje [5].
V nasledujúcej kazuistike uvádzame prípad 21-ročného pacienta s transplantovanou obličkou na chronickej imunosupresívnej liečbe, u ktorého sa vyvinula recidivujúca protetická endokarditída. Implantácia kryoprezervovaného alogénneho homograftu viedla k úspešnému vyliečeniu pacienta.
Kazuistika
Ide o 21-ročného muža, ktorému bola v 5 rokoch života transplantovaná oblička pre hereditárny nefrotický syndróm. Funkcia štepu bola aj 16 rokov po tejto transplantácii výborná, hladina kreatinínu oscilovala v rozmedzí 117–140 μmol/l. Krvný tlak bol kombinovanou antihypertenzívnou liečbou (ACE-inhibítor + blokátor kalciového kanála) dobre kompenzovaný. Pacientovi bola vo veku 15 rokov pre dilatáciu a disekciu ascendentnej aorty nahradená aortálna chlopňa aortálnym mechanickým konduitom. V 16 rokoch života prekonal infekčnú protetickú endokarditídu, ktorá sa úspešne zvládla kombináciou antibiotík.
Ako 21-ročný mal napriek opakovanej ATB liečbe (ciprofloxacín, azitromycín, klaritromycín) takmer 4 týždne trvajúce undulujúce teploty do 38 °C. Pacient naďalej užíval štandardnú chronickú imunosupresiu (prednizon, takrolimus, mykofenolát mofetil). Pre podozrenie na infekčnú endokarditídu bolo indikované echokardiografické vyšetrenie, ktoré verifikovalo perianulárne dutiny až do 1,0 cm s jasnou komunikáciou do ľavej komory a tvoriacou sa pseudoaneuryzmou v periprotetickej oblasti (obr. 1a, 1b). Cievna protéza konduitu bola bez známok disekcie a leaku, maximálna rýchlosť cez protézu do 4,0 m/s, v LVOT 1,3 m/s, PPG 65 mm Hg. CT-3D vyšetrením sa echokardiografický nález potvrdil (obr. 2a, 2b).
Obr. 1a. Transtorakálne echokardiografické vyšetrenie. Zobrazené sú perianulárne dutiny a infiltrácia s komunikáciou do ľavej komory a tvoriacou sa pseudoaneuryzmou v periprotetickej oblasti. 
Obr. 1b. Transezofageálne echokardiografické vyšetrenie. Zobrazené sú perianulárne dutiny a infiltrácia s komunikáciou do ľavej komory a tvoriacou sa pseudoaneuryzmou v periprotetickej oblasti. 
Obr. 2a. CT vyšetrenie – tvoriaca sa pseudoaneuryzma v periprotetickej oblasti. 
Obr. 2b. CT vyšetrenie – tvoriaca sa pseudoaneuryzma v periprotetickej oblasti. 
Pacient bol preto prijatý na Kliniku srdcovej chirurgie a po zvážení hore uvedených nálezov sa rozhodlo o implantácii alogénneho kryoprezervovaného homograftu. Pri príjme bol kardiopulmonálne kompenzovaný, naďalej však subfebrilný, užíval dvojkombináciu antibiotík (vankomycín, ciprofloxacín). Pri kardiochirurgickej operácii bol explantovaný aortálny konduit úspešne nahradený aortálnym kryoprezervovaným homograftom (veľkosti 23) (obr. 3–5) a súčasne bola revaskularizovaná pravá koronárna artéria. Pooperačne vykonaná echokardiografia potvrdila dobrú globálnu systolickú funkciu ľavej komory, oddiely srdca nedilatované, homograft v aortálnej pozícii s adekvátnou funkciou (PPG 12 mm Hg), bez leaku (obr. 6, 7). V bezprostrednom pooperačnom období došlo k prechodnému zhoršeniu renálnych parametrov (max. S-kreatinín 160 μmol/l), zrejme v dôsledku hemodynamických zmien počas operačného výkonu v mimotelovom obehu (mimotelový obeh 300 min, klem na aorte 248 min). Po úprave dávky kalcineurínového inhibítora (takrolimus) sa globálny klírens kreatinínu vrátil k pôvodným hodnotám. Ďalšie laboratórne parametre uvádzame v tab. 1. Infekčnú endokarditídu sme liečili trojkombináciou antibiotík (linezolid, meropenem a fluconazol). Od 10. pooperačného dňa sa zjavili febrility s eleváciou zápalových markerov (leukocyty, CRP, prokalcitonín). Transezofageálnym echokardiografickým vyšetrením sa znázornila mäkká, echodenzná štruktúra veľkosti 0,48 × 0,48 cm v mieste koaptácie nekoronárneho a pravého cípu, s podozrením na čerstvú vegetáciu. Opakované hemokultúry boli negatívne, preto sme pokračovali v nasadenej ATB liečbe (linezolid, meropenem, fluconazol), pre pridruženú enteritídu sme indikovali entizol. Suponovaná pseudomembranózna kolitída sa endoskopicky nepotvrdila. Vzhľadom na celkový stav imunokompromitovaného pacienta sme na odporúčanie nefrológa podali intravenózne imunoglobulíny (Kiovig – v celkovej dávke 30 mg). V ďalšom priebehu bol už pacient afebrilný, zápalové parametre pri ATB mali klesajúcu tendenciu, kontrolné echokardiografické vyšetrenie bolo bez zjavných vegetácií na cípoch náhrady aortálnej chlopne. Cielenú kombináciu ATB sme podľa súčasných odporúčaní pre liečbu protetickej infekčnej endokarditídy ponechali 6 týždňov [4]. Opakovane realizované echokardiografické kontroly boli negatívne, pacient je bez ťažkostí, pracuje.
Image 1. Peroperačná fotografia homograftu pred implantáciou. 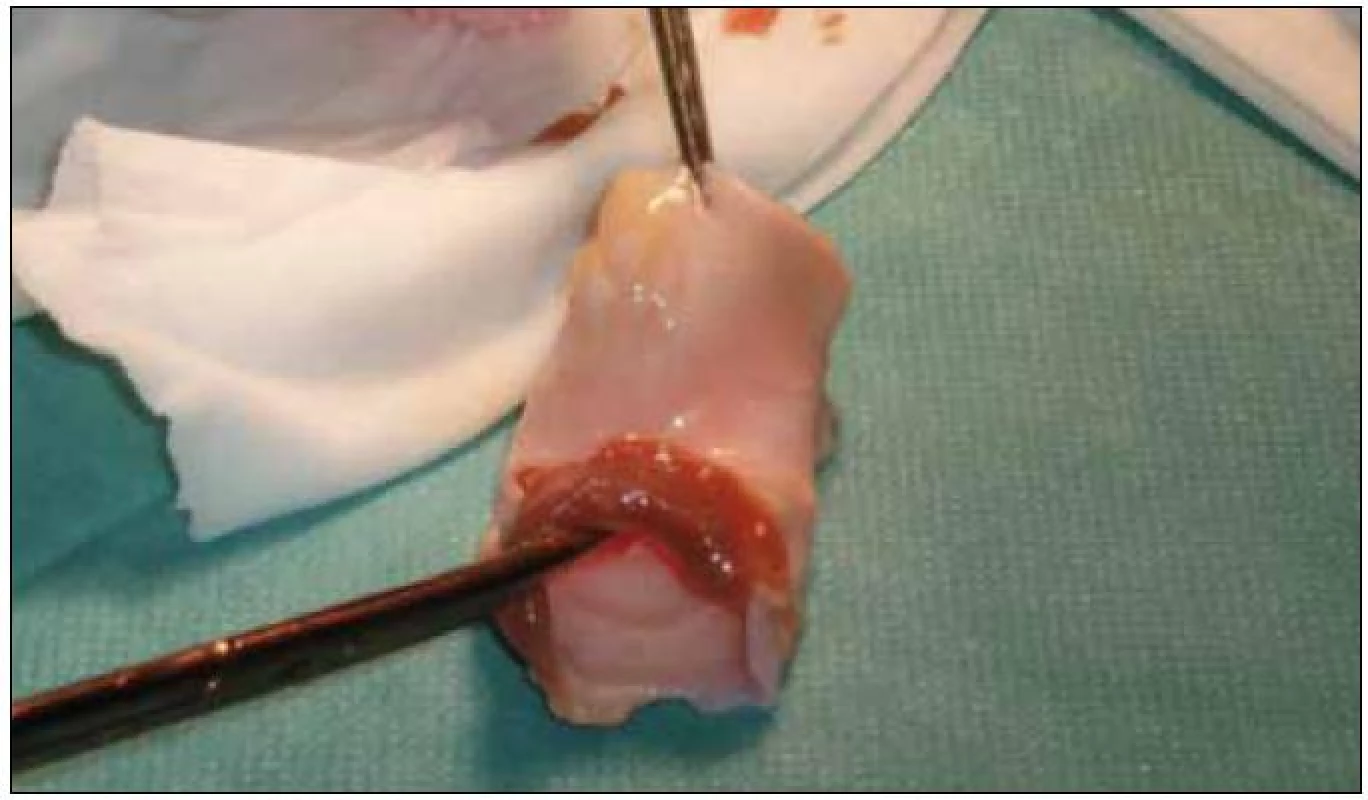
Image 2. Peroperačná fotografia – naloženie stehov do homograftu. 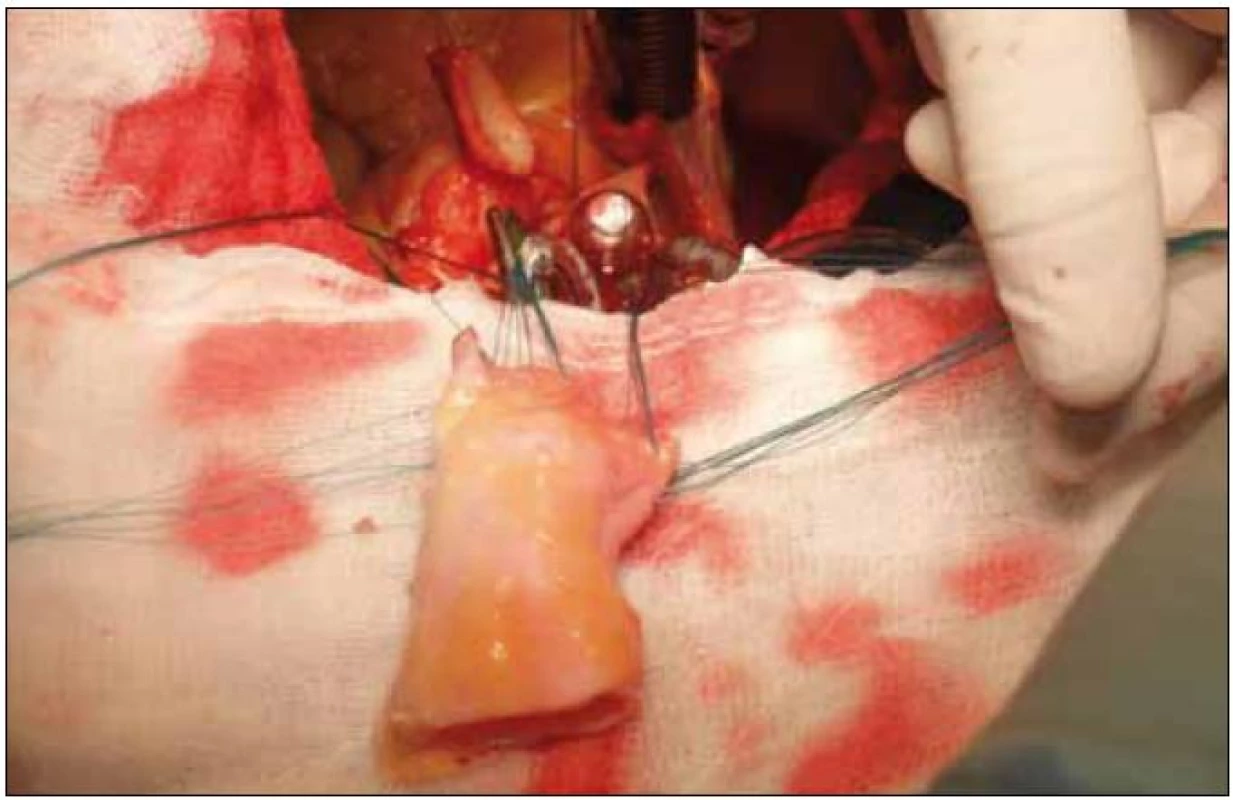
Image 3. Peroperačná fotografia – implantácia homograftu do aortálnej pozície. 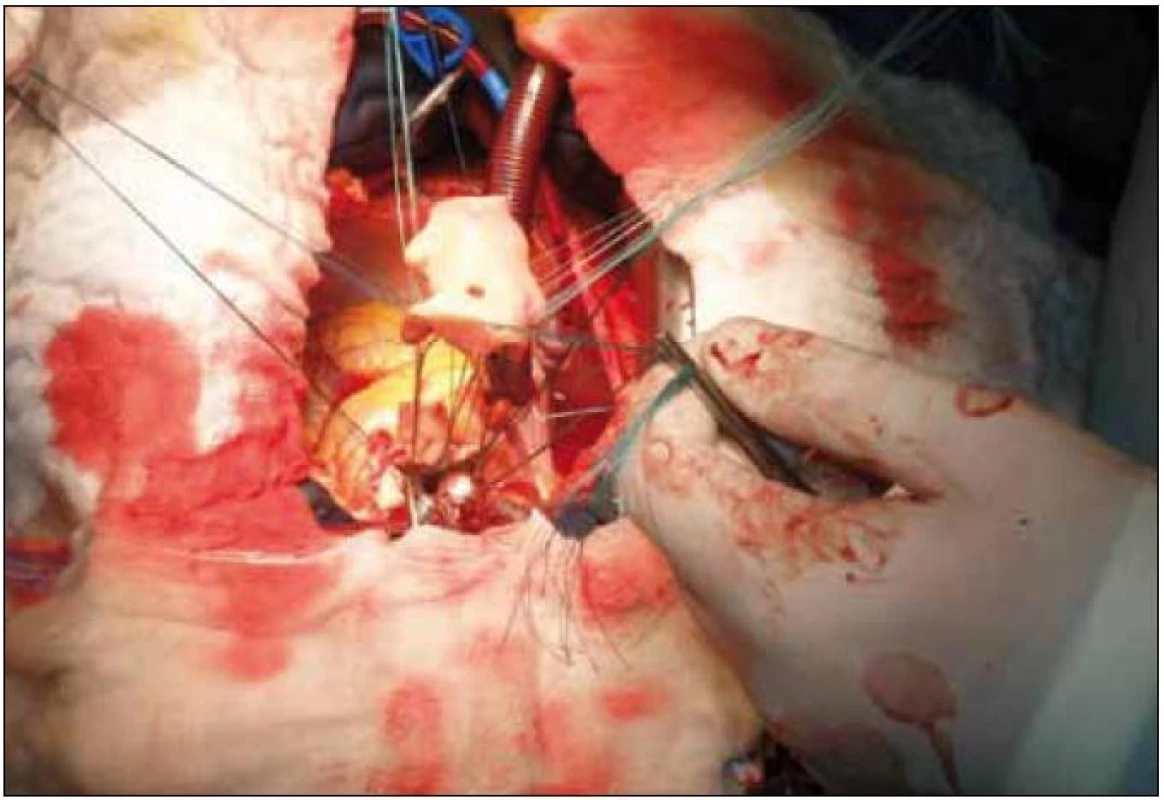
Obr. 6, 7. Transtorakálna echokardiografická kontrola. Okolie homograftu bez infiltrácie, dobrá funkcia chlopne so stopovou regurgitáciou. 
Table 1. Laboratórne parametre u pacienta počas prvých pooperačných dní a pri prepustení. 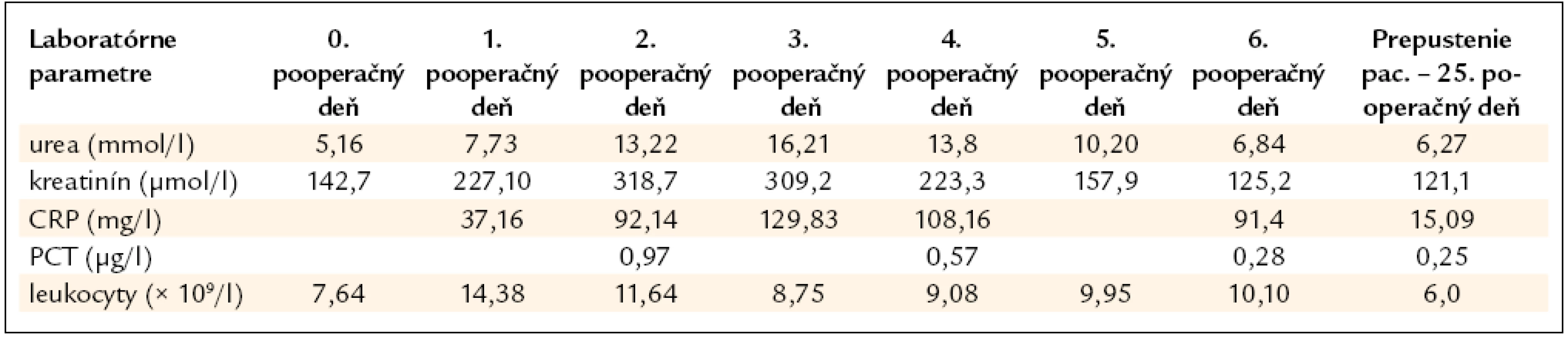
Diskusia
Prvé kadaverózne ľudské tkanivo použil v klinickej praxi Robert E. Gross v roku 1947, v roku 1952 Lam et al prvýkrát predstavili koncept implantácie ľudskej alogénnej chlopne. V bývalom Československu to boli M. Hubka z Bratislavy, v Čechách a na Morave najmä Bohumil Hučín, Bohuslav Fišer a Jaroslav Špatenka [9].
Hlavnou indikáciou pre použitie aortálneho alograftu u dospelých je infekčná endokarditída aortálnej chlopne. Aortálny alograft je minimálne trombogénny a jeho použitie nevyžaduje následnú antikoagulačnú profylaxiu, čo je veľmi výhodné u chorých s rizikom krvácania. Medzi ďalšie výhody patrí maximálna možná efektívna plocha ústia alograftu (effective orifice area – EOA), ktorá je porovnateľná s natívnou chlopňou a súčasne väčšou než stentované i bezstentové chlopne. Navyše, potenciál má dilatácie anulu, a tým ďalšieho zväčšenia EOA pri potrebe zvýšených nárokov na srdcový výdaj (napr. pri záťaži) [9]. Alograft je relatívne odolný voči infekcii. Odolnosť voči perioperačnej infekcii sa vysvetľuje perzistujúcim účinkom antibiotík použitých pri ošetrení tkaniva a tiež veľmi malými či nulovými turbulenciami po implantácii [6,7].
Na druhej strane, nevýhodou homograftu, ale aj autograftu a bioprotézy, je rozvoj degeneratívnych zmien, ku ktorému môže dôjsť už po niekoľkých rokoch od operácie, pričom degeneratívne zmeny môžu vyústiť až do potreby novej náhrady (reoperácie). Nutná je vyššia technická náročnosť implantácie, v niektorých krajinách je tiež limitovaná dostupnosť (danou počtom darcov a dostupnosťou tkanivovej banky) [2,8,9].
Na základe súčasných znalostí nemožno jednoducho uprednostniť, resp. odporúčať určitý typ chlopňovej náhrady pre jednotlivé typy výkonov, rozhodovať sa treba vždy individuálne [2,8].
Implantácia aortálneho alograftu v tejto indikácii sa na viacerých pracoviskách pokladá za metódu voľby, najmä pri protetickej aortálnej endokarditíde a endokarditíde deštruujúcej výtokový trakt ľavej komory srdca [9]. Indikácie k operácii protézovej aortálnej endokarditídy znázorňujú tab. 2 a 3 [10]. Použitie aortálnych alograftov v klinickej praxi nastoľuje celý rad ďalších otázok. Ide najmä o problematiku darcov tkanív, spracovávanie a dlhodobé uchovávanie chlopňových štepov v tkanivových bankách, či antigenicitu a/alebo degeneráciu tkaniva štepu [9].
Table 2. Indikácie chirurgickej liečby protetickej endokarditídy. Upravené podľa [10]. ![Indikácie chirurgickej liečby protetickej endokarditídy. Upravené podľa [10].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/68340ae4c78ef2294321f53a1129650e.png)
Table 3. ACC/AHA indikácie chirurgickej liečby protetickej endokarditídy. Upravené podľa [10]. ![ACC/AHA indikácie chirurgickej liečby protetickej endokarditídy. Upravené podľa [10].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/2c7f2e3eed8bbac14e1e6b6bbe1022eb.png)
Záver
Protetická endokarditída patrí k najzávažnejším komplikáciám chlopňových náhrad. Ani po 40 rokoch vývoja stále nemáme k dispozícii ideálnu chlopňovú náhradu, teda bezpečný jednocestný ventil, ktorý by sa technicky ľahko implantoval, nepoškodzoval by krvné elementy, nebol trombogénny, napodobňoval by reológiu natívnej ľudskej chlopne a fungoval by doživotne. Zlepšenie výsledkov chirurgickej liečby infekčnej endokarditídy aortálnej chlopne možno dosiahnuť len komplexným prístupom. Na základe literárnych údajov [9], ako aj vlastnej skúsenosti, sa domnievame, že liečba recidivujúcej protetickej endokarditídy aortálnej chlopne kryoprezervovaným alogénnym homograftom môže byť vhodnou a úspešnou metódou voľby.
MUDr. Marta Jakubová, PhD.
www.vusch.sk
e-mail: mjakubova@vusch.sk
Doručeno do redakce: 2. 2. 2012
Přijato po recenzi: 21. 3. 2012
Sources
1. Mylonakis E, Calderwood SB. Infective endocarditis in adults. N Engl J Med 2001; 345 : 1318–1330.
2. Beneš J, Gregor P, Mokráček A. Infekční endokarditida. Doporučené postupy diagnostiky, léčby, dispenzarizace a profylaxe. Cor Vasa 2007; 49: K157–K171.
3. Schilberger J, Brychta T, Maňoušek J et al. Úskalí diagnostiky infekční endokarditidy. Vnitř Lék 2001; 47 : 375–380.
4. Horstkotte D, Follath F, Gutschik E et al. Task Force Members on Infective Endocarditis of the European Society of Cardiology; ESC Committee for racticeGuidelines (CPG); Document Reviewers. Guidelines on prevention, diagnosis and treatment of infective endocarditis executive summary; the task force on infective endocarditis of the European society of cardiology. Eur Heart J 2004; 25 : 1–37.
5. Freeman R. Prevention of prosthetic valve endocarditis. J Hosp Infect 1995; 30 (Suppl): 44–53.
6. Jault F, Gandjbakhch I, Chastre JC et al. Prosthetic valve endocarditis with ring abscesses. Surgical management and long term results. J Thorac Cardiovasc Surg 1993; 105 : 1106–1113.
7. Prat A, Fabre OH, Vincentelli A et al. Ross operation and mitral homograft for aortic and tricuspid valve endocarditis. Ann Thorac Surg 1998; 65 : 1450–1452.
8. Guerra JM, Tornos MP, Parmanyer-Miralda G et al. Long term results of mechanical prostheses for treatment of active infective endocarditis. Heart 2001; 86 : 63–68.
9. Mokráček A, Špatenka J, Šulda M et al. Aortální alograft (homograft) v léčbe chlopen ních srdečních vad dospelých s durazem na léčbu infekční endokarditidy aortální chlopně. Vnitř Lék 2007; 53 : 54–62.
10. Horstkotte D, Follath F, Gutschink E et al. Task Force Members on Infective Endocarditis of the European Society of Cardiology; ESC Committee for PracticeGuidelines (CPG); Document Reviewers. Guidelines on prevention, diagnosis and treatment of infective endocarditis executive summary; the task force on infective endocarditis of the European society of cardiology. Eur Heart J 2004; 25 : 267–276.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2012 Issue 6-
All articles in this issue
- Kardiální projevy u pacienta s Addisonovou chorobou a hypotyreózou při autoimunitním polyglandulárním syndromu II. typu
- Teleangiectasia hereditaria haemorrhagica – syndrom Osler-Weber-Rendu. Popis případu a zkušeností s léčbou
- Pohľad internistu na problematiku aortoenterálnej fistuly
- Recidivujúca protetická endokarditída u 21-ročného pacienta s transplantovanou obličkou riešená alogénnym homograftom
- Rezervy v hypolipidemické terapii a dosažení cílových koncentrací lipidů u pacientů s vysokým rizikem kardiovaskulárních příhod
- Katetrová ablace atrioventrikulárních přídatných drah v éře ablační léčby komplexních arytmií: měnící se perspektiva pro nastupující generaci elektrofyziologů
- Poruchy hemostázy u sepse
- Vliv kontinuální a intermitentní náhrady renálních funkcí na antibiotickou léčbu u kriticky nemocných v sepsi – praktický pohled na léčbu vankomycinem a gentamicinem
- Kladribin je velmi účinným lékem pro léčbu histiocytózy z Langerhansových buněk a vzácných histiocytárních nemocí ze skupiny juvenilního xantogranulomu
- Oxidační stres u pacientů s náhradou funkce ledvin hemodialýzou a peritoneální dialýzou
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Teleangiectasia hereditaria haemorrhagica – syndrom Osler-Weber-Rendu. Popis případu a zkušeností s léčbou
- Poruchy hemostázy u sepse
- Kladribin je velmi účinným lékem pro léčbu histiocytózy z Langerhansových buněk a vzácných histiocytárních nemocí ze skupiny juvenilního xantogranulomu
- Vliv kontinuální a intermitentní náhrady renálních funkcí na antibiotickou léčbu u kriticky nemocných v sepsi – praktický pohled na léčbu vankomycinem a gentamicinem
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

