-
Medical journals
- Career
Existuje vzťah medzi zápalovými markermi, oxidačným stresom a pooperačnou fibriláciou predsiení?
Authors: F. Sabol 1; M. Jakubová 2; P. Mitro 3; A. Bomba 4; A. Chmelárová 4; D. Petrášová 4; B. Stančák 3; V. Nagy 5; P. Török 2; A. Šebová 6
Authors‘ workplace: Klinika srdcovej chirurgie VÚSCH, a. s., Košice, Slovenská republika, prednosta MUDr. František Sabol, PhD. 1; Klinika anestéziológie a intenzívnej medicíny VÚSCH, a. s., Košice, Slovenská republika, prednosta doc. MUDr. Pavol Török, CSc. 2; Klinika kardiológie VÚSCH, a. s., Košice, Slovenská republika, prednosta doc. MUDr. Branislav Stančák, CSc. 3; Ústav experimentálnej medicíny Lekárskej fakulty UPJŠ Košice, Slovenská republika, prednosta MVDr. Alojz Bomba, DrSc. 4; Urologická klinika Lekárskej fakulty UPJŠ a UN L. Pasteura Košice, Slovenská republika, prednosta prof. MUDr. Ladislav Valanský, PhD. 5; Klinika rádiodiagnostiky a nukleárnej medicíny UPJŠ a UN L. Pasteura Košice, Slovenská republika, prednosta doc. MUDr. Tatiana Jurgová, CSc. 6
Published in: Vnitř Lék 2012; 58(10): 730-734
Category: Original Contributions
Overview
Úvod:
Fibrilácia predsiení (FP) je jednou z najčastejších komplikácií po operácii srdca. Cieľom práce bolo overiť, či existuje vzťah medzi markermi zápalu, oxidačným stresom a pooperačnou arytmiou.Metodika:
45 pacientov s ischemickou chorobou srdca (12 žien a 33 mužov, priemerný vek 62,3 ± 9,4 rokov) podstúpilo chirurgickú revaskularizáciu myokardu. Peroperačne bol mimotelový obeh (ECC) použitý u 30 pacientov, bez mimotelového obehu bolo revaskularizovaných 15 pacientov. V období prvých 3 pooperačných dní bol stanovený výskyt a dĺžka trvania FP, laboratórne markery zápalu (CRP, leukocyty, TNFα), marker oxidačného stresu (malóndialdehyd – MDA).Výsledky:
Demografické údaje a pridružené ochorenia boli u týchto pacientov podobné. Vznik FP sme dokumentovali u 30 pacientov (66,7 %). U pacientov s pooperačnou FP boli významne vyššie hladiny zápalových parametrov (leukocyty 13,6 ± 3,6 vs 11,3 ± 3,6; 14,7 ± 3,9 vs 12,5 ± 2,9; 13,7 ± 4,1 vs 11,4 ± 13,7; p ≤ 0,05; CRP 138,1 ± 41,1 vs 69,9 ± 25,8; p ≤ 0,001; TNFα 11,3 ± 14,3 vs 8,7 ± 3,6; 12,1 ± 14,5 vs 8,7 ± 3,1; p ≤ 0,05) v porovnaní s pacientmi, u ktorých sa FP nevyskytla. Hodnoty MDA sa signifikantne nelíšili.Záver:
Pacienti s pooperačne prítomnou fibriláciou predsiení mali vyššie hladiny zápalových markerov v porovnaní s pacientmi so sínusovým rytmom, avšak nevýznamné rozdiely v hladinách markeru oxidačného stresu.Kľúčové slová:
fibrilácia predsiení – operácie srdca – markery zápalu – oxidačný stres – pooperačná arytmiaÚvod
Fibrilácia predsiení (FP) je považovaná za najčastejšie sa vyskytujúcu arytmiu po kardiochirurgických operáciách [1]. Je prítomná u 10–65 % pacientov po operáciách srdca [2], častejšie po operáciách chlopní a kombinovaných výkonoch ako po koronárnych rekonštrukciách (CABG) [10]. Napriek zlepšujúcim sa anestéziologickým a chirurgickým technikám sa jej výskyt stále zvyšuje [7], preto sa v ostatných rokoch stala predmetom záujmu a intenzívneho výskumu.
Elektrofyziologická podstata pooperačnej fibrilácie predsiení nie je úplne objasnená. Patofyziologické procesy, ktoré sa podieľajú na rozvoji pooperačnej FP, sú multifaktoriálne (ischemické poškodenie myokardu predsiení, trauma po chirurgickom reze, autonómna nerovnováha v pooperačnom období a i.) [3]. Vedenie vzruchu v predsieňach môže do istej miery ovplyvniť aj zápal, a to tým, že uľahčí vznik reentry, a predisponuje tak k vývoju pooperačnej arytmie [6,9].
Pacienti s pooperačnou FP majú takmer 3-krát vyššie riziko embólie do centrálneho nervového systému [1], táto arytmia býva tiež častou príčinou rehospitalizácie po kardiochirurgických operáciách [2].
Metodika
Na Klinike anestéziológie a intenzívnej medicíny VÚSCH, a. s. v Košiciachsme počas prvých 3 pooperačných dní sledovali výskyt pooperačnej fibrilácie predsiení u pacientov po kardiochirurgickej revaskularizácii myokardu. Súbor tvorilo 45 pacientov (12 žien a 33 mužov; priemerný vek 62,3 ± 9,4 rokov). Pacienti boli rozdelení do 2 skupín podľa toho, či boli operovaní s použitím klasického mimotelového obehu (ECC), n = 30, alebo boli operovaní bez použitia mimotelového obehu (bez ECC), n = 15. Demografické údaje a pridružené ochorenia boli u týchto pacientov podobné.
Štatistická analýza
Intervalové premenné sú uvádzané ako aritmetický priemer ± stredná chyba priemeru. Rozdiel medzi kvantitatívnymi parametrami medzi súbormi sme hodnotili pomocou nepárového Studentovho t-testu. V prípade, že boli významné rozdiely medzi rozptylmi, použili sme Mannov-Whitneyho U-test. Na hodnotenie korelácií premenných v súbore pacientov s ICHS sme použili binárnu logistickú regresnú analýzu. Pri všetkých vykonávaných štatistických hodnoteniach a testoch bola zvolená hladina významnosti p < 0,05, prípadne nižšia.
Výsledky
Vznik pooperačnej FP sme zaznamenali u 30 pacientov, čo predstavuje 66,7 %. Priemerná dĺžka trvania fibrilácie predsiení u pacientov operovaných bez použitia mimotelového obehu bola 3,5 ± 6,3 hod, u pacientov operovaných s použitím mimotelového obehu 6,6 ± 6,9 hod. Trend k dlhšiemu trvaniu pooperačnej arytmie bol v ECC skupine, ale rozdiel nebol štatistický významný. Fibrilácia predsiení sa vyskytla častejšie u pacientov operovaných s použitím štandardného mimotelového obehu (23 vs 8 pacientov). Aj keď je rozdiel evidentný, štatistická významnosť dosiahnutá nebola. Výskyt tejto arytmie predĺžil hospitalizáciu na Klinike anestéziológie a intenzívnej medicíny. U pacientov sme zistili signifikantné rozdiely v hladinách zápalových markerov (leukocyty, CRP, TNFα), čo je znázornené v tab. 1. Signifikantne vyššie hodnoty zápalových markerov boli prítomné u pacientov operovaných s použitím štandardného mimotelového obehu v porovnaní s pacientmi operovanými bez použitia mimotelového obehu. V sledovanej populácii sme nezistili signifikantné rozdiely medzi jednotlivými skupinami v hladinách sérového kália, kreatínkinázy (CK), MB – frakcie kreatínkinázy (CK-MB) a malóndialdehydu (MDA).
Table 1. Základné charakteristiky pacientov po chirurgickej revaskularizácii myokardu. 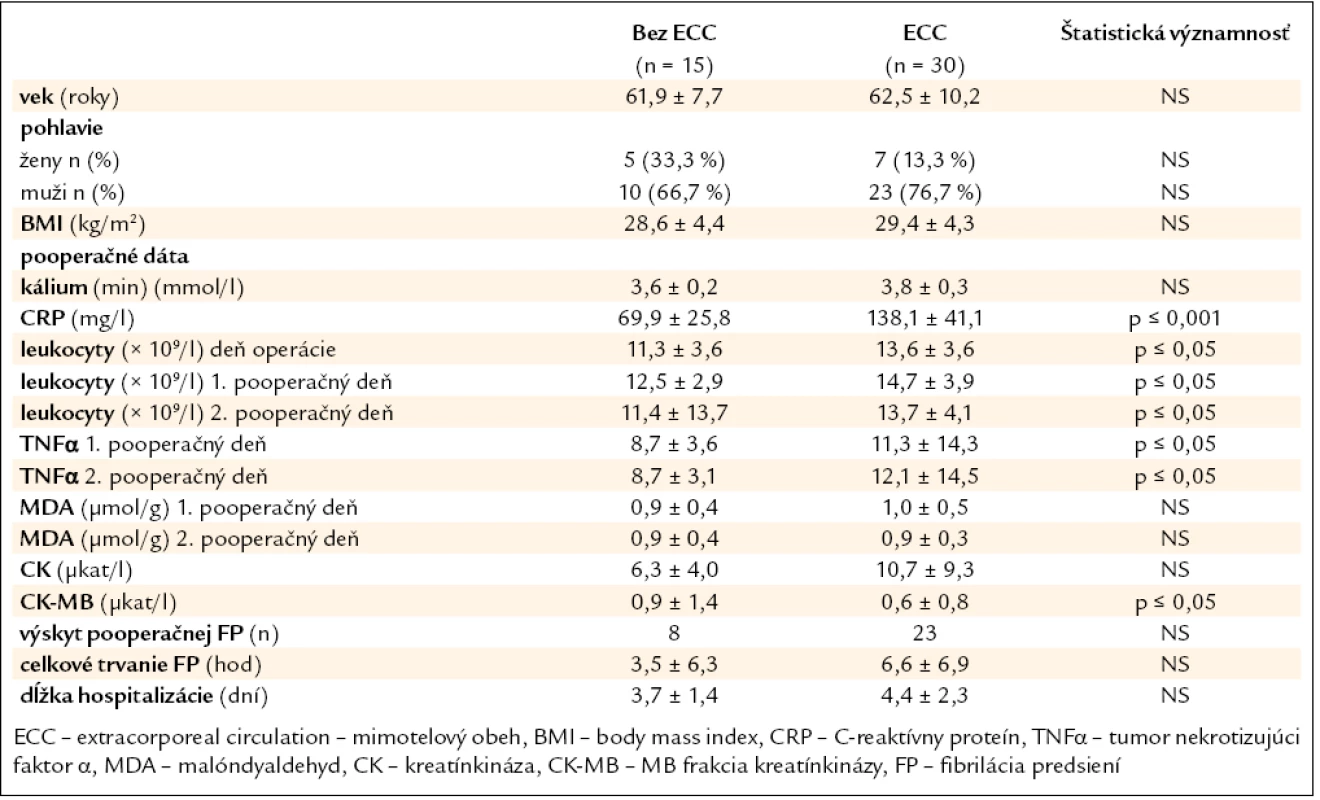
Zistili sme koreláciu medzi dĺžkou trvania FP a TNFα v 1. aj 2. pooperačný deň (r = 0,37, p = 0,012) (graf 1), (r = 0,37, p = 0,013) (graf 2). Nasledujúce sledované parametre (kálium, CK, CK-MB, MDA) na vznik pooperačnej fibrilácie predsiení vplyv nemali.
Graph 1. Priemerné hodnoty TNFα 1. pooperačný deň u pacientov s FP. 
Graph 2. Priemerné hodnoty TNFα 2. pooperačný deň u pacientov s FP. 
Diskusia
Základnou funkciou mimotelového obehu je zachovať cirkuláciu krvi a oxygenáciu organizmu, teda nahradiť funkciu srdca a pľúc v čase zastavenia srdca počas kardiochirurgického výkonu. Už v roku 1981 opísal Kirklin nežiaduce účinky mimotelového obehu spôsobujúce systémovú zápalovú reakciu organizmu [11]. Pri kontakte krvi so syntetickým povrchom mimotelového obehu nastáva aktivácia proteínových a bunkových zložiek krvi [8]. Pooperačne sú prítomné zvýšené hladiny zápalových cytokínov (TNFα), interleukínov (IL-1β, IL-6, IL-8), trombocytov aktivujúcich faktory selektíny, kyslíkových radikálov a ďalších faktorov [5,12].
TNFα patrí medzi polypeptidové prozápalové cytokíny produkované makrofágmi a monocytmi. Pôsobí ako silný pyrogén, aktivuje neutrofily a cievne endotelové bunky. Brasil et al, ale aj Paparela et al popísali signifikantne zvýšené hladiny TNFα u pacientov po chirurgickej revaskularizácii myokardu operovaných pomocou ECC v porovnaní s pacientmi operovanými bez ECC. Hodnoty sérového TNFα boli vyššie v 1. aj v 2. pooperačný deň [12,13]. Strüber et al hodnotil TNFα-1 a TNFα-2 u pacientov operovaných pomocou ECC s pacientmi operovanými bez použitia ECC. Dokumentovali trojnásobný nárast TNFα-1 u pacientov v ECC skupine, podobný výsledok bol aj u TNFα-2 [14].
Za prediktor pooperačnej FP možno považovať zvýšenie hladiny C-reaktívneho proteínu [14], ale aj leukocytózu [17]. Elevované zápalové markery pri pooperačnej arytmii popísali aj iné práce [4,6,8,9,12,15,17–20], čo je v súlade s našimi výsledkami. Tieto štúdie naznačovali, že hoci je mimotelový obeh hlavným faktorom aktivácie komplementového systému v kardiochirurgii, na spustení obranných reakcií organizmu sa podieľajú i ďalšie faktory: trauma po chirurgickom reze, dĺžka trvania tkanivovej ischémie a následnej reperfúzie, hypotermia, nepulzný krvný tok, vplyv heparínu a protamínu, relatívna anémia, ale aj negatívny efekt podaných krvných derivátov [4,29]. Zápal, ktorý vzniká u pacientov po operácii srdca s použitím mimotelového obehu, môže do istej miery ovplyvňovať vedenie vzruchov v predsieňach, a teda viesť k vzniku pooperačnej FP [6,9].
V rámci vplyvu oxidačného stresu je možné hodnotiť antioxidačnú schopnosť pečene prostredníctvom koncentrácie antioxidačne pôsobiaceho tripeptidu glutatiónu (GSH) v homogenáte pečene, prostredníctvom malóndialdehydu (MDA), ktorý je jedným z množstva nízkomolekulových produktov rozkladu lipidov, sa dá vyjadriť peroxidácia lipidov v pečeni [30].
Nižší výskyt pooperačnej FP sa popisuje u pacientov operovaných bez použitia mimotelového obehu [16,31]. Operácie srdca bez použitia mimotelového obehu sú vhodnejšie pre rizikových pacientov s pridruženými ochoreniami [21–23]. Ascione et al a Scott et al popísali nižšie krvné straty a s tým súvisiace redukované použitie krvných transfúzií [24,25]. V niektorých prácach sú uvádzané nižšie zápalové parametre bez použitia mimotelového obehu [24,26], iní signifikantné rozdiely vo svojej práci neudávali [27]. V našom sledovaní v skupine pacientov operovaných bez použitia mimotelového obehu trvala pooperačná FP kratšie ako u pacientov operovaných s použitím mimotelového obehu (3,5 ± 6,3 hod vs 6,6 ± 6,9 hod). Pomerne vysoké zastúpenie pacientov s pooperačnou FP v ECC skupine bolo pravdepodobne spôsobené zaznamenaním každého, aj krátkeho paroxyzmu pooperačnej arytmie.
Záver
Chirurgická revaskularizácia myokardu s použitím mimotelového obehu sa považuje za zlatý štandard pri viaccievnom koronárnom postihnutí [28]. Stále je však spájaná so vznikom systémovej zápalovej odpovede organizmu, ktorá môže byť do istej miery zodpovedná za vznik pooperačnej fibrilácie predsiení a môže viesť až k pooperačnému zlyhaniu orgánov [8].
Je potrebné hľadať nové stratégie liečby, ktoré by zabránili vzniku tejto arytmie a v prípade výskytu jej efektívnu a skorú terapiu [32]. Podľa v súčasnosti platných odporúčaní je u pacientov s vysokým rizikom pooperačnej FP vhodné profylaktické podávanie antiarytmík [33].
Jedným zo spôsobov, ako znížiť vznik systémovej zápalovej reakcie organizmu a redukovať výskyt pooperačnej fibrilácie predsiení je minimalizovať mimotelový obeh. Ďalšou možnosťou sú kardiochirurgické operácie bez použitia mimotelového obehu [21–23]. Modulácia zápalu bude pravdepodobne predstavovať terapeutický cieľ v krátkodobom horizonte a sľubnú cestu v prevencii pooperačnej arytmie.
MUDr. Marta Jakubová, PhD.
www.vusch.sk
e-mail: mjakubova@vusch.sk
Doručeno do redakce: 17. 2. 2012
Přijato po recenzi: 30. 6. 2012
Sources
1. Villareal RP, Hariharan R, Liu BC et al. Postoperative atrial fibrillation and mortality after coronary artery bypass surgery. J Am Coll Cardiol 2004; 43 : 742–748.
2. Maisel WH, Rawn JD, Stevenson WG. Atrial fibrillation after cardiac surgery. Ann Intern Med 2001; 135 : 1061–1073.
3. Echahidi N, Pibarot P, O’Hara G et al. Mechanisms, prevention, and treatment of atrial fibrillation after cardiac surgery. J Am Coll Cardiol 2008; 51 : 795–801.
4. Bharucha DB, Kowey PR. Management and prevention of atrial fibrillation after cardiovascular surgery. Am J Cardiol 2000; 85 : 20D–24D.
5. Lonský V. Mimotělní oběh v klinické praxi. Praha: Grada publishing 2004.
6. Tselentakis EV, Woodford E, Chandy J et al. Inflammation effects on the electrical properties of atrial tissue and inducibility of postoperative atrial fibrillation. J Surg Res 2006; 13 : 68–75.
7. Hogue CW Jr, Hyder ML. Atrial fibrillation after cardiac operation: risks, mechanisms, and treatment. Ann Thorac Surg 2000; 69 : 300–306.
8. Hammon JW. Extracorporeal circulation: organ damage. In: Cohn LH (ed.). Cardiac Surgery in the Adult. New York: McGraw-Hill 2008 : 389–414.
9. Ishii Y, Schuessler RB, Gaynor SL et al. Inflammation of atrium after cardiac surgery is associated with inhomogeneity of atrial conduction and atrial fibrillation. Circulation 2005; 111 : 2881–2888.
10. Podgoreanu MV, Mathew JP. Prophylaxis against postoperative atrial fibrillation: current progress and future directions. JAMA 2005; 294 : 3140–3142.
11. Kirklin JK, Westaby S, Blackstone EH et al. Complement and the damaging effects of cardiopulmonary bypass. J Thorac Cardiovasc Surg 1983; 86 : 845–857.
12. Paparella D, Yau T, Young E. Cardiopulmonary bypass induced inflammation: pathophysiology and treatment: an update. Eur J Cardiothorac Surg 2002; 21 : 232–244.
13. Brasil LA, Gomes WJ, Salomão R et al. Inflammatory response after myocardial revascularization with or without cardiopulmonary bypass. Ann Thorac Surg 1998; 66 : 56–59.
14. Strüber M, Cremer JT, Gohrbandt B et al. Human cytokine responses to coronary artery bypass grafting with and without cardiopulmonary bypass. Ann Thorac Surg 1999; 68 : 1330–1335.
15. Lo B, Fijnheer R, Nierich AP et al. C-reactive protein is a risk indicator for atrial fibrillation after myocardial revascularization. Ann Thorac Surg 2005; 79 : 1530–1535.
16. Archbold RA, Curzen NP. Off-pump coronary artery bypass graft surgery: the incidence of postoperative atrial fibrillation. Heart 2003; 89 : 1134–1137.
17. Abdelhadi RH, Gurm HS, Van Wagoner DR et al. Relation of an exaggerated rise in white blood cells after coronary bypass or cardiac valve surgery to development of atrial fibrillation post-operatively. Am J Cardiol 2004; 93 : 1176–1178.
18. Lamm G, Auer J, Weber T et al. Post-operative white blood cell count predicts atrial fibrillation after cardiac surgery. J Cardiothorac Vasc Anesth 2006; 20 : 51–56.
19. Bruins P, Velthuis H, Yazdanbakhsh AP et al. Activation of the complement system during and after cardiopulmonary bypass surgery: postsurgery activation involves C-reactive protein and is associated with postoperative arrhythmia. Circulation1997; 96 : 3542–3548.
20. Boos CJ, Anderson RA, Lip GY. Is atrial fibrillation and inflammatory disorder? Eur Heart J 2006; 27 : 136–149.
21. Buffolo E, Branco JN, Gerola LR et al. Off-pump myocardial revascularization: critical analysis of 23 years’ experience in 3,866 patients. Ann Thorac Surg 2006; 81 : 85–89.
22. Chamberlain MH, Ascione R, Reeves BC et al. Evaluation of the effectiveness of off-pump coronary artery bypass grafting in high-risk patients: an observational study. Ann Thorac Surg 2002; 73 : 1866–1873.
23. Rastan AJ, Bittner HB, Gummert JF et al. On--pump beating heart versus off pump coronary artery bypass surgery-evidence of pump-induced myocardial injury. Eur J Cardiothorac Surg 2005; 27 : 1057–1064.
24. Ascione R, Liolyd CT, Underwood MJ et al. Inflammatory response after coronary revascularization with or without cardiopulmonary bypass. Ann Thorac Surg 2000; 69 : 1198–1204.
25. Scott BH, Seifert FC, Glass PS et al. Blood use in patients undergoing coronary artery bypass surgery: impact of cardiopulmonary bypass pump, hematocrit, gender, age, and body weight. Anesth Analg 2003; 97 : 958–963.
26. Matata BM, Sosnowski AW, Galiñanes M. Off-pump bypass graft operation significantly reduces oxidative stress and inflammation. Ann Thorac Surg 2000; 69 : 785–791.
27. Johansson-Synnergren M, Nilsson F, Bengtsson A et al. Off-pump CABG reduces complement activation but does not significantly affect peripheral endothelial function: a prospective randomized study. Scand Cardiovasc J 2004; 38 : 53–58.
28. Athanasiou T, Aziz O, Mangoush O et al. Do off-pump techniques reduce the incidence of postoperative atrial fibrillation in elderly patients undergoing coronary artery bypass grafting? Ann Thorac Surg 2004; 77 : 1567–1574.
29. Wagner R. Kardioanestezie a perioperační péče v kardiochirurgii. Praha: Grada Publishing 2009.
30. Uchiyama M, Mihara M. Determination of malonaldehyde precursor in tissues by thiobarbituric acid test. Anal Biochem 1978; 86 : 271–278.
31. van Dijk D, Nierich A, Jansen E et al. Early outcome after off-pump versus on-pump coronary bypass surgery: results from a randomized study. Circulation 2001; 104 : 1761–1766.
32. Jakubová M, Družbacká Ľ, Stančák B et al. Prečo vzniká fibrilácia predsiení po kardiochirurgických operáciách? Vnitř Lék 2011; 57 : 92–96.
33. Camm AJ, Kirchhoff P, Lip GY et al. Guidelines for the management of atrial fibrillation: the Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). Eur Heart J 2010; 31 : 2369–2429.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2012 Issue 10-
All articles in this issue
- Akutní infarkt myokardu u mladých – stala se někde chyba? – editorial
- Méně invazivní kardiochirurgické přístupy pro léčbu ischemické choroby srdeční – editorial
- Viscerální leishmanióza – editorial
- Festina lente! – editorial
- Akutní infarkt myokardu u mladých nemocných – závažné nedostatky v systému akutní a následné péče
- Existuje vzťah medzi zápalovými markermi, oxidačným stresom a pooperačnou fibriláciou predsiení?
- Diagnostika, prognostické faktory a léčba sarkoidózy – retrospektivní analýza
- Fyziologická úloha vitaminu C ve vztahu ke složkám imunitního systému
- Hypoglykemie – fenomén, nad kterým moderní diabetologie pomalu vítězí
- AII antagonisté (candesartan a irbesartan) v léčbě kardiovaskulárních onemocnění
- Febrilní pancytopenie a hepatosplenomegalie jako hlavní symptomy viscerální leishmaniózy
- Vysoké podezření na ICHS získané anamnézou nesmí vyvrátit negativita některých objektivních vyšetřovacích metod – zkušenost ambulantního internisty
- Dabigatran-etexilát v klinické praxi pro prevenci tromboembolických příhod u nemocných s fibrilací síní
- Efekt ivabradinu na tepovou frekvenci, vývoj funkce levé komory a koncentraci NT-proBNP u pacientů se systolickým chronickým srdečním selháním – příklady z praxe
- Diagnostické a léčebné postupy u arteriální hypertenze – verze 2012. Doporučení České společnosti pro hypertenzi
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Fyziologická úloha vitaminu C ve vztahu ke složkám imunitního systému
- Diagnostika, prognostické faktory a léčba sarkoidózy – retrospektivní analýza
- Akutní infarkt myokardu u mladých nemocných – závažné nedostatky v systému akutní a následné péče
- Febrilní pancytopenie a hepatosplenomegalie jako hlavní symptomy viscerální leishmaniózy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

