-
Medical journals
- Career
Sulodexid a nefrotický syndróm pri diabetickej nefropatii
Authors: I. Valočiková
Authors‘ workplace: I. Interná klinika Lekárskej fakulty UPJŠ a FN L. Pasteura Košice, Slovenská republika, prednostka prof. MUDr. Ivica Lazúrová, CSc.
Published in: Vnitř Lék 2011; 57(5): 507-510
Category: Case Reports
Overview
Diabetická nefropatia (DN) je jednou z najzávažnejších, život limitujúcich komplikácií diabetu 1. i 2. typu a je aj najčastejšou príčinou rozvoja terminálnej obličkovej nedostatočnosti. Preto je dôležité DN včas identifikovať, ale najmä intenzívne liečiť. V patofyziológii DN zohrávajú dôležitú úlohu zhrubnutie glomerulovej bazálnej membrány (GBM) a deplécia glykozaminoglykánov (GAG) v GBM s rozvojom straty elektronegativity GBM. Ďalším dôležitým mechanizmom v patofyziológii DN je expanzia mezangia. Sulodexid je vysokopurifikovaný GAG zložený z heparínovej frakcie ako aj dermatánsulfátu. V našej kazuistike referujeme o t. č. 72-ročnej pacientke s obrazom závažného nefrotického syndrómu, najpravdepodobnejšie spôsobeného DN. Exaktná diagnóza DN nebola potvrdená pre opakované odmietnutie obličkovej biopsie pacientkou. Od roku 2000 bola pacientka liečená sulodexidom (preparát Vessel due F). Po asi 1,5 roku od začiatku liečby sme zaznamenali výraznejší pokles proteinúrie (z 10,37 g/d na 4,8 g/d), po asi 3 rokoch bola kvantitatívna proteinúria negatívna.
Kľúčové slová:
nefrotický syndróm – diabetická nefropatia – sulodexid – regresia nefrotického syndrómuÚvod
V patogenéze nefrotického syndrómu (NS) zohrávajú dôležitú úlohu viaceré faktory. Jedným z najvýznamnejších je interakcia filtračnej membrány a podocytov, preto sa novšie razí terminológia tzv. podocytopatie.
Ďalším faktorom zohrávajúcim úlohu pri vzniku NS je strata elektronegativity povrchu GBM. Nositeľmi negatívneho elektrického náboja na povrchu GBM sú najmä kolagén IV. typu, entaktín a sulfátové proteoglykány.
Systém heteropórov, s priemerom 5–10 nm s následnou stratou bielkovín s veľkou molekulovou hmotnosťou, je ďalšou príčinou rozvoja nefrotickej proteinúrie [1].
U chorých s diabetom 1., resp. 2. typu sa veľmi často vyskytujú mikroangiopatické komplikácie. Najmä nefropatia pri diabete sa stáva najčastejšou identifikovateľnou príčinou terminálneho zlyhania obličiek tak v Európe, USA, ako aj v Japonsku a zahrňuje až 40 % všetkých prípadov [2].
Okrem toho majú pacienti na eliminačnej liečbe s diabetom a nefropatiou významne nižšie 5-ročné prežívanie oproti chorým bez diabetu (38 % vs 51 %) [3].
Je známe, že morbidita a mortalita na kardiovaskulárne ochorenia je u diabetikov vysoká a predpovedá ich najmä prítomnosť mikroalbuminúrie (MAU), resp. makroalbuminúrie. Preto je ich ovplyvnenie práve u tejto skupiny chorých veľmi dôležité. Nefroprotektívny účinok inhibítorov ACE, resp. blokátorov receptorov angiotenzínu II je známy už dlhšiu dobu.
Sulodexid zložený z 2 GAG je na trhu od roku 1982 a jeho hlavná indikácia boli „cievne zmeny s rizikom trombózy“. Pravdepodobný mechanizmus účinku sulodexidu u DN spočíva hlavne v úprave elektronegativity GBM [4].
V našej práci uvádzame úplnú regresiu nefrotického syndrómu najpravdepodobnejšie pri DN po liečbe sulodexidom.
Opis prípadu
Pacientka, narodená v roku 1937, bola po prvýkrát v Nefrologickej ambulancii v novembri roku 2000. V anamnéze pacientky bol viac ako 10 rokov prítomný diabetes mellitus 2. typu, posledný mesiac kompenzovaný inzulínom, v roku 1996 diagnostikovaná ICHS s dvojcievnym postihnutím, v tom istom roku realizovaná perkutánna transluminálna koronárna angioplastika (PTCA). V priebehu hospitalizácie zachytené paroxyzmy flutteru predsiení, preto do liečby pridaný propafenon s dobrým efektom. Od mája roku 2000 sledovaná neurológom pre atrofický mozgový proces a Parkinsonovu chorobu.
V októbri roku 2000 bola pacientka hospitalizovaná na Internej klinike pre rozvinutý NS s kvantitatívnou proteinúriou (KVP) 11,87 g/d, klinicky prítomná tekutina v oboch pleurálnych priestoroch. Suponovaná diagnóza kardiálnej dekompenzácie odosielajúcim lekárom nepotvrdená, echokardiografické vyšetrenie nedokázalo systolickú ani diastolickú dysfunkciu (ejekčná frakcia – EF – 56 %). Liečba ACE inhibítormi bola limitovaná pre sklon k výraznej hypotenzii. Renálnu biopsiu za účelom overenia diagnózy DN pacientka opakovane odmietla.
Pri prvom vyšetrení v Nefrologickej ambulancii (november roku 2000) pacientka kardiopulmonálne kompenzovaná, TK 100/70 mm Hg, prítomné prejavy Parkinsonovej choroby. V laboratórnom screeningu obraz NS s KVP 10,37 g/d, hypercholesterolémiou (10,0 mmol/ l), hypertriacylglycerolémiou (4,29 mmol/ l) a hypoalbuminémiou (31,0 g/ l) s miernou redukciou obličkových funkcií 2. štádium K/DOQI. Z liekovej anamnézy vyberáme: molsidomin 2krát 2 mg, propafenon 3krát 150 mg, kyselina acetylsalicylová 100 mg, kyselina tioctová 600 mg 1krát denne, piracetam 1 200 mg 1krát denne, primidone 2krát denne, topiramate 2krát denne. Do liečby v novembri roku 2000 pridaný sulodexid (preparát Vessel due F) 2krát 50 mg, a statín. Inhibítor ACE zatiaľ pre hypotenziu nebol indikovaný.
Vo februári roku 2001 zaznamenávame po prvýkrát pokles KVP na 7,8 g/d, výraznejšia redukcia KVP zachytená v júni roku 2002 s hodnotou KVP 2,02 g/d. Zároveň dochádza k úprave parametrov lipidového statusu (cholesterol 4,25 mmol/ l, triacylglyceroly 2,1 mmol/ l, LDL-cholesterol 2,21 mmol/ l, HDL-cholesterol 1,32 mmol/ l).
Od februára roku 2003, kedy mala KVP 1,1g/d, až doteraz má pacientka prakticky minimálnu (0,15 g/d) až úplne negatívnu KVP. Liečba je nezmenená, sulodexid užíva v 3-mesačných intervaloch, s 2 mesiacmi pauzy, kedy užíva antiagreganciá (kyselina acetylsalicylová 100 mg). Za spomínané obdobie (november roku 2000 – doteraz) došlo k miernej progresii redukcie obličkových funkcií (GF 0,98 ml/s, TR 97,37 %), čo zodpovedá 3. št. K/DOQI.
V tab. 1 sú chronologicky uvedené sledované parametre.
Table 1. Chronológia sledovaných parametrov od roku 2000 do novembra roku 2008. 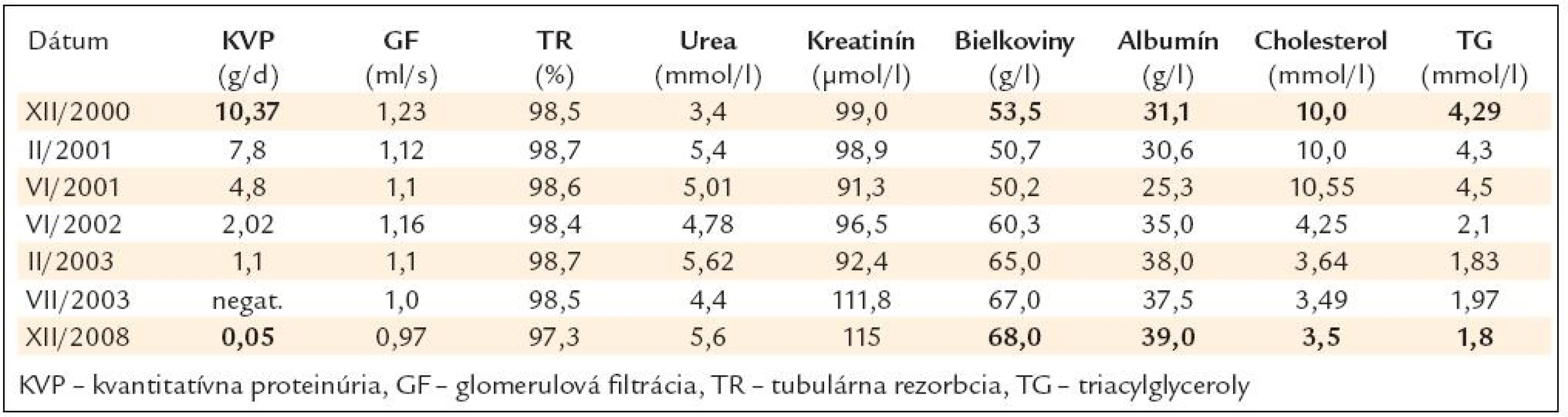
Z ďalších realizovaných vyšetrení uvádzame: Addisov sediment opakovane negatívny (bez dôkazu prítomnosti hematúrie), sporadicky zachytená malá leukocytúria (leukocyty do 5–6 mil.).
Ultrazvukové vyšetrenie obličiek: obe obličky normálneho tvaru aj veľkosti, obojstranne hrúbka parenchýmu do 14 mm, rovný povrch, bez dilatácie dutého systému, echogénnejšia centrálna zóna, bez zjavných patologických echoložísk.
Izotopový renogram potvrdzuje obojstrannú poruchu tubulárnej sekrécie, spomalený tubulárny transport aj vylučovanie rádiofarmaka.
Subjektívne je pacientka bez väčších ťažkostí, kardiopulmonálne je kompenzovaná, bez porúch rytmu, pretrváva hypotenzia (jej jednoznačná príčina nie je známa, môže sa na nej podieľať aj liečba propafenonom), lipidové parametre v norme. Dochádza k progresii neurologického postihnutia (M. Parkinson a atrofický proces mozgu), pre ktoré bola neurológom zmenená liečba.
Diskusia
DN je v posledných rokoch jednou z hlavných príčin zlyhania obličiek s nutnosťou mimotelovej eliminačnej liečby. Hlavné rizikové faktory vzniku a progresie DN sú najmä hyperglykémia, hypertenzia, porucha lipidového metabolizmu, rodinná anamnéza, mužské pohlavie a fajčenie [3].
Hlavnou patofyziologickou zmenou DN je zhrubnutie GBM a deplécia GAG, najmä heparánsulfátu, s výsledným redukovaním elektrostatickej bariéry. Strata tejto bariéry umožňuje únik albumínu a neskôr aj bielkovín väčšej molekulovej hmotnosti do glomerulového filtrátu, s následnou albuminúriou, resp. proteinúriou [5].
Zároveň dochádza k indukcii heparinázy 1(HPR 1) – endoglykozidázy, ktorá degraduje heparánsulfáty, hlavnú súčasť GBM. Práve zvýšená expresia HPR 1 má významnú úlohu pri vzniku proteinúrie pri rozličných nefropatiách [6].
Ďalším dôležitým patofyziologickým nálezom je expanzia mezangia, ktoré mení konfiguráciu glomerulových štruktúr, najmä povrchu glomerulovej kapiláry [7]. Nakoniec sa k štrukturálnym a funkčným glomerulovým zmenám pripája aj poškodenie tubulointerstícia. Práve stupeň tubulointersticiálneho poškodenia je významným prediktorom obličkových výsledkov u osôb s DN [8].
Keďže proteinúria je označovaná ako „nefrotoxín“, je práve jej ovplyvnenie, resp. zabránenie jej vzniku mimoriadne dôležité pre pacientov s oboma typmi diabetu. Základné kroky v liečbe sú udržiavanie normoglykémie a normotenzie, ktoré evidentne spomaľujú rozvoj, resp. progresiu DN [9,10].
Medikamentózne ovplyvnenie DN spočíva v podávaní blokátorov renínového-angiotenzínového systému (RAS), či už inhibítorov ACE alebo blokátorov receptorov angiotenzínu II – sartanov.
Priaznivý efekt blokády RAS na MAU, resp. zjavnú proteinúriu potvrdili 4 veľké štúdie.
Štúdia RENAAL (Reduction of End-points in Non-insulin dependent diabetes mellitus with Angiotensin II Antagonist Losartan) potvrdila, že liečba losartanom u diabetikov 2. typu s DN redukovala o 28 % riziko ESRD, o 25 % znižovala riziko zdvojnásobenia hladiny kreatinínu v sére, o 35 % klesla proteinúria a navyše sa o 32 % redukovala nutnosť hospitalizácií pre kardiálnu dekompenzáciu [11].
Štúdia IDNT (Irbesartan Diabetic Nephropathy Trial), podobne ako štúdia RENAAL potvrdila, že irbesartan je efektívnejší ako tradičná hypotenzívna liečba v spomalení progresie DN do ESRD u diabetikov 2. typu s DN, a to nezávisle od zmien v hodnotách TK [12].
Štúdia IRMA-2 (Irbesartan in Type 2 Diabetes with microalbuminuria) ukázala, že irbesartan je u pacientov s incipientnou DN (s pozitivitou MAU) účinnejší ako iné hypotenzíva v prevencii rozvoja zjavnej proteinúrie [13].
Ďalšia väčšia štúdia u pacientov s DN (BENEDICT – Bergamo Nephrologic Diabetes Complications Trial) dokázala, že rozvoj MAU u jedincov s diabetom 2. typu a hypertenziou môže byť spomalený podávaním kombinácie ACEI s Ca antagonistom [14].
Preparátom, ktorý by mohol ovplyvniť MAU, resp. proteinúriu, je sulodexid. Chemický názov pre sulodexid je glukuronylglykozaminoglykán sulfát. Zložený je z heparánsulfátu (80 %) a dermatansulfátu (20 %) [15]. Sulodexid je na trhu od roku 1982 a jeho prvotné indikácie boli „cievne patologické zmeny s rizikom trombózy“ [4]. Viaceré preklinické štúdie sa snažili objasniť vplyv GAG na DN. Z týchto štúdií vyplýva, že sulodexid sa podieľa predovšetkým na prevencii a zabránení zhrubnutia GBM, ako aj na úprave povrchového náboja GBM [16]. Navyše sa dokázalo, že sulodexid blokuje aktivitu HPR 1 [17]. Ďalším účinkom tohto preparátu je potlačenie expanzie mezangia sprostredkovanej rastovým faktorom TGF-β1 [18].
Okrem ovplyvnenia DN boli dokázané aj iné účinky sulodexidu. Jeho použitím sa inhibovala proliferácia buniek hladkého svalstva ciev, sulodexid v experimentálnych modeloch zabraňoval, resp. spomaľoval rast trombov [19,20].
Takisto v experimentálnom modeli Lauver et al ukázali zmenšenie infarktového ložiska po aplikácii sulodexidu [15].
Z ďalších známych účinkov tohto preparátu sú to najmä hypolipidemický a antisklerotický účinok. V experimente sa po podaní sulodexidu dokázalo zvýšené uvoľňovanie lipoproteínovej lipázy a pokles koncentrácie cirkulujúcich lipidov, ako aj zníženie ukladania lipidov do cievnej steny [15].
Efekt liečby sulodexidom pri ovplyvňovaní MAU, resp. zjavnej proteinúrie u pacientov s DN potvrdili viaceré štúdie. Dĺžka ich trvania bola rôzna (menej ako 2 mesiace, viac ako 1 rok). Okša et al dokázali v skupine 20 diabetikov, že krátkodobá liečba sulodexidom významne znížila albuminúriu u pacientov s DN [21].
Štúdia Di.N.A.S. (The Diabetic Nephropathy and Albuminuria Sulodexide) dokázala signifikantné zlepšenie tak mikro-, ako aj makroalbuminúrie u 223 pacientov s oboma typmi diabetu, bez ohľadu na liečbu ACEI [22].
Heerspink et al realizovali pilotnú štúdiu o efekte sulodexidu u diabetikov 2. typu s perzistentnou albuminúriou. Vyšetrili 149 pacientov s pomerom albumín/kreatinín (ACR) medzi 20–300 mg/ g. Primárnym „koncovým bodom“ bolo buď návrat k normoalbuminúrii (s poklesom ACR najmenej o 25 %), alebo pokles ACR najmenej o 50 % z východiskovej hodnoty. Primárny koncový bod bol dosiahnutý u 33,3 % pacientov (p = 0,075) v skupine pacientov užívajúcich sulodexid v dávke 200 mg [23].
Achour et al u pacientov s oboma typmi diabetu a DN ukázali tak isto, že po ročnej liečbe sulodexidom došlo k významnej redukcii tak MAU, ako aj zjavnej proteinúrie [24].
U našej pacientky sme zaznamenali ústup proteinúrie nefrotického typu zhruba po 1,5 roku liečby. Keďže pacientka opakovane odmietala realizáciu obličkovej biopsie, exaktná diagnóza diabetickej nefropatie z tohto dôvodu nebola možná. Zaznamenali sme však vymiznutie proteinúrie nefrotického typu (10,37 g/d na začiatku liečby na hodnoty 0,05 g/d v novembri roku 2008), pričom pokles proteinúrie v tomto prípade nemožno vysvetliť jedine redukciou GF (z 1,23 ml/s na začiatku liečby na 0,98 ml/s v novembri roku 2008).
Ako ďalšia možná príčina NS by do úvahy prichádzala aj membranózna glomerulonefritída pri diabete. U našej chorej sme ale nezistili prítomnosť hematúrie (ktorá býva asi u ½ chorých s týmto typom glomerulonefritídy), nemala hypertenziu (tá býva u asi 30 % chorých), čo však samozrejme nevylučuje aj túto možnosť príčiny NS. Sulodexid však veľmi pravdepodobne prispel k jeho vymiznutiu. O tom, či by došlo k spontánnemu ústupu NS, je samozrejme možno polemizovať.
U väčšiny našich ďalších pacientov s DN sme po podávaní sulodexidu zaznamenali výraznú redukciu najmä MAU. Pokles až vymiznutie MAU sme docielili najmä u chorých s incipientnou DN. Pre pacientov to znamená určité spomalenie progresie incipientnej DN do nefropatie so zjavnou proteinúriou. U ostatných jedincov so zjavnou proteinúriou sme síce navodili jej pokles, ale úplnú remisiu ako v opisovanom prípade našej pacientky sme nedosiahli.
Uvádzané práce potvrdzujú pozitívny vplyv sulodexidu na priebeh DN, či už s MAU alebo zrejmou proteinúriou.
Existujú však aj výsledky štúdií s opačnými závermi. V marci roku 2008 boli prerušené 2 multicentrické, placebom kontrolované štúdie u oboch typov diabetu s incipientnou, resp. zjavnou DN. Podľa dostupných údajov sulodexid významne neznižoval proteinúriu v porovnaní s placebom [25].
Záver
V našej práci uvádzame prípad úplnej remisie nefrotického syndrómu pri veľmi pravdepodobnej diagnóze DN po liečbe sulodexidom v dávke dvakrát 50 mg podávaného kontinuálne 3 mesiace s 2–3-mesačnými prestávkami. Blokátory RAS (ACEI a sartany) pre výraznú hypotenziu a intoleranciu neboli podávané. Väčší pokles proteinúrie sme zaznamenali po asi 1,5 roku, o 3 roky pacientka nemala dokázanú už žiadnu proteinúriu.
doc. MUDr. Ivana Valočiková, PhD.
www.upjs.sk
e-mail: irosochova@hotmail.comDoručeno do redakce: 17. 6. 2010
Přijato po recenzi: 3. 12. 2010
Sources
1. Brenner BM (ed.). Brenner and Rector’s The Kidney. 2 Volume Set. 8th Ed. 2008.
2. Parving HH, Hovind P, Roassing K et al. Evolving strategies for renoprotection: diabetic nephropathy. Curr Opin Nephrol Hypertens 2001; 10 : 515–522.
3. Villar E, Remontet L, Labeeuw M et al. Effects of age, gender and diabetes on excess death in end-stage renal failure. J Am Soc Nephrol 2007; 18 : 2125–2134.
4. Weis R, Niecestro R, Raz I. The Role of Sulodexide in the Treatment of Diabetic nephropathy. Drugs 2007; 67 : 2681–2696.
5. Jensen T. Pathogenesis of diabetic vascular disease: evidence for the role of reduced heparan sulfate proteoglycan. Diabetes 1997; 46 (Suppl 2): 98–100.
6. van den Hoven H, Rops M, Bakker M. Increased expression of heparinase in overt diabetic nephropathy. Kidney Int 2006; 70 : 2100–2108.
7. Parving HH, Osterby R, Anderson PW et al. Diabetic nephropathy. In: Brenner BM (ed.). The Kidney. 5th Ed. Philadelphia: WB Saunders Company 1996 : 1864–1891.
8. Taft JL, Nolan CJ, Young SP et al. Clinical and histological correlations of decline in renal function in diabetic patients with proteinuria. Diabetes 1994; 43 : 1046–1051.
9. The Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993; 329 : 977–986.
10. United Kingdom Prospective Diabetes Study (UKPDS) Group. Efficacy of atenolol and captopril in reducing risk of macrovascular and microvascular complications in type 2 diabetes. UKPDS 39. BMJ 1998; 317 : 713–720.
11. Brenner BM, Cooper ME, de Zeeuw D et al. RENAAL Study Investigators. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Engl J Med 2001; 345 : 861–869.
12. Lewis EJ, Hunsicker LG, Clarke WR et al. Collaborative Study Group. Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes. N Engl J Med 2001; 345 : 851–860.
13. Parving HH, Lehnert H, Bröchner--Mortensen J et al. Irbesartan in Patients with Type 2 Diabetes and Microalbuminuria Study Group. The effect of irbesartan on the development of diabetic nephropathy in patients with type 2 diabetes. N Engl J Med 2001; 345 : 870–878.
14. Ruggenenti P, Fassi A, Ilieva AP et al. Bergamo Nephrologic Diabetes Complications Trial (BENEDICT) Investigators. Preventing microalbuminuria in type 2 diabetes. N Engl J Med 2004; 351 : 1941–1951.
15. Lauver DA, Lucchesi BR. Sulodexide: A Renewed Interest in This Glykosaminoglycan. Cardiovasc Drug Rev 2006; 24 : 214–226.
16. Gambaro G, Venturini AP, Noonan DM et al. Treatment with glycosaminoglycan formulation ameliorates experimental diabetic nephropathy. Kidney Int 1994; 46 : 797–806.
17. Xu X, Rao G, Maxihimer JB et al. Mechanism of action of sulodexide-mediated control of diabetic proteinuria: inhibition of heparanase-1 activity. Abstract. J Am Soc Nephrol 2005; 16 : 673A.
18. Wang YQ, Liang KH, Pahl MV et al. Effect of heparin on mesangial cell growth and gene espression of matrix proteins. Nephrol Dial Transplant 1998; 13 : 3052–3057.
19. Barbanti M, Giuzzardi S, Calanni F et al. Antithrombotic and thrombolytic activity of sulodexide in rats. Abstract. Int J Clin Lab Res 1992; 22 : 179–184.
20. Buchanan MR, Liao P, Smith LI et al. Prevention of thrombus formation and growth by antithrombin III and heparin cofactor II-dependent thrombin inhibitors: importance of heparin cofactor II. Thromb Res 1994; 74 : 463–475.
21. Okša A, Ponťuch P, Kratochvílova H. Účinok glykozaminoglykanu sulodexidu na albuminúriu u pacientov s diabetes mellitus. Bratisl Lek Listy 1999; 9 : 486–489.
22. Gambaro G, Kinalska I, Oksa A et al. Oral Sulodexide Reduces Albuminuria in Microalbuminuric and Macroalbuminuric Type 1 and Type 2 Diabetic Patients: The Di.N. A.S. Randomized Trial. J Am Soc Nephrol 2002; 13 : 1615–1625.
23. Heerspink HL, Greene T, Lewis JB et al. Collaborative Study Group. Effects of Sulodexide in patients with type 2 diabetes and persistent albuminuria. Nephrol Dial Transplant 2008; 23 : 1946–1954.
24. Achour A, Kacem M, Dibej K et al. One year course of oral sulodexide in the management of diabetic nephropathy. J Nephrol 2005; 18 : 568–574.
25. Cortinovis M, Cattaneo D, Perico N et al. Investigational drugs for diabetic nephropathy. Expert Opin Investig Drugs 2008; 17 : 1487–1500.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2011 Issue 5-
All articles in this issue
- Terapie kritické končetinové ischemie u pacientů se syndromem diabetické nohy pomocí autologních kmenových buněk
- Zlepšení kvality života po ablaci dlouhodobě perzistentní versus paroxysmální fibrilace síní: výsledky dvouletého sledování
- Změny krevních lipidů při dlouhodobé antiretrovirové léčbě
- Kardiotoxicita onkologické léčby
- Sorafenib v léčbě hepatocelulárního karcinomu
- Infekční komplikace u pacientů po srdeční zástavě při terapeutické hypotermii
- Snížení morbidity a mortality nemocných s chronickými formami ischemické choroby srdeční je výsledkem konzervativní léčby
- Faktory ovlivňující vznik a průběh kognitivních poruch u seniorů
- Sulodexid a nefrotický syndróm pri diabetickej nefropatii
- Ormondova choroba (idiopatická retroperitoneálna fibróza)
- Porucha syntézy cholesterolu a jeho prekurzorů u klinicky závažných stavů
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Ormondova choroba (idiopatická retroperitoneálna fibróza)
- Kardiotoxicita onkologické léčby
- Faktory ovlivňující vznik a průběh kognitivních poruch u seniorů
- Porucha syntézy cholesterolu a jeho prekurzorů u klinicky závažných stavů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

