-
Medical journals
- Career
Vývoj autonomních parametrů u pacientů po infarktu myokardu s ST elevacemi
Authors: P. Lokaj 1; J. Pařenica 1; P. Kala 1; N. Honzíková 2; R. Lábrová 1; J. Špinar 1
Authors‘ workplace: Interní kardiologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Jindřich Špinar, CSc., FESC 1; Fyziologický ústav Lékařské fakulty MU Brno, přednostka prof. MU Dr. Nataša Honzíková, CSc. 2
Published in: Vnitř Lék 2010; 56(5): 392-396
Category: Original Contributions
Overview
Pacienti po infarktu myokardu s ST elevacemi (STEMI) jsou ohroženi vznikem autonomní dysfunkce, tedy poklesem baroreflexní senzitivity, poklesem variability v tepových intervalech, vzestupem variability v krevním tlaku v důsledku vzestupu sympatické a/ nebo poklesu parasympatické aktivity. Díky přímé koronární angioplastice, optimální farmakoterapii ICHS a srdečního selhání nedochází dle našich výsledků během jednoročního sledování k signifikantním změnám těchto parametrů a mortalita souboru z kardiální etiologie je nízká. Autonomní dysfunkce a negativní remodelace levé komory se bude týkat pouze malé skupiny pacientů po STEMI, jejichž stratifikace bude obtížná.
Klíčová slova:
infarkt myokardu s ST elevacemi – baroreflexní senzitivita – autonomní dysfunkceÚvod
Pacienti po infarktu myokardu s ST elevacemi (STEMI) jsou ohroženi morfologickou přestavbou levé komory, elektrofyziologickými změnami a/nebo rozvojem autonomní dysfunkce. To vše můžeme shrnout pod pojmem negativní remodelace, která patří mezi hlavní problémy současné kardiologie [1].
Pod pojmem autonomní dysfunkce rozumíme zvýšení sympatické a/nebo pokles parasympatické aktivity, kterou můžeme prokázat poklesem baroreflexní senzitivity (BRS) [2]. Změnu baroreflexní senzitivity pak obvykle definujeme jako prodloužení délky tepového intervalu při zvýšení krevního tlaku o 1 mm Hg. Multicentrická prospektivní studie ATRAMI, zahrnující téměř 1 300 pacientů s jasně prokázanou nízkou hodnotou BRS (< 3 ms/mm Hg, měřeno jako tepově tlaková odpověď po intravenózním podání phenylephrinu), přinesla důkazy o statisticky významně vyšším riziku srdeční mortality u tohoto standardního nezávislého parametru [3]. Později byla nalezena stejná kritická hodnota BRS pomocí spektrální analýzy [4]. Stejně jako pokles BRS, způsobený poklesem variability v tepových intervalech (TIvar), který není schopen utlumit zvýšenou variabilitu v systolickém (STKvar) i diastolickém krevním tlaku (DTKvar), existují další parametry negativní remodelace: z autonomních parametrů se jedná o směrodatnou odchylku NN intervalů (SDNN < 30 ms); z elektrických parametrů o četnost komorových extrasystol více než 10 za hod, z morfologických parametrů o přítomnost pozdních potenciálů či o pokles ejekční frakce levé komory (EF LK < 40%). Přítomnost těchto rizikových faktorů negativní remodelace zvyšuje riziko nejen výskytu dalšího infarktu myokardu, ale také výskytu maligní arytmie, tedy riziko náhlé srdeční smrti (NSS). To dokazuje 2leté sledování pacientů po infarktu myokardu léčených trombolýzou, u kterých se mortalita vyskytla 5krát více při pozitivitě těchto parametrů ve srovnání se skupinou s negativními hodnotami [5].
Cíl
Cílem naší práce bylo:
- a) zjistit vývoj autonomních parametrů v průběhu ročního sledování ve dvou kontrolách u pacientů se STEMI, řešených přímou koronární angioplastikou (PPCI)
- b) zhodnotit rozdíl v autonomních parametrech u skupin dělených dle vstupní kritické hodnoty rizikových faktorů a
- c) odhalit tu podskupinu pacientů, která podléhá negativní remodelaci po STEMI, a je tedy ohrožena rizikem NSS
Materiál a metodika
Z celkového počtu 540 pacientů zařazených do studie jsme zařadili do naší autonomní větve 150 pacientů průměrného věku 64,8 ± 10,7 let, z nichž bylo 40 žen (26,7%) a 110 mužů (73,3%). Průměrná hodnota BMI u souboru dosáhla 28,0 ± 3,7kg/m2. Většina pacientů měla dle koronarografického nálezu postižení 1 či 2 tepen, méně často postižení 3 tepen (graf 1).
Graph 1. Počet postižených koronárních tepen dle koronarografie u souboru 150 pacientů. 
Pacienti byli vyšetřeni 3krát v průběhu jednoho roku po STEMI: 3.–5. den po akutním infarktu myokardu (AIM), tedy v subakutní fázi AIM, poté 3. měsíc a 12. měsíc. 3.–5.den hospitalizace byly hodnoceny – délka delaye (počátek potíží – začátek koronarografie), počet postižených koronárních tepen, tíže akutního srdečního selhání dle Killipovy klasifikace a EF LK dle provedeného echokardiografického vyšetření. Dále byl pacientům měřen neinvazivně krevní tlak z prstu ruky přístrojem Finapres Ohmeda, v klidu, v sedě, při regulovaném dýchání 20 dechů za min, tep po tepu, 3minutový záznam krevního tlaku a délky tepových intervalů. Pomocí spektrální analýzy byla spočítána hodnota TIvar (ms2/Hz), STKvar (mm Hg2/Hz) a DTKvar (mm Hg2/Hz). BRS byla odečtena v ms/mm Hg při frekvenci 0,1Hz [6]. Ve 3. a 12. měsíci po STEMI byli pacienti podrobeni pouze neinvazivnímu vyšetření krevního tlaku ke stanovení BRS, TIvar, STKvar a DTKvar.
Pro statistické porovnání vývoje parametrů autonomní dysfunkce během jednoho roku po STEMI byl použit parametrický párový Wilcoxonův test. Pro porovnání parametrů autonomní dysfunkce mezi dvěma skupinami dle kritické hodnoty rizikového znaku jsme využili parametrického nepárového Mann Whitney U testu. Jako statisticky významný byl hodnocen statistický rozdíl na 5% hladině významnosti. Do studie byli zařazeni pouze pacienti s kompletními výsledky vyšetření.
Výsledky
Podíváme li se na vývoj průměrných hodnot autonomních parametrů – BRS, TIvar, STKvar a DTKvar (tab. 1), pak vidíme nízkou průměrnou hodnotu BRS s tendencí k poklesu v ročním sledování po STEMI (graf 2), signifikantní pokles TIvar, který není schopen utlumit zvýšenou variabilitu jak v systolickém, tak diastolickém krevním tlaku. Tyto změny nebyly ovšem statisticky významné ve většině ze jmenovaných parametrů.
Table 1. Vývoj autonomních parametrů 3.–5. den, 3. a 12. měsíc u pacientů po STEMI. 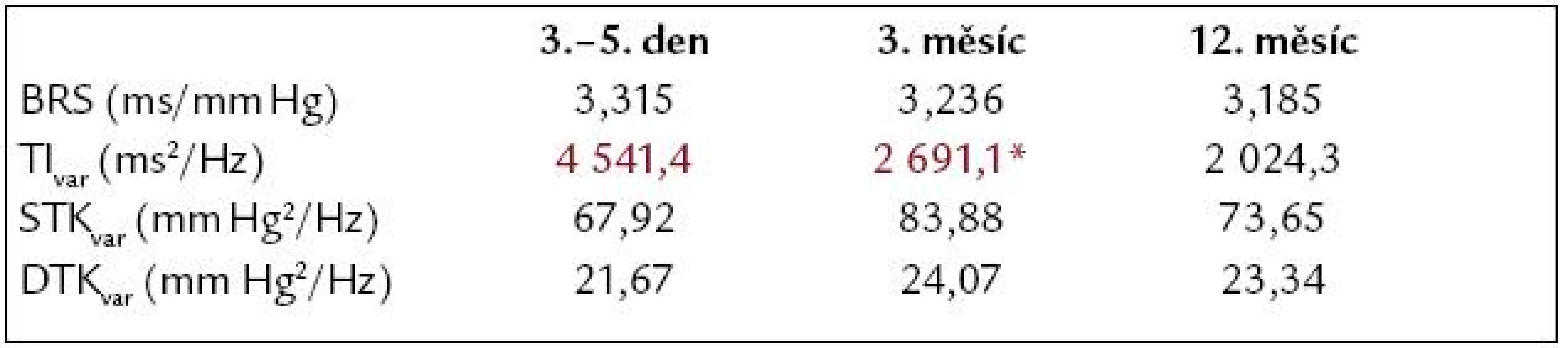
*p < 0,05 Graph 2. Vývoj autonomních parametrů 3.– 5. den, 3. a 12. měsíc u pacientů po STEMI. *p < 0,05 
Provedli jsme podrobnější analýzu vývoje BRS, TIvar a STKvar v průběhu jednoho roku po STEMI podle hodnot EF LK, Killipovy klasifikace, délky delaye a počtu postižených koronárních tepen. Pacienty jsme rozdělili podle hodnot EF LK na 2 soubory (graf 3): soubor pacientů s EF LK > 40% (121; 80,7%) značených hnědě a soubor pacientů s EF LK ≤ 40% (21; 19,3%) značených červeně. Pacienti s přítomností systolické dysfunkce LK mají nižší hodnotu BRS a signifikantně nižší hodnotu TIvar (p < 0,01) než pacienti s mírným či žádným systolickým srdečním selháním. V průběhu roku nacházíme tendenci k mírnému poklesu parametrů BRS a TIvar, které nedostatečně kompenzují narůstající STKvar. I přes jmenované změny se nejedná o změny se statistickou významností.
Graph 3. Vývoj autonomních parametrů při dělení dle ejekční frakce levé komory: hnědě EF LK > 40 %, červeně EF LK ≤ 40 %. *p < 0,05, **p < 0,01 
Při porovnávání parametrů autonomní dysfunkce souboru pacientů dle Killipovy klasifikace akutního srdečního selhání při vstupu (graf 4): Killip I (110; 73,3%) bez přítomnosti akutního srdečního selhání, značené žlutě, a Killip II–IV (40; 26,7%), značené červeně, můžeme vidět trend k poklesu BRS, TIvar a vzestup STKvar během jednoročního sledování. Tyto změny jsou mnohem více vyjádřené ve skupině s přítomností akutního srdečního selhání při vstupu, především signifikantní pokles TIvar u této skupiny (p < 0,05).
Graph 4. Vývoj autonomních parametrů dle Killipovy klasifikace akutního srdečního selhání: Killip I – bez přítomnosti akutního srdečního selhání (značené žlutě), Killip II– IV (značené červeně). *p < 0,05 
Obdobný vztah nacházíme u dělení pacientů do 2 skupin dle délky delaye (graf 5). Jako hraniční hodnota byl zvolen čas 3 hod na základě metaanalýz Zjilstry et al, kteří prokázali úspěšnost PPCI i po této hraniční době [7]. Průměrná hodnota delaye činila 285,7 min. Jak u pacientů s délkou delaye do 3 hod (35; 23,3%), značené šedě, tak u pacientů s délkou delaye delší než 3 hod (115; 76,7%), značené červeně, nacházíme pokles hodnoty BRS, TIvar a nárůst hodnoty STKvar, bez statistické významnosti. Signifikantní pokles TIvar je vyjádřený ve skupině s delším delayem (p < 0,05). Nelze tvrdit, že pacienti s delším delayem mají vyšší baroreflexní senzitivitu, spíše se jedná o chybu způsobenou malým statistickým souborem.
Graph 5. Vývoj autonomních parametrů dle délky delaye: delay ≤ 3 hodiny (značené šedě), delay > 3 hodiny (značené červeně). *p < 0,05 
Při dělení dle počtu postižených koronárních tepen (graf 6) vidíme signifikantní pokles BRS, jejíž hodnota klesá s počtem postižených tepen: jedné (58; 38,7%), značené šedě, dvou (41; 27,3%), značené červeně, a tří koronárních tepen (51; 34%) (p < 0,05). Dále pozorujeme pokles TIvar a vzestup STKvar, přičemž tyto změny jsou výraznější, ale nesignifikantní, u pacientů s postižením více tepen.
Graph 6. Vývoj autonomních parametrů dle počtu postižených koronárních tepen: 1VD (šedá), 2VD (červená) a 3VD (žlutá). *p < 0,05 
Mortalita 150členého souboru pacientů po STEMI v průběhu 3 let sledování (graf 7) byla relativně nízká. Za tři roky zemřeli z celého souboru 4 pacienti. Jeden na bronchopneumonii, dva pacienti z kardiální příčiny (jeden na recidivu IM, druhý na akutní srdeční selhání) a poslední pacient na NSS. Díky relativně malé mortalitě souboru na kardiální etiologii nelze použít statistické hodnocení. Ze srovnání průměrných hodnot BRS a variability v TI mezi skupinou živých a mrtvých pacientů z kardiální etiologie je patrná nižší hodnota BRS i variabilita v TI ve skupině mrtvých pacientů.
Graph 7. Charakteristika živých a mrtvých pacientů (BRS, TI<sub>var</sub>) ve 3letém follow‑up: živý (značené žlutě) a mrtví (značené červeně). 
Diskuze
Zůstává otázkou, zda nízká baroreflexní senzitivita vzniká následkem narůstající sympatické a/nebo poklesem parasympatické aktivity po STEMI a/nebo je již přítomna před STEMI a je jedním z mnoha rizikových faktorů, které se na vzniku AIM podílejí.
Příznivý efekt trombolytické terapie AIM na BRS byl již prokázán v minulých letech. Lze předpokládat, že dnes standardní přímá koronární angioplastika v terapii STEMI povede k menšímu infarktovému ložisku, a tedy i rozvoji negativní remodelace LK a autonomní dysfunkce u menší skupiny pacientů. S tím souvisí i co možná nejkratší délka delaye, jak uvádí Brodie et al, kde nejlepší 30denní výsledky mají pacienti po IM s delayem menším než 2 hod [8]. Nelze opomenout i vliv farmakoterapie, především beta blokátorů (BB) a inhibitorů angiotenzin konvertujícího enzymu (ACEI), které prokazatelně zvyšují BRS u pacientů po AIM [9]. U skupiny BB nacházíme zesílení BRS u pacientů po AIM asi ve 40% případů [10].
Dle našich výsledků se zřejmě negativní remodelace LK a autonomní dysfunkce týká jen malé podskupiny pacientů se STEMI, která ve velkém statistickém souboru nevytváří signifikantní změny. Ze stejného důvodu budeme ve statistickém souboru nacházet pouze malý počet úmrtí z kardiální příčiny těch nejrizikovejších pacientů, jejichž stratifikace bude obtížná.
Závěry
Pacienti po STEMI mají nízkou průměrnou hodnotu baroreflexní senzitivity, která se v průběhu ročního sledování signifikantně nemění. Díky direktní angioplastice, optimální farmakoterapii ischemické choroby srdeční a srdečního selhání nedochází u pacientů po STEMI k signifikantním změnám ve vývoji ani u dalších parametrů autonomní dysfunkce. Můžeme pouze pozorovat trend k poklesu BRS, resp. poklesu TIvar, který není schopen utlumit zvýšené kolísání v krevním tlaku.
Dělení dle rizikových znaků EF LK, Killipovy klasifikace, délky delaye a počtu postižených koronárních tepen také nepřineslo statisticky významné změny v autonomních parametrech mezi jednotlivými skupinami.
Na základě výsledků budeme autonomní dysfunkci a negativní remodelaci LK hledat ve skupině pacientů s přítomností akutního srdečního selhání při vstupu, s postižením více koronárních tepen a delším delayem.
Mortalita v průběhu 3letého sledování na kardiální etiologii byla nízká, tedy bez možnosti statistického zpracování. Avšak mrtví pacienti měli nižší průměrnou hodnotu baroreflexní senzitivity a variabilitu v tepových intervalech. Díky nízké úmrtnosti nelze přičíst nesignifikantní změny vývoje parametrů autonomní dysfunkce úmrtím pacientů s kritickými hodnotami těchto parametrů.
Podporováno vědecko výzkumným záměrem MSM 0021622402.
as. MUDr. Petr Lokaj
www.fnbrno.cz
e-mail: lokajp@fnbrno.cz
Sources
1. Kala P, Poloczek M, Výtiska M et al. Remodelace levé komory po STEMI přední stěny a její vztah k akutním změnám v průběhu primární PCI. Interv Akut Kardiol 2007; 6 : 92 – 96.
2. La Rovere MT, Specchia G, Mortara A et al. Baroreflex sensitivity, clinical correlates and cardiovascular mortality among patients with first myocardial infarction. Circulation 1998; 78 : 816 – 824.
3. La Rovere MT, Digger JT Jr, Marcus FI et al. Baroreflex sensitivity and heart ‑ rate variability in prediction of total cardiac mortality after myocardial infarction. ATRAMI (Autonomic Tone and Reflexes After Myocardial Infarction) investigators. Lancet 1998; 351 : 478 – 484.
4. Honzíková N, Semrád B, Fišer B et al. Risk stratification after myocardial infarction. Scripta Medica 1997; 70 : 153 – 158.
5. Honzíková N, Semrád B, Fišer B et al. Baroreflex sensitivity determined by spectral method and heart rate variability, and two‑years mortality in patients after myocardial infarction. Physiol Res 2000; 49 : 643 – 650.
6. Semrád B, Fišer B, Honzíková N. Baroreflex sensitivity: Do We Have Any Progress? Card Electrophysiol Rev 1999; 3 : 290 – 293.
7. Zijlstra F, Patel A, Jones M et al. Clinical characteristics and outcome of patients with early (< 2 h), intermediate (2–4 h) and late (> 4 h) presentation treated by primary coronary angioplasty or thrombolytic therapy for acute myocardial infarction. Eur Heart J 2002; 23 : 550 – 557.
8. Brodie BR, Stuckey TD, Wall TC et al. Importance of time to reperfusion for 30 - day and late survival and recovery of left ventricular function after primary angioplasty for acute myocardial infarction. J Am Coll Cardiol 1998; 32 : 1312 – 1319.
9. Lantelme P, Cerutti C, Lo M et al. Mechanism of spontaneous baroreflex impairment in Lyon hypertensive rats. Am J Physiol 1998; 275: R920 – R925.
10. La Rovere MT, Mortara A, Specchia Get al. Myocardial infarction and baroreflex sensitivity. G Ital Cardiol 1992; 22 : 639 – 645.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2010 Issue 5-
All articles in this issue
- Perorální hormonální antikoncepce a riziko vzniku žilního tromboembolizmu
- Evaluation of cardiovascular high risk population in Specialists Ambulance: ESA
- Prevalence anémie a vliv na hospitalizační mortalitu pacientů přijatých pro akutní srdeční selhání
- Vývoj autonomních parametrů u pacientů po infarktu myokardu s ST elevacemi
- Familiární hyperkalcemie a hypofosfatemie a jejich význam v diferenciální diagnostice poruch kalcium‑ fosfátového metabolizmu
- Souborný pohled na efekt hormonu a cytokinu prolaktinu v rozvoji a patogenezi autoimunitních onemocnění
- Syndróm polycystických ovárií a autoimunitné ochorenia
- Srdce nemocného s diabetem 1. typu
- Rozdiely medzi pohlaviami v nefarmakologickej liečbe chronického srdcového zlyhávania
- Doporučení ILCOR pro označení automatizovaných externích defibrilátorů (AED)
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Familiární hyperkalcemie a hypofosfatemie a jejich význam v diferenciální diagnostice poruch kalcium‑ fosfátového metabolizmu
- Souborný pohled na efekt hormonu a cytokinu prolaktinu v rozvoji a patogenezi autoimunitních onemocnění
- Syndróm polycystických ovárií a autoimunitné ochorenia
- Perorální hormonální antikoncepce a riziko vzniku žilního tromboembolizmu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

