-
Medical journals
- Career
Souborný pohled na efekt hormonu a cytokinu prolaktinu v rozvoji a patogenezi autoimunitních onemocnění
Authors: M. Fojtíková 1; M. Černá 2; K. Pavelka 1
Authors‘ workplace: Revmatologický ústav Praha, ředitel prof. MU Dr. Karel Pavelka, DrSc. 1; Ústav obecné biologie a genetiky 3. lékařské fakulty UK Praha, přednostka doc. MU Dr. Marie Černá, CSc. 2
Published in: Vnitř Lék 2010; 56(5): 402-413
Category: Reviews
Overview
Prolaktin (PRL) je nejenom hormon produkovaný z adenohypofýzy, který má významnou funkci v reprodukci, ale účinkuje jako cytokin ovlivňující imunitní odpověď. Prolaktin je produkován četnými imunitními buňkami, které zároveň exprimují i jeho receptor (PRL‑R). PRL je pak schopný ovlivňovat lokální mikroprostředí imunitních orgánů a podílet se jak na zrání, tak i funkci imunitních buněk. Úloha PRL v imunitních reakcích je stimulační, jeho přítomnost výrazně zvyšuje schopnost imunitních buněk proliferovat a produkovat cytokiny, jako jsou TNF‑α, IFN-γ, IL‑12, IL‑1β. Tento účinek je dán aktivací řady intracelulárních cest (Jak2/ STAT, Ras/Raf/MAPK a dalších) a aktivací genů spojených s apoptózou a proliferací (Bcl‑XL, Bcl‑2, pim, XIAP) anebo transkripčních faktorů (IRF‑1). Zajímavé je, že PRL sám není schopen spustit imunitní reakci, je spíše faktorem, který udržuje rovnováhu v imunitních reakcích, kontraregulačně ke glukokortikoidům, což se projeví zvláště během kritických podmínek, fyzického, ale i psychického stresu. Hlubší imunosuprese během stresu při současném nedostatku prolaktinu byla zjištěna během experimentů na myších modelech, ale lze jej pozorovat i v humánní medicíně. Na druhou stranu, zvýšení hladiny prolaktinu v séru bylo popsáno u několika autoimunitních chorob, jak systémových, tak orgánově specifických. Elevace hladin PRL u těchto chorob může být způsobena několika faktory: zvýšeným uvolněním prolaktinu z adenohypofýzy díky zánětlivým cytokinům nebo snížené produkci tlumivého dopaminu, případně zvýšenou produkcí prolaktinu v imunitních buňkách. U některých chorob, jako je celiakie a systémový lupus erythematodes (SLE), hladina PRL koreluje s aktivitou onemocnění. To podporuje hypotézu, že nadbytek PRL nakloní rovnováhu v imunitní odpovědi směrem k vyšší aktivitě imunitních buněk a propuknutí autoimunity. V případě SLE prolaktin podporuje přežívání autoreaktivních B‑lymfocytů a jejich schopnost produkovat patogenní autoprotilátky. Teprve další zkoumání účinků PRL a sledování pacientů s hyperprolaktinemií a autoimunitními chorobami nám ukáže, jak využít, možná zatím i skrytých, schopností prolaktinu. Možnost využití medikace ke snížení sérové hladiny PRL v léčbě autoimunitních onemocnění je otázkou, avšak z probíhajících studií se jeví možnost využít stanovení hladiny PRL jako časného markeru aktivity onemocnění.
Klíčová slova:
prolaktin – autoimunitní onemocnění – imunitní buňky – intracelulární cesta – apoptóza – cytokin – stres – aktivita onemocněníÚvod
Autoimunitní onemocnění, jak orgánově specifická, tak systémová, se vyskytují asi u 5–7% populace a patří k závažným důvodům morbidity osob v reprodukčním věku. Etiopatogeneze těchto chorob je široká a na vypuknutí choroby u geneticky predeterminovaného jedince se podílí hormonální stav jedince, faktory zevního prostředí a stres. Role pohlavních hormonů v imunitních reakcích je dlouho známa a vysoký počet žen trpících některými systémovými autoimunitními onemocněními podporuje hypotézu jejich zapojení do etiopatogeneze. Dalším dokladem jejich účinku je také to, že autoimunity mohou propuknout, event. se zhoršit, během fyziologické hormonální dysbalance, těhotenství a laktace. V posledních letech se diskutuje úloha prolaktinu v imunitním systému, zvláště s ohledem k novým poznatkům – prolaktin není jen hormon adenohypofýzy, ale také účinný cytokin produkovaný aktivními imunitními buňkami. Naše práce se snaží podat ucelený přehled o účinku prolaktinu na úrovni nejenom buněčné, ale i molekulární, ve studiích in vitro a in vivo na experimentálních modelech a v humánní medicíně. V druhá části práce se diskutuje vliv prolaktinu v etiopatogenezi autoimunitních chorob, a to jak orgánově specifických, tak i systémových.
PRL – protein & syntéza a izoformy
Protein spojený s laktací, prolaktin (PRL), byl identifikován ve 30. letech minulého století. PRL je globulární protein o velikosti 23 kDa složený ze 199 aminokyselin, který vytváří dvě vazebná místa pro svůj receptor [1–3].
Gen pro prolaktin leží v oblasti 6p22.2–21.3 a je uspořádán do 5 exonů oddělených 4 rozsáhlými introny [4]. Exon 1 je rozdvojen a je místem začátku transkripce: exon 1 v adenohypofýze a předsunutý exon 1A v mimohypofyzárních lokalitách [5]. Před oběma exony 1 se rozkládají dvě na sobě nezávislé regulační oblasti – hypofyzární a mimohypofyzární promotor [5]. Existence mimohypofyzárního promoteru je jedinečná – vyskytuje se pouze u vyšších primátů a člověka. Při transkripci PRL genu vznikají 2 typy mRNA: hypofyzární a o 150 bp delší mimohypofyzární, obsahující exon 1A, který však není přepisován do peptidu [3].
PRL se vyskytuje v několika izoformách: během posttranslačních modifikací dochází u člověka ke glykosylaci, deaminaci a fosforylaci PRL [2,3,6]. Deaminace neovlivňuje účinek PRL, kdežto glykosylovaný PRL má nižší biologickou účinnost. Odlišné biologické vlastnosti (antiangiogenní a proapoptotický účinek) dává PRL a méně častá fosforylace [7].
Ostatní posttranslační úpravy mění velikost PRL – u lidí existují menší a větší varianty, než je základní, 23 kDa PRL: polymerizací vznikají biologicky méně aktivní 50 kDa „big“ PRL a nad 100 kDa velký „big big“ PRL (makroprolaktin), proteolytickým štěpením pak 16 kDa [3]. Big PRL je dimer 23 kDa PRL a tvoří asi 10–15% sérového PRL. Makroprolaktin znamená chemicky různorodou skupinu (od polymerů glykosylovaných monomerů PRL až ke komplexům PRL monomeru s autoprotilátkou proti prolaktinu) a jeho hladina variuje v závislosti na množství celkového PRL [8].
Dva způsoby uvolnění PRL z buňky se od sebe liší původem buňky
Buňky produkující PRL mimo hypofýzu nemají uskladňovací prostor pro vyrobený protein, a ten je proto uvolněn záhy po své syntéze. Regulace uvolnění PRL je tedy dána regulací transkripce PRL genu. Exprese prolaktinu v lymfocytech je stimulována aktivátorem T lymfocytů PHA (fytohemaglutinin) [9] a fyziologickými stimuly cestou cAMP (cyklický adenozinmonofosfát), např. prostaglandiny [10], interleukiny 2 a 4 sekreci prolaktinu z T lymfocytů tlumí [11].
V adenohypofýze je PRL po své syntéze uskladněn v sekrečních váčcích. Z buňky je PRL uvolněn exocytózou závislou na iontech vápníku (Ca). Laktotropy jsou heterogenní skupinou buněk, některé z nich vykazují spontánní akční potenciály vedoucí ke kolísání intracelulárního Ca [12]. I proto nejsou všechny buňky stejně citlivé na působení hlavního regulátoru sekrece PRL, dopaminu [13]. PRL je z laktotropů uvolňován ve 3 modech – bazální sekrece je dána počtem aktivních a funkčních laktotropů, pulzatilní sekrece je výsledkem nepřetržité souhry stimulačních a inhibičních faktorů (některých ještě nepoznaných) (tab. 1) a konečně cirkadiánní sekrece PRL s maximem v nočních hodinách.
Table 1. Faktory ovlivňující uvolnění prolaktinu z laktotropů a mechanizmy, jimiž působí. 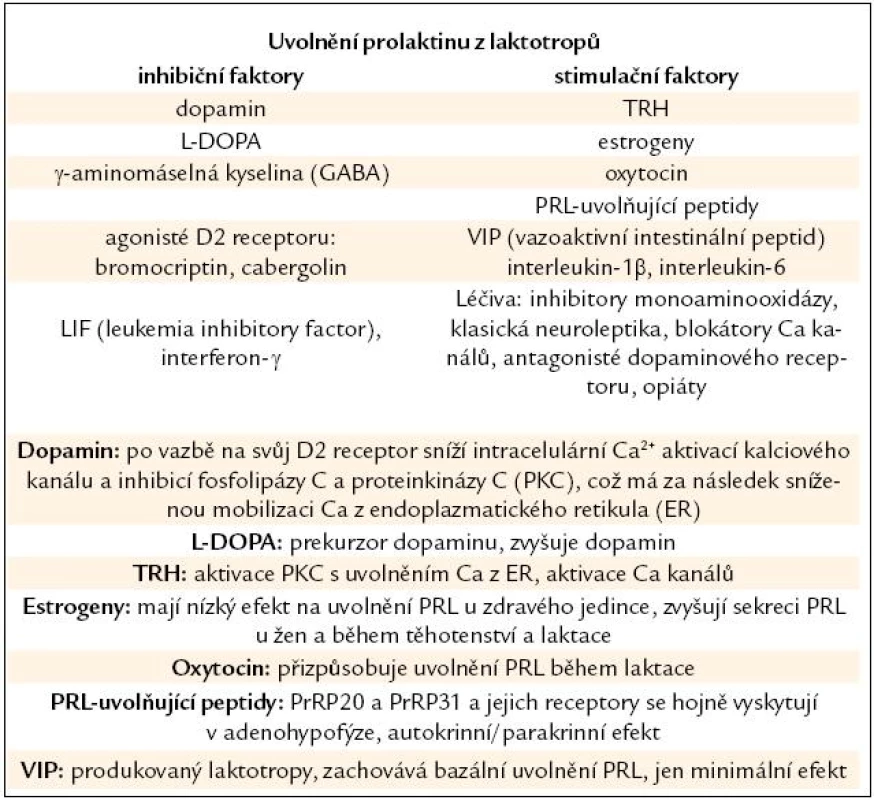
Prolaktin ovlivňuje buněčné děje
Prolaktin ovlivňuje životně důležité procesy v buňce (proliferace, diferenciace, syntéza komponent potřebných pro růst buňky) a účastní se sekreční aktivity, motility a dalších schopností fungující buňky [14,15]. Imunitní buňky jsou citlivé k PRL a ten podporuje jejich zrání a růst i specifické funkce (viz níže).
PRL R: receptor pro prolaktin
PRL je peptidový hormon a jako takový potřebuje k zahájení svého účinku membránový receptor. Receptor pro prolaktin (PRL R) patří spolu s receptorem pro erytropoetin, leptin, interleukiny (IL) 2, 7 a dalšími do rodiny cytokinových receptorů subrodiny I. [16] a v některých tkáních exprese PRL R kolísá v závislosti na reprodukčním stavu jedince [17]. Lidské imunitní buňky exprimují čtyři varianty PRL R [18] (obr. 1).
Image 1. Typy receptoru pro prolaktin (PRL-R). Lidský PRL-R se vyskytuje ve 4 variantách, které vznikají alternativním splicingem. PRL-R se skládá ze 3 domén: a) extracelulární; b) transmembránová; c) cytoplazmatická <ol><li>Dlouhá varianta: Je nejčastější a schopná aktivovat všechny intracelulární cesty, vyskytuje se ve všech lymfatických orgánech (kostní dřeni, lymfatických uzlinách, thymu i slezině) i na leukocytech v cirkulaci.</li> <li>Střední varianta: Zachována schopnost aktivace intracelulárních cest spojených s JAK-2, omezená schopnost aktivovat Src kinázy. Převážně je exprimována ve slezině, kostní dřeni, omezeně v lymfatických uzlinách (LU) a minimálně v thymu a periferních lymfocytech.</li> <li>ΔS varianta: Omezená vazba prolaktinu, avšak rychlejší schopnost aktivovat intracelulární cesty. Pouze 1/3 všech PRL-R je tato varianta, vyskytuje se omezeně v LU, slezině, thymu i leukocytech v cirkulaci, minimálně v kostní dřeni.</li> <li>PRL-BP: PRL-vázající peptid je schopen PRL vázat, nikoli spustit intracelulární cesty. Vyskytuje se sporadicky.</li></ol> 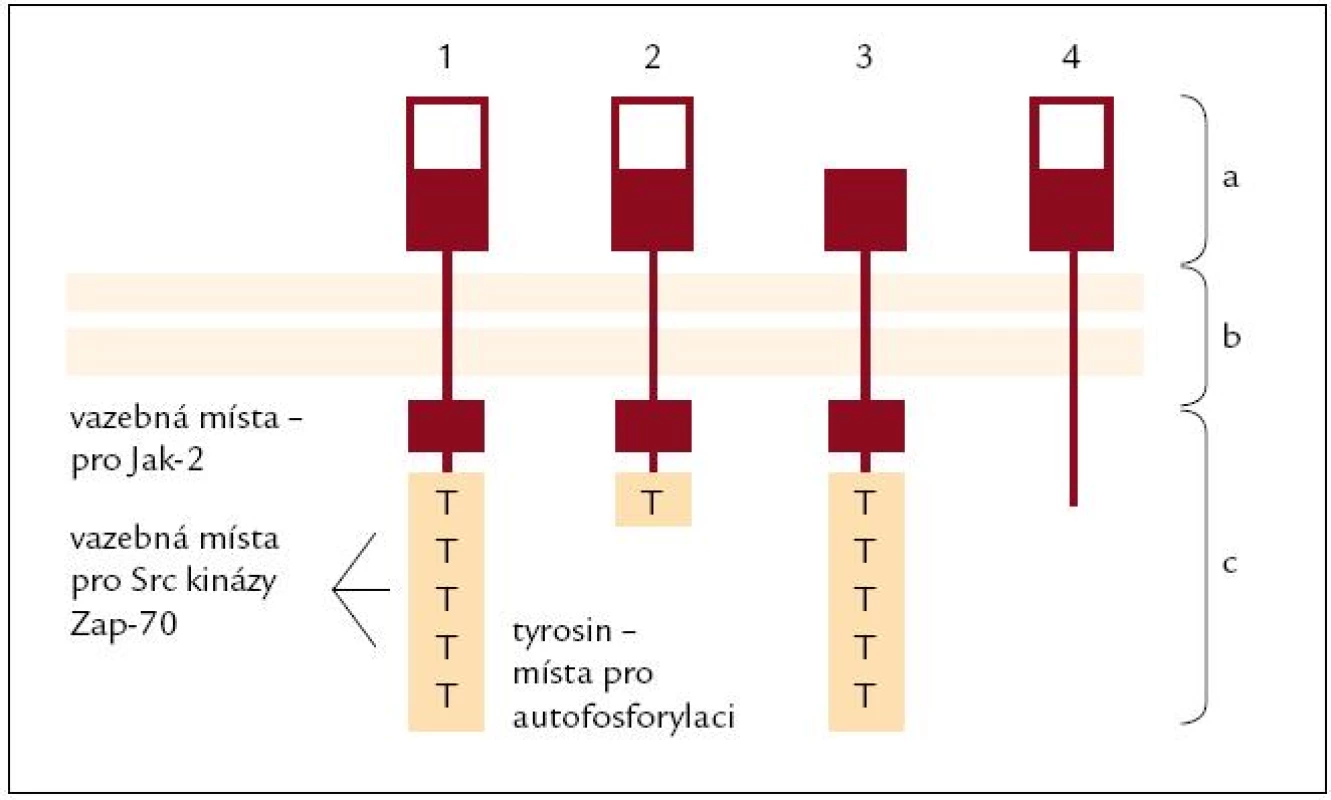
Přenos signálu –vlastní akce PRL v buňce
Po usednutí PRL na receptor následuje dimerizace PRL R a aktivace tyrozinkináz spojených s receptorem. Výsledkem je spuštění několika intracelulárních drah, které vedou v buňce k efektům, jako je syntéza proteinů, cytokinů, inhibice apoptózy, a k jeho označení pro degradaci. Komplexnost intracelulárního účinku prolaktinu je znázorněna na obr. 2.
Image 2. Intracelulární signalizace prolaktinu v imunitních buňkách. <ol><li>Dimerizace PRL-R po vazbě PRL. Následuje rychlá aktivace Janus kinázy (JAK)-2 a spuštění cesty přes transkripční faktory rodiny STAT (Signal Transductors and Activators of Transcription) [16,17]. Intracelulární kaskády vedoucí přes mitogenem-aktivované proteinkinázy (MAPK), fosfatidylinositol-3-kinázu (PI-3K) a proteinkinázu C (PKC) jsou aktivovány s prodlevou několika až desítek min [19–22,24–27].</li> <li>Neaktivní monomery STAT 1, 3 a 5 jsou volně v cytoplazmě, po fosforylaci homo- či heterodimerizují.</li> <li>Aktivní STAT se přesunují do buněčného jádra, kde buďto působí jako aktivátory/ korepresory jaderných receptorů a ostatních transkripčních faktorů, anebo se vážou přímo k promotorům cílových genů: IRF-1 (interferon regulatory factor-1) a další [28].</li> <li>Zpětná regulace intracelulárního účinku prolaktinu: JAK-2 je inhibována faktory SOCS (Supresor Of Cytokine Signaling) a CIS (Cytokine-Inducible SH2 containing protein). V jádře inhibují navázání dimerů STAT na DNA faktory PIAS (Protein Inhibitor of Activated STAT) [30].</li> <li>Fosforylace aminokyseliny serinu v pozici 349 vede k označení receptoru a jeho degradaci [23].</li> <li>Protein‑kinázy rodiny Src spojené s PRL-R aktivují fosfolipázu C (PLC-γ), která štěpí membránové lipidy za vzniku inositol-3 fosfátu (InsP3) a diacylglycerolu (DAG). DAG aktivuje proteikinázu C (PKC), pojítku k aktivaci proteinkináz MAPK.</li> <li>Další převodní intracelulární kináza, PI-3K (fosfatidylinositol-3-kináza) je aktivována DAG (cestou PLC-γ), Src kinázou Fyn nebo aktivovaným Ras GTP.</li> <li>PI-3K fosforyluje proteinkinázu B (Akt).</li> <li>Akt zvyšuje expresi protoonkogenu c-myc jednak přímo, jednak nepřímo: inhibuje GSK (Glukagon Synthese Kinase 3), která zvyšuje degradaci c-myc [25– 27].</li> <li>Signál z PRL-R vede k zahájení syntézy komponent translačního komplexu, cestou Akt/ mTOR (mammalian target of rapamycin).</li> <li>PI-3K aktivovaná Src-kinázou Fyn fosforyluje jednu z mitogen aktivovaných kináz – JNK (Jun-N‑terminal Kinase) – a vede k aktivaci genů spojených s apoptózou.</li> <li>Komplex SHC-Grb2-SOS je aktivovaný jak Src-kinázami (Fyn), tak JAK-2 a fosforyluje Ras GTP, který je začátkem cesty k aktivaci MAPK Erk1/ 2. MAPK Erk1/ 2 aktivuje transkripční faktory c-fos a c-jun, které regulují expresi několika genů včetně antiapoptotických.</li> <li>Na aktivaci faktorů c-myc, c-fos a c-jun se pod vlivem PRL podílí i další z MAPK – p38 a JNK.</li> <li>Několik drah (PI-3K, PlCγ, MAPK, ale i STAT 1, 3, 5) se spojuje k aktivaci antiapoptotických genů (např. pim-1, Bcl-2, Bcl-XL a XIAP) [31– 33]. Mechanizmy jsou individuální pro tu kterou buňku, avšak tato schopnost PRL je dokumentována napříč spektrem imunitních buněk in vitro i in vivo.</li> ![Intracelulární signalizace prolaktinu v imunitních buňkách.
<ol><li>Dimerizace PRL-R po vazbě PRL. Následuje rychlá aktivace Janus kinázy (JAK)-2 a spuštění cesty přes transkripční faktory rodiny STAT (Signal Transductors and Activators of Transcription) [16,17]. Intracelulární kaskády vedoucí přes mitogenem-aktivované proteinkinázy (MAPK), fosfatidylinositol-3-kinázu (PI-3K) a proteinkinázu C (PKC) jsou aktivovány s prodlevou několika až desítek min [19–22,24–27].</li>
<li>Neaktivní monomery STAT 1, 3 a 5 jsou volně v cytoplazmě, po fosforylaci homo- či heterodimerizují.</li>
<li>Aktivní STAT se přesunují do buněčného jádra, kde buďto působí jako aktivátory/ korepresory jaderných receptorů a ostatních transkripčních faktorů, anebo se vážou přímo k promotorům cílových genů: IRF-1 (interferon regulatory factor-1) a další [28].</li>
<li>Zpětná regulace intracelulárního účinku prolaktinu: JAK-2 je inhibována faktory SOCS (Supresor Of Cytokine Signaling) a CIS (Cytokine-Inducible SH2 containing protein). V jádře inhibují navázání dimerů STAT na DNA faktory PIAS (Protein Inhibitor of Activated STAT) [30].</li>
<li>Fosforylace aminokyseliny serinu v pozici 349 vede k označení receptoru a jeho degradaci [23].</li>
<li>Protein‑kinázy rodiny Src spojené s PRL-R aktivují fosfolipázu C (PLC-&gamma;), která štěpí membránové lipidy za vzniku inositol-3 fosfátu (InsP3) a diacylglycerolu (DAG). DAG aktivuje proteikinázu C (PKC), pojítku k aktivaci proteinkináz MAPK.</li>
<li>Další převodní intracelulární kináza, PI-3K (fosfatidylinositol-3-kináza) je aktivována DAG (cestou PLC-&gamma;), Src kinázou Fyn nebo aktivovaným Ras GTP.</li>
<li>PI-3K fosforyluje proteinkinázu B (Akt).</li>
<li>Akt zvyšuje expresi protoonkogenu c-myc jednak přímo, jednak nepřímo: inhibuje GSK (Glukagon Synthese Kinase 3), která zvyšuje degradaci c-myc [25– 27].</li>
<li>Signál z PRL-R vede k zahájení syntézy komponent translačního komplexu, cestou Akt/ mTOR (mammalian target of rapamycin).</li>
<li>PI-3K aktivovaná Src-kinázou Fyn fosforyluje jednu z mitogen aktivovaných kináz – JNK (Jun-N‑terminal Kinase) – a vede k aktivaci genů spojených s apoptózou.</li>
<li>Komplex SHC-Grb2-SOS je aktivovaný jak Src-kinázami (Fyn), tak JAK-2 a fosforyluje Ras GTP, který je začátkem cesty k aktivaci MAPK Erk1/ 2. MAPK Erk1/ 2 aktivuje transkripční faktory c-fos a c-jun, které regulují expresi několika genů včetně antiapoptotických.</li>
<li>Na aktivaci faktorů c-myc, c-fos a c-jun se pod vlivem PRL podílí i další z MAPK – p38 a JNK.</li>
<li>Několik drah (PI-3K, PlC&gamma;, MAPK, ale i STAT 1, 3, 5) se spojuje k aktivaci antiapoptotických genů (např. pim-1, Bcl-2, Bcl-XL a XIAP) [31– 33]. Mechanizmy jsou individuální pro tu kterou buňku, avšak tato schopnost PRL je dokumentována napříč spektrem imunitních buněk in vitro i in vivo.</li>](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/2683a55a2a4fed82b619aced9e4a24ed.jpg)
Prolaktin a imunita: imunomodulační účinky prolaktinuse projevují na několika úrovních
PRL je účinný cytokin [33] a jeho lokální množství v mikroprostředí primárních i sekundárních lymfatických orgánů může ovlivnit trvání a průběh imunitní odpovědi. PRL je syntetizován v thymocytech [34], v monocytech během svého vyzrávání [35] a T a B lymfocytech izolovaných ze sleziny, lymfatických uzlin a tonzil, míst, kde imunitní buňky prodělávají svůj funkční vývoj [36].
PRL v časných fázích vývoje imunitních buněk
Receptor pro prolaktin exprimuje až 90% buněk kostní dřeně [37]. PRL je syntetizován CD34+ stromálními buňkami kostní dřeně a spolu s ostatními růstovými faktory se podílí na zachování dostatečné rezervy progenitorových buněk a prekurzorů B lymfocytů.
Během vyzrávání T lymfocytů v thymudochází k jejich specifické diferenciaci –syntéze jedinečného TCR receptoru, CD4 a CD8 receptorů u pomocných a cytotoxických T lymfocytů. PRL je součástí mikroprostředí thymu a díky svým antiapoptotickým schopnostem zvyšuje přežívání T lymfocytárních prekurzorů. Careno et al prokázali, že PRL zvyšuje syntézu interleukinu (IL) 2a jeho receptoru (IL-2R), která vede k vyšší schopnosti CD25+ TCR – CD3 – CD4 – CD8 – prekurzorů vyzrávat do dvojitě pozitivních thymocytů, TCRlow CD3low CD4+ CD8+ lymfocytů [38].
PRL potencuje průběh imunitní odpovědi
Prolaktin působí v několika krocích imunitní odpovědi (tab. 2). V periferních mononukleárních buňkách (PBMC) a makrofázích PRL během stimulace mitogenem, a razantně méně sám, zvyšuje produkci cytokinů IL-12, IL-1β, interferonu (IFN)γ a tumor nekrotizujícího faktoru (TNF) α in vitro [22,26,39–41,43] i in vivo [42]. Takizawa et al zjistili, že PRL in vitro zvyšuje expresi α řetězce receptoru pro IL-2 (CD25) na povrchu PBMC [44], což vytváří ideální prostředí pro proliferaci T lymfocytů. Stimulační aktivita prolaktinu je částečně závislá na jeho syntéze v imunitních buňkách a autokrinními a parakrinními účinky, neboť při podání anti PRL protilátek je potlačena sekrece IL-2 a IFN-γ i exprese kostimulačních molekul CD69 a CD40L až o 50% [40].
Hladina PRL koreluje s počtem a funkcí B lymfocytů, PRL stimuluje jejich proliferací syntézu imunoglobulinů [45]. V recentní práci Mukherjee et al pozorovali, že panhypopituitární jedinci s nižší hladinou prolaktinu nejsou schopni adekvátně reagovat na vakcinaci [46].
Vyvstává otázka, zda je PRL pro fungování imunitního systému nezbytný. Odpověď je zajímavá
V experimentálních podmínkách lze sledovat účinky prolaktinu na imunitní systém u několika typů hlodavců. Jednak jsou to trpasličí myšky Snell Dwarf s mutací pro transkripční faktory Pit 1 a Prop 1, u kterých nedojde k vyvinutí adenohypofyzárních buněk produkujících TSH, růstový hormon (GH) a prolaktin. Dále hypofyzektomované myši anebo přímo na knock out (KO) myší modely s odstraněným genem pro prolaktin (PRL –/–) anebo jeho receptor (PRL R –/–). Ve studiích z 80. a 90. let byly zjištěny závažné poruchy vývoje imunitních buněk na několika úrovních: zvířata měla hypoplastický thymus, hypocelulární kostní dřeň, deficit CD4+ a CD8+ T lymfocytů a B lymfocytů [47]. Z toho plynoucí poruchu v humorální i buněčné imunitní odpovědi však bylo možno obnovit aplikací prolaktinu. V recentnějších studiích však vykazují zvířata s deficitem PRL neporušené imunitní funkce – thymus je normálně vyvinut, počet i funkce T i B lymfocytů jsou stejné jako u zdravých [48].
Důvody této diskrepance jsou dvojí. Jednak, v případě KO myší mohou nastoupit kompenzační mechanizmy, jako zvýšená exprese růstového hormonu (GH), event. jiných cytokinů, např. IL-2 [48,49]. Druhý důvod nás přivede k důležité roli prolaktinu. V průběhu recentnějších studií byla kontrolní a nemocná zvířata chována odděleně, společný chov laboratorních zvířat během dřívějších pokusů vedl k opakovaným stresovým situacím znevýhodněných zvířat [48]. A právě stres je situace, kdy PRL vyvažuje supresivní účinky adrenokortikotropního hormonu (ACTH) a glukokortikoidů (GC) na imunitní systém. U zvířat podrobených stresu (ztráta krve, chlad) podání PRL zvrátí navozenou imunosupresi, zlepší jejich přežití a sníží výskyt sepse [50,51].
Aktivace HPA osy během stresu
Během stresové reakce na promptní aktivaci sympatoadrenálního systému (SAS) navazuje spuštění osy hypotalamus adenohypofýza nadledviny (HPA): kortikotropní uvolňující faktor (CRH) z hypotalamu stimuluje sekreci ACTH z adenohypofýzy, díky němuž jsou uvolněny glukokortikoidy z kůry nadledvin. Mašinérii HPA osy mohou spustit i prozánětlivé cytokiny: IL-1, 2, 6, TNF-α a IL-6 a IFN-γ.
Na rozdíl od stimulačního účinku molekul aktivovaného SAS [52] mají glukokortikoidy účinek imunosupresivní, který chrání organizmus před přetrváváním zánětlivé odpovědi a poškozením buněk produkovanými cytokiny [53] (tab. 2).
Table 2. Přehled účinků glukokortikoidů a prolaktinu na imunitní systém. 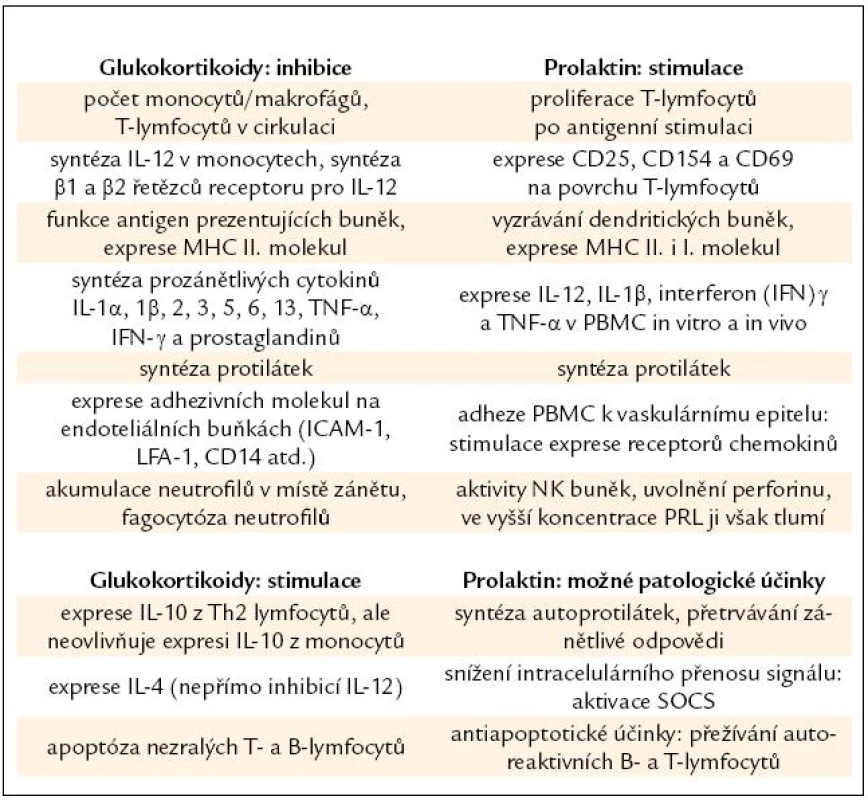
MHC – molekuly hlavního histokompatibilního systému I. a II. třídy, PBMC – periferní mononukleární buňky, NK – přirození zabíječi, LFA – lymfotoxin α, SOCS – Supresor Of Cytokine Signaling , ICAM‑1 – Inter- Cellular Adhesion Molecule 1 Uvolnění PRL během stresu
Během akutního působení stresu dochází v průběhu minut ke zvýšení sekrece dalších adenohypofyzárních hormonů: prolaktinu a růstového hormonu. Prolaktin je uvolňován ve vlně navazující na vyvolávající podnět [54], příčinou této reakce je inhibice tlumivého účinku dopaminu. Při dlouhodobém působení stresorů zvýšené uvolnění PRL do oběhu pomine. Různé situace, jako chirurgické operace, úrazy, psychické napětí, ale i odběr krve a další vedou ke zvýšení hladin PRL [55].
Nevyváženost imunosupresivní/stimulační aktivity při nedostatku/nadbytku PRL
Porušení rovnováhy mezi imunosupresivním působením glukokortikoidů a imunostimulačním efektem prolaktinu vede k výrazným změnám v imunitním systému (tab. 2).
Nedostatek prolaktinu poznáme v kritických situacích
Samostatná nozologická jednotka s kompletním nedostatkem prolaktinu neexistuje. Přesto můžeme efekt nízkého PRL u lidí sledovat – a sice, u kriticky nemocných pacientů v septickém stavu. Ačkoliv je u většiny nemocných zvýšeně uvolňován kortizol při aktivované HPA ose, uvolnění ostatních hormonů adenohypofýzy je ztlumeno [56]. Na snížené hladině prolaktinu se může podílet i aplikace dopaminu. Felmet et al pozorovali epizody hypoprolaktinemie až u 50% kriticky nemocných dětí, prolongovaná hypoprolaktinemie pak byla spojena s lymfopenií, vyšším sklonem k nozokomiálním infekcím a výskytem multiorgánového selhání [57]. I když k depleci lymfocytů během sepse dochází díky mnoha faktorům, tak glukokortikoidy se na jejím rozvoji podílí. Pod jejich vlivem dochází mj. ke zvýšené apoptóze nezralých T a B lymfocytů. Krishnan et al prokázali přímý antagonistický efekt PRL na GC indukovanou apoptózu vyzrávajících CD4+ a CD8+ T lymfocytů v thymu [33]. Na myším modelu PRL –/ – zjistili, že při aplikaci GC dochází k aktivaci kaspázy 3,jednoho z výkonných proteolytických enzymů aktivovaných během apoptózy. Při současné aplikaci PRL však k apoptóze nedošlo, a to díky zvýšené expresi genu XIAP (X linked Inhibitor of Apoptosis Protein), jehož produkt inhibuje kaspázu 3. Samozřejmě, PRL zesiluje i efektorové funkce T , B lymfocytů a monocytů (tab. 2). Matalka et al zjistili, že prolaktin dokáže zvrátit GC navozenou inhibici prozánětlivých cytokinů IFN-γ a IL-12 in vitro [41,58].
Prozatím v plenkách je studium produkce prolaktinu v lymfocytech během sepse nebo traumatu. Matsutani et al prokázali expresi 25kDa peptidu se stejnými imunostimulačními účinky, jaké vykazuje PRL u PRL –/ – myší podrobených experimentální stresové situaci – masivní ztrátě krve [59].
Hyperprolaktinemie během fyziologických a patologických situací
Fyziologicky se hladina PRL rytmicky mění během dne, u žen dochází až k několikanásobnému zvýšení sérové hladiny v průběhu těhotenství a laktace [60]. Hyperprolaktinemie je spojena s patologickými situacemi (adenom hypofýzy secerenující PRL, hypotyreózou, insuficiencí ledvin a jater a dalšími), event. medikací (tab. 1) a projevuje se u obou pohlaví poruchami plodnosti. Mírně zvýšená sérová hladina PRL však nemusí vyvolávat žádné klinické příznaky a vyskytuje až u 3% žen v reprodukčním věku [61].
Stavy se zvýšeným PRL a imunita
Během fyziologické hyperprolaktinemie – těhotenství, je imunitní odpověď ovlivněna i vysokou syntézou estrogenů, progesteronu a glukokortikoidů. Pomyslná rovnováha je převážena na stranu GC a imunitní odpověď se kloní směrem k Th2 [58,62]. Dochází proto k vylepšení onemocnění spojených s převahou Th1 imunitní odpovědi, jako je revmatoidní artritida (RA) anebo roztroušená skleróza. Situace se změní po porodu, kdy hladina kortizolu rychle klesá [62] a převáží imunostimulační efekt prolaktinu. Obě autoimunitní onemocnění mohou v tomto období buďto nově propuknout, anebo relabovat.
Patologie imunitního systému při prolaktinomu nepatří k charakteristice onemocnění. Buskila et al sice detekovali autoprotilátky charakteristické pro systémová revmatická onemocnění u 1/3 žen s adenomy hypofýzy a hyperprolaktinemií, avšak ani jedna z žen systémovým autoimunitním onemocněním netrpěla [63]. V literatuře najdeme ojedinělé kazuistické případy koincidence prolaktinomu a autoimunitních chorob – u SLE byla popsána v 9 případech a u některých případů koreluje s aktivitou onemocnění [64], u psoriázy a RA léčba prolaktinomu vedla k vylepšení klinických projevů [65,66].
Prolaktin & autoimunitní choroby
Role prolaktinu v patogenezi autoimunitních onemocnění je otevřenou otázkou. Vyšší hladina PRL oproti zdravým jedincům byla zjištěna jak u orgánově specifických, tak i systémových revmatických onemocnění (tab. 3).
Table 3. Zvýšená hladina prolaktinu u autoimunitních onemocnění. 
RS – roztroušená skleróza, ANA – antinukleární protilátky, anti-dsDNA – protilátky proti dvoušroubici DNA, DA – dopaminergni agonisté, PRL – prolaktin, SLE – systémový lupus erythematodes Zvýšená hladina prolaktinu u orgánověspecifických autoimunitních onemocnění má různé důvody a PRL ovlivňuje patogenezi nebo klinický průběh těchto chorob
U roztroušené sklerózy (RS) je zvýšená hladina PRL spojena s lézí hypotalamu [67] a se subtypem RS s postižením optického nervu u asijské populace [68]. Zjištění, že hladina PRL stoupá před relapsem RS [67], však nebylo potvrzeno [69]. Berg et al popsali spojitost mezi poklesem počtu aktivních ložisek a hladinou prolaktinu v séru u 9 pacientů během léčby remitentní RS intravenózními pulzy glukokortikoidů [70].
Autoprotilátky proti peroxidáze a tyreoglobulinu se vyskytují častěji u nemocných s farmakologicky navozenou hyperprolaktinemií [71], kteří mají i vyšší riziko rozvoje autoimunitní tyreoiditidy. Zvýšené hladiny PRL se vyskytují u nemocných s Hashimotovou tyreoiditidou i bez prokázané hypotyreózy [72].
Zvýšení hladin sérového PRL u celiakie koreluje se stupněm histologického postižení střeva a malnutricí [73] a naopak, při bezlepkové dietě hladina PRL u nemocných klesá [74].
Tíže kožního postižení u psoriázy se mění s hladinou prolaktinu [65]. Keratinocyty exprimují prolaktinový receptor a mohou produkovat i prolaktin [75]. Velmi recentně bylo v in vitro studiích prokázáno, že keratinocyty pod vlivem PRL syntetizují chemokiny CXCL 9, 10 a 11 [76] a CCL 20 [75], chemoatraktanty pro Th1 a Th17 lymfocyty. Th1 a Th17 patří k hlavním buňkám vyskytujícím se v dermis psoriatických ložisek, kde udržují lokální zánětlivé prostředí.
Zajímavě se vyvinul pohled na roli prolaktinu v patogenezi autoimunitního diabetu (DM1T). Hawkins et al prokázali protektivní účinek bromokriptinu před vypuknutím nemoci u myšího modelu NOD (non obese diabetes) pro spontánní vznik diabetu [77]. Holstad et al sledovali vliv PRL na rozvoj DM1T v těchto časných fázích – během pokusů při opakované aplikaci malých dávek streptozocinu (STZ), chemikálie toxické pro β buňky, překvapivě zjistili, že současné podávání PRL snižuje STZ navozenou infiltraci pankreatických ostrůvků mononukleáry, porušenou funkci β buněk a hyperglykemii [78]. Recentně bylo navíc u STZ modelu prokázáno, že PRL snižuje expresi IFN-γ a TNF-α ve slezině a podílí se na snížení zánětlivé odpovědi na streptozocin [79]. Tento nález neodpovídá představě PRL stimulátora Th1 odpovědi, a i když tuto situaci lze snad vysvětlit odlišným působením PRL jako kofaktoru v imunitní reakci na různé antigeny, vyjasnění úlohy PRL na sy-stémovou imunitní reakci u tohoto modelu bude ještě vyžadovat další pokusy. Zajímavé je, že při sledování PRL/R –/ – knock out myší bylo zjištěno výrazné snížení β buněk Langerhansových ostrůvků a PRL se ukázal jako účinný stimulátor biosyntézy inzulinu a proliferace β buněk in vitro [21] a in vivo [80]. Prozatím zůstává otázkou, zda mononukleární buňky infiltrující Langerhansovy ostrůvky produkují PRL a jestli se PRL u diabetiků 1. typu místně podílí na progresi inzulitidy (svým stimulačním účinkem na proliferaci a funkci T lymfocytů) anebo spíše ochraňuje β buňky před apoptózou.
Hyperprolaktinemie a imunomodulační účinky prolaktinu u systémových revmatických chorob
Systémový lupus erythematodes
Zvýšená hladina prolaktinu byla poprvé zjištěna u mužů se systémovým lupus erythematodes (SLE) na konci 80. let 20. století [81]. Od té doby proběhly četné studie týkající se tohoto hormonu a cytokinu.
Patogeneze SLE & PRL & nejen myší modely SLE
Patogeneze SLE je komplexní, velmi stručně – ústřední úlohu zaujímají autoreaktivní B lymfocyty, které za podpory CD4+ T lymfocytů produkují patologické IgG autoprotilátky. Tvorba imunitních komplexů a jejich depozice do různých tkání (např. ledvin s rozvojem glomerulonefritidy), vazba autoprotilátek na povrchové molekuly cílových buněk s jejich lýzou anebo změnou funkce vytváří mnohotvárné příznaky SLE.
Manipulace s hladinou prolaktinuu experimentálních modelů SLE ovlivňuje průběh onemocnění. U myšího modelu NZBxNZW F1 (charakterizovaného těžkou glomerulonefritidu a vaskulitidou, abnormalitami T lymfocytů, hyperaktivitou B lymfocytů a sexuálním dimorfizmem s horším průběhem choroby u samiček), vede uměle navozená hyperprolaktinemie u obou pohlaví k nadměrné produkci imunoglobulinů, protilátek proti dvoušroubovici DNA (anti dsDNA) a časnému rozvoji glomerulonefritidy. Progresi onemocnění lze snížit podáním bromokriptinu [82].
Podstata úlohy PRL ve vývoji autoreaktivních B buněk je velmi dobře vysvětlena na jiném myším modelu: Balb/c myší – transgenních pro těžký řetězec dsDNA protilátek (R4A γ2b), které vykazují 2 typy B buněk: s nízkou afinitou k dsDNA (produkující nepatogenní protilátky) a druhé, autoreaktivní, s vysoce afinitním B receptorem (BCR), které jsou normálně zlikvidovány [83]. Čtyřtýdenní aplikace PRL vede u těchto myší k rozvoji SLE podobnému fenotypu: počet autoreaktivních B buněk (a patogenních anti-dsDNA protilátek) stoupá a glomeruly se zaplní IgG depozity [32]. Tato situace je způsobena antiapoptotickým efektem PRL. B lymfocyty prodělávající zrání ve slezině procházejí 3 přechodnými stavy: T1→ T2 → zralý B lymfocyt. Přechod mezi T1 a T2 stavem je hlavním místem negativní selekce, to znamená, že autoreaktivní buňky s BCR reagujícím silně na autoantigen zde podléhají apoptóze. PRL ruší navozenou apoptózu tím, že zvyšuje expresi antiapoptotického genu Bcl 2 [32] a snižuje expresi proapoptotického genu Trp 63 [84]. PRL dále zvyšuje expresi receptoru pro lymfocytární faktor BAFF (B cell Activating Factor) a to je další možnost, jak mohou autoreaktivní B lymfocyty přežívat [84].
Únik autoreaktivních B lymfocytů před apoptózou je do jisté míry závislý na CD4+ T lymfocytech [32], která je dána interakcí CD40–CD40L, přičemž PRL zvyšuje expresi obou molekul [84,85]. Efekt prolaktinu je částečně geneticky dán. Geneticky odlišné myši, C57B, rovněž R4A-γ2b, přítomností prolaktinu v dávkách, po kterých Balb/c vykazují lupus like syndrom, nijak netrpí [32]. Situace se ale změní, pokud C57B geneticky upravíme. Peeva et al vsunuli rizikovou oblast Sle 3/5 pro rozvoj SLE u myší (spojená s delším přežíváním autoreaktivních T buněk) do jejich genomu a i u těchto myší se objevily anti dsDNA protilátky a postižení ledvin shodné s lupusovou nefritidou [86].
U humánního SLE prolaktin in vitro i in vivo zvyšuje produkci imunoglobulinů a autoprotilátek v porovnání se zdravými jedinci [87,88]. PRL jako lokální autokrinní a parakrinní proproliferační faktor není hlavní hráč, který ovlivňuje imunitní reakce, ale podporuje jejich aktivnější průběh. Zajímavé je, že PBMC SLE nemocných produkují více prolaktinu v porovnání se zdravými [36]. Prolaktin se tak patrně podílí na vysoké aktivitě imunitního sy-stému u aktivního onemocnění.
PRL a klinická manifestace SLE
Mírná hyperprolaktinemie (HPRL) se vyskytuje u 15–30% SLE [89] a v mnoha pracích hladina PRL koreluje s aktivitou onemocnění [90,91]. Vera Lastra et al pozorovali signifikantní pokles hladin PRL a hodnot skórovacího systém pro aktivitu onemocnění, SLEDAI (SLE Disease Activity Index), během 6 měsíců léčby glukokortikoidy a hydroxychlorochinem u 27 žen s glomerulonefritidou a 16 žen s kožně kloubním flarem [92]. V literatuře však najdeme práce, které souvislost mezi HPRL a aktivitou SLE nepotvrdily. Příčinou diskrepance jsou protilátky proti prolaktinu (anti PRL IgG) měnící PRL v neúčinný makroprolaktin. Anti PRL IgG se vyskytují u 5% nemocných SLE, u nemocných s hyperprolaktinemií až u 40% [93]. U SLE nemocných s HPRL vyšší hladiny makroprolaktinu korelují s nižší aktivitou choroby, kdežto vyšší hladiny volného PRL s aktivitou vyšší [90,91].
Zvýšení hladin sérového PRL byla pozorována i u specifického klinicko laboratorního postižení u SLE (tab. 3). Dvě práce popisují vyšší hladinu PRL v cerebrospinální tekutině u nemocných SLE s postižením CNS [94,95]. Zvýšená hladina prolaktinu byla popsána i u kloubního postižení u SLE [90,91]. V souladu s tím jsme zjistili genetickou asociaci: G alela ve funkčním polymorfizmu mimohypofyzárního promotoru (–1149G/T) vede k vyšší produkci mRNA prolaktinu a v naší předchozí práci je silně spojena s artritidou u SLE [96].
Agonisté D2 receptoru – zklamání v léčbě SLE, naděje pro těhotné SLE?
Léčba SLE je individuální a imunosuprese doprovází pacienta většinou celý jeho další život. Po úspěšných pokusech u experimentálních zvířat a dobrých výsledcích při léčbě prolaktinomu následovalo několik lékových studií s agonisty dopaminového receptoru. Dvě nezávislé studie, u 7 a 11 SLE pacientů, zjistily signifikantní pokles aktivity SLE (dle SLEDAI) po léčbě bromokriptinem (BRC) [97] a quinagolidem [98]. Bohužel v dalším sledování pacientů po vysazení BRC následovalo zvýšení SLE aktivity a kožně kloubní flare [97], u druhé práce chybí follow up [98]. Následovaly dvě dvojitě zaslepené studie s bromokriptinem [99,100]. V první bylo sledováno 66 SLE nemocných v jednoměsíčních intervalech, 36 z nich dostávalo BRC ke své imunosupresivní léčbě, která byla obdobná jako u 30 SLE bez BRC. Na počátku sledování bylo v BRC skupině 51,4% SLE s hyperprolaktinemií, v druhé 40%. Během 1 roku byl signifikantní rozdíl SLEDAI pozorován jen 1krát, v 5. měsíci. Po ukončení studie měla BRC skupina signifikantně nižší hladinu PRL a nižší počet flarů/pacienta a měsíc [99]. Walker SE porovnávala účinek bromokriptinu a hydroxychlorochinu – po ročním sledování zjistila signifikantní pokles aktivity SLE a podávání BRC vyhodnotila jako ekvivalentní k hydroxychlorochinu [100]. Obě studie bohužel nepopisují následné sledování pacientů. Riziko „rebound fenoménu“ po ukončení léčby bromokriptinem a vypuknutí SLE flaru se zdá být vysoké pro použití tohoto léku, který má i vlastní imunosupresivní aktivitu. Širší studie, které by se zabývaly použitím BRC u nemocných SLE, prozatím chybí. Použití bromokriptinu u nemocných SLE s prolaktinomem je indikováno, avšak ukončení léčby musí být velmi opatrné.
Novinkou je použití bromokriptinu u těhotných žen se SLE. Těhotenství, ač probíhá v dnešní době díky multidisciplinární lékařské péči u nemocných se SLE s dobrými výsledky, zůstává až v 60% rizikem pro rozvoj SLE flaru a jsou popsány případy, kdy se SLE během těhotenství nově manifestuje [101]. Hladina PRL koreluje s aktivitou onemocnění během těhotenství a výskytem lupus antikoagulans (LA) [102], přičemž aktivní onemocnění a LA jsou hlavní rizikové faktory pro poškození placenty s následkem spontánních abortů, předčasných porodů nebo intrauterinní růstové retardace dítěte (IUGR) u SLE pacientek. Jara et al zjistili u 15 těhotných SLE žen, že vyšší hladina prolaktinu v 6. a 7. gestačním měsíci, v porovnání se zdravými, silně koreluje s předčasným porodem [103]. Leanos Miranda et al sledovali průběh 99 těhotných SLE pacientek: 13 z nich s autoprotilátkami proti prolaktinu mělo signifikantně lepší průběh těhotenství co do počtu flarů (15,4 vs 62,8%), komplikací stran dítěte – nižší porodní váha a IUGR (7,7 vs 57,5%) a předčasného porodu (40,7 vs 7,7%) [8]. Pilotní studie s přidáním bromokriptinu do léčby 10 SLE nemocným (k 10mg prednisonu) mezi 25. a 35. týdnem těhotenství přinesla potěšující výsledky: žádná z pacientek neměla flare na rozdíl od 2 z 10 nemocných SLE bez BRC a 80% dětí se narodilo v termínu na rozdíl od 50% dětí těhotných bez BRC [103]. Kompletní studie prozatím není zveřejněna a toho času neexistuje podobná práce.
Revmatoidní artritida
RA je chronické autoimunitní onemocnění, s predominancí Th1 imunitní odpovědi. Patologicky prolongovaná zánětlivá imunitní reakce v synoviálních kloubech vede k vytvoření panu a k destrukci přilehlé kosti a chrupavky.
RA & PRL & myší modely & cirkadiánní rytmy PRL a kortizolu u RA
Neidhart et al zjistili, že nedostatek PRL u hypofyzektomovaných krys brzdí rozvoj adjuvantní artritidy, kdežto jeho nadbytek její rozvoj usnadňuje [104]. V druhém zajímavém experimentu bylo zjištěno, že projevy adjuvantní artritidy se vylepšily při stresové situaci, hladovění. V tomto pokusu zůstala hladina PRL stejná, kdežto hladina kortizolu vzrostla, a uplatnily se tak imunitně kontraregulační schopnosti kortizolu [105]. Ratkay et al sledovali rozvoj artritidy u MRL lpr/fas myší, modelu, u kterého dochází ke spontánnímu vzniku artritidy po porodu. Při pokusu, kdy jednu skupinu po porodu odstavili a druhou nechali kojit, zjistili tři poznatky. Za prvé, u odstavených myší se artritida objevila signifikantně méně často (v 32%) na rozdíl od kojících samiček (v 100%), za druhé, subsynoviální zánětlivá infiltrace byla u kojících výraznější, a za třetí, skupina s rozvinutou artritidou měla vyšší hladinu prolaktinu, ale shodnou hladinu kortizolu s odstavenými zvířaty [106].
Zdá se, že rovnováha prolaktin/kortizol je hlavní motor v úloze prolaktinu v patogenezi revmatoidní artritidy. Tomuto odpovídá i zjištění autorů Rovenského et al, kteří u lidí pozorovali potřebu podávání vyšších dávek glukokortikoidů ke zvládnutí nemoci u nemocných s RA s hyperprolaktinemií [107].
Sérový prolaktin & RA
Několik prací se věnuje hladinám prolaktinu u revmatoidní artritidy. Výsledky jsou rozporné, některé práce popisují stejnou, event. nižší sérovou hladinu PRL. Mateo et al zjistili vyšší hladinu sérového PRL u mužů, která koreluje s trváním nemoci a stupněm RTG nálezu [108]. V naší, prozatím probíhající, práci jsme zjistili, že spíše hladina prolaktinu v synoviální tekutině než v séru koreluje s aktivitou RA. Malé otevřené studie s léčbou bromokriptinem u RA nepřinesly smysluplné výsledky [109].
Ostatní systémové revmatické choroby
Zvýšená hladina prolaktinu v séru nemocných se systémovou sklerodermií (SSc) koreluje s mnohočetným postižením a aktivitou onemocnění [110,111]. Czuwara Ladykowska et al zjistili, že lymfocyty SSc pacientů produkují vyšší mRNA prolaktinu [112]; v naší práci jsme bohužel jasnou genetickou asociaci mezi funkčním polymorfizmem v PRL promotoru a SSc nezjistili [113].
Závěr
Vzájemné vztahy mezi neuroendokrinním a imunitním systémem ovlivňují průběh imunitních reakcí a nerovnováha v některých faktorech, jako je hormon a cytokin prolaktin, může vytvořit podklad pro vznik patologie. Prolaktin aktivuje řadu signálních drah, v jejichž důsledku jsou transkribovány geny pro interleukiny, transkripční faktory a antiapoptotické molekuly. Jeho účinky v imunitním systému nejsou ale regulační, prolaktin se chová spíše jako modulátor imunitní reakce – zesiluje Th1 i Th2 odpověď. Zvýšená hladina prolaktinu u různých onemocnění, ať je její příčina jakákoliv (porušená regulace uvolnění prolaktinu z adenohypofýzy vlivem zánětlivých cytokinů nebo snížené produkce tlumivého dopaminu, zvýšená produkce prolaktinu v imunitních buňkách, polymorfizmy v genu pro prolaktin), může modifikovat aktuální nastavení imunitního systému pro rozvoj autoimunity. I během již manifestovaného onemocnění nadbytek prolaktinu ovlivňuje jeho průběh a léčbu, příkladem je zvýšená potřeba glukokortikoidů u revmatoidní artritidy s hyperprolaktinemií. V neposlední řadě prolaktin koreluje s aktivitou onemocnění – např. u systémového lupus erythematodes a celiakie, což by pro klinickou praxi mohlo znamenat vcelku jednoduchou metodu na monitorování aktivity onemocnění a předcházení relapsům.
Tato práce vznikla v rámci projektu IGA Ministerstva zdravotnictví České republiky: Prolaktin a revmatoidní artritida, NR/9292–3.
MU Dr. Markéta Fojtíková
www.revma.cz
e mail: fmar@centrum.cz
Sources
1. Riddle O, Bates RW, Dykshorn SW. The preparation, identification and assay of prolactin – a hormone of the anterior pituitary. Am J Physiol 1933; 105 : 191 – 216.
2. Freeman ME, Kanyicska B, Lerant A et al. Prolactin: structure, function, and regulation of secretion. Physiol Rev 2000; 80 : 1523 – 1631.
3. Bole ‑ Feysot C, Goffin V, Edery M et al. Prolactin (PRL) and its receptor: actions, signal transduction pathways and phenotypes observed in PRL receptor knockout mice. Endocr Rev 1998; 19 : 225 – 268.
4. Goffin V, Shiverick KT, Kelly PA et al. Sequence ‑ Function Relationships Within the Expanding Family of Prolactin, Growth Hormone, Placenta Lactogen, and Related Proteins in Mammals. Endocr Rev 1996; 17 : 385 – 410.
5. Gellersen B, Kempf R, Telgmann R et al. Nonpituitary human prolactin gene transcription is independent of Pit ‑ 1 and differentially controlled in lymphocytes and in endometrial stroma. Mol Endocrinol 1994; 8 : 356 – 373.
6. Piwnica D, Fernandez I, Binart N et al. A new mechanism for prolactin processing into 16K PRL by secreted cathepsin D. Mol Endocrinol 2006; 20 : 3263 – 3278.
7. Ueda E, Ozerdem U, Chen YH et al. A molecular mimic demonstrates that phosphorylated human prolactin is a potent anti‑angiogenic hormone. Endocr Relat Cancer 2006; 13 : 95 – 111.
8. Leaños ‑ Miranda A, Cárdenas ‑ Mondragón G, Ulloa ‑ Aguirre A et al. Anti‑prolactin autoantibodies in pregnant women with systemic lupus erythematosus: maternal and fetal outcome. Lupus 2007; 16 : 342 – 349.
9. Reem GH, Ray DW, Davis JR. The human prolactin gene upstream promoter is regulated in lymphoid cells by activators of T ‑ cells and by cAMP. J Mol Endocrinol 1999; 22 : 285 – 292.
10. Gerlo S, Verdood P, Gellersen B et al. Mechanism of prostaglandin (PG)E2‑induced prolactin expression in human T cells: cooperation of two PGE2 receptor subtypes, E ‑ prostanoid (EP)3 and EP 4, via calcium – and cyclic adenosine 5’ ‑ monophosphate ‑ mediated signaling pathways. J Immunol 2004; 173 : 5952 – 5962.
11. Gerlo S, Verdood P, Hooghe ‑ Peters EL et al. Modulation of prolactin expression in human T lymphocytes by cytokines. J Neuroimmunol 2005; 162 : 190 – 193.
12. Villalobos C, Faught WJ, Frawley LS. Dynamic changes in spontaneous intracellular free calcium oscillations and their relationship to prolactin gene expression in single, primary mammotropes. Mol Endocrinol 1998; 12 : 87 – 95.
13. Ben ‑ Jonathan N, Hnasko R. Dopamine as a prolactin (PRL) inhibitor. Endocr Rev 2001; 22 : 724 – 763.
14. Matera L, Galetto A, Mori M. Effect of prolactin on the antigen presenting function of monocyte ‑ derived dendritic cells. Lupus 2001; 10 : 728 – 734.
15. Goffin V, Bernichtein S, Touraine P et al. Development and potential clinical uses of human prolactin receptor antagonists. Endocr Rev 2005; 26 : 400 – 422.
16. Harvey PW, Everest DJ, Springall CJ. Adverse effects of prolactin in rodents and humans: breast and prostate cancer. J Psychopharmacol 2008; 22 (Suppl 2): 20 – 27.
17. Kokay IC, Bull PM, Davis RL et al. Expression of the long form of the prolactin receptor in magnocellular oxytocin neurons is associated with specific prolactin regulation of oxytocin neurons. Am J Physiol Regul Integr Comp Physiol 2006; 290: R1216 – R1225.
18. Clevenger CV, Furth PA, Hankinson SE et al. The role of prolactin in mammary carcinoma. Endocr Rev 2003; 24 : 1 – 27.
19. Clevenger CV, Kline JB. Prolactin receptor signal transduction. Lupus 2001; 10 : 706 – 718.
20. Neilson LM, Zhu J, Xie J et al. Coactivation of Jak1 positively modulates prolactin‑Jak2 signaling in breast cancer: recruitment of ERK and Stat3 and enhancement of Akt and Stat5a/ b pathways. Mol Endocrinol 2007; 21 : 2218 – 2232.
21. Hügl SR, Merger M. Prolactin stimulates proliferation of the glucose‑dependent beta‑cell line INS ‑ 1 via different IRS ‑ proteins. J Pancreas (Online) 2007; 8 : 739 – 752.
22. Tripathi A, Sodhi A. Production of nitric oxide by murine peritoneal macrophages in vitro on treatment with prolactin and growth hormone: involvement of protein tyrosine kinases, Ca++, and MAP kinase signal transduction pathways. Mol Immunol 2007; 44 : 3185 – 3194.
23. Swaminathan G, Varghese B, Thangavel C et al. Prolactin stimulates ubiquitination, initial internalization, and degradation of its receptor via catalytic activation of Janus kinase 2. J Endocrinol 2008; 196: R1 – R7.
24. Rycyzyn MA, Clevenger CV. The intranuclear prolactin/ cyclophilin B complex as a transcriptional inducer. Proc Natl Acad Sci USA 2002; 99 : 6790 – 6795.
25. Dogusan Z, Hooghe R, Verdood P et al. Cytokine‑like effects of prolactin in human mononuclear and polymorphonuclear leukocytes. J Neuroimmunol 2001; 120 : 58 – 66.
26. Tripathi A, Sodhi A. Prolactin‑induced production of cytokines in macrophages in vitro involves JAK/ STAT and JNK MAPK pathways. Int Immunol 2008; 20 : 327 – 336.
27. Bishop JD, Nien WL, Dauphinee SM et al. Prolactin activates mammalian target ‑ of ‑ rapamycin through phosphatidylinositol 3 - kinase and stimulates phosphorylation of p70S6K and 4E‑binding protein‑1 in lymphoma cells. J Endocrinol 2006; 190 : 307 – 312.
28. Grimley PM, Dong F, Rui H. Stat5a and Stat5b: fraternal twins of signal transduction and transcriptional activation. Cytokine Growth Factor Rev 1999; 10 : 131 – 157.
29. Dogusan Z, Book ML, Verdood P et al. Prolactin activates interferon regulatory factor ‑ 1 expression in normal lympho ‑ hemopoietic cells. Eur Cytokine Netw 2000; 11 : 435 – 442.
30. Martens N, Uzan G, Wery M et al. Suppressor of cytokine signaling 7 inhibits prolactin, growth hormone, and leptin signaling by interacting with STAT5 or STAT3 and attenuating their nuclear translocation. J Biol Chem 2005; 280 : 13817 – 13823.
31. Domínguez ‑ Cáceres MA, García ‑ Martínez JM, Calcabrini A et al. Prolactin induces c ‑ Myc expression and cell survival through activation of Src/ Akt pathway in lymphoid cells. Oncogene 2004; 23 : 7378 – 7390.
32. Peeva E, Michael D, Cleary J et al. Prolactin modulates the naive B cell repertoire. J Clin Invest 2003; 111 : 275 – 283.
33. Larrea F, Martínez ‑ Castillo A, Cabrera V et al. A bioactive 60 - kilodalton prolactin species is preferentially secreted in cultures of mitogen ‑ stimulated and nonstimulated peripheral blood mononuclear cells from subjects with systemic lupus erythematosus. J Clin Endocrinol Metab 1997; 82 : 3664 – 3669.
34. Krishnan N, Thellin O, Buckley DJ et al. Prolactin suppresses glucocorticoid‑induced thymocyte apoptosis in vivo. Endocrinology 2003; 144 : 2102 – 2110.
35. Gingras MC, Margolin JF. Differential expression of multiple unexpected genes during U937cell and macrophage differentiation detected by suppressive subtractive hybridization. Exp Hematol 2000; 28 : 65 – 76.
36. Wu H, Devi R, Malarkey WB. Expression and localization of prolactin messenger ribonucleic acid in the human immune system. Endocrinology 1996; 137 : 349 – 353.
37. Gagnerault MC, Touraine P, Savino W et al. Expression of prolactin receptors in murine lymphoid cells in normal and autoimmune situations. J Immunol 1993; 150 : 5673 – 5681.
38. Carreño PC, Sacedón R, Jiménez E et al. Prolactin affects both survival and differentiation of T ‑ cell progenitors. J Neuroimmunol 2005; 160 : 135 – 145.
39. Matera L, Mori M, Geuna M et al. Prolactin in autoimmunity and antitumor defence. J Neuroimmunol 2000; 109 : 47 – 55.
40. Chavez ‑ Rueda K, Hérnández J, Zenteno E et al. Identification of prolactin as a novel immunomodulator on the expression of co ‑ stimulatory molecules and cytokine secretions on T and B human lymphocytes. Clin Immunol 2005; 116 : 182 – 191.
41. Matalka KZ. Prolactin enhances production of interferon ‑ γ, interleukin‑12, and interleukin‑10, but not of tumor necrosis factor ‑ a in a stimulus ‑ specific manner. Cytokine 2003; 21 : 187 – 194.
42. Majumder B, Biswas R, Chattopadhyay U. Prolactin regulates antitumor immune response through induction of tumoricidal macrophages and release of IL‑12. Int J Cancer 2002; 97 : 493 – 500.
43. Dimitrov S, Lange T, Fehm HL et al. A regulatory role of prolactin, growth hormone, and corticosteroids for human T ‑ cell production of cytokines. Brain Behav Immun 2004; 18 : 368 – 374.
44. Takizawa K, Kitani S, Takeuchi F et al. Enhanced expression of CD69 and CD25 antigen on human peripheral blood mononuclear cells by prolactin. Endocr J 2005; 52 : 635 – 641.
45. Lahat N, Miller A, Shtiller R et al. Differential effects of prolactin upon activation and differentiation of human B lymphocytes. J Neuroimmunol 1993; 47 : 35 – 40.
46. Mukherjee A, Helbert M, Ryder WDJ et al. Failure of antibody response to polysaccharide antigen in treated panhypopituitary adults. Clin Exp Immunol 2009; 156 : 271 – 277.
47. Nagy E, Berczi I. Pituitary dependence of bone marrow function. Br J Haematol 1989; 71 : 457 – 462.
48. Dorshkind K, Horseman ND. The roles of prolactin, growth hormone, insulin‑like growth factor ‑ I, and thyroid hormones in lymphocyte development and function: insights from genetic models of hormone and hormone receptor deficiency. Endocr Rev 2000; 21 : 292 – 312.
49. Moriggl R, Topham DJ, Teglund S et al. Stat5 is required for IL‑2‑induced cell cycle progression of peripheral T cells. Immunity 1999; 10 : 249 – 259.
50. Zellweger R, Wichmann MW, Ayala A et al. Prolactin: a novel and safe immunomodulating hormone for the treatment of immunodepression following severe hemorrhage. J Surg Res 1996; 63 : 53 – 58.
51. Fomicheva EE, Nemirovich ‑ Danchenko EA, Korneva EA. Immunoprotective effects of prolactin during stress‑induced immune dysfunction. Bull Exp Biol Med 2004; 137 : 544 – 547.
52. Dimitrov S, Benedict C, Heutling D et al. Cortisol and epinephrine control opposing circadian rhythms in T cell subsets. Blood 2009; 113 : 5134 – 5143.
53. Buttgereit F, Saag KG, Cutolo M et al. The molecular basis for the effectiveness, toxicity, and resistance to glucocorticoids: focus on the treatment of rheumatoid arthritis. Scand J Rheumatol 2005; 34 : 14 – 21.
54. Reiche AM, Nunes SO, Morimoto HK. Stress, depression, the immune system, and cancer. Lancet Oncol 2004; 5 : 617 – 625.
55. Dostál C, Marek J, Moszkorzová L et al. Effects of stress on serum prolactin levels in patients with systemic lupus erythematosus. Ann NY Acad Sci 2002; 966 : 247 – 251.
56. Gauna C, van den Berghe GH, van der Lely AJ. Pituitary function during severe and life ‑ threatening illnesses. Pituitary 2005; 8 : 213 – 217.
57. Felmet KA, Hall MW, Clark RS et al. Prolonged lymphopenia, lymphoid depletion, and hypoprolactinemia in children with nosocomial sepsis and multiple organ failure. J Immunol 2005; 174 : 3765 – 3772.
58. Matalka KZ, Ali DA. Stress‑induced versus preovulatory and pregnancy hormonal levels in modulating cytokine production following whole blood stimulation. Neuroimmunomodulation 2005; 12 : 366 – 374.
59. Matsutani T, Samy TS, Rue LW 3rd et al. Transgenic prolactin – / – mice: effect of trauma ‑ hemorrhage on splenocyte functions. Am J Physiol Cell Physiol 2005; 288: C1109 – C1116.
60. Mancini T, Casanueva FF, Giustina A. Hyperprolactinemia and prolactinomas. Endocrinol Metab Clin North Am 2008; 37 : 67 – 99.
61. Batrinos ML, Panitsa ‑ Faflia C, Tsiganou E et al. Incidence and characteristics of microprolactinomas (3 – 5mm) in 4199 women assayed for prolactin. Horm Metab Res 1992; 24 : 384 – 91.
62. Elenkov IJ, Wilder RL, Bakalov VK et al. IL‑12, TNF‑α, and hormonal changes during late pregnancy and early postpartum: implications for autoimmune disease activity during these times. J Clin Endocrinol Metab 2001; 86 : 4933 – 4938.
63. Buskila D, Berezin M, Gur H et al. Autoantibody profile in the sera of women with hyperprolactinemia. J Autoimmun 1995; 8 : 415 – 424.
64. Li M, Keiser HD, Peeva E. Prolactinoma and systemic lupus erythematosus: do serum prolactin level matter? Clin Rheumatol 2006; 11 : 1 – 4.
65. Sánches Regaña M, Umbert Millet P. Psoriasis in association with prolactinoma: three cases. Br J Dermatol 2000; 143 : 864 – 867.
66. Erb N, Pace AV, Delamere JP et al. Control of unremitting rheumatoid arthritis by the prolactin antagonist cabergoline. Rheumatology 2001; 40 : 237 – 239.
67. Kira J, Harada M, Yamaguchi Y et al. Hyperprolactinemia in multiple sclerosis. J Neurol Sci 1991; 102 : 61 – 66.
68. Yamasaki K, Horiuchi I, Minohara M et al. Hyperprolactinemia in optico ‑ spinal multiple sclerosis. Intern Med 2000; 39 : 296 – 299.
69. Harirchian MH, Sahraian MA, Shirani A. Serum prolactin level in patients with multiple sclerosis: a case control study. Med Sci Monit 2006; 12: CR177 – CR180.
70. Then Bergh F, Kümpfel T, Schumann Eet al. Monthly intravenous methylprednisolone in relapsing ‑ remitting multiple sclerosis – reduction of enhancing lesions, T2 lesion volume and plasma prolactin concentrations. BMC Neurol 2006; 6 : 19.
71. Poyraz BC, Aksoy C, Balcioğlu I. Increased incidence of autoimmune thyroiditis in patients with antipsychotic‑induced hyperprolactinemia. Eur Neropsychopharmacol 2008; 18 : 667 – 672.
72. Legakis I, Petroyianni V, Saramantis A et al. Elevated prolactin to cortisol ratio and polyclonal autoimmune activation in Hashimoto’s thyroiditis. Horm Metab Res 2001; 33 : 585 – 589.
73. Kapur G, Patwari AK, Narayan S et al. Serum prolactin in celiac disease. J Trop Pediatr 2004; 50 : 37 – 40.
74. Pynnönen PA, Isometsä ET, Verkasalo MA et al. Gluten‑free diet may alleviate depressive and behavioural symptoms in adolescents with celiac disease: a prospective follow‑up case ‑ series study. BMC Psychiatry 2005; 5 : 14.
75. Kanda N, Shibata S, Tada Y et al. Prolactin enhances basal and IL‑17 induced CCL20 production by human keratinocytes. Eur J Immunol 2009; 39 : 996 – 1006.
76. Kanda N, Watanabe S. Prolactin enhances interferon ‑ g‑induced production of CXC ligand 9 (CXCL9), CXCL10, and CXCL11 in human keratinocytes. Endocrinology 2007; 148 : 2317 – 2325.
77. Hawkins TA, Gala RR, Dunbar JC. Prolactin modulates the incidence of diabetes in male and female NOD mice. Autoimmunity 1994; 18 : 155–162.
78. Holstad M, Sandler S. Prolactin protects against diabetes induced by multiple low doses of streptozocin in mice. J Endocrinol 1999; 163 : 229–234.
79. Lau J, Börjesson A, Holstad M et al. Prolactin regulation of the expression of TNF‑α, IFN‑γ and IL‑10 by splenocytes in murine multiple low dose streptozotocin diabetes. Immunol Lett 2006; 102 : 25–30.
80. Labriola L, Montor WR, Krogh K et al. Beneficial effects of prolactin and laminin on primary cultures on human pancreatic islets ‑ cell cultures. Mol Cell Endocrinol 2007; 263 : 120–133.
81. Lavalle C, Loyo E, Paniagua R et al. Correlation study between prolactin and androgens in male patients with systemic lupus erythematosus. J Rheumatol 1987; 14 : 268–272.
82. McMurray RW. Prolactin in murine systemic lupus erythematosus. Lupus 2001; 10 : 742–747.
83. Cohen‑Solal JF, Jeganathan V, Hill L et al. Hormonal regulation of B‑cell function and systemic lupus erythematosus. Lupus 2008; 17 : 528–532.
84. Saha S, Gonzalez J, Rosenfeld G et al. Prolactin alters the mechanism of B cell tolerance induction. Arthritis Rheum 2009; 60 : 1743–1752.
85. Peeva E, Grimaldi C, Spatz L et al. Bromocriptine restores tolerance in estrogen‑treated mice. J Clin Invest 2000; 106 : 1373–1379.
86. Peeva E, Gonzales J, Hicks R et al. Cutting edge: lupus susceptibility interval Sle3/ 5 confers responsiveness to prolactin in C57BL/6 mice. J Immunol 2006; 177 : 1401–1405.
87. Jacobi AM, Rohde W, Volk HD et al. Prolactin enhances the in vitro production of IgG in peripheral blood mononuclear cells from patients with systemic lupus erythematosus but not from healthy controls. Ann Rheum Dis 2001; 60 : 242 – 247.
88. Chavez ‑ Rueda K, Legorreta‑Haquet VM, Cervera ‑ Castillo H et al. Effect of prolactin on lymphocyte activation from systemic lupus erythematosus patients. Ann NY Acad Sci 2007; 1108 : 157–165.
89. McMurray RW, May W. Sex hormones and systemic lupus erythematosus: Review and meta‑analysis. Arthritis Rheum 2003; 48 : 2100 – 2110.
90. Leaños ‑ Miranda A, Cárdenas ‑ Mondragón G. Serum free prolactin concentrations in patients with systemic lupus erythematosus are associated with lupus activity. Rheumatology 2006; 45 : 97–101.
91. Cárdenas ‑ Mondragón G, Ulloa ‑ Aguirre A, Isordia‑Salas I et al. Elevated serum bioactive prolactin concentrations in patients with systemic lupus erythematosus are associated with disease activity as disclosed by homologous receptor bioassays. J Rheumatol 2007; 34 : 1514–1521.
92. Vera ‑ Lastra O, Mendez C, Jara LJ et al. Correlation of prolactin serum concentrations with clinical activity and remission in patients with systemic lupus erythematosus. Effect of conventional treatment. J Rheumatol 2003; 30 : 2140 – 2146.
93. Leaños ‑ Miranda A, Chávez ‑ Rueda KA, Blanco ‑ Favela F. Biologic activity and plasma clearance of prolactin‑IgG complex in patients with systemic lupus erythematosus. Arthritis Rheum 2001; 44 : 866 – 875.
94. Dai L, Wu Y, Zheng DH et al. Cerebrospinal fluid and serum prolactin in systemic lupus erythematosus with and without central nervous system involvement. APLAR J Rheumatol 2007; 10 : 37 – 42.
95. Jara LJ, Irigoyen L, Ortiz MJ et al. Prolactin and interleukin‑6 in neuropsychiatric lupus erythematosus. Clin Rheumatol 1998; 17 : 110 – 114.
96. Fojtíková M, Černá M, Čejková P et al. Extrapituitary prolactin promoter polymorphism in Czech patients with systemic lupus erythematosus and rheumatoid arthritis. Ann Rheum Dis 2007; 66 : 706 – 707.
97. McMurray RW, Weidensaul D, Allen SH et al. Efficacy of bromocriptine in an open label therapeutic trial for systemic lupus erythematosus. J Rheumatol 1995; 22 : 2084 – 2091.
98. Hrycek A, Cieslik P, Tustanowski J et al. Selected serum cytokines in systemic lupus erythematosus treated with quinagolide. Lupus 2001; 10 : 424 – 430.
99. Alvarez ‑ Nemegyei J, Cobarrubias ‑ Cobos A, Escalante ‑ Triay F et al. Bromocriptine in systemic lupus erythematosus: a double‑blind, randomized, placebo ‑ controlled study. Lupus 1998; 7 : 414 – 419.
100. Walker SE. Bromocriptine treatment of systemic lupus erythematosus. Lupus 2001; 10 : 762 – 768.
101. Ruiz ‑ Irastorza G, Khamashta MA. Lupus and pregnancy: ten questions and some answers. Lupus 2008; 17 : 416 – 420.
102. Jara LJ, Pacheco ‑ Reyes H, Medina G et al. Prolactin levels are associated with lupus activity, lupus anticoagulant, and poor outcome in pregnancy. Ann NY Acad Sci 2007; 1108 : 218 – 226.
103. Jara LJ, Cruz ‑ Cruz P, Saavedra MA et al. Bromocriptine during pregnancy in systemic lupus erythematosus: a pilot clinical trial. Ann NY Acad Sci 2007; 1110 : 297 – 304.
104. Neidhart M, Flückiger EW. Hyperprolactinaemia in hypophysectomized or intact male rats and the development of adjuvant arthritis. Immunology 1992; 77 : 449 – 455.
105. Jurčovičová J, Stančíková M, Švík K et al. Stress of chronic food restriction attenuates the development of adjuvant arthritis in male Long Evans rats. Clin Exp Rheumatol 2001; 19 : 371 – 376.
106. Ratkay LG, Weinberg J, Waterfield JD. The effect of lactation in the post‑partum arthritis of MRL ‑ lpr/ fasmice. Rheumatology 2000; 39 : 646 – 651.
107. Rovensky J, Bakosova J, Payer J et al. Increased demand for steroid therapy in hyperprolactinemic patients with rheumatoid arthritis. Int J Tissue React 2001; 23 : 145 – 149.
108. Mateo L, Nolla JM, Bonnion MR et al. High serum prolactin levels in men with rheumatoid arthritis. J Rheumatol 1998; 25 : 2077 – 2082.
109. Chuang E, Molitch ME. Prolactin and autoimmune diseases in humans. Acta Biomed 2007; 78 (Suppl 1): 255 – 261.
110. Macejová Z, Trejbal D, Oetterová M et al. Prolaktín ‑ marker aktivity systémových ochorení spojiva? Vnitř Lék 2008; 54 : 1039 – 1044.
111. Mirone L, Barini A. Androgen and prolactin (Prl) levels in systemic sclerosis (SSc): relationship to disease severity. Ann NY Acad Sci 2006; 1069 : 257 – 262.
112. Czuwara‑Ladykowska J, Sicinska J, Olszewska M et al. Prolactin synthesis by lymphocytes from patients with systemic sclerosis. Biomed Pharmacother 2006; 60 : 152 – 155.
113. Fojtíková M, Cejková P, Bečvář R et al. Polymorphism of the extrapituitary prolactin promoter and systemic sclerosis. Rheumatol Int 2009. Epub ahead of print.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2010 Issue 5-
All articles in this issue
- Perorální hormonální antikoncepce a riziko vzniku žilního tromboembolizmu
- Evaluation of cardiovascular high risk population in Specialists Ambulance: ESA
- Prevalence anémie a vliv na hospitalizační mortalitu pacientů přijatých pro akutní srdeční selhání
- Vývoj autonomních parametrů u pacientů po infarktu myokardu s ST elevacemi
- Familiární hyperkalcemie a hypofosfatemie a jejich význam v diferenciální diagnostice poruch kalcium‑ fosfátového metabolizmu
- Souborný pohled na efekt hormonu a cytokinu prolaktinu v rozvoji a patogenezi autoimunitních onemocnění
- Syndróm polycystických ovárií a autoimunitné ochorenia
- Srdce nemocného s diabetem 1. typu
- Rozdiely medzi pohlaviami v nefarmakologickej liečbe chronického srdcového zlyhávania
- Doporučení ILCOR pro označení automatizovaných externích defibrilátorů (AED)
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Familiární hyperkalcemie a hypofosfatemie a jejich význam v diferenciální diagnostice poruch kalcium‑ fosfátového metabolizmu
- Souborný pohled na efekt hormonu a cytokinu prolaktinu v rozvoji a patogenezi autoimunitních onemocnění
- Syndróm polycystických ovárií a autoimunitné ochorenia
- Perorální hormonální antikoncepce a riziko vzniku žilního tromboembolizmu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

