-
Medical journals
- Career
Difuzní plošná normolipemická xantomatóza a nekrobiotický xantogranulom, asociované s monoklonální gamapatií – přínos PET ‑ CT pro stanovení rozsahu nemoci a zkušenosti s léčbou. Popis dvou případů a přehled literatury
Authors: Z. Adam 1; L. Zahradová 1; M. Krejčí 1; L. Pour 1; R. Koukalová 2; Z. Řehák 2; J. Feit 3; L. Křen 3; M. Mechl 4; V. Vašků 5; A. Sirotková 6; R. Hájek 1; J. Mayer 1
Authors‘ workplace: Interní hematologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Jiří Vorlíček, CSc. 2 Oddělení PET CT Masarykova onkologického ústavu Brno, přednosta prim. MU Dr. Karol Bolčák, Ph. D. 3 Ústav patologie Lékařské fak 1
Published in: Vnitř Lék 2010; 56(11): 1158-1168
Category: Case Reports
Overview
Monoklonální gamapatie se může projevit více typy kožního postižení. Jedním z nich je plochý normolipemický xantom anebo nekrobiotický xantogranulom. V našem sdělení popisujeme dva pacienty s těmito kožními projevy. První z nich má rozsáhlá kožní ložiska plochých xantomů, monoklonální gamapatii s > 10% infiltrací kostní dřeně klonálními plazmocyty a nejasnou lymfadenopatií v oblasti retroperitonea dle PET ‑ CT. Velikost této lymfadenopatie (histologicky bez maligní infiltrace a bez prokázané infekční etiologie) se v průběhu 4 let sledování zásadně nemění. Při opakovaných PET ‑ CT kontrolách klesala hodnota SUV ze 7,5 na 3,8 v této infiltraci. Čtyři cykly léčby kombinací bortezomibu, cyklofosfamidu a dexametazonu nevedly k poklesu monoklonálního imunoglobulinu ani ke změnám kožních morf. Domníváme se, že abdominální lymfadenopatie souvisí s xantomatózou, ale souvislost se nepodařilo exaktně prokázat. Druhého pacienta sledujeme již přes 10 let, zpočátku jako MGUS, později jako asymptomatický mnohočetný myelom. V posledním roce se začaly objevovat ojediněle na horní končetině a četněji na dolní končetině bolestivé infiltráty v podkoží a v kůži. Tyto infiltráty jsou zřetelné při pohmatu. Excelentně byly infiltráty znázorněny PET ‑ CT zobrazením, na němž hlava, hrudník i břicho bylo bez patologického nálezu, skelet také bez osteolytických ložisek. Na dolních končetinách v kůži a v podkoží, zejména na obou bércích, byly při CT zobrazení dobře zřetelné četné infiltráty, zasahující až do hloubky 2 cm. Největší infiltrát byl v distální části pravého bérce dorzálně o velikosti 3,5 × 2 × 10 cm. Při PET snímání v oblasti dolních končetin byla zřetelná patologická kumulace ve všech výše popsaných infiltrátech, v dolní části pravého bérce dosáhla kumulace glukózy 10,0 SUV. Při CT zobrazení dolních končetin je podkoží prosáklé se zvýšenou denzitou i v místech, kde není zvýšená kumulace 18fluoroglukózy. Po ozáření 40 Gy se zmenšila velikost infiltrátů v ozářené oblasti a vymizela jejich bolestivost. Závěr: PET ‑ CT zobrazení informuje o mimokožních projevech plochých normolipemických xantomů a excelentně zobrazilo postižení kůže a podkoží nekrobiotickým xantogranulomem. Chemoterapie cyklofosfamid, bortezomib a dexametazon nevedla ani k poklesu koncentrace monoklonálního imuglobulinu, ani ke zmenšení plošných normolipemických xantomů. Radioterapie cílená na velká ložisko xantogranulomu vedla k parciální regresi a vymizení bolestivosti infiltrátu.
Klíčová slova:
monoklonální gamapatie – mnohočetný myelom – normolipemické xantomy – nekrobiotický xantogranulom – bortezomib – dexametazon – cyklofosfamid – PET ‑ CT vyšetřeníÚvod
Xantom je označení pro žlutou či oranžovožlutavou plochu, mírně vyvýšenou nad povrch s ostrou hranicí oproti nepoškozené pokožce. Xantomy postihují nejčastěji oblasti očních víček, ale také flexorové části končetin a trup. Mohou být průvodním znakem hyperlipoproteinemie, ale existují také normolipemické formy.
Xantogranulom je označení pro žlutou či žlutooranžovou tkáň, která tvoří uzlíky (granulomy) a může výjimečně i ulcerovat (nekrobiotický xantogranulom).
V histologickém obraze plochých xantomů dominují makrofágy naplněné tukovými částicemi. V histologickém obraze xantogranulomu jsou mimo pěnitých histiocytů s tukovými inkluzemi přítomny také zánětlivé buňky, lymfocyty, plazmocyty, makrofágy a obrovské Toutonovy buňky.
V rámci skupiny xantomatózních a xantogranulomatózních nemocí se v literatuře nejčastěji uvádějí následující jednotky:
- nekrobiotický xantogranulom asociovaný s monoklonální gamapatií,
- normolipemická xantomatóza asociovaná s monoklonální gamapatií,
- periokulární xantogranulom dospělých bez vazby na monoklonální imunoglobulin,
- juvenilní xantogranulom, který postihuje pouze mladé jedince, ale výjimečně i dospělé; tato nemoc má jak kožní, tak i mimokožní projevy,
- Erheimova - Chesterova nemoc, postihující dospělé osoby,
- xanthoma disseminatum.
Tyto nemoci mají podobné histologické složení. Rozdíly v uvedených jednotkách jsou spíše ve formě klinické prezentace než v morfologii. Možná proto se tyto názvy neodrazily ve WHO klasifikaci krevních (s tedy i histiocytárních) nemocí, která uvádí pouze jednotku diseminovaný juvenilní xantogranulom a pod tento termín shrnuje jako synonyma další jednotky, které mají podobný morfologický vzhled, obsahují pěnité histiocyty s tukovými inkluzemi, ačkoliv jejich klinické formy se liší. V některých případech byla prokazatelná klonalita histiocytů, v jiných ne [1,2].
Oproti této sjednocující nomenklatuře WHO klasifikace krevních nemocí je terminologie dermatologické odborné literatury velmi divergentní (xantogranulom, eruptivní xantogranulom, nekrobiotický xantogranulom, xanthoma disseminatum, papularní xantom, generalizovaný eruptivní histiocytom, progresivní nodulární histiocytom). Jejich diferenciální diagnostiku popisují četní autoři [3,4,6]. Následující text přináší popis 2 případů a přehled publikované literatury o léčbě těchto nemocí.
Kazuistiky
Pacient s plochými normolipemickými xantomy asociovanými s monoklonální gamapatií
Muž, narozený v roce 1951, přišel poprvé v roce 2006 na vyšetření k lékaři pro difuzní plošnou normolipemickou xantomatózu. Žluté vystupující plochy postihovaly víčka, krk, flexorové části končetin, literární stěnu trupu. Lipidy, cholesterol i triglyceridy byly zcela v mezích fyziologických hodnot.
Z ložiska xantomu byla odebrána histologie. Vzorek byl v roce 2006 hodnocen na 2 pracovištích s následujícím výsledkem: část kůže s normálně utvářenou epidermis, v dermis jsou mezi kolagenními pentlicemi a především perivaskulárně lokalizované pěnité histiocytární elementy s PAS negativním materiálem. Perivaskulárně jsou pěnité buňky provázené lymfocytárním infiltrátem. Histologický nález odpovídá plochému xantomu.
Pro nález monoklonální gamapatie byl tento muž předán na hematologické pracoviště k diferenciálně diagnostickému vyšetření monoklonální gamapatie.
Koncentrace monoklonálního imunoglobulinu typu IgG κ v roce 2006 byla 11,2 g/ l. V moči byly prokázány volné řetězce κ ve velmi nízké koncentraci do 0,04 g/ l. β2 - mikroglobulin byl nízký, 1,48 mg/ l. Při histologickém hodnocení válečku kostní dřeně (trepanobiopsie) bylo zjištěno jen mírné zvýšení počtu plazmocytů na 5 – 9 % všech jaderných elementů. Dle barvení λ a κ řetězců v plazmocytech se jednalo o klonální plazmocelulární populaci.
V rámci standardního postupu při diferenciálně diagnostickém vyšetření monoklonální gamapatie bylo provedeno RTG vyšetření skeletu, které neprokázalo osteolytická ložiska a vyšetření kostní denzity – bez průkazu osteoporózy.
Proto bylo provedeno PET-CT vyšetření s nálezem zvýšené akumulace radioaktivní glukózy ve 4 lymfatických uzlinách parakaválně. Jejich velikost byla stanovena na 23 mm.
Klasické sérologické vyšetření neprokázalo žádnou infekci, nebyla prokázána ani sarkoidóza. Pro podezření na maligní lymfom byla v prosinci roku 2006 provedena probatorní laparotomie a odběr uzlin na histologii. V morfologickém obraze nebyla prokázána malignita. Folikulární struktura lymfatické uzliny byla zachována, ale převážně v interfolikulárních prostorech a na obvodu folikulů byly přítomny četné nevelké nekazeifikující granulomy z epiteloidních buněk. Plazmatické buňky byly přítomny v obvyklé lokalizaci a kvantitě a byly polyklonální. Speciální barvení na acidorezistentní tyčinky, plísně i bakterie bylo negativní. Uzlina byla bez známek primární či sekundární malignity, bez známek plazmocelulární dyskrasie či lymfomu, ale i bez známek zánětu.
Po roce (31. 10. 2007) bylo provedeno kontrolní PET-CT vyšetření. Opět byla nalezena zvýšená aktivita v několika na sebe navazujících uzlinách v oblasti retroperitonea ve výši L2, L3. Jejich průměr byl 18 mm. Navíc ve srovnání s minulým vyšetřením byla vyšší aktivita v jedné uzlině mediastina.
Kontrolní PET-CT vyšetření (27. 9. 2008) popsalo v úrovni hilu pravé ledviny několik splývavých zvětšených uzlin o celkové velikosti 4 × 2 × 2,9 cm. Hodnota akumulace radioaktivní 18fluorodexyglukózy byla 7,5 SUV. Uzlina v mediastinu byla jen mírně aktivní, hodnota SUV 2,6.
Na dalším kontrolním PET-CT vyšetření (3. 4. 2009) se zobrazil přetrvávající paket uzlin v dutině břišní zvýšeně kumulující radioaktivní glukózu (SUV 3,82). V mediastinu bez nálezu zvýšené kumulace glukózy.
Tři roky od zjištění monoklonální gamapatie jsme měli tedy stále patologicky zvětšené uzliny v dutině břišní, přičemž nedocházelo ani k jejich regresi, ani k progresi. Tyto uzliny stále zvýšeně kumulovaly radioaktivní 18fluorodexyglukózy.
Zvažovali jsme proto i Erdheimovu-Chesterovu nemoc s přítomným infiltrátem v retroperitoneálních uzlinách.
Při posledním PET-CT bylo vyšetření provedeno v rozsahu od horní poloviny stehen proximálně, nebyly snímány dlouhé kosti končetin, na nichž jsou obvykle nacházeny typické změny pro Erdheimovu-Chesterovu nemoc. Proto jsme přistoupili k vyšetření magnetickou rezonancí, neboť tato metoda umí také odhalovat změny kostní dřeně související s Erheimovou-Chesterovou nemocí, jak jsou popsány ve Vnitřním lékařství [21].
Celotělové MR vyšetření však přineslo necharakteristický nález v kostní dřeni dolních končetin. V kostní dřeni obou tibií jsou neostře ohraničená ložiska, která nemají charakter lytických ložisek myelomu, i když mají stejné signálové charakteristiky (nízký signál v T1 a vysoký signál v T2), obdobný nález je v obou femurech, kostech pánevních a kosti křížové. V oblasti páteře je kromě horizontálního sakra nález normální.
Vzhledem k progresivně se zvětšujícím plochám xantomů, které nemocného trápily stálým svěděním, jsme březnu roku 2009 provedli další trepanobiopsii. V ní již bylo popsáno 10 % plazmocytů exprimujících lehké řetězce κ, čili 10 % klonálních plazmocytů. Oproti první trepanobiopsii tedy mírné navýšení počtu plazmocytů.
Koncentrace monoklonálního IgG κ byla 11,7 g/ l, koncentrace celkového IgG byla 16,07 g/ l, IgM 0,64 g/ l a IgA 1,39 g/ l.
Klonální plazmocelulární proliferace v kostní dřeni a laboratorní nálezy splnily kritéria mnohočetného myelomu dle Myeloma Working Group z roku 2003. Nález na skeletu při MR vyšetření a popisovaná kauzální souvislost plošného xantomu i nekrobiotického xantogranulomu s monoklonální gamapatií pak lze interpretovat jako plazmocelulární proliferace (symptomatický mnohočetný myelom) s poškozením těla formou kožních xantomových depozit. Stav kožního postižení ukazují obr. 1 – 6.
Obr. 1–6. Kožní povrch s plochými ložisky normolipemických xantomů, které mají žlutooranžovou barvu a poměrně ostré ohraničení od nepostižení kůže. 
Pro léčbu jsem zvolili kombinaci CVD (cyklofosfamid 50 mg denně, bortezomib – Velcade 1,3 mg/ m2 i.v. 1., 4., 8. a 15. den a dexamezon 40 mg 1. – 4. a dále 15. – 18. den cyklu, který se opakoval v 28denních intervalech). Pacient absolvoval celkem 4 cykly této chemoterapie.
Kontrolní vyšetření po 4 cyklech chemoterapie však neprokázalo žádnou léčebnou odpověď. Koncentrace monoklonálního imunoglobulinu byla před zahájením léčby 9,4 g/ l, po ukončení léčby byla 8,1 g/ l. Krevní obraz byl před zahájením léčby i po jejím ukončení ve fyziologickém rozmezí.
Kožní projevy se také nijak nezměnily. Uvedená léčba neovlivnila ani plazmocelulární proliferaci a jí produkovaný monoklonální imunoglobulin, ani xantomy. Kontrolní PET-CT vyšetření po uvedené léčbě prokázalo dle low dose CT přetrvávání patologické lymfadenopatie v dutině břišní, došlo však ke zmenšení uzlinové infiltrace na velikost 21 × 16 mm a akumulace 18fluorodeoxyglukózy se zmenšila na SUV 3,82.
Léčba kombinací cyklofosfamidu, dexametazonu a bortezomibu byla v tomto případě po 4 cyklech bez léčebného efektu, ale také bez jakéhokoliv projevu toxicity. Parametry, dle nichž hodnotíme účinnost léčby, uvádíme v tab. 1.
Table 1. Parametry monoklonální gamapatie v době stanovení diagnózy, před léčbou a po léčbě. 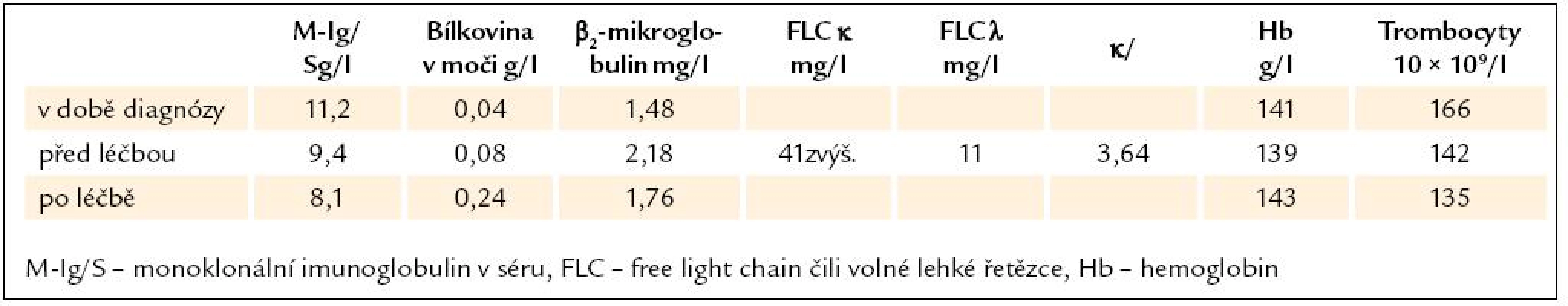
Vzhledem k neúspěchu této léčby jsme od další léčby ustoupili a pacienta budeme jenom sledovat. Od chemoterapie jsme očekávali vymizení monoklonálního imunoglobulinu a s tím – při popisované kauzální souvislosti gamapatie a xantomů – také pomalé mizení xantomů. Toho se však nepodařilo docílit. Jinou agresivnější léčbu bychom podali jedině při jednoznačných známkách další klinicky signifikantní progresi onemocnění.
Příčina mezenteriální lymfadenopatie, která trvá nejméně 3 roky bez progrese či regrese, je zatím neobjasněná, možné vysvětlení uvádíme v diskuzi.
Popis pacienta s nekrobiotickým xantogranulomem v oblasti bérců
Pacient je u nás sledován od roku 1999 pro monoklonální gamapatii IgG κ. Po standardních vyšetřeních byla v roce 1999 diagnóza uzavřena jako monoklonální gamapatie nejistého významu (MGUS), bez průkazu myelomu či jiné lymfoproliferace. Koncentrace monoklonálního IgG κ byla v roce 1999 jen 12,6 g/ l, koncentrace polyklonálních imunoglobulinů byla v mezích normy.
Tento muž byl 10 let kontrolován pro monoklonální gamapatii na našem pracovišti, koncentrace monoklonálního Ig se zvýšila, hodnoty se pohybovaly mezi 16 a 26 g/ l. V březnu roku 2008 se nemocnému objevil nebolestivý nádorek na levém předloktí. Byla provedena excize ložiska, výsledek histologického vyšetření zněl: kožní excize s granulomatózními změnami nejasné etiologie, v diferenciální diagnóze necrobiosis lipoidica, nelze vyloučit polékové změny.
Nemocný neměl žádné jiné nové potíže, monoklonální imunoglobulin zůstával stabilní, nadále docházel na pravidelné kontroly.
V lednu roku 2009 se však objevil nový zdravotní problém. Nemocný si stěžoval na bolesti v oblasti pravé Achillovy šlachy. V průběhu několika měsíců se pak na bércích obou dolních končetin objevily bolestivé indurace s maximem v oblasti obou Achillových šlach, bolestivé na tlak, ale i spontánně citlivé, zejména v noci (obr. 7 – 9). Původ této granulomatózní indurace neměl vysvětlení v žádném úrazu ani mechanickém dráždění. Proto jsme přistoupili k punkční biopsii z této indurace. Histologické vyšetření bylo uzavřeno jako rozsáhlý nekrobiotický xantogranulom, nález je stejný jako v histologickém vyšetření z tumoru levého předloktí.
Obr. 7–9. Morfy nekrobiotického xantogranulomu na bércích. 
V červenci roku 2009 byl nemocný pro zhoršující se bolestivost v místě postižení ošetřen na chirurgii, kde byla provedena evakuace nekrotických hmot a nemocnému se výrazně ulevilo, ložiska postižení se však dále rozšiřovala. U pacienta jsme provedli kontrolní trepanobiopsii s cílem zjistit, zda se monoklonální gamapatie již netransformovala v mnohočetný myelom. V kostní dřeni bylo nalezeno 10 – 15 % plazmocytů, což již odpovídá diagnóze mnohočetného myelomu.
V lednu roku 2010 jsme provedli první PET-CT vyšetření se snímáním rozšířeným i na dolní končetiny. Hlava, hrudník, břicho bylo bez patologického nálezu, skelet také bez zřetelných osteolytických ložisek při CT zobrazení. Na dolních končetinách v kůži a v podkoží, zejména na obou bércích, byly při CT zobrazení dobře zřetelné četné infiltráty, zasahující až do hloubky 2 cm. Největší infiltrát byl v distální části pravého bérce dorzálně o velikosti 3,5 × 2 cm a v kraniokaudálním rozměru až 10 cm. Nečetné drobné morfy byly také v podkoží obou stehen. Jeden drobný infiltrát byl mediálně od pately vlevo. I v místech, kde není pozitivita PET obrazu, je podkoží bérců prosáklé se zvýšenou denzitou.
PET zobrazení prokazuje mírně vyšší aktivitu v oblasti plicních hilů, ale stejný obraz byl již v roce 2008. Při snímání dolních končetin byla zřetelná patologická akumulace 18fluorodeoxyglukózy ve všech viditelných infiltrátech na CT obraze. Na některých místech, zejména v oblasti dolní části pravého bérce, dosáhla kumulace glukózy značně vysoké hodnoty – 10,0 SUV (obr. 10 a 11).
Image 1. PET CT trupu, není patologická aktivita. 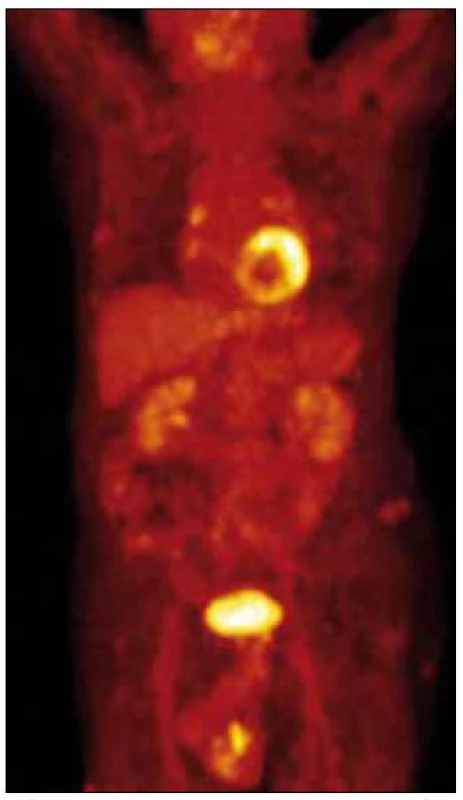
Image 2. PET CT končetin, je zřetelná velmi vysoká akumulace <sup>18</sup>fluorodeoxyglukózy v oblasti xantogranulomů, svědčící o jejich vysoké metabolické aktivitě. 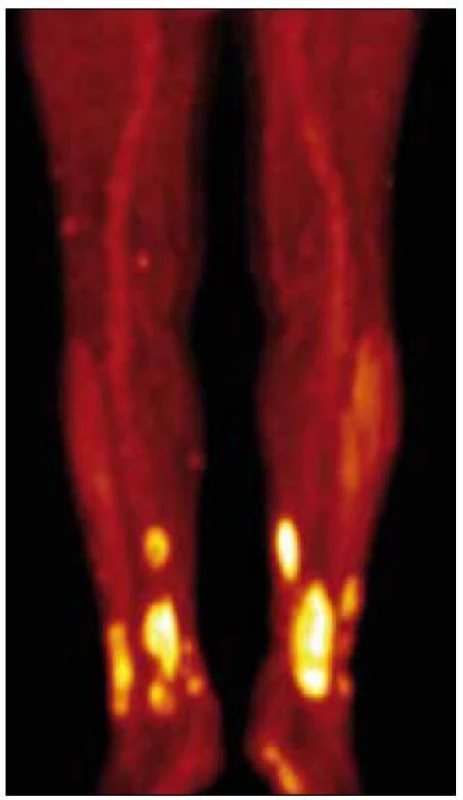
Léčba pacienta je obtížně proveditelná pro jeho vyšší věk, tíživou sociální situaci a malou mobilitu. Radioterapie na bolestivé největší infiltráty na DK však vedla k jejich podstatnému zmenšení a k vymizení bolestivosti.
Vysvětlení pojmu SUV
SUV (standard uptake value) je veličina vyjadřující poměr mezi lokální a průměrnou koncentrací radiofarmaka v těle, a vztahuje se tedy k úrovni tkáňového metabolizmu. Časté je užívání cut off hodnot k rozlišení mezi benigním a maligním nálezem (za tzv. „hranici malignity“ je považována SUVmax 2,5). Hodnoty SUV nejsou platné všeobecně, jsou závislé na mnoha faktorech, jako např. glykemii, časovém odstupu vyšetření od podání radiofarmaka, somatotypu pacienta a v neposlední řadě na tzv. „partial volume effekt“ (vede k podhodnocení intenzity metabolizmu u malých ložisek), mohou se lišit podle vyšetřujícího pracoviště a jsou specifické i pro jednotlivé typy tumorů.
Navzdory určité relativitě této veličiny byla v četných pracích prokázána výpovědní hodnota týkající se reakce na léčbu, délky trvání remise, doby přežití atd. Jinými slovy, tumory s vyšší hodnotou SUVmax mají signifikantně horší prognózu. U zobrazených tumorů odráží SUV mj. zvýšenou celularitu, počet mitóz a hladinu proliferačních markerů a vykazuje vysokou míru korelace s histopatologickými markery nádorové agresivity.
Diskuze
Normolipemická plochá xantomatóza asociovaná s monoklonální gamapatií
Difuzní plochá normolipemická xantomatóza asociovaná s monoklonální gamapatií byla poprvé popsána Altmanem a Winkelmannem v roce 1962. Typickými klinickými projevy jsou žluté až oranžové plošné plaky s palpačně i vizuálně zřetelnými okraji.
Typicky se xantomy objevují v obličeji v oblasti očí, na laterální straně krku a laterálních plochách trupu a dále na končetinách v oblastech flexorů. Ložiska obvykle bývají symetricky uložená a většinou jsou symptomatická [6].
Parametry metabolizmu tuků jsou obvykle v normě. Již v roce 1966 si povšiml Lynch souvislosti normolipemické ploché xantomatózy s monoklonální gamapatií, což potvrdily i další zprávy [7,8]. Dle přehledu publikovaných případů provází difuzní normolipemickou xantomatózu obvykle monoklonální imunoglobulin obsahující λ řetězce [9,10]. Histopatologicky je xantomatóza charakterizovaná kumulací pěnitých histiocytů s inkluzemi lipidů.
Nekrobiotický xantogranulom
Nekrobiotický xantogranulom je vzácná granulomatózní kožní choroba, pro niž jsou charakteristické žluté až žlutooranžové kožní morfy charakteru plak, papul a nodulů, které se postupně slévají do větších ploch, průměru 0,5 – 2 a více cm. V těchto ložiscích jsou někdy přítomny teleangiektazie. Asi u poloviny pacientů dochází časem k ulceracím s následným jizvením těchto ložisek [11]. Kožní ložiska postihují jak trup, tak končetiny. Periorbitální krajina je postižena v 80 – 85 % případů [12]. Proto s očními komplikacemi se na oční specialisty obrací 50 – 80 % všech pacientů s nekrobiotickým xantogranulomem. Infiltráty způsobují pokles víčka a omezují oční hybnost, někdy diplopii, skleritidu, snížený vízus, keratitidu. Infiltrace víček může způsobit ptózu a omezit mobilitu oka. Nekrobiotický xantogranulom byl poprvé popsán v roce 1980 Kossardem [12].
Nekrobiotický xantogranulom bývá také velmi často asociován s monoklonální gamapatií nejistého významu či s mnohočetným myelomem. Monoklonální imunoglobulin bývá obvykle typu IgG κ [13 – 16].
Výjimečně byl nekrobiotický xantogranulom popsán ve spojitosti s chronickou lymfatickou leukemií či nehodgkinským lymfomem [17]. V literatuře bylo publikováno přibližně 100 případů [11]. Nekrobiotické xantogranulomy jsou tvořeny pěnitými buňkami (histiocyty s tukovými inkluzemi), lymfocyty a obrovskými Teutonovými buňkami, které se jinak běžně nacházejí kolem cizích těles. Místy bývá přítomna kolagenní nekrobióza [18 – 20].
Mimokožní projevy nekrobiotického xantogranulomu
Nekrobiotický xantogranulom může postihnout i mimokožní oblasti. Nejčastěji byly makroskopicky a mikroskopicky podobné morfy nalezeny v respiračním traktu, laryngu, faryngu, bronších a v plicích. Další, často popisovanou lokalizací nemoci bylo srdce. Výjimečně byly masy xantogranulomu popsány v slzné žláze, slezině, kostní dřeni, ve frontální kosti lebeční, v příčně pruhovaných svalech a dále v okolí ledvin, ovarií a ve střevě [12,13,18 – 29,31 – 43]. Citovaná literatura dokládá, že nekrobiotický xantogranulom se může vyskytovat i jinde než na kůže obličeje, ta nemusí být vůbec postižena. Nekrobiotický xantogranulom může překvapit i v mimokožních lokalizacích.
Takže postižení podkoží dolních končetin bez postižení hlavy a trupu, jak uvádíme u druhého pacienta, je jedna z mnoha možných lokalizací nemoci.
Patofyziologii normolipemické ploché xantomatózy a nekrobiotického xantogranulomu vysvětluje více hypotéz, žádná však není jednoznačně prokázána
Tvorba komplexů monoklonálního imuglobulinu s lipoproteiny
Již před více lety byla vyslovena hypotéza, že monoklonální imunoglobulin (M-Ig) formuluje komplexy s cirkulujícími lipoproteiny a že tyto komplexy M-IgG – low-density lipoproteiny se deponují v kůži, kde jsou fagocytovány makrofágy, které nakonec vytvářejí ložiska pěnitých buněk [44,45].
Patologicky zvýšená aktivita makrofágů
Mastura popsal pacienta s nekrobio-tickým xantogranulomem a hypolipidemií a prokázal zvýšenou fagocytární aktivitu mikrofágů. Z tohoto pozorování odvodil hypotézu, že makrofágy jsou stimulovány (makrofágy stimulujícím faktorem nebo C3b částí komplementu) a to vede ke zvýšené fagocytóze lipidů makrofágy. Tuky napěchované makrofágy se pak ukládají v určitých typických „odpadních skládkách“, takže výsledkem jsou depozita makrofágů napěchovaných lipidovými partikulemi v určitých oblastech organizmu. Na vytvořené depozitum reaguje organizmus zánětlivou reakcí se vznikem obrovských Toutonových buněk [46].
Vazba monoklonálního imunoglobulinu na receptory pro low denzity lipoproteiny
Nejčastěji uváděná hypotéza vychází ze skutečnosti, že histopatologická analýza ložisek xantogranulomů prokázala monoklonální imunoglobulin vázaný na low denzity lipoproteiny [47]. Tato hypotéza předpokládá, že monoklonální protein u těchto pacientů je funkčně podobný lipoproteinům, váže se svým Fc fragmentem na lipoproteinové receptory monocytů a indukuje formování xantomů či xantogranulomu [22,46,48].
Zcela ojedinělá je infekční hypotéza
Zcela ojedinělá byla zpráva Zenglera, který u 6 ze 7 studovaných pacientů našel přítomné borrelie [49].
V literatuře jsou popisovány i případně bez paraproteinu a jejich počet se odhaduje na 20 % [50].
Podobné jednotky – juvenilní xantogranulom a Erdheimova-Chesterova choroba
U dětí byl popsán případ žlutých kožních morf bez vazby na paraproteinemii jako xanthoma disseminatum a tato jednotka byla u popsaného dítěte považována za histiocytární proliferaci ze skupiny non Langerhans cell histiocytóz. Šlo o 5letého chlapce, u něhož byly přítomny kožní xantomatózní projevy, byl však také přítomen diabetes insipidus a poškození kostí kalvy. Diabetes insipidus byl u těchto dětských forem popsán ve 40 % případů [51,52]. Těmto pediatrickým případům juvenilního diseminovaného xantogranulomu se může podobat v dospělosti průběh Erdheimovy-Chesterovy nemoci. Odpovídá tomu popis 49letého muže, který si stěžoval na patologickou únavu, vyšetření prokázalo patologické masy v oblasti retroperitonea. Histologie prokázala mezenterickou panikulitidu se zánětlivou infiltrací tvořenou lymfocyty a makrofágy, v této retroperitoneální mase však nebyly popsány typické pěnité buňky, takže histologie odpovídala nespecifickému zánětu. Teprve později byly prokázány pěnité buňky retrobulbárně a diagnóza byla uzavřena jako Erdheimova-Chesterova nemoc [53]. To je důvod, proč u prvního pacienta, kde histologie prokázala jen nespecifické zánětlivé změny, které však spontánně v průběhu 3 let neodezněly a ani se nenašlo přijatelné vysvětlení, uvažujeme, že by se mohlo jednat o první příznak této formy xantogranulomatózy.
Uvedením tohoto případu chceme poukázat na to, že hranice mezi nekrobiotickým xantogranulomem vázaným na monoklonální gamapatii, plochými normolipemickými xantomy a Erdheimovou-Chesterovou nemocí není nikterak ostrá. Všechny tyto nemoci obsahují pěnité histiocyty a není vůbec jasné, proč v některých případech se nemoc omezí na kůži a tvoří ploché normolipemické xantomy, někdy se vyskytuje ve formě nekrobiotického xantogranulomu a u dětí pak ve formě juvenilního diseminovaného xantogranulomu a u dospělých ve formě Erdheimovy-Chesterovy nemoci.
Klinické příznaky jsou popsány v úvodu. Informace o léčbě těchto případů jsou dostupné pouze z popisu případů, žádné klinické studie neřeší otázku, co považovat za optimální léčbu těchto nemocných. Největší soubor publikovali autoři z Mayo kliniky, kteří od roku 1994 do roku 2007 registrovali celkem pouze 17 případů s nekrobiotickým xantogranulomem. Mayo klinika je pracoviště, které mimo jiné soustředí nemocné s monoklonální gamapatií z rozsáhlých oblastí USA. I tato práce tedy dokladuje, jak vzácná je tato porucha.
Zkušenosti s léčbou těchto výjimečných případů
V literatuře lze nalézt četné léčebné postupy, které však byly jen výjimečně úspěšné. Nekrobiotický xantogranulom i difuzní ploché xantomy představují chronické, pomalu progredující onemocnění. Operační léčba nebyla nikdy dlouhodobě úspěšná. V popisu skupiny nemocných, publikovaném Mehreganem a Winkelmannem v roce 1992, byla nejčastěji léčebná odpověď popisována po chlorambucilu, léčebné odpovědi po melfalanu nebyly tak časté. Po nitroložiskové aplikaci kortikoidů nedocházelo ke zlepšení. Jeden pacient se zlepšil po plazmaferéze.
V popisech případů, které byly zveřejněny po roce 1992, byly pro léčbu použity kortikosteroidy, alkylační cytostatika, antimetabolity, antimikrobiální léky a jiné postupy s variabilními výsledky. Pokud je po některém léčebném postupu popsáno zlepšení, tak velmi často není uvedena délka trvání léčebné odpovědi. Výsledky některých léčebných postupů se pokusíme stručně sumarizovat.
Kortikosteroidy
Zevní aplikace kortikosteroidů (masti, krémy) na plochy xantogranulomu nevedla k léčebnému úspěchu [17,54,55]. Několik pacientů odpovědělo na nitroložiskovou aplikaci kortikosteroidů [56,57] a na systémovou aplikaci kortikosteroidů [50,58 – 61,63], ale po této léčbě v některých případech došlo k recidivě nemoci [63].
Alkylační cytostatika
Alkylační cytostatika jsou nejčastěji testované léčebné postupy. Obvykle jsou podávány v monoterapii nebo v kombinaci s glukokortikosteroidy.
Po léčbě cyklofosfamidem bylo u 4 léčených popsáno zlepšení, zatímco u dalších 4 nebyl pozorován žádný přínos této léčby. Cyklofosfamid byl přínosem také u podobné nemoci, xanthoma disseminatum [56,64 – 70].
Z pacientů, kteří byli léčeni chlorambucilem, došlo u 6 ke zlepšení [12,26,66,70,71] a u 3 se nedostavil žádný léčebný efekt [59,65].
Melfalan byl snad používán nejčastěji. Uvádí se, že asi 10 ze 12 pacientů se po léčbě melfalanem zlepšilo [74 – 79], ačkoliv v jednom případě došlo k recidivě nemoci.
Ve 3 případech nekrobiotického xantogranulomu byla podána kombinovaná chemoterapie pro jinou přítomnou hematologickou nemoc, zpočátku došlo k regresi xantogranulomu, ale po ukončení léčby kožní morfy recidivovaly [56].
Antimetabolity
Po metotrexátu nebyla popsána léčebná odpověď, zatímco po azathioprinu s kortikosteroidy bylo popsáno zlepšení [26,80]. Pro zhodnocení účinku metabolitů je však málo údajů.
Thalidomid
Thalidomid byl použit v kombinaci se steroidy a uvádí se, že došlo ke zlepšení očních příznaků [71,78].
Interferon α
Byl použit a v jednom případě se uvádí zlepšení [61,81].
Vinblastin
U dětských forem xanthoma disseminatum bez monoklonálního Ig se používá kortikoterapie a dále léčba vinblastinem jako u histiocytózy z LCH buněk [51].
Další léčebné postupy
Plazmaferéza také nepřinesla očekávaný užitek [71,82]. Mechanická abraze nebo ablativní laserová léčba je jednou z mála forem, jak léčit normolipemickou xantomatózu [83,84].
Vysokodávkovaná chemoterapie
Vysokodávkovaná chemoterapie s autologní transplantací krvetvorných buněk byla zatím použita zcela výjimečně a z první pozitivní výsledek nelze zevšeobecňovat [85].
Nové léky – Revlimid
V literatuře jsem našli první zprávu o ústupu monoklonální gamapatie i kožních projevů nemoci při léčně revlimidem [86]. Je možné, že tento lék bude přinášet úspěchy tam, kde předchozí léčebné postupy selhaly.
V našich případech jsme na základně vysoce pravděpodobné souvislosti monoklonální gamapatie s normolipemickými plochými xantomy, ale i s nekrobiotickým xantogranulomem přistoupili v 1. případě k léčbě, která obsahovala 2 pro tuto diagnózu často používané léky, alkylační cytostatikum (cyklofosfamid) a glukokortikosteroid (dexametazon) a k těmto lékům, u nichž byl popsán efekt v případě xantogranulomu, jsme přidali bortezomib. Tato trojkombinace je vysoce účinná u mnohočetného myelomu, vede velmi často ke kompletním remisím. Při léčbě touto kombinací jedné naší pacientky vymizel monoklonální imunoglobulin typu IgA a vymizely i kožní příznaky způsobené monoklonálním imunoglobulinem – IgA pemphigus. Tato pacientka je již 2 roky od léčby stále v kompletní remisi.
Léčbu jsem podali s nadějí, že při dosažení kompletní hematologické remise (tedy při úplném vymizení monoklonálního imunoglobulinu) by měly ustupovat i xantomy, pokud je pravdivá hypotéza o kauzální souvislosti.
V našem případě však tato léčba nevedla k vymizení monoklonálního imunoglobulinu ani k vymizení xantomů, takže nemůžeme potvrdit ani vyvrátit hypotézu o souvislosti monoklonálního imunoglobulinu a normolipemických xantomů.
V 2. případně nekrobiotického xantogranulomu jsme pro závažný stav nemocného použili pouze kurativní radioterapii na bolestivé podkožní ložiska xantomu v dávce 40 Gy. Po ní došlo k výraznému zmenšení těchto morf, ale jen v ozářeném poli. Literární údaj o excelentní účinnosti revlimidu jsme zatím neověřili. Prokázali jsme přínos PET-CT zobrazení v případě pacienta normolipenickými xantomy (nález 4 roky trvající lymfademopatie zatím neobjasněné etiologie). V případně pacienta s nekrobiotickým xantogranulomem PET-CT vyšetření prokázalo schopnost excelentně detekovat jak v low dose CT, tak v PET obraze mnohočetné postižení měkkých tkání dolních končetin s vysokou kumulací 18fluorogluglukózy.
Závěry pro praxi
- V případě nálezu plochých xantomů či xantogranulomu je nutno pomýšlet na souvislost s monoklonální gamapatií a vyšetřit přítomnost monoklonálního imunoglobulinu.
- V případě xantomu či xantogranulomu asociovaného s monoklonální gamapatií je přínosné provedení PET-CT vyšetření, které může odhalit mimokožní projevy této nemoci. V případě postižení končetin je nutno požádat o rozšíření snímání PET-CT i na tyto končetiny.
- PET-CT má excelentní potenciál potvrdit diseminaci xantogranulomů v kůži i hlouběji, intenzita akumulace 18fluorodeoxyglukózy souvisí s mírou agresivity nemoci. Pokud jsou snímány i končetiny, může PET-CT odhalit typickou akumulaci 18fluorodeoxyglukózy v epifýzách dlouhých kostí končetin.
- Pro uvedené nemoci není definována léčba první volby, popsané zkušenosti s léčbou shrnujeme v diskuzi. V případě xantogranulomu vedla radioterapie k vymizení bolestivosti a zmenšení morfy v ozářením poli [87].
Tato publikace byla připravena v rámci projektu MUNI/ A/ 1012/ 2009 s názvem „Optimalizace diagnostiky a terapie maligních chorob a komplikací, které tyto maligní nemoci provázejí, s využitím nových molekulárně biologických metod“, a také je součástí aktivit v rámci grantů IGA MZ: NR9225, NS10387 a NS10406.
prof. MUDr. Zdeněk Adam, CSc.
www.fnbrno.cz
e-mail: z.adam@fnbrno.czDoručeno do redakce:19. 2. 2010
Přijato po recenzi: 12. 5. 2010
Sources
1. Janssen D, Fölster ‑ Holst R, Harms D et al. Clonality in juvenile xanthogranuloma. Am J Surg Pathol 2007; 31 : 812 – 813.
2. Decaux O, Laurat E, Perlat A et al. Systemic manifestations of monoclonal gammopathy. Eur J Intern Med 2009; 20 : 457 – 461.
3. Alexander AS, Turner R, Uniate L et al. Xanthoma disseminatum: a case report and literature review. Br J Radiol 2005; 78 : 153 – 157.
4. Vick VL, Wilson MW, Fleming JC et al. Orbital and eyelid manifestations of xanthogranulomatous diseases. Orbit 2006; 25 : 221 – 225.
5. Asarch A, Thiele JJ, Ashby ‑ Richardson et al. Cutaneous disseminated xanthogranuloma in adult: a case report and review of the literature. Cutis 2009; 83 : 243 – 249.
6. Altman J, Winkelmann RK. Diffuse normolipemic planae xanthoma. Generalized xanthelasma. Arch Dermatol 1962; 85 : 633 – 640.
7. Lynch PJ, Winkelmann RK. Generalized plane xanthoma and systemic disease. Arch Dermatol 1966; 93 : 639 – 640.
8. Williford PM, White WL, Jorizzo JL et al. The spectrum of normolipemic plane xanthoma. Am J Dermatopathol 1993; 15 : 572 – 575.
9. Taylor JS, Lewis LA, Battle JD Jr et al. Plane xanthoma and multiple myeloma with lipoprotein‑paraprotein complexing. Arch Dermatol 1978; 114 : 425 – 431.
10. Marcoval J, Moreno A, Bordas X et al. Diffuse plane xanthoma: clinicopathologic study of 8 cases. J Am Acad Dermatol 1998; 39 : 439 – 442.
11. Wood AJ, Wagner MV, Abbott JJ et al. Necrobiotic xanthogranuloma: a review of 17 cases with emphasis on clinical and pathologic correlation. Arch Dermatol 2009; 145 : 279 – 284.
12. Kossard S, Winkelmann RK. Necrobiotic xanthogranuloma with paraproteinemia. J Am Acad Dermatol 1980; 3 : 257 – 270.
13. Ugurlu S, Bartley GB, Gibbon LE. Necrobiotic xanthogranuloma: long term outcome of ocular and systemic involvement. Am J Ophthalmol 2000; 129 : 651 – 657.
14. Mehregan DA, Winkelmann RK. Necrobiotic xanthogranuloma. Arch Dermatol 1992; 128 : 94 – 100.
15. Finan MC, Winkelmann RK. Necrobiotic xanthogranuloma with paraproteinemia. A review of 22 cases. Medicine (Baltimore) 1986; 65 : 376 – 388.
16. Martínez Fernández M, Rodríguez Prieto MA, González J et al. Necrobiotic xanthogranloma associated with myeloma. J Eur Acad Dermatol Venereol 2004; 18 : 328 – 331.
17. Oumeish OY, Oumeish I, Tarawneh Met al. Necrobiotic xanthogranuloma asso-ciated with paraproteinemia and non‑Hodg-kin’s lymphoma developing into chronic lymphocytic leukemia: the first case reported in the literature and review of the literature. Int J Dermatol 2006; 45 : 306 – 310.
18. Winkelmann RK, Dahl PR, Perniciaro C. Asteroid bodies and other cytoplasmic inclusions in necrobiotic xanthogranuloma with paraproteinemia. J Am Acad Dermatol 1998; 38 : 967 – 970.
19. Randell PL, Heenan PJ. Necrobiotic xanthogranuloma with paraproteinaemia. Australas J Dermatol 1999; 40 : 114 – 115.
20. Robertson DM, Winkelmann RK. Ophthalmic features of necrobiotic xanthogranuloma with paraproteinemia. Am J Ophthalmol 1984; 97 : 173 – 183.
21. Adam Z, Balšíková K, Pour L et al. Diabetes insipidus, následovaný po 4 letech dysartrií a lehkou pravostrannou hemiparézou – první klinické příznaky Erdheimovy-Chesterovy nemoci. Popis a zobrazení případu s přehledem informací o této nemoci. Vnitřní Lék 2009; 55 : 1173–118.
22. Martínez Fernández M, Rodríguez Prieto MA, González J et al. Necrobiotic xanthogranloma associated with myeloma. J Eur Acad Dermatol Venereol 2004; 18 : 328 – 331.
23. Fernández ‑ Herrera J, Pedraz J. Necrobiotic xanthogranuloma. Semin Cutan Med Surg 2007; 26 : 108 – 113.
24. Machado S, Alves R, Lima M et al. Cutaneous necrobiotic xanthogranuloma (NXG): successfully treated with low dose chlorambucil. Eur J Dermatol 2001; 11 : 458 – 462.
25. Hunter L, Burry AF. Necrobiotic xanthogranuloma: a systemic disease with paraproteinemia. Patology 1985; 17 : 533 – 536.
26. Fortson JS, Schroeter AL. Necrobiotic xanthogranuloma with IgA paraproteinemia and extracutaneous involvement. Am J Dermatopathol 1990; 12 : 579 – 584.
27. Bara C, Barbarot S, Hamitou M et al. Systemic necrobiotic xanthogranuloma with initial pericardial and pulmonary involvement. Ann Dermatol Venereol 2003; 130 : 341 – 344.
28. Novak PM, Robbins TO, Winkelmann RK. Necrobiotic xanthogranuloma with myocardial lesions and nodular transformation of the liver. Hum Pathol 1992; 23 : 195 – 196.
29. Shah KC, Poonnoose SI, Georgie R et al. Necrobiotix xanthogranuloma with cutaneous and cerebral manifestations. Case report and review of the literature. J Neurosurg 2004; 100 : 1111 – 1114.
30. Umbert I, Winkelmann RK. Necrobiotic xanthogranuloma with cardiac involvement. Br J Dermatol 1995; 133 : 438 – 443.
31. Yasukawa K, Kato N, Hamasaka A et al. Necrobiotic xanthogranuloma: isolated skeletal and muscle involvement and unusual changes. J Am Acad Dermatol 2005; 52 : 729 – 731.
32. Winkelmann RK, Litzow MR, Umbert IJ et al. Giant cell granulomatous pulmonary and myocardial lesions in necrobiotic xanthogranuloma with paraproteinemia. Mayo Clin Proc 1997; 72 : 1028 – 1033.
33. Bakir B, Unuvar E, Terzibasioglu E et al. Atypical lung involvement in a patient with systemic juvenile xanthogranuloma. Pediatr Radiol 2007; 37 : 325 – 327.
34. Amer R, Peer J. Pappo O et al. Necrobiotic xanthogranuloma associated with choroidal infiltration and syncytial giant cell hepatitis. J Neuroophthalmol 2005; 25 : 189 – 192.
35. Betts CM, Pasquinelli C, Costa AM et al. Necrobiotic xanthogranuloma without periorbital involvement: an ultrastructural investigation. Ultrastruct Pathol 2001; 25 : 437 – 444.
36. Orsey A, Paessler M, Lange BJ et al. Central nervous system juvenile xanthogranuloma with malignant transformation. Pediatr Blood Cancer 2008; 50 : 927 – 930.
37. Ozcelik U, Dogru D, Akcoren Z et al. Xanthoma disseminatum: a child with respiratory system involvement and bronchiectasias. Pediatr Pulmonol 2005; 39 : 84 – 87.
38. Smith HC, Sargent LD, Lundin DB. Necrobiotic xanthogranuloma of the chest wall. Dermatol Online J 2006; 12 : 12 – 16.
39. Stockman A, Delanghe J, Geerts ML et al. Diffuse plane normolipaemic xanthomatosis in a patient with chronic lymphatic leukaemia and monoclonal gammopathy. Dermatology 2002; 204 : 351 – 354.
40. Stork J, Kodetová D, Vosmík E et al. Necrobiotic xanthogranuloma presenting as a solitary tumor. Am J Dermatopathol 2000; 22 : 453 – 456.
41. Spicknall KE, Mehregan DA et al. Necrobiotic xanthogranuloma. Int J Dermatol 2009; 48 : 1 – 10.
42. Tucker NA, Discepola MJ, Blanco G et al. Necrobiotic xanthogranuloma without dermatologic involvement. Can J Ophthalmol 1997; 32 : 396 – 399.
43. Ferrara G, Palombi N, Lipizzi A et al. Nonnecrobiotic necrobiotic xanthogranuloma. Am J Dermatopathol 2007; 29 : 306 – 308.
44. Bullock JD, Bartley GB, Campbell RJ et al. Necrobiotic xanthogranuloma with paraproteinemia. Case report and pathogenetic theory. Trans Am Ophthalmol Soc 1986; 84 : 342 – 354.
45. Hafner O, Witte T, Schmidt RE et al. Necrobiotic xanthogranuloma in IgG κ plasmacytoma and Quincke edema. Hautarzt 1994; 45 : 339 – 343.
46. Matsuura F, Yamashita S, Hirano K et al. Activation of monocytes in vivo causes intracellular accumulation of lipoprotein‑derived lipids and marked hypocholesterolemia – a possible pathogenesis of necrobiotic xanthogranuloma. Atheroslerosis 1999; 142 : 355 – 365.
47. Jeziorska M, Hassan A, Mackness MI et al. Clinical, biochemical, and immunohistochemical features of necrobiotic xanthogranulomatosis. J Clin Pathol 2003; 56 : 64 – 68.
48. Langlois S, Brochot P, Reguiai Z et al. Necrobiotic xanthogranuloma with multiple myeloma. Case report and pathogenic hypotheses. Joint Bone Spine 2006; 73 : 120 – 122.
49. Zelger B, Eisendle K, Mensing C et al. Detection of spirochetal micro‑organism by focus bloating microscopy in necrobiotic xanthogranuloma. J Am Acad Dermatol 2007; 57 : 1026 – 1030.
50. Chang SE, Lee WS, Lee MW et al. A case of necrobiotic xanthogranuloma without paraproteinemia presenting as a solitary tumor on the thigh. Int J Dermatol 2003; 42 : 470 – 472.
51. Yagci B, Varan A, Altinock G et al. Xanthoma disseminatum in a child with cranial involvement. J Pediatr Hematol Oncol 2008; 30 : 310 – 312.
52. Weitzman S, Jaffe R. Uncommon histiocytic disorders: the non Langerhans cell histiocytoses. Pediatr Blood Cancer 2005; 45 : 256 – 264.
53. Moore FO, Berne JD, Fox AD. Mesenteric panniculitis and Erdheim ‑ Chester disease: xanthogranulomatous diseases confused with malignancy. J Am Coll Surg 2007; 204 : 326 – 327.
54. Nestle FO, Hofbauer G, Burg G. Necrobiotic xanthogranuloma with monoclonal gammopathy of the IgG l type. Dermatology 1999; 198 : 434 – 435.
55. Wee SA, Shupack JL. Necrobiotic xanthogranuloma. Dermatol Online J 2005; 11 : 24 – 25.
56. Cornblath WT, Dotan SA, Trobe JD et al. Varied clinical spectrum of necrobiotic xanthogranuloma. Ophthalmology 1992; 99 : 103 – 107.
57. Elner VM, Mintz R, Demirci H et al. Local corticosteroid treatment of eyelid and orbital xanthogranuloma. Trans Am Ophthalmol Soc 2005; 103 : 69 – 73.
58. Sabet LM, Wexler D, Salama S et al. An unusual cause of refractive chronic bilateral leg ulceration. J Cutan Med Surg 2004; 8 : 432 – 437.
59. Chave TA, Chowdhury MM, Holt PJ. Recalcintrant necrobiotic xantohogranuloma responding do pulsed high‑dose dexamethasone plus maintenance therapy with oral prednisone. Br J Dermatol 2001; 144 : 158 – 161.
60. Valentine EA, Friedman HD, Zamkoff KW et al. Necrobiotic xanthogranuloma with IgA multiple myeloma: a case report and literature review. Am J Hematol 1990; 35 : 283 – 285.
61. Venencie PY, Le Bras P, Toan ND et al. Recombinant interferon a ‑ 2b treatment of necrobiotic xanthogranuloma with paraproteinemia. J Am Acad Dermatol 1995; 32 : 666 – 667.
62. Scupham RK, Fretzin DB. Necrobiotic xanthogranuloma with paraproteinemia. Arch Pathol Lab Med 1989; 113 : 1389 – 1391.
63. Plotnick H, Taniguchi Y, Hashimoto K et al. Periorbital necrobiotix xanthogranuloma and stage I multiple myeloma. Ultrastructure and response to pulsed dexamethasone documented by magnetic resonance imaging. J Am Acad Dermatol 1991; 25 : 373 – 377.
64. Kossard S, Chow E, Wilkinson B et al. Lipid and giant cell poor necrobiotic xanthogranuloma. J Cutan Pathol 2000; 27 : 374 – 378.
65. Wells J, Gillespie R, Zardawi I. A case of recalcitrant necrobiotic xanthogranuloma. Australas J Dermarol 2004; 45 : 213 – 215.
66. Meyer S, Szeimies RM, Landthaler M et al. Cyclophosphamide ‑ dexamethasone pulsed therapy for treatment of recalcitrant necrobiotic xanthogranuloma with paraproteinemia and ocular involvement. Br J Dermatol 2005; 153 : 443 – 445.
67. Stover DG, Alapati S, Regueira O et al. Treatment of juvenile xanthogranuloma. Pediatr Blood Cancer 2008; 51 : 130 – 133.
68. Seaton, ED, Pillai GJ, Chu AC. Treatment of xanthoma disseminatum with cylophosphamide. Br J Dermatol 2004; 150 : 346 – 349.
69. Flann S, Wain EM, Halpern S et al. Necrobiotic xanthogranuloma with paraproteinaemia. Clin Exp Dermatol 2006; 31 : 248 – 251.
70. Chave TA, Hutchinson PE. Necrobiotic xanthogranuloma with two monoclonal paraproteins and no periorbital involvement at presentation. Clin Exp Dermatol 2001; 26 : 493 – 496.
71. Hauser C, Schifferli J, Saurat JH. Complement consumption in a patient with necrobiotic xanthogranuloma and paraproteinemia. J Am Acad Dermatol 1991; 24 : 908 – 911.
72. Torabian SM, Fazel N, Knuttel R. Necrobiotic xanthogranuloma treated with chlorambucil. Dermatol Online J 2006; 12 : 11 – 12.
73. Luck J, Layton A, Noble BA. Necrobiotix xanthogranuloma with orbital involvement. J R Soc Med 1992; 85 : 357 – 358.
74. Criado PR, Vasconcellos C, Pegas JR et al. Necrobiotic xanthogranuloma with l paraproteinemia: case report of successful treatment with melphalan and prednisone. J Dermatolog Treat 2002; 13 : 87 – 89.
75. Ito Y, Nishimura K, Yamanaka K et al. Necrobiotic xanthogranuloma with paraproteinemia: an atypical case. J Dtsch Dermatol Ges 2008; 6 : 40 – 43.
76. Russo CG. Necrobiotic xanthogranuloma with scleroderma. Cutis 2002; 70 : 311 – 316.
77. Saeki H, Tomita M, Kai H et al. Necro-biotic xanthogranuloma with paraproteinemia successfully treated with melphalan, prednisolone and skin graft. J Dermatol 2007; 34 : 795 – 797.
78. Wilhelmus KR, Yen MT, Rice L et al. Necrobiotic xanthogranuloma with posterior scleritis. Arch Ophthalmol 2006; 124 : 748.
79. Ziemer M, Wedding U, Sander CS et al. Necrobiotic xanthogranuloma – rapid progression under treatment with melphalan. Eur J Dermatol 2005; 15 : 363 – 365.
80. Hayden A, Wilson DJ, Rosenbaum JT. Management of orbital xanthogranuloma with methotrexate. Br J Ophthalmol 2007; 91 : 434 – 436.
81. Georgiou S, Monastirli A, Kapranos N et al. Interferon a monotherapy for necrobiotic xanthogranuloma. Acta Derm Venereol 1999; 79 : 484 – 485.
82. Finelli LG, Ratz JL. Plasmapheresis, a treatment modality for necrobiotic xanthogranuloma. J Am Acad Dermatol 1987; 17 : 351 – 354.
83. Lorenz S, Hohenleutner S, Hohenleutner U et al. Treatment of diffuse plane xanthoma of the face with the erbium: YAG laser. Arch Dermatol 2001; 137 : 1413 – 1415.
84. Vieira V, Del Pozo J, Martínez W et al. Necrobiotic xanthogranuloma associated with lymphoplasmacytic lymphoma. Palliative treatment with carbon dioxide laser. Eur J Dermatol 2005; 15 : 182 – 185.
85. Goede JS, Misselwitz B, Taverna C et al. Necrobiotic xanthogranuloma successfully treated with autologous stem cell transplantation. Ann Hematol 2007; 86 : 303 – 306.
86. Silapunt S, Chon SY. Generalized necrobiotic xanthogranuloma successfully treated with lenalidomide. J Drugs Dermatol 2010; 9 : 273 – 276.
87. Histiocyte society. Available from: www.histiocytesociety.org/ site/ .
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2010 Issue 11-
All articles in this issue
- Metastatické postihnutie srdca a perikardu – MR kazuistiky
- Difuzní plošná normolipemická xantomatóza a nekrobiotický xantogranulom, asociované s monoklonální gamapatií – přínos PET‑ CT pro stanovení rozsahu nemoci a zkušenosti s léčbou. Popis dvou případů a přehled literatury
- Autoimunitný polyglandulárny syndróm typ 2 asociovaný s autoimunitnou hypofyzitídou a coeliakiou
- Lymfomu podobný průběh agresivní multisystémové histiocytózy z Langerhansových buněk v dospělosti a přínos PET/ CT vyšetření při hodnocení difuzní metabolické aktivity v plicním parenchymu
- Centrální pravostranná hemiparéza jako dominující projev systémové vaskulitidy
- Profesor MU Dr. František Pór a profesor Dr. Med. Robert Klopstock, poslucháči Lekárskych fakúlt v Budapešti a v Prahe
- Jiný pohled na akutní krvácení do horního trávicího traktu u pacientů s jaterní cirhózou
- Stratifikace rizika pomocí zátěžového SPECT zobrazení myokardu v kombinaci se stanovením koronárního kalciového skóre u rizikových pacientů s diabetem a/ nebo ledvinným selháním
- Stanovenie progresie karcinómu prostaty využitím metodiky RT‑PCR
- Osteoporóza pri chronickej obštrukčnej chorobe pľúc
- Inhibitory angiotenzin konvertujícího enzymu a blokátory receptorů pro angiotenzin II v léčbě fibrilace síní
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Centrální pravostranná hemiparéza jako dominující projev systémové vaskulitidy
- Autoimunitný polyglandulárny syndróm typ 2 asociovaný s autoimunitnou hypofyzitídou a coeliakiou
- Lymfomu podobný průběh agresivní multisystémové histiocytózy z Langerhansových buněk v dospělosti a přínos PET/ CT vyšetření při hodnocení difuzní metabolické aktivity v plicním parenchymu
- Stanovenie progresie karcinómu prostaty využitím metodiky RT‑PCR
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

