-
Medical journals
- Career
Některé současné názory na chronickou ischemickou srdeční chorobu
Authors: J. Vojáček
Authors‘ workplace: I. interní klinika Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Jan Vojáček, DrSc., FESC, FACC
Published in: Vnitř Lék 2009; 55(9): 827-831
Category: 80th Birthday - prof. MUDr. Miloš Štejfa, DrSc., FESC
Overview
Chronická ischemie myokardu je způsobena přechodným nepoměrem mezi zásobením myokardu kyslíkem a spotřebou kyslíku myokardem. Nejčastější příčinou ischemické srdeční choroby je ateroskleróza věnčitých tepen. V současné době je z praktických důvodů diagnostika koronárního postižení založena až na detekci ischemie myokardu. Na základě údajů z moderních studií je možné i při současné moderní medikamentózní léčbě stratifikovat prognózu nemocných s chronickou ischemickou srdeční chorobou do podskupin s nízkým, středním a vysokým rizikem. U nemocných s nízkým rizikem je průměrná roční mortalita pod 1 %, u nemocných se středním rizikem 1–2 % a u nemocných s vysokým rizikem nad 2 %. Revaskularizační výkony mohou zlepšit prognózu u některých podskupin nemocných s chronickou ischemickou srdeční chorobou. Revaskularizace též snižuje výskyt ischemických epizod a v některých podskupinách zlepšuje funkci levé srdeční komory.
Klíčová slova:
ischemická srdeční choroba – koronární nemoc – intervenční léčba – chirurgická léčbaIschemická srdeční choroba je zásluhou prof. MUDr. Miloše Štejfy, DrSc.,FESC, dlouhodobě středem zájmu v českém písemnictví, a to jak ve svých chronických formách, tak v prioritních popisech akutních forem [1–3].
Přestože je dnes u nás větší pozornost věnována akutním formám ischemické srdeční choroby, výrazné pokroky v poznání patofyziologie, klinického průběhu, prognózy i léčby jsou patrné také u chronických forem tohoto onemocnění. I když se obě tyto formy zásadně liší výskytem, prognózou, patofyziologií i léčebnými postupy, stále platí, že jde o různé projevy téhož onemocnění. Současné rozdělení uvádím v tab. 1.
Table 1. Klinické formy ischemické srdeční choroby. 
Chronická ischemie myokardu je způsobena přechodným nepoměrem mezi zásobením myokardu kyslíkem a spotřebou kyslíku myokardem. Nejčastější příčinou ischemické srdeční choroby je ateroskleróza věnčitých tepen.
Na vzniku ischemie myokardu u nemocných se zúžením věnčitých tepen aterosklerózou se podílí kromě stupně morfologického zúžení věnčité tepny i porucha vazodilatace či přítomnost abnormálně vystupňované vazokonstrikce epikardiálních částí věnčitých tepen i arteriol (obr. 1). Vznik ruptur koronárních plátů se vznikem různého stupně koronární trombotické obstrukce již na jedné straně zcela zásadně odlišuje akutní formy ischemické srdeční choroby, na druhé straně mnohočetné, často němě probíhající ruptury i nevýznamných plátů a jejich následné hojení je zodpovědné za progresi koronární nemoci.
Image 1. Patofyziologické mechanizmy a klinická prezentace různých forem ischemické srdeční choroby. 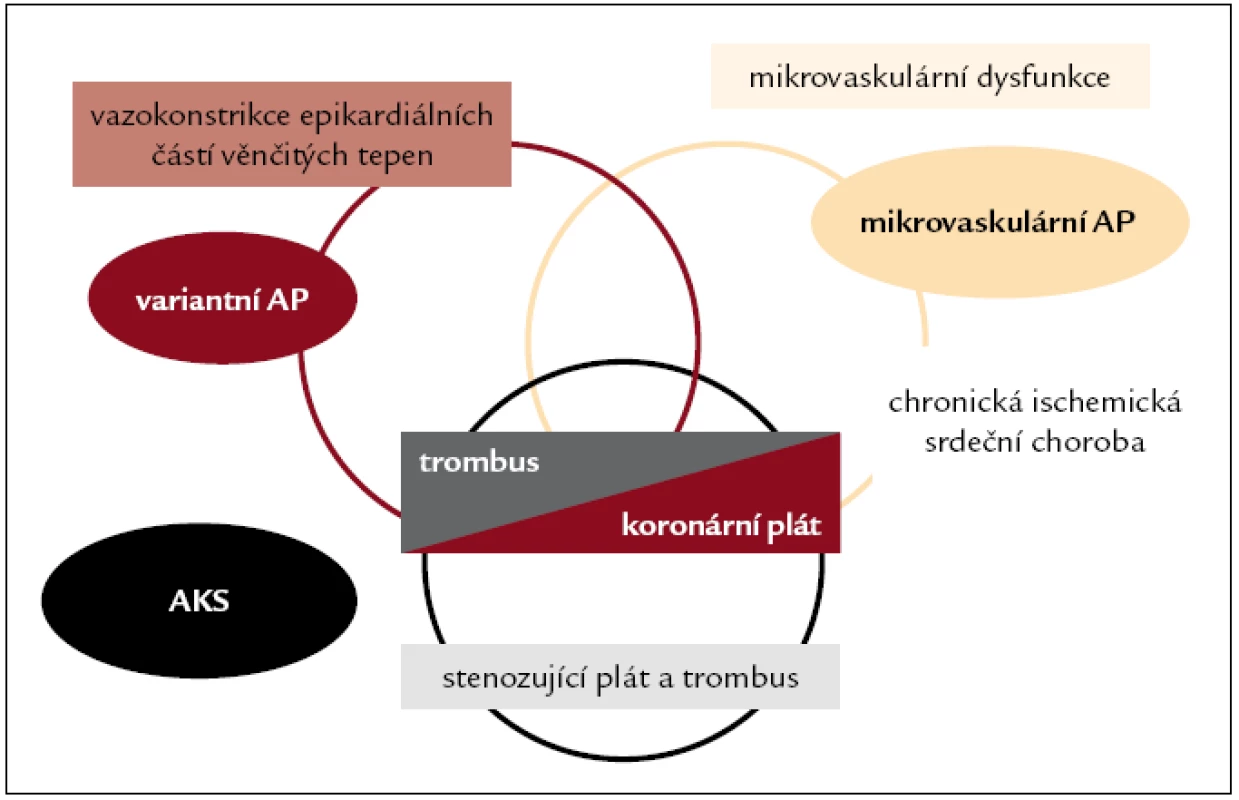
I u zdánlivě chronických forem onemocnění může být ischemie myokardu krátkodobá od několika vteřin do několika minut, ale může trvat i desítky minut či hodiny.
Vznik ischemie myokardu je provázen regionální poruchou funkce myokardu zprvu ve smyslu postižení metabolizmu myokardu, později diastolických funkčních parametrů a posléze i vznikem regionální systolické poruchy. U nemocných s kritickým zúžením věnčité tepny a dlouhodobě trvající ischemií myokardu dochází ke vzniku dlouhodobé poruchy kinetiky zásobované části myokardu, která bývá po určitou dobu reverzibilní. V důsledku omezení kinetiky může být po různě dlouhou dobu zachována viabilita myokardu (což může být dokumentováno řadou diagnostických postupů, ale zlatým standardem je obnovení kinetiky po normalizaci průtoku věnčitou tepnou) a potom hovoříme o hibernovaném myokardu.
Hibernující a omráčený myokard jsou formy chronické reverzibilní ischemické dysfunkce myokardu. Oba stavy se mohou vyskytovat u téhož nemocného, rozdíl mezi nimi v klinice není ostrý, i když teoreticky hibernace předpokládá reverzibilní omezení kinetiky v povodí kriticky zúžené věnčité tepny, kdežto omráčený myokard je definován jako reverzibilní porucha kinetiky myokardu po obnovení průtoku po určitou dobu uzavřenou věnčitou tepnou. V současné době je hibernace považována spíše za opakované omráčení myokardu po opakovaných epizodách těžké ischemie v důsledku cirkadiálních vzestupů srdeční frekvence a epizod vazokonstrikce s kritickým poklesem perfuze myokardu za koronární stenózou.
Vznik ischemie či nekrózy myokardu může být provázen vznikem poruch srdečního rytmu a může vyústit až v náhlou smrt.
I dnes je stále nezbytné rozlišovat mezi pojmy koronární nemoc a ischemická srdeční choroba. Jako koronární nemoc je označováno jakékoliv (prakticky v naprosté většině aterosklerotické) postižení věnčitých tepen, i když nemusí docházet ke vzniku ischemie myokardu. Jako ischemická srdeční choroba jsou potom označovány formy vyvolávající ischemii myokardu.
V současné době je z praktických důvodů diagnostika koronárního postižení založena až na detekci ischemie myokardu. Zlepšující se možnosti neinvazivní morfologické diagnostiky (srdeční NMR, mnohovrstevná počítačová tomografie) i invazivního vyšetřování (koronarografie, intravaskulární ultrazvuk, optická koherenční tomografie aj.) však umožňují včasnou detekci koronární nemoci již u symptomatických osob. Problémy spojené se spolehlivostí metod k neinvazivní detekci koronární nemoci však zatím neumožňují širší využití; prakticky jde spíše především o možnost vyloučit koronární postižení u negativního nálezu, pozitivní nález je nespecifický. Navíc invazivní diagnostika asymptomatické koronární nemoci má z klinického hlediska jen spíše teoretický význam. Zatím je indikace k revaskularizaci asymptomatických nemocných omezena jen na některé vybrané podskupiny, kde revaskularizaci může prokazatelně zlepšit prognózu.
Revaskularizační výkony mohou zlepšit prognózu u nemocných s chronickou ischemickou srdeční chorobou při postižení kmene levé věnčité tepny, všech tří větví koronárních tepen a postižení proximální časti r. interventricularis anterior. Revaskularizace též snižuje výskyt ischemických epizod a v některých podskupinách zlepšuje funkci levé srdeční komory, což bylo prokázáno pro symptomatické nemocné s postižením kmene levé věnčité tepny, dvou nebo tří tepen s postižením proximálního úseku RIVA (tj. před odstupem první septální větve) a s postižením tří tepen a současně se snížením ejekční frakce levé komory srdeční v European Coronary Surgery Study (ECSS) [4]. Ve studii CASS byli zařazeni jen velmi málo symptomatičtí nemocní, ale analýza databáze ukázala, že kardiochirurgická léčba výrazně zlepšila stav nemocných s postižením tří tepen bez ohledu na funkci levé komory a postižení proximální RIVA [5]. Metaanalýza tří velkých studií – VA, ECSS a CASS – a několika malých studií [6] ukázala 10letý benefit chirurgické léčby pro nemocné s postižením tří tepen, dvou tepen a jedné tepny při postižení RIVA bez ohledu na stav funkce levé komory srdeční. Pokud nebyla postižena proximální RIVA, byla lepší prognóza pouze u nemocných s postižením tří tepen nebo kmene levé věnčité tepny.
Srovnání chirurgické léčby s implantací lékových stentů u nemocných s postižením více tepen ve studii SYNTAX ukázalo, že po jednom roce nebyl rozdíl v prognóze (přežívání, výskyt infarktu a kombinované endpointy), nemocní s intervenční léčbou však měli častěji opakovanou revaskularizaci.
Na jedné straně může tedy provedení koronarografického vyšetření identifikovat nemocné se závažnými angiografickými nálezy, kde i při absenci závažných symptomů prokazatelně revaskularizační léčba příznivě ovlivňuje prognózu (nemocní se stenózou kmene levé věnčité tepny, s postižením dvou nebo tří věnčitých tepen při postižení proximální části r. interventricularis anterior a s postižením tří tepen při poklesu funkce levé komory srdeční), na druhé straně studie COURAGE ukázala, že prognóza málo symptomatických nemocných při konzervativní léčbě je velmi dobrá [7,8]. Prognóza v této studii však byla hodnocena pouze u nemocných bez prognosticky závažného nálezu na věnčitých tepnách a bez limitující anginy pectoris.
Byla vypracována i riziková stratifikace nemocných s chronickou anginou pectoris, která by měla usnadnit indikaci koronarografického vyšetření (tab. 2). Vzhledem ke skutečnosti, že i prognosticky velmi závažné koronarografické nálezy mohou byt spojeny se zcela minimální klinickou symptomatologií, mělo by být provedeno koronarografické vyšetření u každého nemocného s anginou pectoris.
Table 2. Indikace koronarografického vyšetření [9]. ![Indikace koronarografického vyšetření [9].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/966b28eeaa1960820a24d107e233f202.png)
Na základě údajů z moderních studií je možné i při současné moderní medikamentózní léčbě stratifikovat prognózu nemocných s chronickou ischemickou srdeční chorobou do podskupin s nízkým, středním a vysokým rizikem. U nemocných s nízkým rizikem je průměrná roční mortalita pod 1 %, u nemocných se středním rizikem 1–2 % a u nemocných s vysokým rizikem nad 2 % [9].
Pro stratifikaci nemocných s chronickou ischemickou srdeční chorobou můžeme použít:
- stratifikaci na základě klinických údajů
- stratifikaci na základě zátěžového testu
- stratifikaci na základě funkce levé komory srdeční
- stratifikaci na základě koronarografického vyšetření
Tato stratifikace předpokládá provedení koronarografického vyšetření k posouzení koronární anatomie u nemocných se středním rizikem na základě klinického vyšetření nemocného a na základě výsledku zátěžového testu, případně echokardiografického posouzení funkce levé komory srdeční a nepochybně je koronarografie indikována u nemocných v rizikové skupině.
Prognózu nemocných s chronickou stabilní anginou pectoris zhoršuje postižení periferních tepen či přítomnost fyzikálních známek dysfunkce levé srdeční komory.
Přibližně 50 % nemocných s chronickou ischemickou srdeční chorobou a chronickou kontraktilní dysfunkcí levé komory srdeční má reverzibilní poruchu kinetiky a může mít prospěch z revaskularizace [10]. Chronická reverzibilní ischemická dysfunkce myokardu může byt způsobena hibernací myokardu nebo jeho stunningem. Některé údaje naznačují, že zásoby energetických substrátů mohou být dlouhodobě zachovány a že dochází k upregulaci genů programujících dlouhodobé přežívání buněk za nevýhodných podmínek [11,12]. Dále bylo dokumentováno stabilní dlouhodobé (až dvouleté) přetrvávání nezměněného poměru perfuze myokardu/metabolizmus myokardu/regionální kinetika u nemocných s hibernujícím a omráčeným myokardem [13]. Uvedené pochody vedou k dočasnému omezení kontraktility myokardu a revaskularizace vede k restauraci metabolických adaptačních mechanizmů i k obnovení kinetiky v postižené oblasti. Na druhé straně je známo, že pokud takto postižené oblasti myokardu nejsou revaskularizovány, poruchy perfuze a metabolické změny vedou ke ztrátě myocytů, fibróze a k ireverzibilnímu poškození myokardu. Tento děj je závislý na hloubce ischemie i na čase a platí závislost v tom smyslu, že čím časnější je revaskularizace, tím větší zlepšení funkce levé komory srdeční a prognózy lze očekávat. Viabilitu myokardu lze prokazovat pomocí řady testů: od nejjednodušších, jako je postextrasystolické obnovení kinetiky postižené oblasti přes obnovení kinetiky po malých dávkách dobutaminu, průkazu zachovale perfuze pomocí single photon emission computed tomography (SPECT) za použití thalia-201 (201Tl) nebo techneciem-99m (99mTc) označeně sestamibi, pomocí NMR či průkazem zachovalého metabolizmu pomocí palmitátu značeného 11C nebo 18F-2-deoxi-glukózy při pozitron emisní tomografii.
Časná detekce viability myokardu je důležitá pro rozhodnutí o případné revaskularizaci a je založena na metodách posuzujících různé funkce myokardu:
- kontraktilní rezervu
- integritu buněčné membrány
- metabolizmus myokardu se současným zhodnocením perfuze myokardu v dané oblasti (tab. 3)
Table 3. Postupy po užívané pro hodnocení viability myokardu. 
Souhrnné posouzení rozsáhlé metaanalýzy studií provedených v letech 2001–2007 ukázalo, že nejvyšší specificitu dosahující téměř 80 % pro předpověď zlepšení regionální kinetiky levé komory srdeční po revaskularizaci myokardu má dobutaminová echokardiografie při senzitivitě přes 80 %. Naopak nejvyšší senzitivitu přes 90 % měla NMR a PET sken s 18F-2-deoxi-glukózou následované 201Tl a nejnižší senzitivitu kolem 80 % dobutaminová echokardiografie a 99mTc – SESTAMIBI (obr. 2) [10].
Image 2. Specificita a senzitivita jednotlivých testů pro hodnocení viability myokardu [10]. dobut echo – dobutaminová echokardiografie, NMR – nukleární magnetická rezonance, <sup>99m</sup>Tc – technecium 99m SESTAMIBI, <sup>201</sup>Tl – thaliový perfuzní scan, FDG – <sup>18</sup>F 2-deoxi-glukóza ![Specificita a senzitivita jednotlivých testů pro hodnocení viability myokardu [10]. dobut echo – dobutaminová echokardiografie, NMR – nukleární magnetická rezonance, <sup>99m</sup>Tc – technecium 99m SESTAMIBI, <sup>201</sup>Tl – thaliový perfuzní scan, FDG – <sup>18</sup>F 2-deoxi-glukóza](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/c2430f65cc9b5450564176352c82ddc5.png)
Markery kontraktilní rezervy předpovídají obnovení regionální funkce myokardu s vyšší specificitou než markery zachovale funkce buněčné membrány [10]. Posouzení viabilní a neviabilní tkáně se nechová binárně, ale pravděpodobnost obnovení regionální funkce je kontinuální proměnná závislá na velikosti perfuzního defektu, velikosti kontraktilní rezervy a stupni transmurality nebo „MRI contrast hyperenhancement“. Čím větší je množství dysfunkčního, ale viabilního myokardu, tím větší je vzestup ejekční frakce po revaskularizaci. Nemocní s chronickou ischemickou dysfunkcí levé srdeční komory a zjištěnou viabilitou zahrnující více než 25 % velikosti levé komory zpravidla zlepšují funkci po revaskularizaci. U části nemocných s prokazatelnou rozsáhlou oblastí viabilního myokardu však přesto nedochází po revaskularizaci ke zlepšení funkce myokardu. To dokumentuje i výrazně nižší specificita vyšetření hodnotících viabilitu myokardu, a tedy predikujících zlepšení funkce levé komory po revaskularizaci (58 %) oproti jejich senzitivitě 93 % – to znamená, že ve skutečnosti méně nemocných s předoperačně dokumentovaným viabilním myokardem opravdu po revaskularizaci zlepší funkci levé srdeční komory. Jsou to především nemocní s remodelovanou a dilatovanou komorou, kteří nemusí zlepšit svoji funkci po revaskularizaci, přestože je přítomný viabilní myokard. Změna ejekční frakce levé komory srdeční po revaskularizaci je lineárně proporcionální předoperačnímu endsystolickému objemu levé komory s největším klinickým zlepšením u nemocných s malou levou komorou (definovanou jako endsystolický objem menší než 130 ml) a viabilním myokardem a nejhorším u nemocných s velkou levou komorou a malým množstvím viabilního myokardu [14]. Pokud jde o prognózu – nejlepší prognózu mají nemocní s jinak srovnatelnou globální funkcí levé komory a s prokazatelným viabilním myokardem, pokud podstoupí revaskularizaci ve srovnání s vyšší mortalitou nemocných s viabilním myokardem a s medikamentózní léčbou [15]. Nemocní s neviabilním myokardem v jinak srovnatelných podskupinách mají zhoršenou prognózu, přičemž chirurgická revaskularizace u těchto nemocných je zatížena nejvyšší časnou mortalitou.
Podporováno Výzkumným záměrem FN č. MZO 00179906.
prof. MUDr. Jan Vojáček, DrSc., FESC, FACC
www.fnhk.cz
e-mail: vojacjan@fnhk.cz
Doručeno do redakce: 26. 7. 2009
Sources
1. Stejfa M Jr, Mocek J, Dvorak I. On “imminent infarction”. Cardiologia 1962; 40 : 24–32.
2. Štejfa M Jr. Chronická angina pectoris. Čas Lék Čes 1968; 107 : 729–732.
3. Stejfa M. Instable angina pectoris and the pre-infarct condition. Z Gesamte Inn Med 1977; 32 : 203–205.
4. Varnauskas E. Twelve-year follow up of survival in the randomized European Coronary Surgery Study. N Engl J Med 1988; 319 : 332–337.
5. Myers WO, Schaff HV, Gersh BJ et al. Improved survival of surgically treated patients with triple vessel coronary artery disease and severe angina pectoris. A report from the Coronary Artery Surgery Study (CASS) registry. J Thorac Cardiovasc Surg 1989; 97 : 487–495.
6. Yusuf S, Zucker D, Peduzzi P et al. Effect of coronary artery bypass graft surgery on survival: overview of 10-year results from randomised trials by the Coronary Artery Bypass Graft Surgery Trialists Collaboration. Lancet 1994; 344 : 563–570.
7. Boden WE, O’Rourke RA, Teo KK et al. COURAGE Trial Research Group. Optimal Medical Therapy with or without PCI for Stable Coronary Disease. N Engl J Med 2007; 356 : 1503–1516.
8. Boden WE, O’Rourke RA, Teo KK et al. COURAGE Trial Investigators. Impact of optimal medical therapy with or without percutaneous coronary intervention on long-term cardiovascular end points in patients with stable coronary artery disease (from the COURAGE Trial). Am J Cardiol 2009; 104 : 1–4.
9. Fox K, Garcia MA, Ardissino D et al. Task Force on the Management of Stable Angina Pectoris of the European Society of Cardiology; ESC Committee for Practice Guidelines (CPG). Guidelines on the management of stable angina pectoris: executive summary: the Task Force on the Management of Stable Angina Pectoris of the European Society of Cardiology. Eur Heart J 2006; 27 : 1341–1381.
10. Schinkel AF, Bax JJ, Poldermans D et al. Hibernating myocardium: diagnosis and patient outcome. Curr Probl Cardiol 2007; 32 : 375–410.
11. Wiggers H, Noreng M, Paulsen PP et al. Energy stores and metabolites in chronically reversibly and irreversibly dysfunctional myocardium in humans. J Am Coll Cardiol 2001; 37 : 100–108.
12. Depre C, Kim SJ, John AS et al. Program of cell survival underlying human and experimental hibernating myocardium. Circ Res 2004; 95 : 433–440.
13. Wiggers H, Nielsen SS, Holdgaard P et al. Adaptation of nonrevascularized human hibernating and chronically stunned myocardium to long-term chronic myocardial ischemia. Am J Cardiol 2006; 98 : 1574–1580.
14. Bax JJ, Schinkel AF, Boersma E et al. Extensive left ventricular remodeling does not allow viable myocardium to improve in left ventricular ejection fraction after revascularization and is associated with worse long-term prognosis. Circulation 2004; 110 (11 Suppl 1): II18–II22.
15. Allman KC, Shaw LJ, Hachamovitch R et al. Myocardial viability testing and impact of revascularization on prognosis in patients with coronary artery disease and left ventricular dysfunction: a meta-analysis. J Am Coll Cardiol 2002; 39 : 1151–1158.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2009 Issue 9-
All articles in this issue
- Myokarditidy
- Transplantace srdce
- Kombinační léčba hypertenze blokátory osy renin-angiotenzin
- Hladiny cholesterolu v závislosti na věku
- Echokardiografie u nemocných s ischemickou chorobou srdeční
- Transplantace krvetvorných buněk
- Chronická B-lymfatická leukemie a jí podobné stavy
- Tako-tsubo kardiomyopatie
- Snížení obsahu soli v potravě – opomíjený postup v prevenci a léčbě hypertenze v populaci
- Léčit, či neléčit nemocné s chronickým srdečním selháním statiny?
- Jak zlepšit odpověď na srdeční resynchronizační léčbu?
- Kontrola kardiovaskulárních rizikových faktorů u diabetiků 2. typu
- Prediabetes – 2009
- Některé současné názory na chronickou ischemickou srdeční chorobu
- Cílové hodnoty léčby hypertenze. Budou platit i u starších hypertoniků, diabetiků a u pacientů s ICHS?
- AT1-blokátory u arteriální hypertenze
- Význam autologní transplantace u mnohočetného myelomu
- Jaterní cirhóza a její léčba
- Chirurgická léčba plicní embolie
- Nejčastější chlopenní vady srdce: aortální stenóza a mitrální regurgitace. Několik poznámek ke guidelines a k doporučením kardiologických společností
- Diabetes a vaskulárne poškodenie
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hladiny cholesterolu v závislosti na věku
- Chronická B-lymfatická leukemie a jí podobné stavy
- Jaterní cirhóza a její léčba
- Transplantace krvetvorných buněk
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

