-
Medical journals
- Career
Naše první zkušenosti s transplantací autologních kmenových buněk kostní dřeně v léčbě pakloubů, opožděného hojení zlomenin a defektních zlomenin dlouhých kostí
Authors: M. Šír 1; V. Procházka 2; J. Gumulec 3; L. Pleva 1
Authors‘ workplace: Traumatologické centrum FN Ostrava, přednosta doc. MUDr. Leopold Pleva, CSc. 1; Radiodiagnostický ústav FN Ostrava, přednostka prim. MUDr. Jana Chmelová, Ph. D. 2; Ústav klinické hematologie FN Ostrava, přednosta prim. MUDr. Jaromír Gumulec 3
Published in: Vnitř Lék 2009; 55(3): 187-189
Category: 15th Parizek's Days
Overview
Ačkoliv došlo v posledních letech k velkému rozvoji traumatologie a ortopedie v používání nových sofistikovaných technik, implantátů a navigačních metod, dochází nadále v některých případech k selhání těchto nových metod. Jednou z cest do budoucnosti je regenerativní medicína využívající růstový potenciál kmenových buněk, které mají schopnost obnovovat poškozené tkáně. Nabízí se komplexnější využití kmenových buněk kostní dřeně, které se již řadu let využívají v transplantační medicíně. V traumatologii a ortopedii se kmenové buňky mohou uplatnit v léčbě kostních defektů, tedy v léčbě pakloubů, opožděného hojení zlomenin, defektních zlomenin a aseptických kostních nekróz. Růst a tvorba kosti je složitý proces s převahou anabolických dějů a řadou zpětných vazeb, nicméně právě v kostní dřeni pacienta se nalézají potřebné progenitory kostního růstu. Jsou to mezenchymální kmenové buňky MSCs (Mesenchymal Stem Cells), hemopoetické kmenové buňky HSCs (Hemopoietic Stem Cells) a také trombocyty obsahující řadu potřebných růstových faktorů. Existuje řada prací s pozitivními výsledky léčby pakloubů kmenovými buňkami, pouze několik z nich je však v humánní medicíně statisticky významných. V Traumatologickém centru FN Ostrava jsme v roce 2008 tuto metodu použili u 11 pacientů. Ve sledovaném souboru jsme léčili paklouby dlouhých kostí, opožděné hojení tříštivých zlomenin a defektní zlomeniny dlouhých kostí. Autologní koncentrát kmenových buněk kostní dřeně jsme v jednom sezení v lehké anestezii Propofolem aplikovali do místa kostního defektu. Výsledky tohoto málo početného souboru pacientů ještě nejsou k dispozici, nicméně získali jsme první zkušenosti.
Klíčová slova:
regenerativní medicína – kmenové buňky kostní dřeně – léčba pakloubůÚvod
V posledních letech se zvyšují požadavky na nákladný osteosyntetický materiál a sofistikované kloubní protézy. Je to důsledkem skutečnosti, že se u mladších lidí zvyšuje počet vysokoenergetických úrazů při rizikových sportovních aktivitách a starší generace touží prožít své stáří aktivně s dokonalými kloubními náhradami. Začínají se ve větší míře používat nové biomateriály a do praxe se zavádí zcela nové, ale finančně velmi nákladné metody (navigace). Jedním z východisek do budoucnosti je nalezení nových medicínských postupů, které by nebyly tolik finančně náročné.
Jako velmi perspektivní se jeví přímé využití růstového potenciálu tkání a orgánů – regenerativní medicína. Nejsnadnější cestou v této oblasti je rozsáhlejší a komplexnější využití kmenových buněk kostní dřeně, které se již řadu let užívají v transplantační medicíně, především v léčbě leukemie.
V traumatologii a ortopedii se výzkum v oblasti autologních kmenových buněk ubírá cestou podpory kostního hojení tam, kde je z nejrůznějších důvodů zpomaleno. Jedná se především o paklouby, opožděné hojení zlomenin, defektní zlomeniny a aseptické kostní nekrózy. Standardní léčba pakloubů představuje obvykle operační léčbu spočívající:
- v odstranění vaziva, které nedovoluje dohojení kosti v místě původní zlomeniny
- dekortikaci, což je oživení obou konců kosti, které ztratily růstový potenciál
- podpoře kostního hojení (produkce kostní hmoty):
– vložením vitálního štěpu autologní kosti nebo štěpu heterologního
– distrakční osteogenézou dle Ilizarova
– kostním štěpem s mikrovaskulární anastomózou
- ve stabilizaci (klid pro hojení) vnitřní nebo zevní fixací
Existuje řada publikovaných prací, které dokazují příznivý účinek aplikace kmenových buněk v léčbě pakloubů, pouze jedna práce prof. Ph. Hernigou a spolupracovníků v léčbě atrofických pakloubů tibie je významná. Autoři zde dosáhli 80% zhojení avitálního pakloubu tibie po perkutánní aplikaci autologních kmenových buněk kostní dřeně v kombinaci s léčbou zevním fixátorem.
Výsledky výzkumu kmenových buněk v traumatologii a ortopedii ukazují, že jejich aktivitu využíváme 2 základními směry:
- Přímou perkutánní aplikací autologních kmenových buněk kostní dřeně dostáváme do cílových tkání buněčné progenitory procesu reparace kosti a jiných tkání pojiva.
- Využíváme kmenových buněk jako vehikula, s jehož pomocí dostáváme do cílových tkání genovou výbavu, která následně ovlivňuje přítomné potenciální buňky k produkci růstových faktorů.
Podle recentních znalostí je reparace kosti proces vyžadující přítomnost progenitorů angiogeneze z hemopoetické části kostní dřeně (charakterizovány stěnovými antigeny CD 34, CD 45), progenitorů kostního růstu z mezenchymálních buněk kostní dřeně (CD 29, CD 44, CD 71, CD 105). Současně je nutná přítomnost růstových faktorů pro angiogenezu a kostní hojení, jejich zdrojem jsou trombocyty obsahující řadu těchto růstových faktorů (VEGF, PDGF, TGF, IGF, FGF, EGF) a také vlastní progenitorové buňky, které secernují další nutné růstové faktory.
Ve zdravé kosti neustále probíhají anabolické i katabolické pochody. Kostní růst je však svou povahou převážně anabolický proces. Existují 4 základní principy umožňující růst, resp. produkci kosti:
- a) osteoindukce, kterou způsobují růstové kostní faktory (růstové kostní faktory jsou přítomny ve vitální kosti, trombocytech, kmenových buňkách kostní dřeně); hlavní úlohu v osteoindukci mají kostní růstové faktory – BMP 2, 7 (Bone morphogenetic protein) – regulují chemotaxi, mitózu a diferenciaci kostních buněk, hrají roli v inicializaci kostního hojení, další významnou úlohu mají růstové faktory obsažené v trombocytech
- b) osteoprodukce – tuto schopnost mají především osteoblasty, které jsou obsaženy ve vitálních kostních štěpech a kmenových buňkách kostní dřeně
- c) osteokondukce je podpora migrace osteogenních buněk do místa kostního defektu (anorganická část kostních štěpů, kalcium trifosfát, hydroxyapatit)
- d) mechanická stimulace – vzniká při zátěži končetiny při chůzi nebo biofyzikální stimulací (low intensity ultrasound); bylo prokázáno, že mechanická stimulace ovlivňuje proliferaci a diferenciaci osteogenních buněk
Chirurgická technika
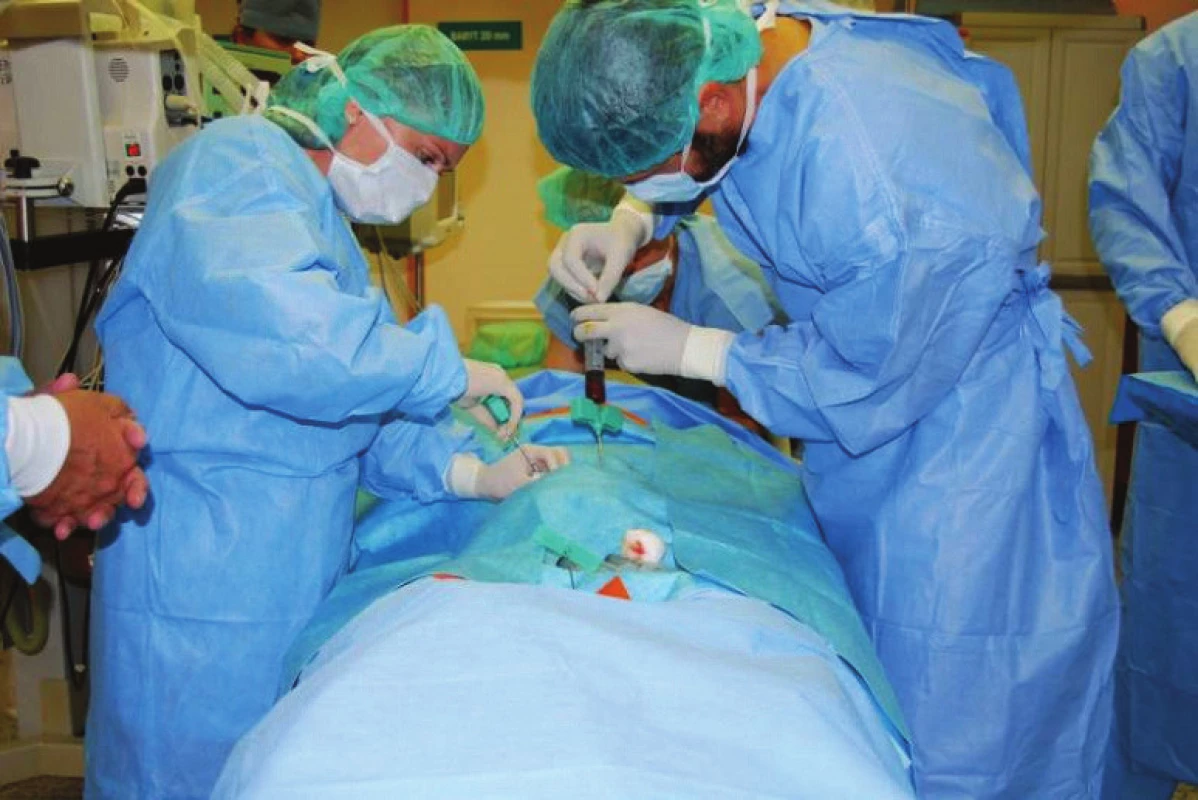
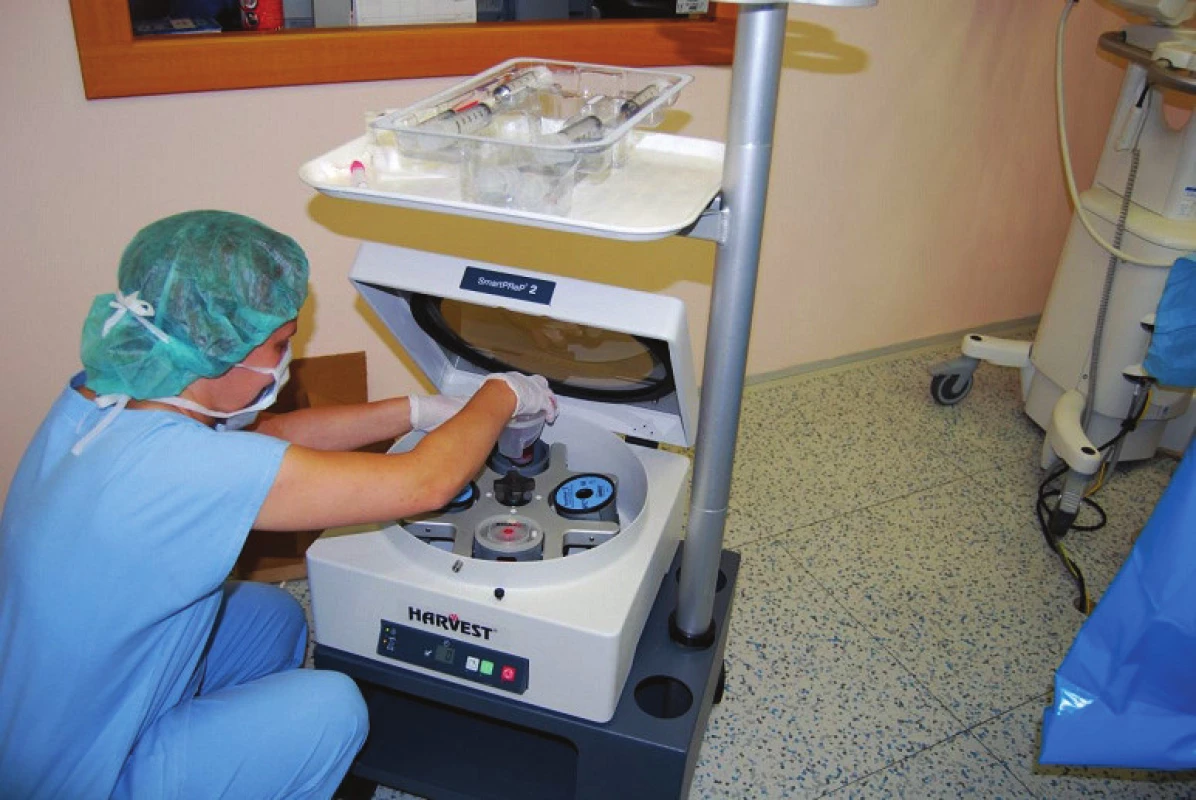
Provádí se v šetrné anestezii Propofolem, nejprve se provede perkutánní odběr kostní dřeně z obou lopat kostí kyčelních v pozici na břiše (obr. 1). Získáváme 120–240 ml punktátu kostní dřeně, technika odběru je taková, že odebíráme kostní dřeň po částech, aby nedocházelo k aspiraci většího množství periferní krve. Odebraná kostní dřeň je ihned přemístěna do plastikových sáčků s antikoagulačními látkami (obr. 2). Poté je provedena centrifugace trvající 15 min, kdy dochází k separaci buněk s lehčími jádry (bezjaderných buněk), které jsou odstraněny společně s plazmou z koncentrátu (obr. 3). Získáme koncentrát jaderných buněk kostní dřeně, který obsahuje asi 16–20 % původního objemu punktátu. Tento koncentrát obsahuje progenitory kostního růstu. 1 ml koncentrátu obsahuje až 20 milionů jaderných buněk, z nichž asi 1 500 je kmenových buněk mezenchymálních.
Image 2. Příprava dřeňového koncentrátu. 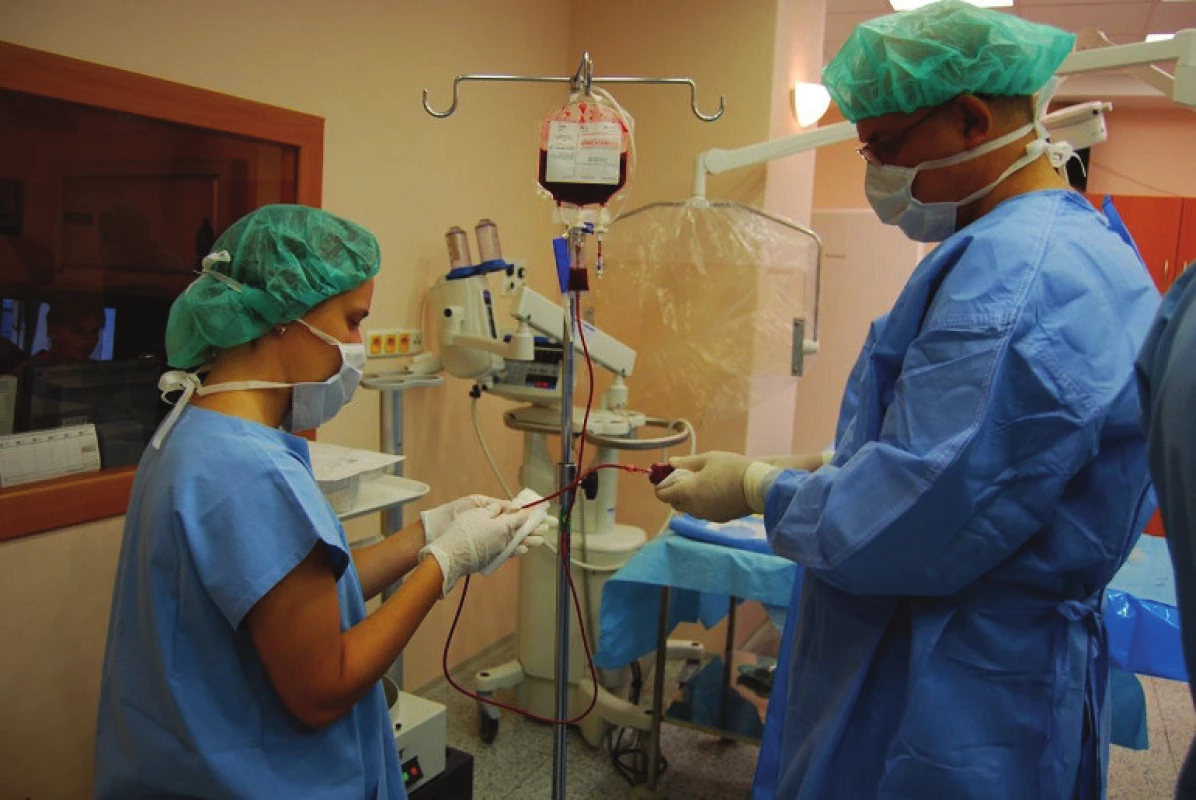
Stejným trokárem, který byl použit na aspiraci kostní dřeně, pak provádíme vlastní perkutánní aplikaci do místa pakloubu. Pozice špičky trokáru je kontrolována RTG zesilovačem (obr. 4, 5). Špičkou trokáru nejprve rozrušíme vazivovou tkáň v místě pakloubu a posléze pomalu aplikujeme koncentrát mezi oba konce kosti z laterálního i mediálního přístupu tak, aby byl koncentrát uložen v celém rozsahu pakloubu (obr. 6). Kožní vstup uzavíráme zdrhovacím stehem.
Obr. 4, 5. Kontrola pozice trokáru pod RTG zesilovačem. 
Image 4. Perkutánní aplikace dřeňového koncentrátu do místa pakloubu. 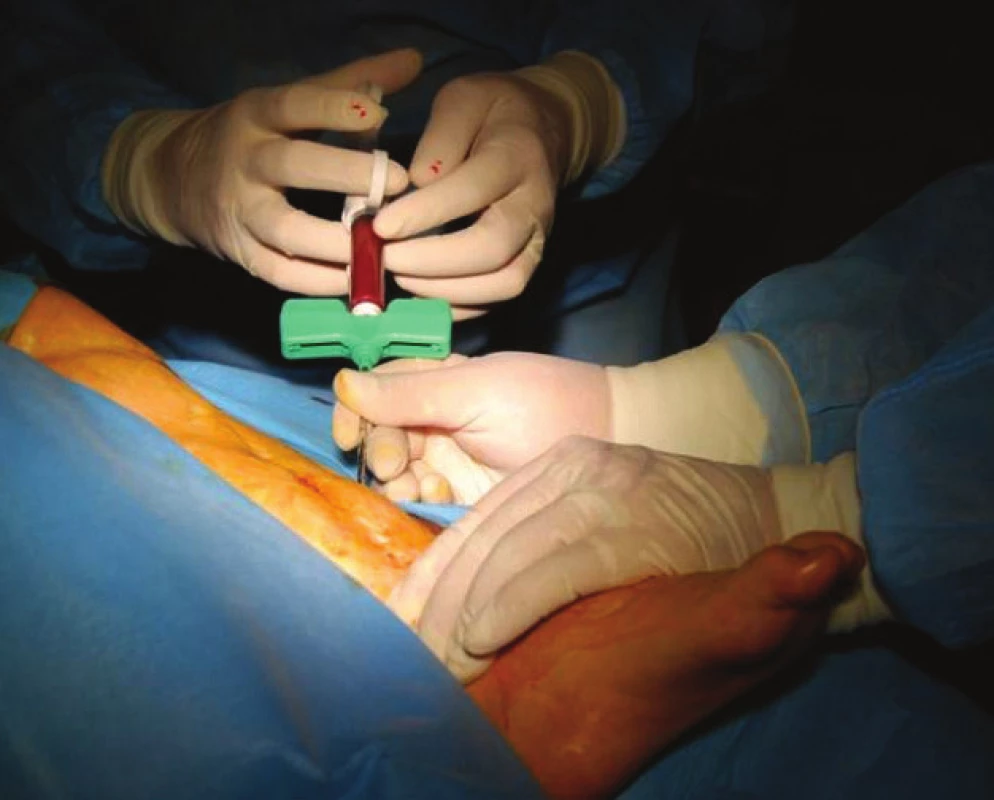
Pooperační péče
Všichni pacienti mají provedenu stabilizaci pakloubu vnitřní nebo zevní fixací, 1. týden není dovoleno končetinu zatěžovat, protože očekáváme vznik vaskularizace. Od 2. týdne dovolujeme postupně se zvyšující zátěž končetiny při chůzi až do plné zátěže po 5 týdnech. Tímto způsobem jsme léčili celkem 11 pacientů (tab. 1).
Závěr a výsledky
Soubor pacientů nelze prozatím hodnotit, protože uběhla krátká doba léčby, soubor je málo početný a u některých pacientů probíhal současně infekční proces měkkých tkání. Nicméně první zkušenosti jsme již získali.
Všichni pacienti hodnotili vlastní operační aplikaci kmenových buněk jako bezproblémovou.
Zaznamenali jsme velmi dobrý analgetizační efekt. U prvních pacientů jsme nerozrušovali vazivo, u dalších již rutinně vazivo pakloubu perkutánně rozrušujeme trokárem. U 2 pacientů jsme využili klasické součásti léčby pakloubů, byla provedena komprese pakloubu zevním fixátorem s osteotomií fibuly kvůli velkému defektu kosti. U pacientů se současně probíhajícím infektem měkkých tkání tato metoda není vhodná. V budoucnu budeme do koncentrátu autologních buněk kostní dřeně přidávat osteokonduktivní materiály (tento postup bude vyžadovat otevřenou operační léčbu). Chystáme se vyzkoušet směs autologních buněk kostní dřeně s trombocytárním gelem. Později přidáme i modulaci léčby rekombinantními růstovými faktory (BMP).
Doručeno do redakce: 9. 2. 2009
MUDr. Milan Šír
www.fnspo.cz
e‑mail: milan.sir@fnspo.cz
Sources
1. Hernigou P, Mathieu G, Poignard Aet al. JBJS Percutaneous Autologous Bone – Marrow Grafting for Nonunions Pountos. J Bone Joint Surg Br 2005; 87 : 1430–1437.
2. Jones E, Tzioupis C, McGonagle D et al. Growing bone and cartilage. The Role of Mesenchymal Stem Cells. J Bone Joint Surg Br 2006, 88 : 421–426.
3. Simpson AHRW, Mills L, Noble B. The role of growth factors and related agents in accelerating fracture healing. J Bone Joint Surg Br 2006; 88 : 701–705.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2009 Issue 3-
All articles in this issue
- Prevence žilní tromboembolické nemoci v ortopedii a traumatologii
- Antitrombotická profylaxe v těhotenství
- Profylaxe venózního tromboembolizmu v gynekologii
- Operace srdce jako závažný zásah do koagulačního stavu pacienta
- Péče o pacienty s nemocí chladových protilátek, kryoglobulinemií a kryofibrinogenemií před kardiochirurgickými zákroky
- Trombofilní stavy: význam pro prevenci a léčbu žilního tromboembolizmu
- Antifosfolipidový syndrom v roce 2009
- Metabolické a aktivační děje v krevních destičkách a možnosti jejich inhibice
- Úloha kaválních filtrů v prevenci plicní embolie
- Příprava pacientů s antikoagulační léčbou k invazivním zákrokům
- Krvácivé komplikace antikoagulační léčby
- Laboratorní postup při nálezu trombocytopenie
- Pokroky v antitrombotickej liečbe – antitrombotiká s anti‑Xa účinkom
- Molekulární metody v diagnostice trombofilních stavů
- Záchrana ischemickej končatiny terapeutickou angiogenézou
- Užití adultních humánních kmenových buněk kostní dřeně při terapii míšního poranění
- Naše první zkušenosti s transplantací autologních kmenových buněk kostní dřeně v léčbě pakloubů, opožděného hojení zlomenin a defektních zlomenin dlouhých kostí
- Profylaxe tromboembolické nemoci ve vnitřním lékařství
- Prevence žilního tromboembolizmu v chirurgii, laparoskopické chirurgii, urologii
- Profylaxe a léčba tromboembolické nemoci v onkologii
- Transplantace autologních kmenových buněk kostní dřeně u pacientů s chronickou kritickou končetinovou ischemií a diabetickou nohou
- Trombotické komplikace u dětí s onkologickým onemocněním
- Léčba trombózy u dětí pomocí kontinuální intravenózní infuze – možná alternativa k subkutánnímu podání tam, kde je třeba
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Laboratorní postup při nálezu trombocytopenie
- Péče o pacienty s nemocí chladových protilátek, kryoglobulinemií a kryofibrinogenemií před kardiochirurgickými zákroky
- Prevence žilní tromboembolické nemoci v ortopedii a traumatologii
- Antitrombotická profylaxe v těhotenství
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career