-
Medical journals
- Career
Léčba mnohočetné angiomatózy postihující skelet, břišní i hrudní dutinu interferonem α, thalidomidem a zoledronátem
Authors: Z. Adam 1; L. Křikavová 2; M. Krejčí 1; M. Mechl 2; L. Pour 1; M. Moulis 3; J. Vaníček 4; Č. Neumann 5; M. Navrátil 1; K. Veselý 6; J. Vorlíček 1
Authors‘ workplace: Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Vorlíček, CSc. 1; Radiologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří A. Válek, CSc. 2; Ústav patologie Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jirka Mačák, CSc. 3; Klinika zobrazovacích metod Lékařské fakulty MU a FN u sv. Anny Brno, přednosta doc. MUDr. Petr Krupa, CSc. 4; Chirurgická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Zdeněk Kala, Ph. D. 5; I. patologicko-anatomický ústav Lékařské fakulty MU a FN u sv. Anny Brno, přednostka doc. MUDr. Markéta Hermanová, Ph. D. 6
Published in: Vnitř Lék 2008; 54(6): 653-664
Category: Case Reports
Overview
Mnohočetná angiomatóza je velmi raritní onemocnění, tvořené histologicky benigními angiomatózními útvary, které přesahují jeden orgán či tkáň. U popisovaného případu mladého muže poškozovaly hemangiomy více obratlů, prorůstaly peritoneální dutinou a zasahovaly i do žaludku a způsobovaly opakovanou hematemezi. Angiomatózní hmoty zasahovaly i do mediastina. Pacient měl bolesti kostí a zažívací potíže. Léčba byla zahájena zprvu 2 léky s antiangiogenním působením: interferonem α (zprvu 6 milionů jednotek 3krát týdně, pro nežádoucí účinky dávka redukována na 3 milióny 3krát týdně) a zoledronátem (4 mg i.v. 1krát za 28 dní). Při této léčbě sice po 2 měsících vymizely bolesti kostí, ale dle pozdější CT kontroly došlo jen k malé regresi angiomatózních hmot v dutině břišní a v mediastinu. Teprve přidání thalidomidu (Myrin) v dávce 100 mg denně k pravidelné aplikaci výše uvedených dávek interferonu a zoledronátu způsobilo dle CT kontroly zásadní zmenšení angiomatózních hmot na pouhá rezidua, tedy parciální remisi nemoci. Po přerušení léčby však došlo po roce k recidivě, takže nyní byla obnovena léčba uvedenou trojkombinací. Při opakovaném dosažení regrese angiomatózních hmot bude následovat udržovací léčba. Kombinovaná léčba interferonem α, thalidomidem a zoledronátem prokázala velmi dobrý léčebný účinek u tohoto případu mnohočetné angiomatózy.
Klíčová slova:
angiomatosis - osteolýza - mnohočetný myelom - zoledronát - thalidomid - interferon αÚvod
Vaskulární neoplazie zahrnují heterogenní skupinu cévních proliferací, skládajících se z endoteliálních buněk, hladké svaloviny a pericytů, které dohromady vytvářejí ložiska arteriálních, kapilárních, venózních nebo lymfatických cest, tak jak je uvádí tab. 1. Do skupiny s agresivnějším chováním patří vzácné případy tzv. angiomatózy, což je klinický i patologicko-anatomický termín pro velké, neohraničené a někdy i vícečetné hemangiomy, tvořící cévní tumory, které prorůstají orgány a tkáněmi a postupně progredují. Ačkoliv gastrointestinální angiomatóza je obvykle benigní, přesto může být příčinou náhlého úmrtí, způsobeného nezastavitelným krvácením nebo střevní obstrukcí.
Table 1. Diferenciální diagnostika reaktivních a neoplastických vaskulárních lézí [7,23]. ![Diferenciální diagnostika reaktivních a neoplastických vaskulárních lézí [7,23].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/69d8b63477ae7366003d9ed1362c4e5f.png)
Tab. 1. Diferenciální diagnostika reaktivních a neoplastických vaskulárních lézí [7,23] – pokračování. ![Tab. 1. Diferenciální diagnostika reaktivních a neoplastických vaskulárních lézí [7,23] – pokračování.](https://pl-master.mdcdn.cz/media/image/69291f6b0f7e6ef85c7acc9b1b656384.png?version=1537794419)
Následujícím popisem případu chceme upozornit na tyto vzácné a obtížně diagnostikovatelné případy. Symptomy angiomatózy lze přirovnat k chameleonovi, neboť se liší dle toho, který orgán je postižen. Relativně konstantním příznakem, provázejícím angiomatózu většího rozsahu, je chronická stabilní diseminovaná intravaskulární koagulace s nízkou koncentrací fibrinogenu, zvýšenými D-dimery a případně s protaženými koagulačními časy a sníženým počtem trombocytů, obvykle bez zřetelných krvácivých projevů. Pokud tento typ koagulopatie zjistíme, je nutno v první radě pomýšlet na cévní neoplazie.
Popis případu
Klinický průběh a výsledky vyšetření
S mnohočetnou angiomatózou jsme se setkali u mladého muže (ročník 1977). Stručně shrneme jeho anamnézu. V 8 letech prodělal nekomplikovanou apendektomii. V roce 1992 (15 let) vznikla náhle hydrokéla ve varleti vlevo a o rok později vpravo, řešena chirurgicky. Pak se mu vedlo opět dobře. První problémy, související s angiomatózou, se objevily v dubnu roku 2003 (26 let). Začal pociťovat bolesti v bederní páteři, zprvu jen při námaze, později i v klidu. Původ bolestí byl zprvu vysvětlován sportem, byly provedeny „opichy“ a rehabilitační léčba, vše bez efektu. Když se tato obvyklá léčba bolestí zad minula účinkem, byl odeslán na RTG snímek páteře, na němž byl abnormální nález, hodnocený jako kostní dysplazie nebo Pagetova choroba. A s tímto podezřením, plynoucím z RTG snímku, byl poslán na ortopedickou kliniku. V roce 2003 vyslovili radiodiagnostici na základně MRI páteře podezření na vícečetnou kostní formu angiomatózy (obr. 1, 2 a 3). Bylo to poprvé, kdy se v dokumentaci nemocného objevil termín angiomatóza. Pro nejasný obraz na snímku páteře a pánve byla provedena první excize a histologické vyšetření kosti, bez jasného závěru. S cílem ověřit toto podezření byla provedena v říjnu roku 2003 angiografie tepen v oblasti pánve, která neprokázala nic patologického a nepotvrdila tedy podezření, plynoucí z MRI obrazu skeletu.
Image 1. T2 vážený obraz, sagitální obraz bederní páteře. V oblasti obratlových těl je patrná nehomogenně skvrnitá struktura s převažujícím vyšším signálem, který svědčí o patologické infiltraci kostní dřeně. 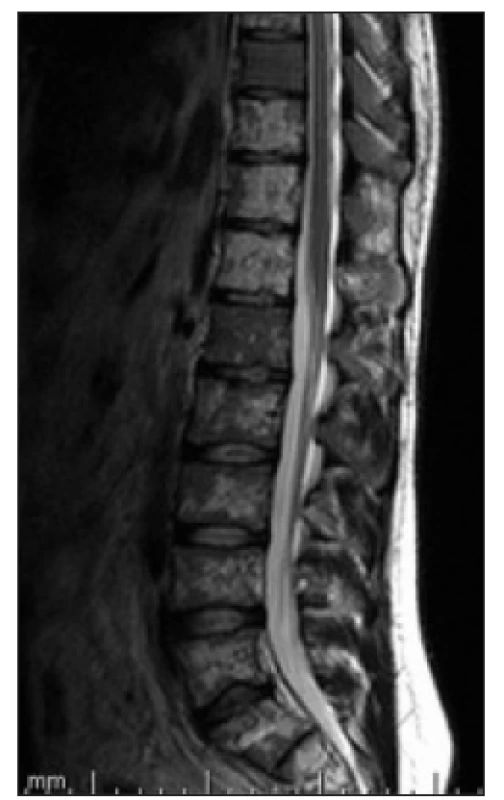
Image 2. T1 vážený obraz, sagitální obraz bederní páteře. Nehomogenní signál z kostní dřeně obratlových těl s převažujícími okrsky nízkých intenzit ve srovnání s intenzitami meziobratlových plotének, které ukazují na abnormální strukturu kostní dřeně. Páteřní kanál je volný. 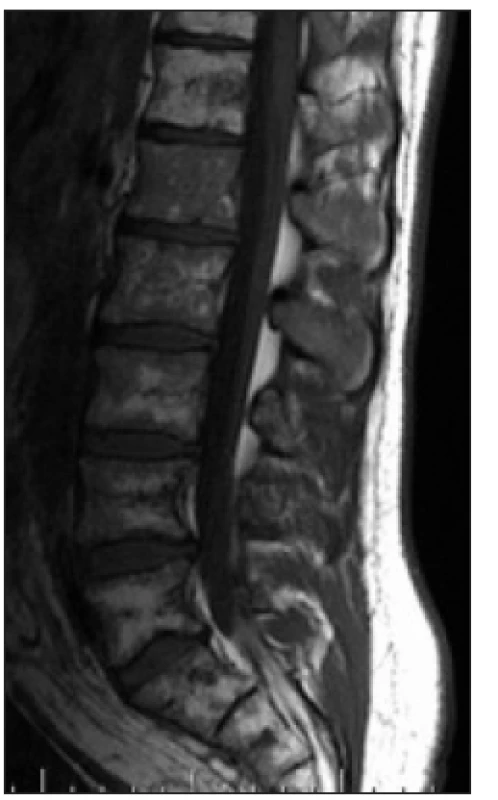
Image 3. T2 vážený obraz, koronární obraz sakroiliakálního skloubení. Patrná je infiltrace kosti křížové (nehomogenně zvýšený signál) a dále též ilické kosti přilehlé sakroiliakálnímu skloubení vlevo. 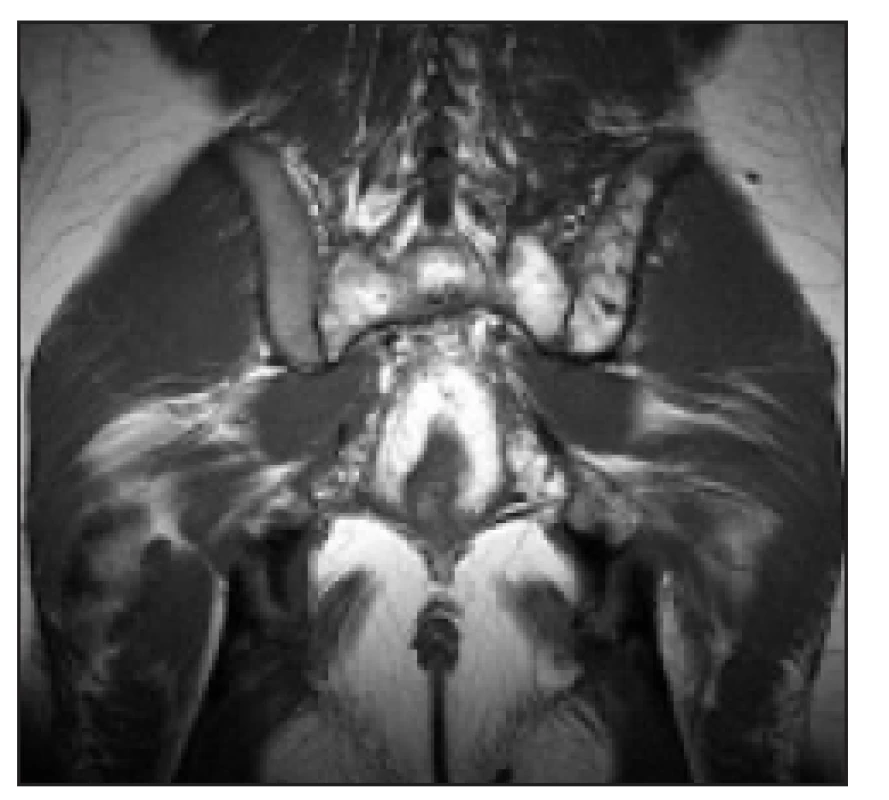
V prosinci roku 2003 provedena punkce pánve pod CT kontrolou ze suspektního ložiska, bez jednoznačného diagnostického závěru. Nejasné kostní postižení, které způsobovalo bolesti, zůstávalo pořád bez jasného pojmenování.
V únoru roku 2004 provedli ortopedové další excizi z lopaty kosti kyčelní. Výsledek histologie byl zavádějící, vzorek byl hodnocen jako fibróza kostní dřeně, a vzniklo tak podezření na primární myelofibrózu.
Vyslovené podezření na myelofibrózu bylo důvodem, proč byl pacient poslán na Interní hematoonkologickou kliniku v Brně. V březnu roku 2004 byla provedena standardní vyšetření, prováděná pro diagnostiku myelofibrózy, která však tuto nemoc nepotvrdila. Hodnoty krevního obrazu, koagulace a fibrinogenu byly zcela v normě. Aspirační hodnocení kostní dřeně ze sternální punkce (myelogram) bylo bez patologie. Hematologické vyšetření bylo ukončeno v květnu roku 2004 se závěrem: „Myelofibróza ani jiné krevní onemocnění nepotvrzeno“.
Vzhledem k tomu, že se současně s bolestmi v zádech objevily nespecifické tlakové bolesti v oblasti břišní dutiny, začal mladý muž docházet na gastroenterologické pracoviště. Byly provedeny opakované kolonoskopie (první 20. 5. 2003). V oblasti levého tračníku byly patrné červené makuly s centrálním projasněním. V terminálním ileu pouze nodulární hyperplazie. První histologie při kolonoskopii byla odebrána v roce 2003. Závěr zněl: mírná folikulární lymfoidní hyperplazie s lehce nadlimitní zánětlivou celulizací. Dále provedena gastroskopie bez jasně patologického makroskopického a mikroskopického nálezu. Nález na střevě přináší obr. 4 a 5.
Image 4. Nález na střevě při kolonoskopii. 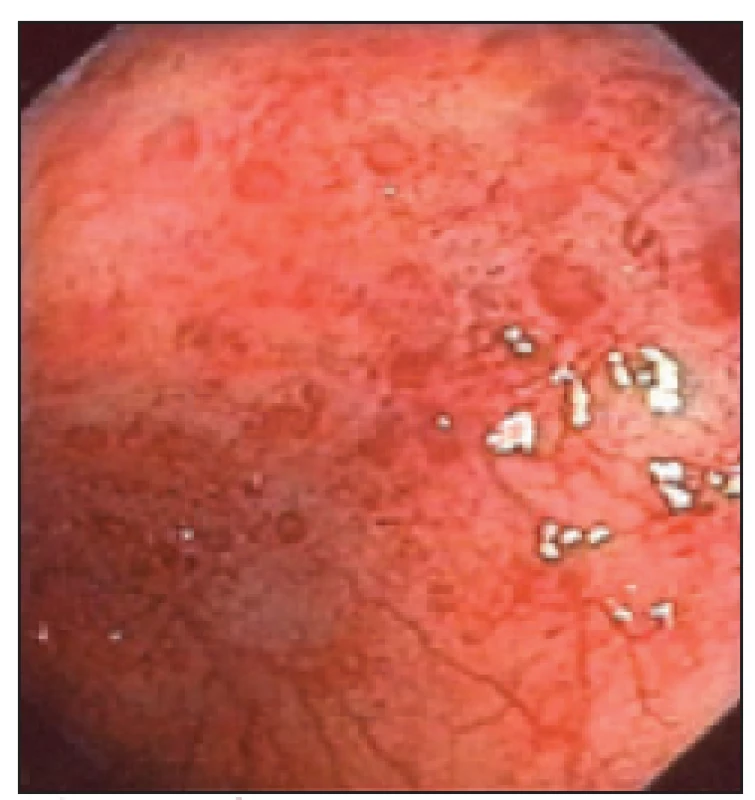
Image 5. Nález na střevě při kolonoskopii. 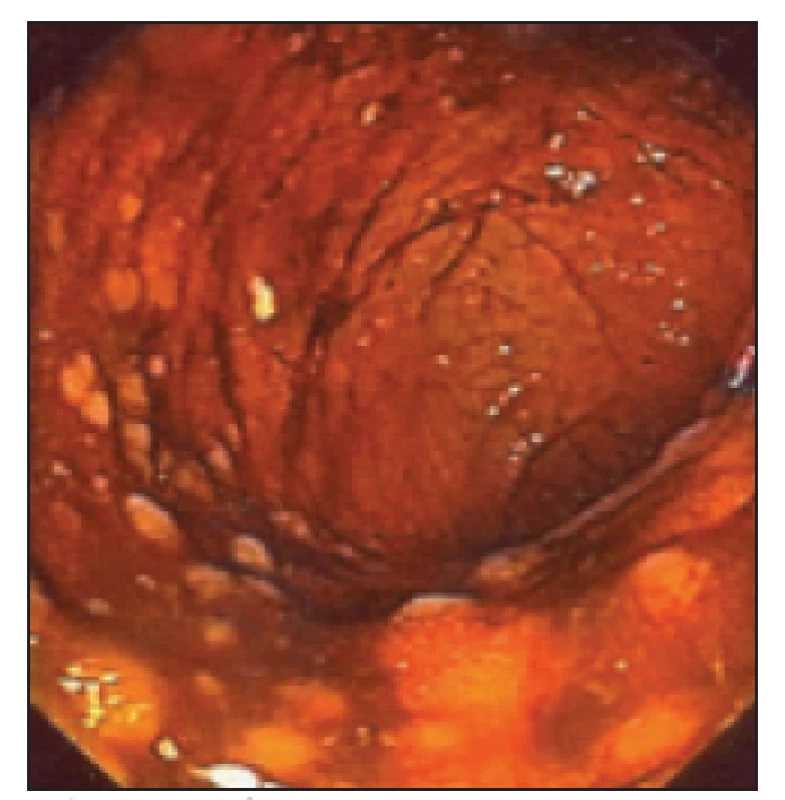
Obr. 6 a 7. CT vyšetření břicha po intravenózní aplikaci jodové kontrastní látky ze dne 9. 5. 2005 – před zahájením léčby. Šipka ukazuje na patologickou infiltraci v retroperitoneu, která je hypodenzní a postkontrastně se nesytí. 
Obr. 8 a 9. CT vyšetření břicha po intravenózní aplikaci jodové kontrastní látky ze dne 17. 10. 2005 – po zahájení léčby. Patrna je regrese retroperitoneální infiltrace (šipka), která zmenšila svůj objem, její denzity však zůstávají nezměněné. 
Obr. 10 a 11. CT vyšetření břicha po intravenózní aplikaci jodové kontrastní látky ze dne 29. 1. 2007 – po léčbě – již jen zcela minimální rezidua atologických hmot v retroperitoneu (šipka), a to především paraaortálně vpravo v úrovni hlavy pankreatu. 
Obr. 12 a 13. CT vyšetření hrudníku po intravenózní aplikaci jodové kontrastní látky ze dne 6. 5. 2005 – před zahájením léčby – hypodenzní atologická infiltrace mediastina retrosternálně, paratracheálně a subkarinálně (šipky), která má stejné denzitní charakteristiky jako infiltrace v retroperitoneu. 
Počátkem roku 2005 došlo ke zhoršení zdravotního stavu, bolesti v zádech se zhoršovaly, objevily se otoky nohou a sideropenická anémie.
V květnu roku 2005 byl přijat na naše pracoviště se závažnou anémií, vyžadující transfuze. Dalším překvapivým nálezem byla hypoproteinemie. Okultní krvácení nebylo nepotvrzeno, vstřebávací křivka železa byla normální, a tak začala léčba preparáty železa. Proteinurie nebyla potvrzena, a tak se předpokládaly ztráty bílkovin zažívacím traktem. Opakovala se kolonoskopie se závěrem: „obraz lehké nodulární hyperplazie na céku, v colon descendens pod lienální flexurou byl popsán okrsek skrvnité hyperemie, o průměru 3 cm. V sigmoideu drobná aftózní ložiska s hyperemickým lemem. Histologicky opět nespecifické změny“.
Pro nejasný stav byla v květnu roku 2005 odebrána uzlina z třísla. Ta však neobjasnila nejasný nález na CT břišní dutiny z května roku 2005 (obr. 6, 7, 12 a 13), a proto byla v květnu roku 2005 provedena laparotomie. Po otevření dutiny břišní byl překvapující nález velkých hemangiomatózních uzlů v oblasti mezenteria a retroperitonea.
Operační nález z probatorní laparotomie: peritoneální dutina bez výpotku.
- Revize tenkých kliček: asi do 1/2 orálního jejuna patrná atypická struktura, zesílená granulovaná stěna, další tenké střevo normálního charakteru. Provedena enterotomie a odběr stěny v celé síle na histologii. Mesenterium příslušné takto změněnému střevu je zesílené, hmatné uzliny a houbovitá tkáň s dilatovanými cévami.
- Revize podjaterní krajiny: celá stěna žlučníku prorostlá vaskulární tkání, ligamentum hepatoduodenale infiltrované, patrná dilatovaná cévní pleteň. Játra palpačně i vizuálně bez patologií, slezina normální velikosti a struktury.
- Maximum změn nacházíme v retroperitoneu, z něhož se vyklenuje tkáň houbovité struktury, ze které prosvítají uzly charakteru hemangiomů a procházející cévy průměru 0,5-1,0 cm. Tyto změny sestupují až k ilickým svazkům. Dále je jimi prostoupeno téměř celé mezokolon. Volný úsek jen od hepatické flexury do 1/2 příčného tračníku. Směrem k lienální flexuře cévní změny patrny i při okraji střeva. Mezosigma již celé prostoupené, nedovoluje manipulaci se střevem, ale přesto patrny cévní malformace i na stěně břišní směrem k lopatě kosti kyčelní. Za vzestupným tračníkem hmatná stejná tkáň jako v retroperitoneu.
- Žaludek bez výraznějších patologií, v oblasti pyloru až k duodenu začínají obdobné patologické změny s dilatovanými žilami. Nad žaludkem v retroperitoneu stejný nález angiomatózy. Odběr histologie z retroperitonea hrozí exsangvinací, a proto nebyl neproveden. Byla odebrána část tkáně z adheze mezi žlučníkem a duodenem, kterým probíhá dilatovaná céva. Dále na stěně pyloru volíme jedno místo s dilatovanou cévou a mezi stehy provádíme excizi. Došlo k masivnímu arteriálnímu krvácení, které bylo stavěno prošitím stěny žaludku. Od dalších odběrů se ustoupilo a byla učiněna následující opatření: kontrola hemostázy, drén k pyloru, sutura laparotomie.
- Operační diagnóza: angiomatosis retroperitonei, vesicae feleae a mesocoli.
Shrnutí všech bioptických vyšetření
U daného pacienta byla histologicky vyšetřena excize stěny žaludku s přiléhajícími měkkými tkáněmi, biopsie levé kosti kyčelní, biopsie tříselné uzliny, opakovaně trepanobiopsie z kosti kyčelní a opakovaně mikroexcize ze sliznice duodena.
Diagnostická byla excize stěny žaludku, provedená při explorativní laparotomii. Histologicky byla nalezena vaskulární proliferace, postihující stěnu žaludku a přiléhající měkké tkáně. Ložisko bylo tvořeno spletí krevních cév různého charakteru a kalibru - cévy byly venózního nebo kapilárního typu, byly přítomny i kavernózní prostory, vše náhodně roztroušené. Ojediněle zastiženy také typické klastry malých cév, radiálně vycházejících z centrálně lokalizované větší žíly. V korelaci s klinickým nálezem byla stanovena diagnóza angiomatózy.
Stejná vaskulární proliferace byla zjištěna i v oblasti intertrabekulárních prostorů spongiózní kosti, získané biopsií levé kosti kyčelní. V této lokalizaci byla proliferace provázena sekundární myelofibrózou.
V tříselné uzlině nalezena jako následek cirkulačních změn tzv. vaskulární transformace sinusů, morfologicky neodlišitelná od angiomatózy.
V opakovaných trepanobiopsiích z kosti kyčelní a v opakovaných mikroexcizích sliznice duodena nebyly nalezeny žádné patognomické změny ve vztahu k angiomatóze.
Léčba a její výsledky
Vstupní CT obraz před léčbou dokumentují obr. 6, 7, 12 a 13. Ta byla zahájena 23. června 2005 interferonem α (Introna) a zoledronátem (Zometa). Interferon α byl zpočátku podáván v dávce 6 miliónů jednotek 3krát týdně. Tato dávka však byla spojena s výraznými nežádoucími účinky, které nemocný nebyl schopen dlouhodobě snášet, a proto byly dávky interferonu postupně sníženy na 3 miliony jednotek 3krát týdně. V této dávce toleroval interferon α dlouhodobě.
Zoledronát byl po celou dobu podáván ve standardní dávce 4 mg nitrožilní infuzí v intervalech 28 týdnů, bez jakýchkoliv průvodních nežádoucích projevů.
V průběhu léčby, v září roku 2005, se objevila život ohrožující hematemeze. Mladý muž byl přijat na jednotku intenzivní péče. Konzervativní léčba nevedla k zastavení krvácení, proto bylo přistoupeno k angiografii a embolizaci žaludeční tepny. První MRI vyšetření bylo provedeno 26. 8. 2005 (obr. 14 a 14) a první kontrolní CT vyšetření dne 17. 10. 2005 s nálezem mírné regrese patologické infiltrace (obr. 8 a 9).
Při kontrolním vyšetření po 4měsíční léčbě bylo pouze částečné zmenšení rozsahu patologických hmot na CT zobrazení dutiny břišní a hrudní. Bolesti kostí však ustaly velmi záhy, již po 2 měsících.
Obr. 14 a15. MR vyšetření mediastina ze dne 26. 8. 2005, T1 vážený obraz v sagitální (obr. 9) a koronární (obr. 10) rovině – po zahájení léčby – patologická tkáň v předním mediastinu retrosternálně má v T1 smíšeně nízký signál a je jednoznačně ohraničena oproti okolnímu tuku (šipka). Oboustranná infiltrace paravertebrálně navazuje na obratlová těla, která mají abnormální strukturu (Th8,10,12), což je obraz hemagiomatózy postihující skelet i měkké tkáně. 
Vzhledem k malému účinku výše uvedené 4měsíční léčby interferonem α a vzhledem k nutnosti redukovat v prvních 3 měsících používané vyšší dávky interferonu α (6 milionů jednotek) na 3 milióny jednotek 3krát týdně jsme zvažovali, kterým dostupným lékem potencovat tuto léčbu. Po domluvě s pacientovou zdravotní pojišťovnou byl od června roku 2006 přidán další lék s prokázaným inhibičním vlivem na angiogenezi - thalidomid (Myrin), v dávce 100 mg denně.
V červenci roku 2006 se objevily epiparoxyzmy. Pacient do té doby nikdy neměl epileptický záchvat. Nabízela se souvislost s krvácením v oblasti CNS, proto byl mozek zobrazen metodami MRI a CT. Žádné krvácení či hemangiomy nebyly prokázány. Také EEG neprokázalo patologickou aktivitu v CNS. Thalidomid má nežádoucí účinky na periferní nervy, u některých nemocných ovlivňuje i funkci vyšší nervové činnosti, ale epiparoxyzmy nejsou u tohoto léku popisovány a ani u ostatních nemocných léčených u nás thalidomidem pro mnohočetný myelom jsme epiparoxyzmus nepozorovali. Proto bylo rozhodnuto nepodávat dlouhodobou antiepileptickou léčbu.
Na velmi dobrý léčebný efekt bylo možné usuzovat také z vyšetření koagulace. Při zahájení léčby byly zřetelné známky diseminované intravaskulární koagulace (nízká koncentrace fibrinogenu, pohybující se v rozmezí 1,3-1,5 g/l a vysoké hodnoty D-dimerů, pohybující se mezi hodnotami 10 a 15). Při úspěšné léčbě se intenzita diseminované intravaskulární koagulace zmenšila, takže došlo k vzestupu fibrinogenu na hodnotu 2,6 g/l a také poklesla hodnota D-dimerů na hodnotu kolem 3,0, což je však stále ještě v pásmu patologicky vyšších hodnot.
Podávání trojkombinace (interferon α, thalidomid a zoledronát) bylo přerušeno v prosinci roku 2006 na žádost nemocného. Důvod pro přerušení nebyly nežádoucí účinky této léčby, ale zásadní a pochopitelné přání mladého muže - založit vlastní rodinu. Thalidomid je teratogenní, interferon α sice nemá prokázané nežádoucí vlivy na spermie, u žen bylo popsáno opakované početí a donošení zdravého plodu v průběhu interferonové léčby, takže zde tak rigorózní doporučení pro přerušení léčby není, nicméně interferon α má další nežádoucí účinky (fatigue, často indukuje depresivní nálady), což není optimální situace pro plánované rodičovství.
Vyhodnocení dosažené léčebné odezvy bylo provedeno měsíc po jejím ukončení, v lednu roku 2007 (obr. 10, 11, 16 a 17). Byla prokázána výrazná regrese patologických tkání v břišní dutině a v mediastinu na pouhé reziduální hmoty. Pro hodnocení léčebné odezvy u angiomatózy jsme nenalezli kritéria. Pokud bychom se vyjadřovali v termínech používaných u solidních nádorů, tak dle zobrazovacích vyšetření lze hodnotit léčebný efekt jako parciální remisi nemoci, kompletní remise nebylo dosaženo, protože rezidua byla stále zřetelná, i když již nevelká. Vzhledem k mnohočetnosti ložisek není možné hodnotit míru zmenšení v procentech.
Obr. 16 a 17. CT vyšetření hrudníku po intravenózní aplikaci jodové kontrastní látky ze dne 1. 2. 2007 – po léčbě – patrná je podstatná regrese mediastinálních infiltrátů subkarinálně, s pouze malými rezidui paratracheálně. 
Léčba byla tedy ukončena a domluvili jsme se na kontrolní vyšetření a na obnovení léčby nejpozději do roka a do dne.
Nemoc však předstihla plánovanou kontrolu, mladý muž byl v září roku 2007 opět přijat pro akutní krvácení do žaludku. Při provedeném CT zobrazení byly prokázané opět patologické hmoty v dutině břišní i mediastinu, které dosahovaly téměř původní velikosti před zahájením léčby v červnu roku 2005.
Takže v současnosti nemocný opět pokračuje v pravidelné aplikaci interferonu α v dávce 3 miliony jednotek 3krát týdně, thalidomidu v dávce 100 mg denně se zvažovaným navýšením dávky při dobré toleranci na 150-200 mg denně a pravidelnou aplikací zoledronátu.
Diskuse
Hemangiomy se vyskytují nejčastěji v raném dětském věku, incidence se v jednotlivých publikacích pohybuje mezi 3-10 %. Hemangiomy nejsou výjimečným nálezem ani v dospělosti, jsou často diagnostikovány náhodně při vyšetřování orgánů či tkání metodou sonografie. Mnohočetná angiomatóza, diagnostikovaná v dospělosti, je však velmi raritním onemocněním, o němž lze získat informace z popisu případů, nikoliv z klinických studií. Údaje o incidenci mnohočetné angiomatózy jsme v literatuře nenašli [1-6].
Hemangiomy mohou v dospělosti postihnout kterýkoliv orgán a projevit se v kterémkoliv věku. Expandující hemangiomy mohou způsobit jak lokální kompresi, tak destrukci okolí a mohou být zjevné jako viditelný či hmatný patologický útvar [7-11].
Pokud vzniknou významné arteriovenózní zkraty, tak případně způsobí hyperkinetický oběh a někdy srdeční selhání.
V případech, kdy tyto cévní neoplazie postihují dlouhé kosti a obratle, způsobují bolesti pohybového aparátu. Osteolytická ložiska, patrná na RTG snímku, mohou připomínat mnohočetný myelom [12].
Je-li hemangiom dostatečně velký, může být příčinou stabilní lokalizované intravaskulární koagulace s konzumpcí koagulačních faktorů, snížením fibrinogenu a trvalým zvýšením D-dimerů. Někdy dochází i k sekvestraci destiček a ke trombocytopenii. Klasický Kasabachův-Merittové syndrom je popisován jako hypokoagulace s deficitem trombocytů [13,14].
Nejzávažnější a vždy akutní komplikací je krvácení z hemangiomu, které může být smrtelné. V této kritické a život ohrožující situaci se ukázal přínosným rekombinantní faktor VIIa [15].
V tab. 1 informujeme o současné WHO klasifikaci cévních neoplazií. Rozlišuje vaskulární malformace, benigní, semimaligní a maligní vaskulární tumory. Angiosarkomy jsou velmi vzácné a vyskytují se ve věku kolem 60-70 let. Vyznačují se velmi agresivním chováním. Dříve zmiňované dělení hemangiomů na kapilární, kavernózní a smíšené ztratilo význam, protože v sobě neobsahuje prognostickou informaci. Termíny hemangiom či lymfangiom se používají pro ložiskové, dobře ohraničené procesy. V posledních letech byly popsány některé markery, které umožní odlišit proliferativní a neproliferativní hemangiomy [16,17].
Termín angiomatóza se používá pro víceložiskové a nepřesně ohraničené cévní tumory, které prorůstají více orgány a prostupují více tkání.
Angiomatóza může postihovat oblast gastrointestinálního traktu, střevní stěnu, mezenterium, retroperitoneum a břišní orgány, např. játra. Ačkoliv gastrointestinální angiomatóza je obvykle benigní, přesto může být příčinou náhlého úmrtí, způsobeného nezastavitelným krvácením nebo střevní obstrukcí. Kavernózní střevní hemangiomy někdy vytváření polyploidní útvary, postihují celé střevo, ale i okolní tkáně a orgány. Přibližně 2/3 případů angiomatózy jsou diagnostikovány v prvních 2 dekádách života a téměř všechny případy se projeví do 40 let [11-14,18-22].
Hemangiomy je možné zviditelnit sonograficky, zobrazují se jako hyperechogenní noduly s nepatrným posteriorním akustickým zvýrazněním, lze je prokázat dopplerovským vyšetřením. Vzhledem k difuznímu růstu angiomatózních hmot však v tomto našem případě sonografické vyšetření nevedlo k rozpoznání této nemoci.
Při CT se zobrazují jako hypodenzní ložiska s denzitou odpovídající cévním strukturám, které lze potvrdit typickým sycením po aplikaci kontrastní látky (obr. 2, 6, 7 a 13). Velmi dobře se znázorňují pomocí MRI zobrazení. V T1 váženém obraze mají hemangiomy nízkou intenzitu signálu, zatímco při T2 zobrazení vykazují vysokou intenzitu, která umožní velmi dobře odlišit hemangiomatózní struktury od ostatních orgánů [18-21,24-27].
U popsaného případu mladého muže nebyly v mládí přítomny žádné kožní hemangiomy a ani při apendektomii v dětství nebyla v břišní dutině nalezena žádná patologická angiomatózní ložiska.
První příznaky mnohočetné angiomatózy způsobila destrukce obratlů a pánve pozvolně progredujícími hemangiomy - které již 2 roky před operačně potvrzenou diagnózou tvořily vysoce suspektní obrazy pro tuto diagnózu na MRI zobrazení.
Logický krok ortopedů bylo provedení excize z nejasného ložiska. Odběr z lopaty kosti kyčelní byl patology mylně interpretován jako myelofibróza s podezřením na primární myelofibrózu. Musíme zdůraznit, že při odběrech malého vzorku materiálu při biopsii kosti je stanovení diagnózy angiomatózy téměř nemožné. V literatuře se uvádí, že při histologickém vyšetření kosti, postižené agresivně rostoucím hemangiomem, bývá v histologickém preparátu vždy výrazné fibrózní stroma, které díky krvácení bývá plné depozit hemosiderinu. Pouze v případě, že se provede speciální imunohistochemie - znázornění endoteliálních povrchů pomocí přítomnosti znaků CD31 a CD34, je možné vyslovit podezření na hemangiom [12].
První příznaky angiomatózy, bolesti kostí - a první pokus o histologickou diagnózu z kostní excize tedy nevedly k objasnění diagnózy.
Pacient však měl i břišní diskomfort, byla diagnostikována hypoalbuminemie a také hypochromní anémie. Zažívací potíže byly důvodem k opakovaným endoskopickým vyšetřením. Je zřejmé, že u pacienta dočasně docházelo nejen ke ztrátám krve a železa zažívacím traktem, ale také ke ztrátám bílkovin. Makroskopický obraz střevní sliznice byl sice abnormální, ale nedovolil žádnou jasnou diagnózu, ani biopsie sliznice nepomohla objasnit etiologii viditelných změn. Podobné komplikace popisují i další autoři [7,13,18,28]. Nicméně nemůžeme přesně vysvětlit, proč v určité době došlo k hypoalbuminemii a co přesně způsobilo změny v středním lumen.
V roce 2005 však byla u pacienta nalezena zvětšená uzlina v třísle. Z diagnostických důvodů byla exstirpována a následovalo CT mediastina a břicha v rámci diferenciální diagnostiky lymfadenopatie.
Překvapením byly nejasné infiltrativní změny v oblasti mediastina a břicha. Ty vedly k probatorní laparotomii a makroskopickému i histologickému stanovení diagnózy.
Přehled léčebných možností stručně uvádí tab. 2.
#Tab:2#
V našem případě jsme záměrně nepoužívali prednison, neboť pacient měl opakovaně život ohrožující hematemezi.
Z tohoto relativně nevelkého výběru léků s prokázaným antiangiogenním účinkem jsme vybrali interferon α a zoledronát.
Při první CT kontrole, provedené přibližně po 5měsíční léčbě, byla patrná regrese patologických hmot, ale stále ještě byly hmoty dosti zřetelné. Přesnější vyjádření léčebné odezvy v procentech zmenšení patologické tkáně vzhledem k difuznosti projevů není reálné.
Co se týká kostních projevů, tak léčba interferonem a zoledronátem vedla k vymizení bolestí do 2 měsíců od zahájení léčby. Postižení skeletu angiomatózními hmotami je však velmi rozsáhlé, takže je nutné pokračovat v aplikaci zoledronátu i po vymizení bolestí, a to dlouhodobě.
Vzhledem k neúplné regresi patologických hmot jsme po 5měsíční léčbě interferonem α zvažovali další léčebné možnosti.
Zcela horkou novinkou je protilátka proti vaskulárnímu endoteliálním růstovému faktoru (anti VEGF) bevacizumab (Avastin). V roce 2006 jsme však v literatuře nenašli žádnou zmínku o použití tohoto léku u angiomatózy. Publikovány byly pouze četné zprávy o použití Avastinu v onkologických indikacích, v nichž má klinickými studiemi dokumentovanou léčebnou odezvu. U nemocných s plicními metastázami byly popisovány i případy krvácení z metastáz, velmi pravděpodobně související s léčbou bevacizumabem. A tyto případy s hemoragickou komplikací v nás vzbudily obavy z podání bevacizumabu nemocnému s angiomatózou. A tak jsme do kombinace zvolili thalidomid, lék, který má také antiangiogenní působení, ale který v žádném z případů nevede ke krvácivým komplikacím.
Kombinovanou léčbu thalidomid, interferon a zoledronát měl náš mladý muž jen 6 měsíců, pak byla provedena kontrola metodou CT. Překvapujícím výsledkem bylo téměř kompletní vymizení patologických hmot na CT zobrazení. Tento excelentní nález na CT a touha mít vlastní děti vedly mladého muže k žádosti o přerušení léčby, neboť thalidomid má známé teratogenní účinky, interferon α sice nemá mutagenní ani teratogenní účinky, ale mimo jiné způsobuje určitou míru fatigue, čili patologické únavy.
Bohužel při přerušení léčby došlo k recidivě angiomatózy do původních rozměrů. A ani ne za rok od přerušení léčby přivedla mladého muže masivní hematemeze zpět na JIP našeho pracoviště. CT potvrdilo recidivu a mladý muž je již opět léčen thalidomidem, interferonem α a zoledronátem, tentokráte je plánována minimálně roční léčba a v případě, že by došlo k vymizení patologických angiomatózních změn při CT zobrazení, plánujeme přejít na udržovací léčbu. V případě neúspěchu by bylo na zvážení podání bevacizumabu.
Závěr
Mnohočetná angiomatóza je agresivní, byť nemaligní cévní onemocnění. Pro léčbu byl standardně používán prednison a interferon α. V případně opakované hematemezy nejsou glukokortikoidy bezpečné. Kombinace interferonu α se zoledronátem a thalidomidem však vedla k objektivní léčebné odezvě dle CT zobrazení.
Tato práce vznikla a byla podporována v rámci projektu MŠMT: LC 06027 a VZ 0021622434.
prof. MUDr. Zdeněk Adam, CSc.
www.fnbrno.cz
e-mail: z.adam@fnbrno.cz
Doručeno do redakce: 3. 1. 2008
Přijato po recenzi: 19. 3. 2008
Sources
1. Haggstrom AN, Drolet BA, Baselga E et al (Hemangioma Investigators Group). Prospective study of infantile hemangiomas. Demographic, prenatal and perinatal characteristics. J Pediatr 2007; 150 : 291-294.
2. Kalousová J. Komplexní léčba hemangiomatózy jater. Čes Slov Pediatr 1994; 49 : 698-699.
3. Bláhová K, Mottl M, Tůma S. Hemangiomatóza jater u tříměsíčního kojence. Čes Slov Pediatr 1991; 46 : 434-436.
4. Mottl H, Koutecký J, Buncová M et al. Sdružený výskyt preaurikulárního hemangiomu s hemangiomatózou tenkého střeva a mesenteria. Čes Slov Pediatr 1985; 40 : 523-526.
5. Mottl H. Teleangiektatický hemangiom: Difúzní hemangiomatóza mesenteria a střeva. Čes Slov Pediatr 1985; 40 : 523-526.
6. Srbová J. Hemangiomatóza. Sestra 2005; 15 : 46.
7. Langer C, Thonhofer R, Hagenbarth K et al. Diffuse Hämangiomatose von Leber und Milz bei Erwachsenen. Pathologie 2001; 22 : 424-428.
8. Ito K, Ichiki T, Ohi K et al. Pulmonary capillary hemangiomatosis with severe pulmonary hypertension. Circ J 2003; 67 : 793-795.
9. Kawasaki I, Ito T, Ksuchia T et al. Is angiomatosis an intrinsic pathohistological features of massive osteolysis? Report of an autopsy case and review of the literature. Virchows Arch 2003; 442 : 400-406.
10. Dufau JP, Tourneau A, Audouin J et al. Isolated diffuse hemangiomatosis of the spleen with Kasabach-Merrit-like syndrome. Histopathology 1999; 35 : 337-344.
11. Kairi-Vassilatou E, Grapa D, Kontogianni-Katsarou K et al. Clinicopathological features of unusual vascular leasions of the pelvis, retroperitoneum and colon in females. A report of five cases and review of the literature. Eur J Gynecol Oncol 2006; 27 : 250-255.
12. Bölke E, Gripp S, Peiper M et al. Multifocal epiteloid hemangioendotelioma: a case report of a clinical chemeleon. Eur J Med Res 2006; 11 : 1-15.
13. Marinis A, Kairi E, Theodosopoulos T et al. Right colon and liver hemangiomatosis: A case report and review of literature. World J Gastroenterol 2006; 12 : 6405-6407.
14. Moon WA, Yy HCh, Lee JM et al. Diffuse hepatic hemangiomatosis in an adult. J Korean Med Sci 2000; 15 : 471-474.
15. Blatný J, Štěrba J, Magnová O. Léčba život ohrožujícího krvácení u kojence s hemangiomatózou a s projevy Kasabacha-Merritové pomocí rekombinantního faktoru VIIA. Čes Slov Pediatr 2002; 57 : 401-402.
16. Werner JA, Eivazi BJ, Folz AA et al. State of the Art zur Klassifikation, Diagnostik und Terapie von zervikofazialen Hämangiomen und vaskulären Malformationen. Laryngo Rhino Otol 2006; 85 : 883-891.
17. Neuman J, Rosioreanu A, Schuss A et al. Radiology Patology Conference: sclerosing hemangioma of the lung. Clinical Imaging 2006; 30: 409-412.
18. Levy AD, Abbot RM, Rohrmann CA et al. Gastrointestinal hemangiomas. AJR Am Roentgenol 2001; 177 : 1073-1077.
19. Scafidi DE, Mcleary MS, Young LW. Diffuse neonatal gastrointestinal hemangiomatosis. CT finding. Pediatric Radiol 1998; 28 : 512-518.
20. Hsu RM, Horton KM, Fishman EK. Diffuse cavernous hemangiomatosis of the colon. Findings on three dimensional CT colonography. AJR Amer J Roentgenol 2002; 179 : 1042-1048.
21. Djouhri A, Arrive L, Bouras T et al. Diffuse cavernous hemangiomatosis of the rectosigmoid colon: imaging findings. J Comp Assist Tomogr 1998; 22 : 851-855.
22. Lyon DG, Mantia AG. Large bowel hemangiomas. Dis Colon Rectum 1984; 27 : 404-407.
23. Weiss SW, Goldblum J, Enzinger FM et al. Soft Tissue Tumors 4th ed. Philadelphia, PA: Mosby 2001, 891-914.
24. Bank ER, McLeary MS, Young LW. Diffuse neonatal gastrointestinal hemangiomas. CT finding. Radiology 1987; 165 : 657-661.
25. Park DDE, Ricketts RR. Infantile gastrointestinal hemangioma as a couse of chronic anemia. South Med J 1992; 85 : 201-205.
26. Caseiro-Alves F, Brito J, Araujo AE et al. Liver haemangioma: common and uncommon findings and how to improve the differential diagnosis. Eur Radiol 2007; 15 : 300-306.
27. Goodman, P, Dominquez, R, Castillo M. Diffuse, neonatal hemagniomatosis: imaging finding in two patients. J Comp Assist Tomogr 1992; 16 : 117-121.
28. Lin ChH, Hsieh HF, Yy JCh et al. Spontaneous rupture of a large exogastric hemangioma. Complicated by hemoperitoneum and sepsis. J Formos Med Ass 2006; 105 : 1027-1030.
29. Mulliken JB, Boon LM, Takahashi H et al. Pharmacologic therapy for endangering hemangiomas. Curr Opin Dermatol 1995; 10 : 110-113.
30. Hasan Q, Swee TT, Gush J et al. Steroid therapy of a proliferating hemangiomas: histochemical and molecular changes. Pediatrics 2000; 105 : 117-121.
31. Uysal KM, Olgun N, Erbay A et al. High dose oral methylprednisolone therapy in childhood. Pediatr Hematol Oncol 2001; 18 : 335-341.
32. Hurovitz SA, Hurvitz CH, Sloninsky L et al. Successful treatment with cyclophosphamide of life threatening diffuse hemangiomatosis involving the liver. J Pediatr Hematol Oncol 2000; 22 : 527-532.
33. Gottschling S, Schneider G, Meyer S et al. Two infants with life threatening diffuse neonatal hemangiomatosis treated with cyclophosphamide. Pediatr Blood Cancer 2006; 46 : 239-242.
34. White CW. Treatment of hemangiomatosis with recombinant interferon alpha. Semin Hematol 1990; 27 : 15-22.
35. Takahashi A, Ogawa Ch, Kanazawa T et al. Remission induced by interferon alpha in a patient with massive osteolysis: a severe case of Gorham-Stout syndrome. J Pediatr Surg 2005; 40 : 47-50.
36. Nevolová P, Bláhová K, Kabelka Z. Úspěchy léčby rozsáhlé hemangiomatózy u 17měsíčního dítěte po podání interferonu alfa. Ref výběr Dermatovenereol 1996; 2 : 83.
37. Harper L, Michael JL, Enjolras O et al. Successful management of a retroperitoneal Kaposiform hemangioendotelioma with Kasabach-Merritt phenomenon using alpha interferon. Eur J Pediatr Surg 2006; 16 : 369-372.
38. D´Amato RJ, Loughnan MS, Flynn E et al. Thalidomide is an inhibitor of angiogenesis. Proc Natl Acad Sci USA 1994; 91 : 4082-4085.
39. Kenyon BM, Browne F, D´Amato RJ. Effects of thalidomide and related metabolites in a mouse corneal model of neovascularization. Exp Eye Res 1997; 64 : 971-978.
40. Or R, Feferman R, Shoshan S. Thalidomide reduces vascular density in granulomatous tissue of subcutaneously implanted polyvinyl alcohol sponges in Quinea pigs. Exp Hematol 1998; 26 : 217-221.
41. Bauer KS, Dixon SC, Figg WD. Inhibition of angiogenesis by thalidomide requires metabolic activation, which is species dependent. Biochem Pharmacol 1998; 55 : 1827-1834.
42. Rajkumar SV, Witzig TE. A review of angiogenesis and antiangiogenic therapy with thalidomide in multiple myeloma. Cancer Treat Rev 2000; 26 : 351-362.
43. Vacca A, Scavelli C, Montefusco V et al. Thalidomide dowregulates angiogenic genes in bone marrow endothelial cell of patients with multiple myeloma. J Clin Oncol 2005; 23 : 5334-5346.
44. Ma L, del Soldato P, Wallace JL. Divergent effects of new cyclooxygenase inhibitors on gastric ulcer healing. Shifting the antiogenic balance. Proc Natl Acad Sci USA 2002; 99 : 13243-13247.
45. Masferrer JL, Leahy KM, Koki AT et al. Antiantiogenic and antitumor activities of cyclooxygenase-2 inhibitors. Cancer Res 2000; 60 : 1306-1311.
46. Gilheeney SW, Scott, RM, Turner C et al. Treatment of Von Hippel Lindau associated hemangioblastoma in pediatric patients with bevacizumab (Avastin). Neurolo-Oncology 2007; 9: Abstr. 168.
47. Nelson SC, Bostrom BC. Successful use of bevacizumab in live threatening steroid-resistant infantile hepatic hemangioendotelioma. Pediatr Blood Cancer 2007; 48: Abstr. 611.
48. Ramasamy-Karthik Stehen L, Jackie Ch et al. Bevacizumab for POEMS syndrome. Blood 2006; 108: Abstr. 366B.
49. Ziemssen F, Voelker M, Inhoffen W et al. Combined treatment of juxtapapillary haemagnioma with intravitreal bevacizumab and photodynamic therapy. Eye 2007; 21 : 1125-1126.
50. Von Buelow M, Pape S, Hoerauf H. Systemic bevacizumab treatment of a juxtapappillary retinal haemangioma. Acta Ophthalmol Scand 2007; 85 : 114-116.
51. Meyerle-Catherine B, Bailay FK, Diana I et al. Intravitreal bevacizumab for retinal angiomatous proliferation. Retina 2007; 27 : 451-457.
52. Li EC, Davis LE. Zoledronic acid: A new parenteral bisphosphonate. Clin Ther 2003; 25 : 2666-2708.
53. Wood JM, Bonjean K, Ruetz S et al. Novel anti-angiogenic effects of the bisphosphonate compound zoledronic acid, a potent inhibitor of bone resorption. J Pharmacol Exp Ther 2002; 302 : 1055-1061.
54. Hasmim M, Bieler G, Rüegg C. Zoledronic acid inhibits endothelial cell adhesion, migration and survival through the suppression of multiple, prenylation-dependent signaling pathways. J Thromb Haemost 2007; 5 : 166-173.
55. Bellahcene A, Chaplet M, Bonjean K et al. Zoledronic acid inhibits alpha-beta3 and alpha-beta5 integrin cell surface expression in endothelial cells. Endothelium 2007; 14 : 123-130.
56. Giraudo E, Inoue M, Hanahan D. An amino-bisphosphonate targets MMP-9-expressing macrophages and angiogenesis to impair cervical carcinogenesis. J Clin Incest 2004; 114 : 623-633.
57. Croucher PI, De Raeve H, Perry M et al. Zoledronic acid treatment of 5T2MM bearing mice inhibits the development of myeloma bone disease: evidence fordecreased osteolysis, tumor burden and angiogenesis, and increased survival. J Bone Miner Res 2003; 18 : 482-492.
58. Fournier P, Boissier S, Filleur S et al. Bisphosphonates inhibit angiogenesis in vitro and testosterone-stimulated vascular regrowth in the ventral prostate in castrated rats. Cancer Res 2002; 2 : 6538-6544.
59. Adam Z, Ševčík P, Vorlíček J et al.: Kostní nádorová choroba. Praha: Grada Publishing 2004.
60. Wood J, Bonjean K, Ruetz S et al. Novel antiangiogenic effects of the bisphosphonate compound zoledronic acid. J Pharmacol Exp Ther 2002; 302 : 1055-1061.
61. Loo WJ, Lanigan SW. Recent advances in laser therapy for the treatment of cutaneous vascular disorders. Lasers Med Sci 2002; 17 : 9-12.
62. Winter H, Drager E, Sterry W. Sclerotherapy for threatment of hemangiomas. Dermatol Surg 2000; 26 : 105-108.
63. Geh JLC, Geh VSY, Jemec B et al. Surgical treatment of periocular hemangiomas. A single center experience. Plast Reconstr Surg 2007; 119 : 1553-1562.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2008 Issue 6-
All articles in this issue
- Řízená hypotermie - editorial
- Srovnávací studie detekce a vyhodnocování velikosti jícnových varixů s využitím radiální endosonografie s frekvencí 12 a 20 MHz vs ezofagogastroduodenoskopie
- Neskoré recidívy fibrilácie predsiení u pacientov po elektrickej kardioverzii
- Nadměrné ochlazení během mírné hypotermie po srdeční zástavě - fenomén zasluhující pozornost
- Hypertenze u HIV pozitivních pacientů
- Homogenita repolarizace u pacientů po akutním infarktu myokardu hodnocená z dlouhodobých 12svodových elektrokardiografických záznamů
- Léčba krvácení transfuzními přípravky a krevními deriváty
- 60 let od objevu LE (lupus erythematosus) buněk
- Internistická škola profesora MUDr. Františka Póra
- Příprava pacientů s poruchou hemostázy k invazivním lékařským zákrokům
- Osobnost typu C (cancer personality): současný stav poznatků a implikace pro další výzkum
- Riziko vzniku kardiovaskulárnych ochorení v súvislosti s rádioterapiou
- Léčba mnohočetné angiomatózy postihující skelet, břišní i hrudní dutinu interferonem α, thalidomidem a zoledronátem
- Akútna cholestáza po užívaní nimesulidu a kontraceptív: kazuistika a prehľad literatúry
- Zobrazení stenózy ramus interventricularis anterior výpočetní tomografií a selektivní koronarografií
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Léčba krvácení transfuzními přípravky a krevními deriváty
- Neskoré recidívy fibrilácie predsiení u pacientov po elektrickej kardioverzii
- Zobrazení stenózy ramus interventricularis anterior výpočetní tomografií a selektivní koronarografií
- Osobnost typu C (cancer personality): současný stav poznatků a implikace pro další výzkum
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

