-
Medical journals
- Career
Neskoré recidívy fibrilácie predsiení u pacientov po elektrickej kardioverzii
: M. Gurčiková; J. Kalužay; S. Remišová; O. Jurkovičová; P. Ponťuch
: IV. interná klinika Lekárskej fakulty UK a FNsP Bratislava, Slovenská republika, prednosta prof. MUDr. Peter Ponťuch, CSc.
: Vnitř Lék 2008; 54(6): 604-608
: Original Contributions
Cieľ:
Analyzovať faktory ovplyvňujúce vznik neskorých recidív fibrilácie predsiení po úspešnej elektrickej kardioverzii.Metódy:
Do súboru sme zaradili 43 pacientov, u ktorých bola v rokoch 2002-2006 vykonaná elektrická kardioverzia. Retrospektívne sme analyzovali údaje zo zdravotných záznamov. Za neskorú recidívu arytmie sme považovali tú, ktorá vznikla u pacientov prepustených so sínusovým rytmom.Výsledky:
Medián dĺžky sledovania celého súboru pacientov bol 33 [17, 48] mesiacov. Neskorú recidívu fibrilácie predsiení sme zaznamenali u 20 z celkového počtu 43 pacientov (46,5 %). V priebehu 6 mesiacov po elektrickej kardioverzii sme zaznamenali recidívu arytmie u 2 pacientov, do jedného roka u 6 pacientov a v období dlhšom ako rok u 12 pacientov. Medián času do recidívy bol 15 [6, 33] mesiacov. Ženy v porovnaní s mužmi mali zachytenú recidívu arytmie častejšie (p < 0,02), vysvetlením môže byť ich vyšší vek, častejší výskyt tyreopatie a artériovej hypertenzie. V skupine pacientov s tyreopatiou sme zistili častejší výskyt recidívy arytmie (p < 0,04) ako u pacientov bez anamnézy tyreopatie, a to aj napriek normálnym hodnotám TSH. Pacienti s recidívou arytmie mali vyššie hodnoty systolického (130 vs 120 mm Hg, p < 0,05) a pulzového krvného tlaku (50 vs 40 mm Hg, p < 0,01) tesne po kardioverzii. Medzi oboma podskupinami sme nezistili významný rozdiel vo veku, veľkosti ľavej predsiene, ejekčnej frakcii ľavej komory a medzi zastúpením kardiovaskulárnych a nekardiovaskulárnych rizikových faktorov.Záver:
Aj po úspešnej elektrickej kardioverzii sme zaznamenali výskyt neskorej recidívy fibrilácie predsiení v sledovanom období u 46,5 % pacientov. Vyššie riziko recidívy fibrilácie predsiení majú ženy, pacienti s anamnézou tyreopatie a pacienti s vyššími hodnotami systolického a pulzového krvného tlaku.Kľúčové slová:
fibrilácia predsiení - elektrická kardioverzia - neskoré recidívy fibrilácie predsieníÚvod
Fibrilácia predsiení (FP) je najčastejšia pretrvávajúca arytmia. Je charakterizovaná nekoordinovanou aktiváciou predsiení s následnou poruchou ich mechanickej funkcie. Odhaduje sa, že približne 4,5 miliónov pacientov v Európskej Únii má paroxyzmálnu alebo perzistentnú fibriláciu predsiení. V posledných rokoch rovnako narastá počet hospitalizácií z dôvodu FP. Napr. v Dánsku vzrástol počet hospitalizovaných pre FP v priebehu posledných 20 rokov až o 60 % [1]. Pokus o obnovenie a udržanie sínusového rytmu často vyžaduje použitie elektrickej kardioverzie (EKV). Je dokumentovaných množstvo faktorov ovplyvňujúcich úspešnosť EKV, ako aj vznik recidív. V práci sme analyzovali neskoré recidívy arytmie u pacientov po EKV prepustených so sínusovým rytmom.
1. Základné charakteristiky v celom súbore pacientov a v podskupinách. 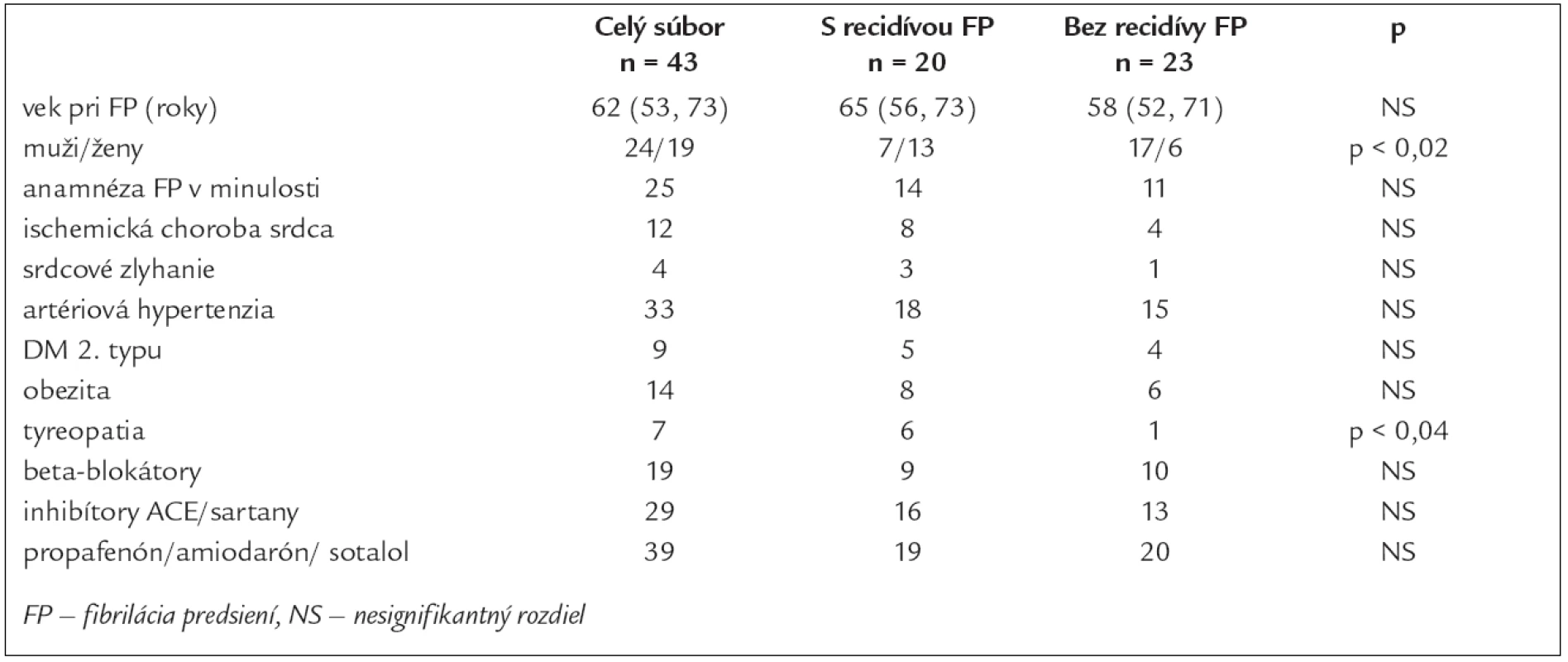
Metódy
Retrospektívne sme analyzovali a identifikovali 43 pacientov prepustených so sínusovým rytmom po elektrickej kardioverzii pre FP, u ktorých nebola echokardiografickým vyšetrením zistená chlopňová chyba. Elektrická kardioverzia bola realizovaná na koronárnej jednotke IV. internej kliniky LF UK a FNsP v Nemocnici sv. Cyrila a Metoda v Bratislave - Petržalke v období od januára roku 2002 do decembra roku 2006. Analyzovali sme údaje zo zdravotných záznamov pacientov. Za neskorú recidívu FP sme považovali tú, ktorá vznikla u pacientov prepustených so sínusovým rytmom.
Meranie krvného tlaku
Meranie krvného tlaku (TK) počas hospitalizácie sa uskutočnilo pri príjme pacienta a následne 2krát denne certifikovaným sfygmomanometrom za štandardizovaných podmienok. Tesne po vlastnej EKV sa TK monitoroval tlakovými monitormi na koronárnej jednotke (Dash 3000, GE Medical Systems). Zo získaných hodnôt systolického, diastolického, stredného a pulzového TK sme v analýzach použili maximálne hodnoty TK zaznamenané počas hospitalizácie od dátumu prijatia do EKV, TK meraný pred elektrickou kardioverziou a hneď po nej.
Elektrická kardioverzia
Všetky EKV sa uskutočnili synchronizovaným monofázickým elektrickým výbojom štandardným protokolom v krátkodobej celkovej intravenóznej anestézii (thiopental alebo midazolam i.v.). Štandardná poloha elektród bola anterolaterálna s použitím defibrilátora Marquette series 900. U všetkých pacientov bola EKV realizovaná do 48 hod od začiatku arytmie, alebo až po nastavení na účinnú perorálnu antikoagulačnú liečbu podľa platných smerníc pre liečbu pacientov s FP.
Transtorakálna echokardiografia
U všetkých pacientov bola vykonaná transtorakálna echokardiografia v období od 1 do 6 týždňov pred EKV podľa štandardného protokolu. Výsledky merania použité v analýzach obsahovali údaje o veľkosti ľavej predsiene, ejekčnej frakcii ľavej komory a prítomnosti hypertrofie ľavej komory.
Analyzované údaje
Zo zdravotných záznamov a nemocničného informačného systému sme získali údaje o veku, pohlaví pacientov, trvaní arytmie, anamnéze pravdepodobnej FP v minulosti, anamnéze artériovej hypertenzie, ischemickej choroby srdca, ostatných kardiovaskulárnych a nekardiovaskulárnych ochorení. Diagnóza ischemickej choroby srdca bola stanovená najčastejšie podľa typických klinických príznakov, anamnézy infarktu, podľa echokardiograficky dokumentovaných ložiskových porúch kinetiky, alebo typických EKG zmien. Sledovali sme aj antiarytmickú a antihypertenzívnu liečbu, echokardiografické parametre, údaj o neskorých recidívach arytmie po prepustení so sínusovým rytmom, vrátane záznamov o trvaní sínusového rytmu do januára roku 2007. Vzhľadom k veľkosti súboru pacientov sme pacientov liečených antiarytmikami I. alebo III. skupiny analyzovali spoločne.
Zastúpenie dichotomických kvalitatívnych premenných sme charakterizovali ich relatívnym výskytom. Rozdiel v kontinuálnych parametroch sme testovali neparametrickým obojsmerným Mannovho-Whitneyho U-testom. Vzťahy medzi úspešnosťou kardioverzie a rôznymi dichotomickými kvalitatívnymi premennými sa testovali v 2 × 2 kontingenčných tabuľkách obojstranným Fisherovým exaktným testom.
Výsledky
Základné charakteristiky súboru 43 pacientov, ktorí podstúpili EKV a boli prepustení so sínusovým rytmom, uvádzame v tab. 1. Žiadny pacient, u ktorého sme realizovali EKV, nemal zavedený kardiostimulátor. Antiarytmiká I. alebo III. skupiny pred EKV dostávalo 31 (72 %) pacientov. Medián trvania FP pred EKV s 25% a 75% kvartilom bol 4 (2, 53) dni. Medián trvania hospitalizácie po EKV bol 5 (2, 8) dní. Z 39 pacientov prepustených s antiarytmickou liečbou I. alebo III. skupiny 17 (44 %) pacientov dostávalo propafenon, 19 (49 %) amiodaron a 3 (8 %) sotalol. Nebol rozdiel v zastúpení jednotlivých antiarytmík u pacientov s recidívou a bez recidívy FP. Čas do recidívy FP, vyjadrený v mediáne a 25% a 75% kvartiloch, bol 15 (6, 33) mesiacov. Doba sledovania u pacientov bez recidívy FP do roku 2007 bola 26 (12, 36) mesiacov, medián dĺžky sledovania celého súboru pacientov bol 33 (17, 48) mesiacov. Do 6 mesiacov od elektrickej kardioverzie sme zaznamenali recidívu FP u dvoch pacientov, do 1 roka u 6 pacientov a u 12 pacientov v období dlhšom ako 1 rok. U pacientov s tyreopatiou, najčastejšie charakteru chronickej lymfoidnej tyreoiditídy s potrebou liečby hormónmi štítnej žľazy, sme potvrdili častejší výskyt recidív FP, a to i napriek normálnym hodnotám TSH. U jedného pacienta s údajom tyreopatie bol v dostupnej dokumentácii iba údaj o strume bez diagnózy chronickej tyreoitídy. V skupine s recidívou FP sme zistili vyššie hodnoty systolického a pulzového TK bezprostredne po EKV (tab. 2). Porovnaním výskytu recidív FP u oboch pohlaví sme zistili častejšie recidívy v skupine žien. V podskupinách pacientov sme síce zaznamenali tendenciu k častejšiemu výskytu recidív FP vo vyššom veku, ale rozdiel nebol štatisticky významný. Medzi oboma podskupinami sme nezistili významný rozdiel vo veku, veľkosti ľavej predsiene, ejekčnej frakcii ľavej komory a medzi zastúpením kardiovaskulárnych a nekardiovaskulárnych rizikových faktorov. Porovnaním výskytu FP v jednotlivých mesiacoch počas celého roka sme pozorovali trend k väčšiemu počtu recidív v chladnejších mesiacoch roka (graf 1).
2. Priemerné hodnoty krvného tlaku, echokardiografických parametrov a TSH v skupinách pacientov s recidívou FP a bez recidívy FP. 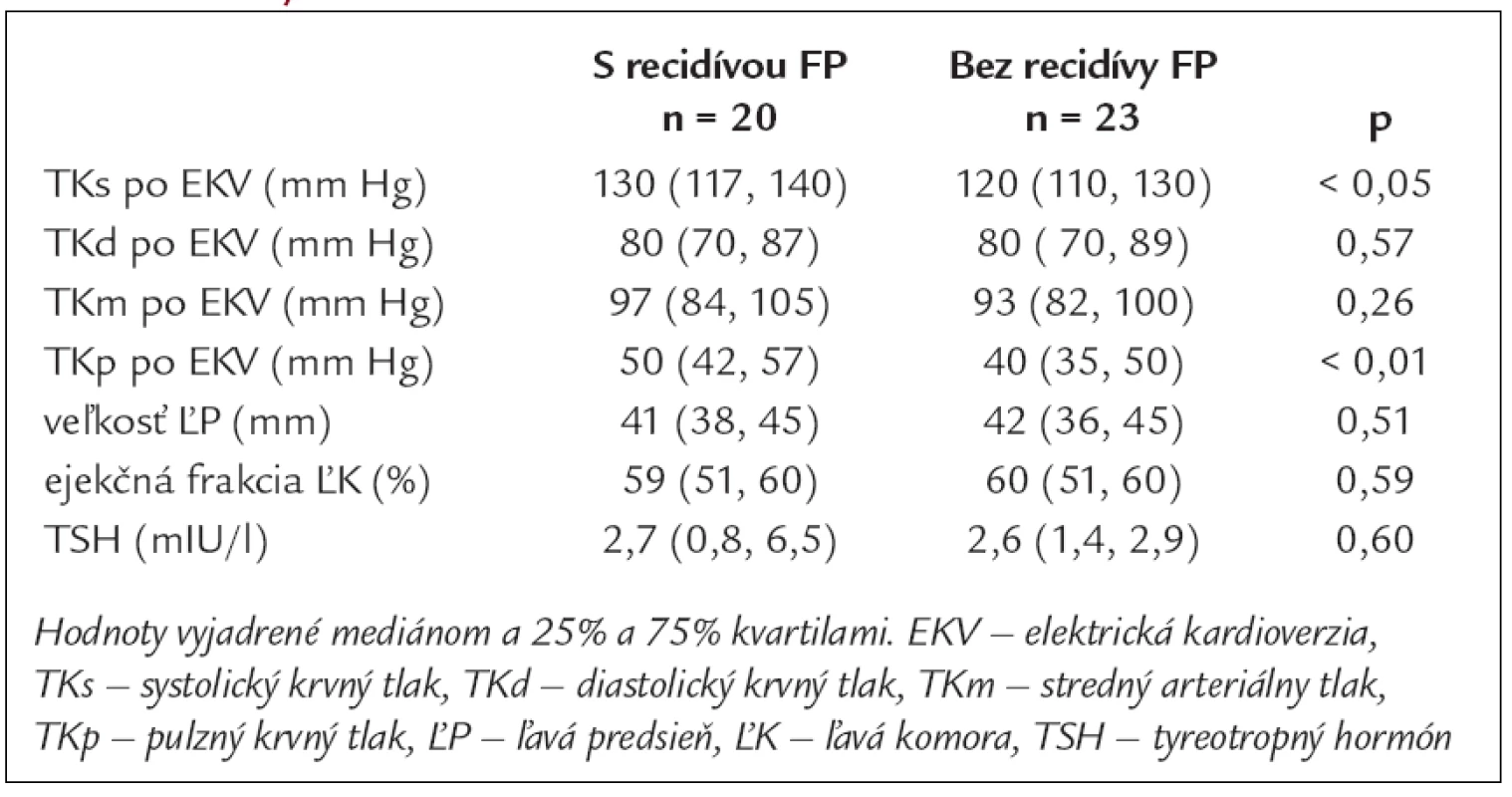
1. Výskyt recidív fibrilácie predsiení v jednotlivých mesiacoch v priebehu celého roka. 
Diskusia
Klinická úspešnosť EKV je významnou mierou ovplyvnená vznikom recidív FP, a to v krátkej časovej nadväznosti na samotnú EKV, ako aj neskôr u pacientov prepustených so sínusovým rytmom. V našej štúdii sme zistili, že aj po úspešnej EKV má recidívu FP v sledovanom období najmenej 46,5 % pacientov, a to aj napriek po EKV podávanej účinnej profylaktickej antiarytmickej liečbe antiarytmikami triedy I. C alebo III. V podobných prácach Frick et al zistili udržanie sínusového rytmu 4 týždne po prvej EKV len u 37 % pacientov [2], Blich et al zaznamenali udržanie sínusového rytmu pol roka po kardioverzii len u 61 % pacientov [3]. V ďalšej štúdii u pacientov nastavených po EKV na účinnú antiarytmickú liečbu (sotalol vs chinidín spolu s verapamilom) malo recidívu FP počas priemerného 266dňového sledovania 67 % pacientov, u 41 % pacientov sa recidíva FP hodnotila ako perzistujúca FP [4]. V inej štúdii sa u 13 % pacientov s anamnézou FP v minulosti napriek antiarytmickej liečbe vyskytovali asymptomatické paroxyzmy FP [5]. Asymptomatické recidívy FP sme v našej práci nesledovali.
Výsledky našej štúdie dokumentujú, že jedným z prediktorov recidív FP sú vyššie hodnoty systolického a pulzového TK. Riziko novovzniknutej FP u pacientov s artériovou hypertenziou bolo vo Framinghamskej populácii zvýšené 1,5násobne [6]. V menšej štúdii Katritsis et al poukázali na možnosť „okultnej“ artériovej hypertenzie ako jedného z možných faktorov zodpovedných za vznik idiopatickej „lone“ FP [7]. Špecifický vplyv výšky pulzového TK na incidenciu FP zaznamenal aj Mitchell et al [8]. Adekvátna kontrola TK je preto odôvodnená nielen z pohľadu zníženia kardiovaskulárneho rizika hypertonikov, ale pravdepodobne aj z hľadiska dlhodobej úspešnosti udržania sínusového rytmu po EKV. Vyšší výskyt recidív FP u žien sa môže pripísať vyššiemu zastúpeniu artériovej hypertenzie. Ženy s FP však majú v porovnaní s mužmi vyšší priemerný vek a okrem artériovej hypertenzie sú u nich častejšie aj ochorenia štítnej žľazy [9-10].
Van Noord v sledovanej skupine pacientov s artériovou hypertenziou poukázal na lepšie udržiavanie sínusového rytmu po elektrickej kardioverzii, ak sú pacienti liečení beta-blokátormi [11]. Pozitívny prínos z pohľadu prevencie vzniku FP, zvýšenia úspešnosti EKV a prevencie recidív FP však preukázali najmä inhibítory ACE a blokátory angiotenzínových receptorov, a to či už samostatne alebo v kombinácii s antiarytmickou liečbou [12-15]. Inhibítory ACE tiež pravdepodobne zabraňujú progresii z paroxyzmálnej do chronickej FP [16].
V nami sledovanom súbore pacientov sa v malej podskupine pacientov s dokumentovanou tyreopatiou vyskytli recidívy FP až v 85 %, a to aj napriek hodnotám TSH považovaným za normálne. Gammage et al poukázali na vyšší výskyt FP už u pacientov so subklinickou hypertyreózou [17]. U eutyreoidných pacientov s normálnymi hodnotami TSH nezávisle korelovala s výskytom FP samotná hladina voľného T4, ktorý sa ako skríningový test na funkciu štítnej žľazy bežne nevyšetruje. Liekom voľby pre pacientov s FP v súvislosti s hypertyreózou je beta-blokátor [18]. Zaujímavá je otázka, či by liečba beta-blokátorom bola indikovaná u všetkých pacientov s anamnézou FP a tyreopatie na prevenciu recidív arytmie.
Viacerí autori pozorovali častejší výskyt FP v zimných mesiacoch roka [19], podobnú tendenciu sme zistili aj v našom súbore pacientov. Jedným z vysvetlení sezónnej variácie výskytu FP by mohol byť vyšší výskyt respiračných infekcii v zimných mesiacoch roka, ale aj zvýšený hemodynamický stres, neurohumorálna aktivita a následne aj vyšší výskyt myokardiálnej ischémie. Španielska skupina na základe zhrnutia doterajších poznatkov a vlastných sledovaní predložila ďalšiu hypotézu o vplyve sezónnych zmien v periférnej koncentrácii tyreoidálnych hormónov zvlášť u pacientov s ochorením štítnej žľazy užívajúcich fixnú dávku levotyroxínu [20]. Výskyt FP by sa mohol u pacientov s tyreopatiou znížiť sezónnou modifikáciou dávky podávaných tyreoidálnych hormónov.
Vo viacerých štúdiách bolo dokumentované vyššie riziko recidív FP u pacientov s dilatáciou ľavej predsiene [21]. Veľkosť ĽP sa môže signifikantne zväčšiť relatívne rýchlo po vzniku arytmie, po kardioverzii môže naopak dôjsť k regresii dilatácie ľavej predsiene [22]. Pacienti indikovaní na EKV na pracovisku autorov mali v priemere len miernu dilatáciu ĽP, čo môže vysvetľovať, že sme nezistili signifikantný rozdiel vo veľkosti ĽP u pacientov s recidívou a bez recidívy FP.
Záver
Potvrdili sme pomerne vysoký výskyt recidív fibrilácie predsiení u pacientov po úspešnej elektrickej kardioverzii. Vyššie riziko recidívy fibrilácie predsiení mali ženy, pacienti s anamnézou tyreopatie a pacienti s vyššími hodnotami systolického a pulzového krvného tlaku. U pacientov s anamnézou fibrilácie predsiení je preto okrem profylaktickej antiarytmickej liečby odôvodnená dôsledná kontrola krvného tlaku. U pacientov s FP a súčasnou tyreopatiou sa v budúcnosti môže potvrdiť potreba častejších kontrol funkčného stavu pri substitučnej liečbe hormónmi štítnej žľazy.
MUDr. Marcela Gurčiková
www.nspr.sk
e-mail: marcela.gurcikova@gmail.com
Doručeno do redakce: 8. 2. 2008
Přijato po recenzi: 15. 3. 2008
Sources
1. Friberg J, Buch P, Scharling H et al. Rising rates of hospital admissions for atrial fibrillation. Epidemiology 2003; 14 : 666-672.
2. Frick M, Frykman V, Jensen-Urstad M et al. Factors predicting success rate and recurrence of atrial fibrillation after first electrical cardioversion in patients with persistent atrial fibrillation. Clin Cardiol 2001; 24 : 238-244.
3. Blich M, Edoute Y. Electrical cardioversion for persistent or chronic atrial fibrillation: outcome and clinical factors predicting short and long term success rate. Int J Cardiol 2006; 107 : 389-394.
4. Fetsch T, Bauer P, Engberding R et al. Prevention of atrial fibrillation after cardioversion: results of the PAFAC trial. Eur Heart J 2004; 25 : 1385-1394.
5. Page RL, Tilsch TW, Connolly SJ et al. Asymptomatic or “silent” atrial fibrillation: frequency in untreated patients and patients receiving azimilide. Circulation 2003; 107 : 1141-1145.
6. Benjamin EJ, Levy D, Vaziri SM et al. Independent risk factors for atrial fibrillation in a population-based cohort. The Framingham Heart Study. JAMA 1994; 271 : 840-844.
7. Katritsis DG, Toumpoulis IK, Giazitzoglou E et al. Latent arterial hypertension in apparently lone atrial fibrillation. J Interv Card Electrophysiol 2005; 13 : 203-207.
8. Mitchell GF, Vasan RS, Keyes MJ et al. Pulse pressure and risk of new-onset atrial fibrillation. JAMA 2007; 297 : 709-715.
9. Humphries KH, Kerr CR, Connolly SJ et al. New-onset atrial fibrillation: sex differences in presentation, treatment, and outcome. Circulation 2001; 103 : 2365-2370.
10. Gurevitz OT, Varadachari CJ, Ammash NM et al. The effect of patient sex on recurrence of atrial fibrillation following successful direct current cardioversion. Am Heart J 2006; 152 : 155.
11. Van Noord T, Tieleman RG, Bosker HA et al. Beta-blockers prevent subacute recurrences of persistent atrial fibrillation only in patients with hypertension. Europace 2004; 6 : 343-350.
12. Ueng KC, Tsai TP, Yu WC et al. Use of enalapril to facilitate sinus rhythm maintenance after external cardioversion of long-standing persistent atrial fibrillation. Results of a prospective and controlled study. Eur Heart J 2003; 24 : 2090-2098.
13. Madrid AH, Peng J, Zamora J et al. The role of angiotensin receptor blockers and/or angiotensin converting enzyme inhibitors in the prevention of atrial fibrillation in patients with cardiovascular diseases: meta-analysis of randomized controlled clinical trials. Pacing Clin Electrophysiol 2004; 27 : 1405-1410.
14. Yin Y, Dalal D, Liu Z et al. Prospective randomized study comparing amiodarone vs. amiodarone plus losartan vs. amiodarone plus perindopril for the prevention of atrial fibrillation recurrence in patients with lone paroxysmal atrial fibrillation. Eur Heart J 2006; 27 : 1841-1846.
15. Wachtell K, Lehto M, Gerdts E et al. Angiotensin II receptor blockade reduces new-onset atrial fibrillation and subsequent stroke compared to atenolol: the Losartan Intervention For End Point Reduction in Hypertension (LIFE) study. J Am Coll Cardiol 2005; 45 : 712-719.
16. Hirayama Y, Atarashi H, Kobayashi Y et al. Angiotensin-converting enzyme inhibitor therapy inhibits the progression from paroxysmal atrial fibrillation to chronic atrial fibrillation. Circ J 2005; 69 : 671-676.
17. Gammage MD, Parle JV, Holder RL et al. Association between serum free thyroxine concentration and atrial fibrillation. Arch Intern Med 2007; 167 : 928-934.
18. Hrnciar J. Thyrotoxic heart disease. Part II - aspects of treatment of thyrotoxicosis with cardiac involvement. Vnitř Lék 2002; 48 : 137-141.
19. Murphy NF, Stewart S, MacIntyre K et al. Seasonal variation in morbidity and mortality related to atrial fibrillation. Int J Cardiol 2004; 97 : 283-288.
20. Sojo L, Corcoy R. Seasonal variation in morbidity and mortality related to atrial fibrillation - could thyroid function contribute? Int J Cardiol 2006; 107 : 281.
21. Olshansky B, Heller EN, Mitchell LB et al. Are transthoracic echocardiographic parameters associated with atrial fibrillation recurrence or stroke? Results from the Atrial Fibrillation Follow-Up Investigation of Rhythm Management (AFFIRM) study. J Am Coll Cardiol 2005; 45 : 2026-2033.
22. Schotten U, de Haan S, Neuberger HR et al. Loss of atrial contractility is primary cause of atrial dilatation during first days of atrial fibrillation. Am J Physiol Heart Circ Physiol 2004; 287: H2324-H2331.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2008 Issue 6-
All articles in this issue
- Controlled hypothermia – editorial
- Comparative study of detection and evaluation of the size of oesophageal varices with the use of 12 and 20 MHz frequency radial endosonography vs. esophagogastroduodenoscopy
- Late recurrences of atrial fibrillation in patients after direct-current cardioversion
- Overcooling during mild hypothermia in cardiac arrest survivors - phenomenon we should keep in mind
- Hypertension in HIV positive patients
- Repolarization homogeneity in patients after acute myocardial infarction assessed from long-term 12-lead electrocardiographic recordings
- Treatment of haemorrhage with transfusion preparations and blood derivatives
- The 60th anniversary of the discovery of the LE (lupus erythematosus) cell
- Professor MUDr. František Pór’s School of Internal Medicine
- Preparation of patients with haemostatic disorder for invasive medical interventions
- Cancer personality: Current view and implications for future research
- The risk of cardiovascular diseases induced by radiotherapy
- Treatment of multiple angiomatosis involving the skeleton and the abdominal and thoracic cavities with interferon α, thalidomide and zoledronate
- Acute cholestasis following treatment with nimesulide and oral contraception - case report and review
- Imaging of stenosis of ramus interventricularis anterior by computed tomography and selective coronarography
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Treatment of haemorrhage with transfusion preparations and blood derivatives
- Late recurrences of atrial fibrillation in patients after direct-current cardioversion
- Imaging of stenosis of ramus interventricularis anterior by computed tomography and selective coronarography
- Cancer personality: Current view and implications for future research
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

