-
Medical journals
- Career
Sledování protinádorové buněčné imunitní odpovědi u nemocných s renálním karcinomem, porucha proliferace T-lymfocytů
Authors: Š. Lukešová 1,4; V. Vroblová 2; D. Hlávková 2; O. Kopecký 1,4; D. Vokurková 2; P. Morávek 3; H. Šafránek 3; P. Souček 2
Authors‘ workplace: II. interní klinika Lékařské fakulty UK a FN Hradec Králové, přednosta. prof. MUDr. Jaroslav Malý, CSc. 1; Ústav klinické imunologie a alergologie Lékařské fakulty UK a FN Hradec Králové, přednosta prof. RNDr. Jan Krejsek, CSc. 2; Urologická klinika Lékařské fakulty UK a FN Hradec Králové, přednosta. doc. MUDr. Petr Morávek, CSc. 3; Oddělení klinické imunologie a mikrobiologie Oblastní nemocnice Náchod, přednosta prim. MUDr. Otakar Kopecký, CSc. 4
Published in: Vnitř Lék 2008; 54(2): 139-145
Category: Original Contributions
Overview
Úvod:
Řada pozorování nasvědčuje tomu, že u nemocných s renálním karcinomem (renal cell carcinoma - RCC) hraje imunitní systém důležitou roli při kontrole růstu nádoru. RCC je více než jiné nádory infiltrován leukocyty (Tumor Infiltrating Lymphocytes - TIL). Dominantní populaci TIL buněk tvoří T-lymfocyty. Názory na úlohu T-lymfocytárních subpopulací, B-lymfocytů a NK buněk v protinádorové odpovědi nejsou jednotné.Cíl:
Stanovit fenotyp a aktivaci lymfocytárních buněk a porovnat jejich zastoupení v nádorovém stromatu (TIL), v periferní krvi a v krvi z renální žíly u nemocných s RCC.Soubor nemocných a metodika:
Vzorky periferní krve z kubitální a renální žíly a buňky nádorového stromatu byly získány od 60 pacientů v průběhu operace pro primární RCC. TIL byly izolovány z mechanicky dezintegrované nádorové tkáně. PBL a TIL byly podrobeny imunofenotypové multiparametrové analýze. Pomocí průtokového cytometru byly charakterizovány jejich povrchové a aktivační znaky.Výsledky:
Hlavní populací TIL byly T-lymfocyty CD3+ (70,4 %). Počet CD3+/CD8+ T-lymfocytů byl signifikantně vyšší v TIL, 39,7 % (p < 0,01), zatímco CD4+ T-lymfocyty byly většinovou populací v periferní krvi, 41,35 % (p < 0,001). Zastoupení CD3+/69+ T-lymfocytů bylo signifikantně vyšší v TIL, 32,05 %, než v PBL (p < 0,001). Naopak, počty CD3+/CD25+, CD8+/57+ a CD4+/RA+ (naivní CD4+ T-lymfocyty) byly vyšší v PBL (p < 0,001). Rozdíly v zastoupení NK buněk (CD3-/16+56+) a CD3+/DR+ T buněk v TIL a PBL nebyly signifikantní.Závěr:
Uvedené výsledky dokazují, že v porovnávaných kompartmentech (tumor/PBL) jsou charakteristiky a intenzita protinádorové odpovědi rozdílné. CD3+/CD8+ T-lymfocyty jsou dominantní lymfocytární populací TIL. Znalost fenotypu a funkcí efektorových buněk zodpovědných za protinádorovou odpověď jsou základní podmínkou pochopení protinádorové imunitní odpovědi a jejího selhání.Klíčová slova:
tumor-infiltrující lymfocyty - CD4 - CD8 - průtoková cytometrie - renální karcinomÚvod
Nádorová onemocnění jsou jednou ze 3 nejčastějších příčin smrti člověka. Podle současných představ je maligní transformace buňky projevem akumulace genetických poruch. Eukaryotické buňky jsou vybaveny mechanizmy, které mohou genetickou poruchu opravit na úrovni DNA, nebo zahájit proces apoptózy. Selhání těchto opravných mechanizmů otevírá cestu k maligní transformaci buňky [5]. Jednou z posledních obranných bariér je protinádorová odezva imunitního systému. Za protinádorovou odezvu jsou odpovědny cytotoxické T-lymfocyty a NK-buňky. Cytotoxická aktivita T-lymfocytů je zajišťována prostřednictvím exocytární dráhy, při které jsou uvolňovány perforiny a granzymy, jejichž působením dochází v terčové (nádorové) buňce k iniciaci procesu apoptózy. Druhým mechanizmem, který vede k zahájení apoptózy nádorové buňky, je cesta zahrnující proapoptotické působení molekuly Apo/Fas a cesta zprostředkovaná TNFα [14,19]. Existuje velká podobnost v efektorových mechanizmech cytotoxicity mezi CD8+ cytotoxickými T-lymfocyty a NK-buňkami. V případě RCC existuje řada prací analyzujících buňky infiltrující nádor a jejich podíl na protinádorové odezvě. Není však jednotný názor na zastoupení a úlohu T-lymfocytárních subpopulací, B-lymfocytů a NK-buněk [4,10,26,29].
Cílem naší práce bylo pomocí multiparametrové analýzy na průtokovém cytometru stanovit fenotyp a známky aktivace cytotoxických buněk a porovnat jejich zastoupení v TIL a v krvi odebrané z venae renalis a cubitalis.
Soubor nemocných a metodika
V období mezi dubnem roku 2005 a srpnem roku 2006 bylo provedeno chirurgické odstranění ledvinového nádoru 60 pacientům. Soubor byl tvořen 23 ženami a 37 muži ve věkovém rozmezí od 32 do 83 roků. Průměrný věk pacientů byl 66,35 let.
Většině pacientů byla provedena radikální nefrektomie (58 pacientů). Ve 2 případech byla provedena resekce části ledviny. Bilaterální nález tumoru ledviny byl nalezen u 1 pacienta, kterému byla provedena jednostranná nefrektomie s výhledem enkapsulace tumoru na druhé postižené ledvině.
Podle histologických nálezů se v 83 % (50 pacientů) jednalo o konvenční světlobuněčný karcinom, v 8 % (5 pacientů) šlo o papilární karcinom, ve 3 % (2 pacienti) byl nalezen chromofobní karcinom. V jednom případě byl diagnostikován sarkomatoidní karcinom, který vznikl transformací chromofobního karcinomu, v 1 případě jsme identifikovali uroteliální karcinom s dlaždicobuněčnou diferenciací a v 1 případě neklasifikovatelný karcinom vycházející pravděpodobně z Henleovy kličky („loopom“).
K určení stupně pokročilosti onemocnění jsme použili platnou klasifikaci TNM. Do T1a patřilo 27 % pacientů (16 případů), do T1b 28 % pacientů (17 případů), do T2 bylo zařazeno 5 % pacientů (3 případy), do T3a 27 % (16 případů), do T3b 10 % pacientů (6 případů), 1 pacient byl zařazen do T3c a 1 pacient do T4. Rozřazení do stadií je shodné s číselnými indexy prvotního ložiska. Jen 6 pacientů zařazených do T3 a jeden do T2 byli zařazeni do stadia IV pro současný výskyt metastáz. Uzlinové postižení N1 bylo potvrzeno u 2 pacientů, N2 rovněž u 2 pacientů. Patologická lymfadenopatie u ostatních nemocných (91 %, 54 pacientů) nebyla prokázána. Do M1 bylo pro vzdálené metastázy zařazeno 7 pacientů (12 %), u 53 pacientů (88 %) nebyly vzdálené metastázy prokázány.
Od každého pacienta byl v den operace odebrán vzorek nádorové tkáně, krev z kubitální a renální žíly. Krev z v. cubitalis i krev z renální žíly byly odebírány do zkumavek s heparinem. Nádorová tkáň, odebraná do pufrovaného fyziologického roztoku s heparinem (25 j/ml), byla mechanicky dezintegrována a zhomogenizována pomocí nůžek, pinzety a homogenizátoru na jednotlivé buněčné elementy, které byly přefiltrovány, 2krát promyty pufrovaným fyziologickým roztokem s 5% azidem sodným a naředěny na přibližnou koncentraci 5 × 105 buněk. Zpracování vzorků bylo provedeno do 2 hod po odběru.
Vždy 25 µl buněčné suspenze a heparinizované krve bylo inkubováno 20 min s 10 µl naředěnými přímo značenými monoklonálními protilátkami (Beckman Coulter Company, Inc., USA) v následujících kombinacích: CD45‑FITC/CD14‑PE, CD3‑FITC/CD16+56‑PE/CD19‑PC5, RO‑FITC/RA‑PE/CD4‑PC, CD8‑FITC/DR‑PE/CD3‑PC5, CD69‑FITC/CD25‑PE/CD3‑PC5, CD57‑FITC/TcRαβ-PE/ CD8‑PC5, CD57‑FITC/TcRγδ-PE/CD8‑PC5. Po lyzování červených krvinek lyzačním roztokem (0,5 ml OptiLyse C, Beckman Coulter, Inc., USA) jsme přidali fyziologický roztok (Infusio Natrii Chlorati Isotonica ‑ IMUNA Pharm a.s., Slovensko) s 5% azidem sodným (Natriumazid‑MERCK, SRN) . Měření bylo provedeno na průtokovém cytometru Coulter® Epics® XL (Coulter, Fullerton, USA). Vyhodnocení naměřených vzorků bylo provedeno analyzačním programem CXP sofware analysis. Základní funkce a exprese membránových molekul jsou uvedeny v tab. 1.
Table 1. Exprese a hlavní funkce stanovených membránových znaků. 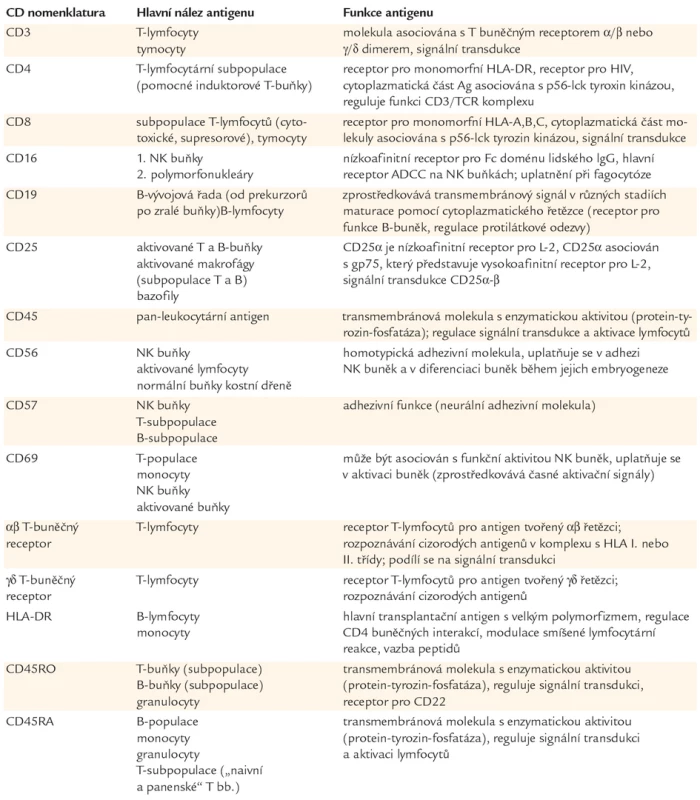
Pro statistické zpracování byl použit program Sigmastat verze 2.0. Vlastní statistika je zpracována standardními metodami pro statistické porovnání několika skupin. Párová data (PK a L) byla posuzována párovým t-testem v případě, že test na normální rozložení byl úspěšný. Jinak byl použit Wilcoxon Signed Rank Test. Ostatní data (nepárová) byla v případě úspěšně vyhodnoceného testu na normalitu vyhodnocena nepárovým t-testem, v opačném případě Mannovým-Whitneyovým Rank Sum testem.
Studie byla povolena etickou komisí LF UK Hradec Králové. Před vstupem do studie pacienti podepsali informovaný souhlas.
Výsledky
Průměrná čistota lymfocytárních suspenzí izolovaných z tumoru byla 89,3 % a nepůsobila obtíže při měření a porovnání nálezů ve vzorcích žilní krve a buněčné suspenze z nádoru.
Výsledky měření jsou uvedeny v tab. 2. Počty buněk nesoucích fenotyp CD3+/69+ a CD3+/8+ byly signifikantně vyšší v TIL v porovnání s PBL (s lymfocyty v krvi z renální a loketní žíly). Naopak, počty buněk s fenotypem CD3+/4+, CD19+, CD3+/16+/56+, CD3+/25+, CD8+/57+, CD4+/45RA+ byly signifikantně vyšší v PBL v porovnání s TIL. CD3+/8+ T-lymfocyty byly dominantní lymfocytární populací v nádorové tkáni, naopak CD3+/4+ T-lymfocyty byly většinovou populací v periferní a renální žilní krvi. Zastoupení NK-buněk (CD3-/16+/56+) a CD3+/DR+, CD8+/DR+, CD25+, CD4+/45RO+ T-lymfocytů a minoritní populace cytotoxických buněk CD3-/8+ nepatřící do T-lymfocytů nevykazovalo statisticky významné rozdíly. Lymfocytární populace v renální žíle se neliší od žíly periferní.
Table 2. Imunofenotypové nálezy mononukleárních buněk v periferní krvi (PK), renální žíle (RŽ) a tumor infiltrujících lymfocytech (v nádoru ledviny – TIL). 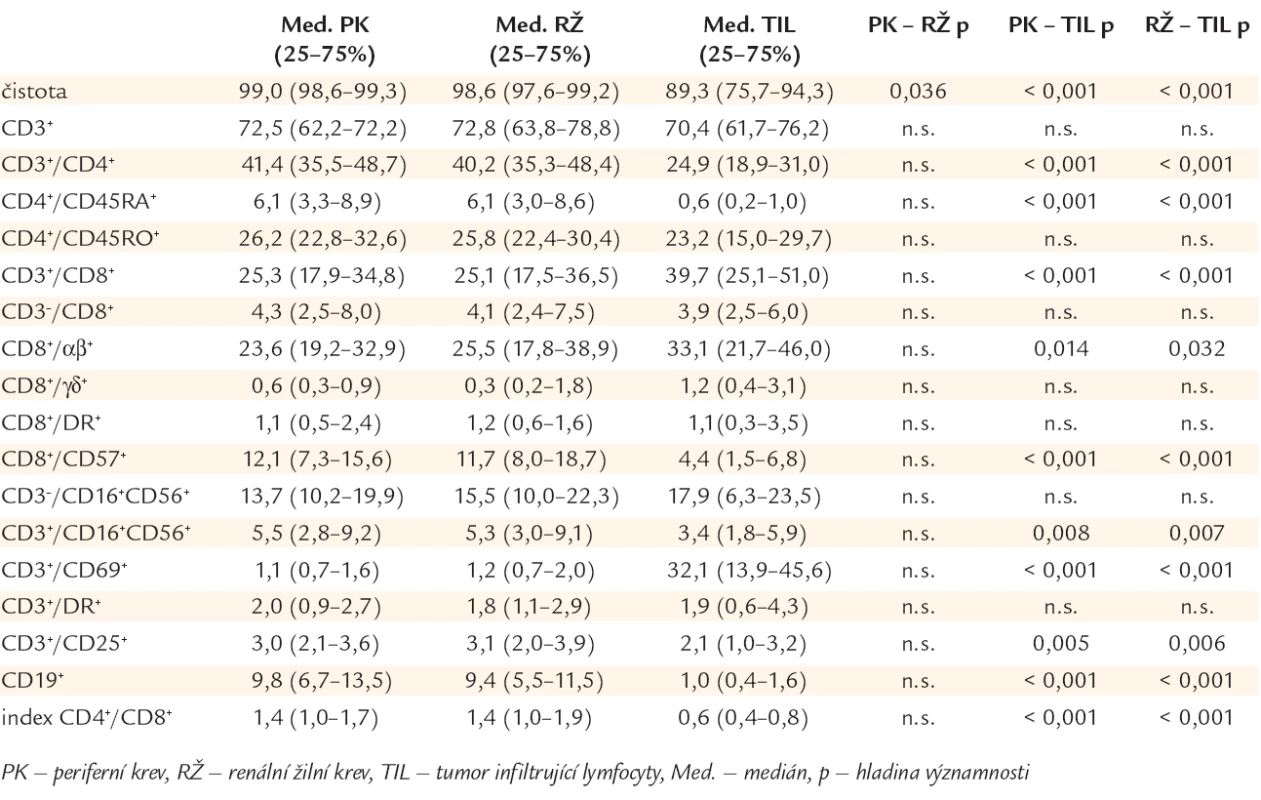
Diskuse
Klinická pozorování jak spontánních regresí primárních i sekundárních ložisek RCC, tak i léčebné odezvy u 15-20 % nemocných po podání IL-2 svědčí pro účinnou protinádorovou odezvu. Za protinádorovou odezvu jsou zodpovědny tumor infiltrující lymfocyty (TIL). Jedná se o heterogenní populaci cytotoxických buněk nesoucích převážně fenotyp CD3+/CD8+ a CD3-/CD16+/CD56+. CD4+ T-lymfocyty a B-lymfocyty jsou většinou autorů shledány minoritní populací v TIL [27]. Na všech uvedených buněčných populacích izolovaných z RCC jsou nalézány znaky časné i pozdní aktivace [5]. Pro efektivní protinádorovou odezvu je důležité rozpoznání nádorových struktur T-lymfocyty. V tomto ohledu je za klíčovou považována role dendritických buněk (dendritic cells - DC) a monocytů infiltrujících tumor. Dendritické buňky předkládají nádorové antigeny cytotoxickým lymfocytům a mohou svým cytokinovým spektrem upřednostňovat Th1 nebo Th2 odezva CD4+ subsetů [11].
Až u 70 % renálních tumorů tvoří CD8+ T-lymfocyty hlavní buněčnou populaci TIL buněk [21]. S tímto nálezem souhlasí i naše pozorování. Převaha populace CD3+CD8+ buněk byla popsána i ve stromatu nádorů vycházejících z jiných tkání [9,20,29,40,41]. Protinádorovou aktivitu vykazují CD4+ T-lymfocyty, které jsou hlavním producentem IL-2. Působením IL-2 je indukována diferenciace a aktivace cytotoxických T-lymfocytů a NK-buněk [6]. Th1 subset CD4+ T-lymfocytů produkuje IFNγ a zesiluje cytotoxickou funkci CD8+ T-lymfocytů. Naopak převažuje-li aktivita Th2 subsetu, je upřednostňována protilátková odezva a prostřednictvím IL-4 a IL-5 je potlačována funkce Th1 podtypu. Přítomnost efektorových buněk infiltrujících tumor a jejich aktivace je dokladem lokální imunitní odezvy [15].
Igarashi et al porovnali zastoupení lymfocytárních subpopulací v tumor infiltrujících lymfocytech (TIL). Tato studie hodnotila korelaci mezi fenotypem TIL a odezvou na léčbu interferonem-α. U nemocných s pokročilým onemocněním (III. a IV. stadiem), u kterých CD4+ T-lymfocyty tvořily více než 40 % TIL buněk, bylo podáním interferonu-α dosaženo parciální remise nebo stabilizace nemoci. Naopak, u nemocných s počtem CD8+ TIL vyšším než 25 % nebylo dosaženo léčebné odezvy. Zvýšení CD8+ a snížení CD4+ tumor infiltrujících lymfocytů bylo spojeno z horší prognózou onemocnění. Nadto in vitro provedené funkční analýzy TIL potvrdily, že CD4+ T-lymfocyty vykazují známky aktivace, zatímco CD8+ T-lymfocyty v některých případech neexprimovaly povrchové molekuly svědčící pro aktivaci a tyto buňky nebyly schopny efektivně indukovat cytolýzu terčových buněk [17]. U našich pacientů byl receptor pro antigen (TcR) na CD8+ T-lymfocytech tvořený převážně heterodimerem α/β. Poměr CD8+ T lymfocyt s TcR α/β k TcR γ/δ byl stejný v periferní krvi, krvi z renální žíly i TIL. Naproti tomu u pacientů s lokalizovanou chorobou (I. a II. stadium) nemá fenotyp TIL prognostický význam [35,38].
Specifické T-lymfocyty se po setkání s antigenem aktivují, což je provázeno změnou exprese aktivačních molekul, jako například molekuly CD69, HLA-DR a receptoru pro IL-2 (CD25) [22,31]. Exprese časné aktivační molekuly CD69 je detekovatelná za 2-3 hod po stimulaci. Počty buněk nesoucích fenotyp CD3+/69+ byly u našich pacientů signifikantně vyšší v TIL než v periferní krvi. Arteficiální stimulace při zpracování nádorové tkáně byla blokována azidem sodným, který byl obsažen v ředícím i promývacím roztoku (0,1%). Tiemenssen popsal zvýšenou expresi CD69 molekuly na antigeny stimulovaných T-lymfocytech. Vlivem TGF-β (transformujícího růstového faktoru) na aktivované T-lymfocyty došlo k signifikantním zvýšení exprese CD69 [36]. Aktivované lymfocyty však neměly vyjádřenou expresi molekuly CD25, která odráží časné stadium buněčné aktivace a je přítomna na TIL nemocných, odpovídajících na léčbu rekombinantními cytokiny [34]. Zvýšená exprese CD25 (řetězce α, který je součástí receptoru pro IL-2) na T-lymfocytech u renálního karcinomu je považována za průkaz lokální protinádorové aktivity [1,2,23,32]. V našem souboru jsme nalezli naopak signifikantně snížené zastoupení CD25+ T-lymfocytů v TIL v porovnání s periferní krví [28,30]. Vlivem nádorového mikroprostředí je porušeno vyzrávání aktivovaných TIL, část buněk vstupuje do apoptózy. V nádorové tkáni, ale i v séru nemocných s nádory je prokazován TGFβ, produkovaný nádorovými buňkami. TGFβ se významně podílí na nádorové angiogenezi.
U našich nemocných nebyl v porovnání s periferní krví zjištěn ani zvýšený počet TIL nesoucích molekulu HLA-DR. Vyjádření HLA-DR molekul je projevem prolongované stimulace. Molekuly HLA-DR II. třídy je možné prokázat na buňkách se zpožděním 48 - 72 hod po antigenní stimulaci [8]. Výsledky naší studie se shodují s jinými pracemi, popisujícími expresi molekul HLA-DR na CD3 a CD8 pozitivních T-lymfocytech. Ačkoliv zastoupení CD3+/DR+ a CD8+/DR+ buněk bylo u našich pacientů vyšší v TIL než PBL, nebyly tyto rozdíly signifikantní [7,37].
NK-buňky v periferní krvi jsou fenotypově heterogenní populací. CD56 molekula je prezentována téměř na všech NK-buňkách, zatímco CD57 molekula je prezentována jen na zralých NK-buňkách. Přítomnost NK-buněk je důležitá pro účinnost léčby IL-2. Donskov et al uvádí, že v průběhu léčby světlobuněčného karcinomu ledviny nebyla prokázána detekovatelná přítomnost CD56+ buněk v tumoru [12]. Naopak bylo prokázáno, že přítomnost CD57 pozitivních buněk je pro dosažení léčebné odezvy po podání IL-2 nezbytná. Bylo potvrzeno, že přítomnost CD57+ NK-buněk v nádoru má vliv na délku přežití jak u renálního karcinomu, tak u karcinomu kolorektálního a u karcinomu žaludku. NK-buňky jsou považovány za klíčovou populaci zajišťující kontrolu nádorového bujení [18]. Nízký počet NK-buněk mezi TIL je spojen s vyšším rizikem progrese nádoru. Chybění CD3-CD56+CD16+ buněk v periferní krvi a/nebo mezi TIL buňkami u nemocných s RCC je spojeno s rizikem rozvoje metastáz, což svědčí o protektivní roli těchto buněk [16,39]. Zastoupení NK-buněk v periferní krvi a nádorovém stromatu nevykazovalo u našich nemocných rozdílů [24].
Infiltrace nádoru lymfocyty vykazujícími cytotoxickou aktivitu namířenou proti nádorovým buňkám je považována za známku účinné protinádorové odezvy. Navzdory těmto nálezům, spontánní regrese tumoru a terapeutická odezva na podání biologické léčby jsou pozorovány pouze u malé části nemocných s karcinomem ledviny. Přítomnost aktivovaných T-lymfocytů nemusí odrážet protinádorovou odezvu. Zvýšená exprese molekuly CD69, která není nenásledovaná vyjádřením CD25 a HLA-DR na T-lymfocytech, je třeba považovat za projev selhání protinádorové imunitní odezvy [21,37].
B-lymfocyty tvoří minoritní populaci TIL. Ačkoliv přesná role B-lymfocytů není známa, vyjádření molekuly CD69 na B-lymfocytech infiltrujících tumor svědčí o jejich účasti v protinádorové odezvě [25]. V případě nádoru může protilátková odezva na nádorové antigeny vést po navázání protilátky k zablokování epitopů rozpoznávaných specifickými cytotoxickými T-lymfocyty a potencovat nádorový růst. Vyšší zastoupení B-lymfocytů mezi TIL bylo pozorováno u nemocných s převahou aktivity Th2 infiltrujících lymfocytů. Význam role antigen prezentující buňky nebyl v případě B-lymfocytů u nádorových onemocnění jednoznačně prokázán [3,27,33,40,41]. U našich nemocných tvořily B-lymfocyty méně než 1 % TIL a jejich počty byly v porovnání s počty v PBL signifikantně nižší.
K odlišným závěrům dospěl Shabtai v práci, která porovnávala zastoupení T - a B-lymfocytů v TIL a periferní žilní krvi u 8 nemocných s pokročilým renálním karcinomem. Poměr počtu B-lymfocytů infiltrujících nádor k B-lymfocytům v periferní krvi byl 2,4, zatímco poměr T-lymfocytů infiltrujících nádor k T-lymfocytům v periferní krvi byl 0,48. Navíc T-lymfocytární populace byla zastoupena převážně CD3+/CD4+ lymfocyty [34]. U těchto nemocných pravděpodobně došlo k převážení Th2 odezvy nad Th1 s tvorbou protilátek blokujících specifické nádorové antigeny a cytokinů, které umožnily nádorový růst [15].
Porovnáním lymfocytárních subpopulací v periferní krvi a v renální žíle nebyl zjištěn statisticky signifikantní rozdíl v jejich zastoupení. Tento nález jsme vzhledem k relativnímu průtoku renální žilou předpokládali, nicméně literární údaje o tomto nálezu jsme v literatuře nenalezli. V naší studii jsme využili možnosti peroperačního odběru krve z renální žíly.
Závěr
Lze shrnout, že zastoupení aktivovaných T-lymfocytů v nádoru je vyšší než v periferní krvi. CD3+/CD8+ T-lymfocyty jsou dominantní lymfocytární populací TIL. Ze znalosti fenotypu efektorových buněk lze usuzovat na charakter protinádorové imunitní odezvy. Za hlavní příčinu selhání protinádorové odpovědi je považováno cytokinové mikroprostředí uvnitř nádoru a nedostačující nádorové antigenní podněty. Výsledkem je neúčelná zánětová lokální reakce a progrese tumoru. K prolomení tohoto stavu, při kterém jsou tolerovány nádorové struktury, nevedou ve většině případů ani imunomodulační zásahy interleukinem-2 a interferonem-α [13].
Tento příspěvek vznikl s podporou grantu výzkumného záměru IGA: NR/8914-4.
Zkratky
BP-filtr - bandpass filtr
CV - koeficient variability
DNA - deoxyribonukleová kyselina
FITC - fluorescein izothiokyanát
Med. - median
p - probability level (hladina významnosti)
PC5 - phycoerythrin cyanin 5
PE - phycoerythrin
PI - propidium jodid
RNA - ribonukleová kyselina
TNM - Tumor, Nodi, Metastasis klasifikace
MUDr. Šárka Lukešová
www.fnhk.cz
e-mail: mudr.sarka.lukesova@seznam.cz
Doručeno do redakce: 18. 12. 2006
Přijato po recenzi: 8. 10. 2007
Sources
1. Bayer AL, Baliga P, Woodward JE. Differential effects of transferrin receptor blockade on cellular mechanisms involved in graft rejection. Transplant Immunol 1999; 7 : 131.
2. Bayer AL, Baliga P, Woodward JE. Transferrin receptor in T cell activation and transplantation. J Leukocyte Biol 1998; 64 : 19.
3. Bilik R, Mor C, Hazaz B et al. Characterisation of T lymphocyte populations infiltrating primary breast cancer. Cancer Immunol. Immunother 1989; 28 : 143-147.
4. Böhm M, Ittenson A, Schierbaum KF et al. Pretreatment with interleukin-2 modulates peri-operative immuno-dysfunction in patients with renal cell carcinoma. Eur Urol 2002; 41 : 458-468.
5. Bremers AJA, Parmiani G. Immunology and immunotherapy of human cancer: present concepts and clinical developments. Crit Rev Oncol Hematol 2000; 34 : 1-25.
6. Bubeník J. Interleukin-2 Therapy of Cancer. Folia Biol (Praha) 2004; 50 : 120-130.
7. Coventry BJ, Weeks SC, Heckford SE et al. Lack of IL-2 cytokine expression despite IL-2 messenger RNA transcription in tumor-infiltrating lymphocytes in primary human breast carcinoma: selective expression of early activation markers. J Immunol 1996; 156 : 3486.
8. Chadburn A, Inghirami G, Knowels DM. The kinetics and temporal expression of T cell activation-associated antigens CD15 (LeuM1), CD30 (Ki-1) EMA and CD11c (LeuM5) by benign activated T cells. Hematol Pathol 1992; 6 : 193.
9. Chakraborty NG, Sporn JR, Pasquale DR et al. Suppression of lymphokine-activated killer cell generation by tumor-infiltrating lymphocytes. Clin Immunol Immunopathol 1991; 59 : 407-416.
10. Characiejus D, Pašukoniené V, Kazlauskaité N et al. Predictive value of CD8highCD57+ lymphocyte subset in interferon therapy of patients with renal cell carcinoma. Anticancer Res 2002; 22 : 3679-3684.
11. de Jong EC, Smits HH, Kapsenberg ML. Dendritic cell-mediated T cell polarization. Spr Sem Immun 2005; 26 : 289-307.
12. Donskov F, Bennedsgaard KM, von der Maase H et al. Intratumoural and peripheral blood lymphocyte subsets in patients with metastatic renal cell carcinoma undergoing interleukin-2 based immunotherapy: association to objective response and survival. Br J Cancer 2002; 87 : 194-201.
13. Eckschlager T, Kodet R. Renal cell carcinoma in children: a single institution’s experience. Med Pediatr Oncol 1994; 23 : 36-39.
14. Elsässer-Beile U, Gierschner D, Welchner T et al. Different expression of Fas and Fas ligand in tumor infiltrating and peripheral lymphocytes of patients with renal cell carcinomas. Anticancer Res 2003; 23 : 433-438.
15. Elsässer-Beile U, Grussenmeyer T, Gierschner D et al. Semiquantitative analysis of Th1 and Th2 cytokine expression in CD3+, CD4+, and CD8+ renal-cell-carcinoma-infiltrating lymphocytes. Cancer Immunol. Immunother 1999; 48 : 204-208.
16. Hayakawa K, Morita T, Augustus LB et al. Human renal cell carcinoma cells are able to activate natural killer cells. Int J Cancer 1992; 51 : 290.
17. Igarashi T, Takahashi H, Tobe T et al. Effect of tumor-infiltrating lymphocyte subsets on prognosis and susceptibility to interferon therapy in patients with renal cell carcinoma. Urol Int 2002; 69 : 51-56.
18. Indrová M, Bubeník J, Jakoubková J et al. Subcutaneous interleukin-2 in combination with vinblastine for metastatic renal cancer: cytolytic activity of peripheral blood lymphocytes. Neoplasma 1994; 41 : 197-200.
19. Klener P jr, Anděra L, Klener P et al. Cell death signalling pathway in the pathogenesis and therapy of haematologic malignancies: Overview of therapeutic approaches. Folia Biol (Praha) 2006; 52 : 119-136.
20. Koo AS, Tso CL, Shimabukuro T et al. Autologous tumor-specific cytotoxicity of tumor-infiltrating lymphocytes derived from human renal cell carcinoma. J Immunother 1991; 10 : 347-354.
21. Kowalczyk D, Skorupski W, Kwias Z et al. Flow cytometric analysis of tumour-infiltrating lymphocytes in patients with renal cell carcinoma. Br J Urol 1997; 80 : 543-547.
22. Kronke M, Leonard WJ, Depper JM et al. Sequential expression of genes involved in human T lymphocyte growth and differentiation. J Exp Med 1985; 161 : 1593-1598.
23. Lucivero G, Dalla Mora L, Bresciano E et al. Functional characteristics of cord blood T lymphocytes after lectin and anti-CD3 stimulation. Differences in the way T cells express activation molecules and proliferate. Int J Clin Res 1996; 26 : 255.
24. Lukešová Š, Kopecký O, Vroblová V et al. Porovnání v zastoupení lymfocytárních populací u světlobuněčného karcinomu ledviny (v nádorové tkáni, renální žíle a periferní krvi). 307-309. In: Edukační sborník z XXX. brněnských onkologických dnů s XX. Konferencí pro sestry a laboranty. Brno: Masarykův onkologický ústav 2006.
25. Malinowski K, Kono K, Takayama T et al. Inhibition of lymphocyte proliferative responses by renal cell carcinoma extract. Transplant Proc 1997; 29 : 839.
26. Martel CL, Lara PN Renal cell carcinoma: current status and future directions. Crit Rev Oncol Hematol 2003; 45 : 177-190.
27. Mitropoulos D, Kooi S, Rodriguez-Villanueva J et al. Characterization of fresh (uncultured) tumour-infiltrating lymphocytes (TIL) and TIL-derivied T cell lines from patients with renal cell carcinoma. Clin Exp Immunol 1994; 97 : 321-327.
28. Nakamura K, Kitani A, Fuss I et al. TGF-β1 plays an important role in the mechanism of CD4+ CD25 – regulatory T cell activity in both humans and mice. J Immunol 2004; 172 : 834-842.
29. Panelli MC, Nagorsen D, Wang E et al. Mechanism of immune response during immunotherapy. Yonsei Med J 2004; 45 (Suppl): 15-17.
30. Park H, Paik D, Jang E et al. Acquisition of anergic and suppressive activities in transforming growth factor-β-costimulated CD4+ CD25 – T cells. Inter Immunol 2004; 16 : 1203-1213.
31. Reed JC, Alpers JD, Nowell PC et al. Sequential expression of protooncogenes during lecitin-stimulated mitogenesis of normal human lymphocytes. Proc Natl Acad Sci USA 1986; 83 : 3982-3986.
32. Rodriguez MA, De Sanctis JB, Blasini AM et al. Human IFN-γ up-regulates IL-2 receptors in mitogen-activated T lymphocytes. Immunol 1990; 69 : 554.
33. Santin AD, Ravaggi A, Bellone S et al. Tumor-infiltrating lymphocytes contain higher numbers of type 1 cytokine expressors and DR+ T cells compared with lymphocytes from tumor draining lymph nodes and peripheral blood in patients with cancer of the uterine cervix. Gynecol Oncol 2001; 81 : 424-432.
34. Shabtai M, Ye H, Frischer Z et al. Increased expression of activation markers in renal cell carcinoma infiltrating lymphocytes. J Urol 2002; 168 : 2216-2219.
35. Schoof DD, Terashima Y, Peoples GE et al. CD4+ T cell clones isolated from human renal cell carcinoma possess the functional characteristics of Th2 helper cells. Cellular Immunol 1993; 150 : 114-123.
36. Tiemessen MM, Kunzmann S, Schmidt-Weber CB et al.: Transforming growth factor-β inhibits human antigen-specific CD4+ T cell proliferation without modulating the cytokine response. Inter Immunol 2003; 12 : 1495-1504.
37. van den Hove LE, van Gool SW, van Poppel H et al. Identification of an enriched CD4+ CD8α++ CD8β+ T-cell subset among tumor-infiltrating lymphocytes in human renal cell carcinoma. Int J Cancer 1997; 71 : 178.
38. van den Hove LE, van Gool SW, van Poppel H et al. Phenotype, cytokine production and cytolytic capacity of fresh (uncultured) tumour-infiltrating lymphocytes in human renal cell carcinoma. Clin Exp Immunol 1997; 109 : 501-509.
39. Whiteside TL, Herberman RB The role of natural killer cells in immune surveillance of cancer. Curr Opinion Immunol 1995; 7 : 704-710.
40. Whitford P, Mallon EA, George WD et al. Flow cytometric analysis of tumour infiltrating lymphocytes in breast cancer. Br J Cancer 1990; 62 : 971-975.
41. Zeromski J, Dworacki G, Kruk-Zagajewska A et al. Assessment of immunophenotype of potentially cytotoxic tumor infiltrating cells in laryngeal carcinoma. Arch Immunol Ther Exp 1993; 41 : 57-62.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2008 Issue 2-
All articles in this issue
- Sledování protinádorové buněčné imunitní odpovědi u nemocných s renálním karcinomem, porucha proliferace T-lymfocytů
- Stanovení hodnot 24hodinového ambulantního monitorování krevního tlaku odpovídajících kazuálnímu tlaku 130/80 mm Hg
- Faktory se vztahem k hodnotám NT-proBNP u hemodynamicky stabilních pacientů s normální systolickou funkcí levé komory
- Invazivní aspergilové infekce u hematoonkologických nemocných: význam jednotlivých diagnostických metod, léčebných postupů a nástin finanční náročnosti léčby
- Dyslipidemie indukovaná antiretrovirovými léčivy
- Infekce tepenných rekonstrukcí: praktický pohled
- Význam endokanabinoidního systému v regulaci energetické rovnováhy
- Odporúčania pre diagnostiku a liečbu periférneho artériového ochorenia končatín (PAO)
- Každý den u nás umírá zbytečně nejméně 60 osob!
- Kvantifikace pravo-levého zkratu u pacientky s mnohočetnými plicními arteriovenózní malformacemi v rámci hemoragické hereditární teleangiektázie pomocí celotělové scintigrafie s 99mTc-makroagregatem humánního sérového albuminu: kazuistika
- Současné možnosti zobrazení magnetickou rezonancí v kardiologii
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Odporúčania pre diagnostiku a liečbu periférneho artériového ochorenia končatín (PAO)
- Kvantifikace pravo-levého zkratu u pacientky s mnohočetnými plicními arteriovenózní malformacemi v rámci hemoragické hereditární teleangiektázie pomocí celotělové scintigrafie s 99mTc-makroagregatem humánního sérového albuminu: kazuistika
- Faktory se vztahem k hodnotám NT-proBNP u hemodynamicky stabilních pacientů s normální systolickou funkcí levé komory
- Sledování protinádorové buněčné imunitní odpovědi u nemocných s renálním karcinomem, porucha proliferace T-lymfocytů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

