-
Medical journals
- Career
Invazivní aspergilové infekce u hematoonkologických nemocných: význam jednotlivých diagnostických metod, léčebných postupů a nástin finanční náročnosti léčby
Authors: Z. Ráčil 1; J. Mayer 1; I. Kocmanová 2; B. Wagnerová 1; J. Winterová 1; F. Folber 1; M. Lengerová 1; M. Moulis 3; D. Žáčková 1; L. Šmardová 1; A. Janíková 1; M. Navrátil 1; D. Dvořáková 1; J. Vorlíček 1
Authors‘ workplace: Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Vorlíček, CSc. 1; Oddělení klinické mikrobiologie FN Brno, pracoviště Bohunice, přednostka prim. MUDr. Alena Ševčíková 2; Ústav patologie Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jirka Mačák, CSc. 3
Published in: Vnitř Lék 2008; 54(2): 157-168
Category: Original Contributions
Overview
Východiska a cíle:
Invazivní aspergilóza (IA) představuje nejvýznamnější invazivní mykózu u hematoonkologických nemocných. Cílem předkládané práce je analýza výskytu, diagnostiky a léčby IA na hematoonkologickém pracovišti v České republice. Tato data dosud chybí.Pacienti a metody:
Byla provedena retrospektivní analýza zdravotnické a laboratorní dokumentace za období od ledna roku 2000 do prosince roku 2006 u nemocných z našeho pracoviště s diagnózou pravděpodobné/prokázané IA.Výsledky:
Celkem bylo diagnostikováno 52 případů IA u 51 nemocných (17,3 % prokázaná IA/82,7 % pravděpodobná IA). Ve sledovaném období došlo k výraznému nárůstu počtu případů IA diagnostikovaných v jednom roce (1 IA v roce 2000 vs 21 IA v roce 2006) a většina (61,5 %) infekcí byla nozokomiálního původu. Ve 46 případech (88,5 %) se jednalo o izolovanou plicní formu IA. Nejrizikovějšími nemocnými byli pacienti léčeni pro akutní leukemii nebo podstupující alogenní transplantaci krvetvorné tkáně (dohromady 52 %). V klinickém obraze dominovala přetrvávající horečka (92,3 % případů) a příznaky postižení plicního parenchymu (69,2 % případů). Konvenční diagnostické metody včetně autopsie dokázaly zachytit IA pouze v 15 (28,8 %) případech. Ve všech ostatních případech (71,2 %) umožnila stanovení diagnózy IA detekce galaktomananu (GM). Její zavedení také zkrátilo zahájení účinné antimykotické léčby o 4 dny. Iniciální léčba IA vedla souhrnně k dosažení léčebné odezvy (kompletní a parciální remise) u 18 (34,6 %) infekcí - nejvyšší procento léčebné odezvy bylo zaznamenáno při monoterapii vorikonazolem (42 %) a při použití kombinace kaspofunginu s vorikonazolem (83 %). Pro selhání iniciální léčby byla u 21 (40,3 %) případů IA podávána terapie záchranná. Nejčastěji byla zvolena kombinace kaspofunginu s vorikonazolem anebo monoterapie vorikonazolem s léčebnou odpovědí 55 %, resp. 50 %. Zavedení nových antimykotik spolu se zvýšením počtu případů IA vedlo k výraznému nárůstu roční ceny antimykotické léčby a to z 11,5 tisíce Kč v roce 2000 na 6,2 miliónu Kč v roce 2006.Závěr:
IA je stále častější infekční příčinou úmrtí u nemocných s hematologickou malignitou. Rutinní zavedení a používání nových nekultivačních metod v diagnostice IA spolu s časnou aplikací nových, účinných antimykotik však umožňuje významně zlepšit prognózou nemocných s touto závažnou infekcí.Klíčová slova:
invazivní mykóza - Aspergillus - invazivní aspergilóza - galaktomanan - časná diagnóza - antimykotická léčba - hematologické malignityÚvod
Invazivní mykotické infekce patří v současné době mezi jedny z hlavních infekčních příčin mortality nemocných s hematologickou malignitou. V posledních 2 dekádách jsme svědky změn v epidemiologii těchto infekcí - nejčastěji se u této skupiny nemocných objevuje invazivní aspergilóza (IA) s incidencí 10-20 % a s mortalitou 50-90 % u nejvíce rizikových z nich (pacienti s akutní leukemií a po alogenní transplantaci krvetvorné tkáně) [1-3].
Od počátku 21. století však dochází k výraznému zlepšení diagnostiky této život ohrožující infekce a to jednak zavedením rutinního provádění vysoce rozlišovacího CT plic (HRCT plic) u febrilních neutropenických pacientů nereagujících na léčbu širokospektrými antibiotiky a především pak rozšířením pravidelného monitoringu přítomnosti aspergilového antigenu (galaktomananu) v séru nemocných v riziku IA [4,5].
Kromě toho se v posledních několika letech výrazně rozšířily léčebné možnosti u této závažné infekce. K dispozici jsou nové lékové formy polyenů, nové a účinnější azoly a zcela nová třída antimykotik - echinokandiny [6].
Precizní diagnostika a cílená a současně často razantní léčba umožňují v některých centrech výrazně zlepšit prognózu pacientů [7].
Přestože je k dispozici celá řada publikací analyzujících případy IA na jednotlivých světových pracovištích [8], práce podobného charakteru v české literatuře dosud prezentována nebyla.
Cílem předkládaného sdělení je retrospektivní analýza případů invazivních aspergilových infekcí na jednom z velkých hematoonkologických pracovišť v České republice, zejména posouzení výskytu, rizikových faktorů, klinických projevů, diagnostiky a léčby této hluboké mykózy. Lze se oprávněně domnívat, že obdobná situace může být i na jiných pracovištích.
Pacienti a metody
Sledovaná populace
Interní hematoonkologická klinika FN Brno-Bohunice má k dispozici 74 lůžek pro léčbu celého spektra hematologických malignit. Průměrná roční obložnost ve sledovaném období 2000-2006 byla 93,8 % (91,3-95,4 %). Celkový počet hospitalizací byl 19 514, což je v průměru 2 788 hospitalizací (2 618-2 920) za rok.
Nemocní byli obvykle hospitalizováni na standardním 3lůžkovém pokoji s centrální úpravou vzduchu, ovšem kromě pacientů podstupujících alogenní transplantaci krvetvorné tkáně, kteří byli ve většině případů umístěni na jednolůžkovém pokoji s úpravou vzduchu pomocí HEPA filtru, a to až do doby přihojení štěpu (absolutní počet neutrofilních granulocytů > 1,0 × 109/l).
Po dobu neutropenie, respektive u pacientů po alogenní transplantaci krvetvorné tkáně také po dobu intenzivní imunosuprese pro reaktivaci štěpu proti hostiteli (Graft Versus Host Disease - GvHD), byla nemocným podávána antimykotická profylaxe flukonazolem v dávce 400 mg/den.
Během hospitalizace byli pacienti pečlivě sledováni stran rozvoje příznaků invazivní mykotické infekce. Denně lékaři prováděli klinická vyšetření, konvenční snímek srdce a plic byl indikován vstupně a následně v průběhu febrilní neutropenie minimálně 1krát týdně ev. častěji. V týdenním intervalu probíhala surveillance bakteriologického a mykologického osídlení v moči, stěru z rekta a dutiny ústní. Odběr hemokultur a kultivační vyšetření ostatních klinických materiálů bylo prováděno v případě rozvoje febrilií respektive klinických příznaků infekce. Od května roku 2003 také probíhal pravidelný screening nemocných v riziku invazivní aspergilózy pomocí detekce aspergilového antigenu - galaktomananu (kit Platelia® Aspergillus, Bio-Rad, France) v séru, a to nejméně 2krát týdně u rizikových nemocných (alogenní HSCT a léčba akutní leukemie), a u ostatních pacientů pak při febriliích nereagujících na antibiotika a při rozvoji plicních infiltrátů na zobrazovacích metodách. Vzorek séra testovaný v Platelia® Aspergillus byl označen jako pozitivní při indexu pozitivity (IP) vyšším než 0,5. Jako galaktomanan (GM) pozitivní nemocný byl označen pacient s minimálně 2 pozitivními odběry za sebou.
V případě zvýšené pravděpodobnosti vzniku invazivní mykotické infekce (febrilní neutropenie nereagující 5 dnů na antibiotickou léčbu, rozvoj plicních infiltrátů na konvenčním RTG snímku plic, pozitivní kultivace s průkazem vláknité houby v materiálu z dýchacích cest) proběhla série vyšetření s cílem prokázat etiologické agens. V maximální možné míře bylo provedeno HRCT plic a v případě pozitivity bronchoalveolární laváž (BAL). Lavážní tekutina byla vyšetřována kultivačně, cytologicky, imunofluorescenčně pro průkaz Pneumocystis jiroveci a molekulárně biologicky pro průkaz virových patogenů, mykoplazmat, chlamydií a opět Pneumocystis jiroveci. Od září roku 2003 byla tekutina získaná laváží testována na přítomnost galaktomananu.
Spíše výjimečně byla prováděna biopsie plicních infiltrátů nalezených na HRCT plic (tenkojehlová pod CT kontrolou, torakoskopicky nebo torakotomicky) nebo eventuálně biopsie jiných postižených tkání. Získaný materiál byl pak opět vyšetřen histologicky, cytologicky a kultivačně.
Jako empirická antimykotická léčba bývá většinou zvolen konvenční amfotericin B, v indikovaných případech kaspofungin nebo vorikonazol.
V případě úmrtí nemocného byla v maximálně možné míře a při souhlasu rodiny provedena patologicko-anatomická pitva. Ve sledovaných letech byla sekce provedena průměrně u 63 % (92-44 %) pacientů zemřelých na našem pracovišti. Procento sekcí bylo poněkud vyšší v letech 2000, 2001 a 2005 (92 %, 71 % a 79 %).
Design studie
Tato retrospektivní analýza zahrnuje 7leté období od 1. ledna 2000 do 31. prosince 2006. Případy invazivní aspergilózy byly retrospektivně identifikovány z různých zdrojů - histologické výsledky sekčních a bioptických materiálů, mikrobiologické výsledky (kultivace, mikroskopie, galaktomanan) a zdravotnická dokumentace.
Definice
Do analýzy byli zahrnuti nemocní s prokázanou a pravděpodobnou IA dle EORTC/MSG (European Organization for Research and Treatment of Cancer/Mycosis Study Group) kritérií [9]. Jako pacienti s „prokázanou“ IA byli označeni nemocní s pozitivním histologickým/kultivačním průkazem Aspergillus spp. ze sterilního místa nebo ze sekce. „Pravděpodobná“ IA byla přiřazena pacientům s kombinací rizikových faktorů, klinických příznaků (nález na zobrazovacích metodách většinou v kombinaci s příznaky orgánového postižení) a mikrobiologických kritérií (průkaz Aspergillus spp. z materiálu z dýchacích cest nebo pozitivita GM v séru, ev. v tekutině z BAL).
Jako nozokomiální byly označeny infekce, u kterých došlo k rozvoji projevů po 7 a více dnech od příjmu na naše pracoviště (pozitivní klinické příznaky z orgánového postižení infekcí, zobrazovací metody, mikrobiologické nebo histologické vyšetření), přestože jednoznačná definice nozokomiálního původu IA není v literatuře přesně vymezena [10]. V ostatních případech byly infekce považovány za získané v komunitě (k projevům infekce došlo do 7 dnů od přijetí) nebo za neklasifikovatelné (diagnóza byla stanovena až sekčně nebo nebylo možno přesně stanovit začátek příznaků).
Při hodnocení léčebné odezvy infekce jsme vycházeli z posouzení přežívání nemocného, jeho klinického stavu, radiologického nálezu a vývoje mikrobiologických parametrů (především galaktomananu). Kompletní a parciální léčebná odezva byly považovány za úspěšný výsledek léčby a nevedly ke změně antimykotické léčby (s výjimkou „step down“, při němž byla dvojkombinace změněna za monoterapii). Naopak stabilní stav infekce, stejně tak jako progrese onemocnění byly považovány za selhání léčby a při příznivé celkové prognóze nemocného byla tato situace indikací ke změně antimykotické léčby. Za selhání antimykotické léčby bylo považováno také úmrtí antimykotiky léčeného nemocného z důvodů progrese IA.
Výsledky
Základní charakteristika souboru
Mezi lety 2000-2006 bylo diagnostikováno 52 případů IA u 51 nemocných. Došlo k významnému nárůstu počtu nově zjištěných onemocnění IA za rok - z 1 případu v roce 2000 na 21 infekcí v roce 2006 (graf 1).
Graph 1. Počet případů pravděpodobné/prokázané invazivní aspergilózy (IA) na Interní hematoonkoloigcké klinice FN Brno-Bohunice v letech 2000–2006. 
Mezi histologicky prokázané infekce („proven IA“) patřilo 9 (17,3 %) případů IA a zbylých 43 (82,7 %) pak patřilo mezi infekce pravděpodobné („probable IA“).
Většina případů (88,5 %) invazivních aspergilových infekcí byla omezena na postižení plic. K diseminaci infekce došlo v 6 (11,5 %) případech - nejčastěji do jater a sleziny (3 případy), izolovaně pak do jiných tkání (tračník, mozek, myokard, ledviny, nadvarle, paranazální dutiny).
Za nozokomiálně získané bylo označeno 32 (61,5 %) případů infekcí, ve 12 (23,1 %) případech se jednalo o infekce komunitní a u 8 (15,4 %) pacientů nebylo možné původ onemocnění určit (tab. 1).
Table 1. Charakteristika souboru. 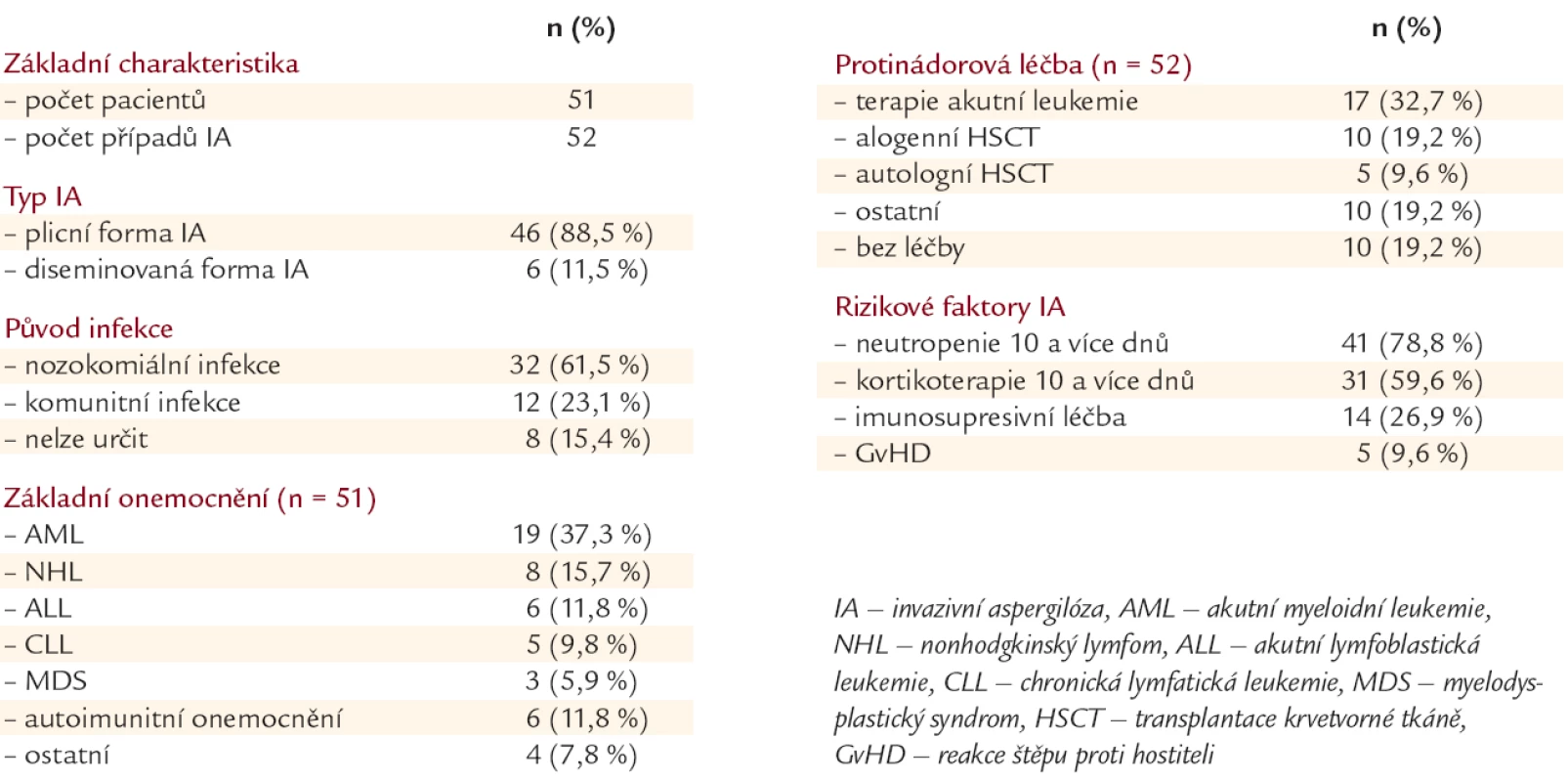
Základní onemocnění a rizikové faktory IA
Základní hematologické onemocnění pacientů s IA ukazuje graf 2. Z grafu je velice dobře vidět rizikovost nemocných s akutní leukemií - téměř polovina (48 %) všech případů byla diagnostikována právě u pacientů s tímto onemocněním.
Graph 2. Rozdělení případů IA dle základního hematologického onemocnění (n = 51 pacientů). 
AML – akutní myeloidní leukemie, NHL – nonhodgkinský lymfom, ALL – akutní lymfoblastická leukemie, CLL – chronická lymfatická leukemie, MDS – myelodysplastický syndrom, autoimunita – autoimunitní onemocnění Graf 3 pak zobrazuje jejich protinádorovu léčbu. K 52% počtu infekcí došlo opět u pacientů léčených chemoterapií pro akutní leukemii anebo podstupujících alogenní transplantaci krvetvorné tkáně.
Graph 3. Rozdělení případů IA dle typu protinádorové léčby. 
HSCT – transplantace krvetvorné tkáně Z analýzy vyplývá vztah výskytu IA k aktivitě základního nádorového onemocnění: 20 případů (38,4 %) bylo diagnostikováno u pacientů, kteří dosud nebyli léčeni nebo právě podstoupili 1. sérii hematologické léčby - tedy s aktivní nádorovou chorobou. Na druhou stranu 23 infekcí (44,2 %) vzniklo u vysoce „předléčených“ jedinců, kteří obdrželi 5 a více sérií protinádorové léčby, z významné části pro recidivy hematologického onemocnění. Opět se tedy často jednalo o pacienty s aktivní základní chorobou. Velká „předléčenost“ je také pravděpodobnou příčinou četnějšího výskytu případů IA u nemocných s NHL a CLL v našem souboru - 4 (80 %) pacienti s CLL a 4 (50 %) s NHL byli vysoce „předléčeni“.
Nejčastějším rizikovým faktorem byla dlouhodobá neutropenie (10 a více dnů), a to u 41 případů (78,8 %), dlouhodobá kortikoterapie (10 a více dnů) u 31 (59,6 %), imunosupresivní léčba u 14 (26,9 %) a GvHD v 5 (9,6 %) případech IA (tab. 1). Neutropenie a imunosupresivní léčba jako závažné rizikové faktory IA mohou být vysvětlením pro vznik infekce u 10 nemocných, kteří neobdrželi protinádorovou léčbu - 5 (50 %) z nich byli pacienti s akutní leukemií nebo MDS, iniciálně neutropeničtí a dosud neléčení, a další 4 (40 %) z výše jmenované skupiny byli nemocní léčeni imunosupresivní (většinou kombinovanou) léčbou pro autoimunitní onemocnění.
Klinické projevy
Nejčastějším orgánem postiženým invazivní aspergilovou infekcí byly plíce (98 % případů IA mělo postižení plicního parenchymu). U většiny nemocných jsme pak nacházeli klinický obraz, odpovídají pneumonii s dlouhotrvající horečkou nereagující na podávání širokospektrých antibiotik. Febrilie nereagující na antibiotickou léčbu byla přítomna u 92,3 % infekcí a 69,2 % případů mělo minimálně jeden z příznaků plicního postižení při IA, jakými jsou kašel (54 %), dušnost (31 %), torakalgie (6 %), hemoptýza (2 %). Příznaky z postižení mimoplicních tkání se vyskytly u 3 (5,7 %) infekcí (enteroragie a porucha vědomí); 2 nemocní (3,8 %) byli v době diagnózy afebrilní a asymptomatičtí (graf 4). V obou případech šlo o pacienty s nově diagnostikovanou akutní leukemií, u kterých byl současně se zahájením protinádorové léčby zahájen také pravidelný monitoring GM. Pozitivní výsledek testu u rizikového nemocného inicioval časné provedení HRCT s pozitivním výsledkem.
Graph 4. Klinické projevy IA a jejich výskyt. 
Diagnostické metody
Autopsie
Autopsie byla provedena u 16 (64 %) z 25 zemřelých nemocných. U 5 pacientů vedla až sekce ke stanovení diagnózy IA. V 6 případech autopsie potvrdila diagnózu stanovenou již ante mortem (5 případů bylo diagnostikováno na základě detekce GM a 1 pak pomocí HRCT). Naopak u 5 autoptických vyšetření pacientů s pravděpodobnou IA (stanovenou 1krát na základě nálezu na HRCT a 4krát podle výsledků GM) nebyla histologicky ani kultivačně aspergilová infekce zachycena. Všichni nemocní z této skupiny však byli v době úmrtí léčeni antimykotiky a ve 2 případech dokonce několik týdnů.
Biopsie primárně sterilních tkání
Pouze ve 2 (3,8 %) případech byla provedena tkáňová biopsie (plíce; nadvarle a slezina) a v obou případech s pozitivním výsledkem histologického vyšetření. Kultivace naopak byla ze všech bioptovaných tkání od obou nemocných negativní.
Konvenční mykologické vyšetření materiálu z dýchacích cest
Sputum bylo odebráno a vyšetřeno konvenčními mykologickými metodami (kultivace, mikroskopie) u 49 nemocných (94,2 %). Toto mykologické vyšetření však přineslo pozitivní výsledek pouze 3krát (6,1 %). U všech 3 pacientů byla navíc pozitivní pouze kultivace s identickým výsledkem nálezu Aspergillus fumigatus. Mikroskopické vyšetření sputa bylo u všech 3 nemocných negativní.
BAL byl proveden ve 30 (57,7 %) případech. Konvenční mykologická diagnostika však byla pozitivní pouze u 2 nemocných (6,7 %). U obou byl vykultivován Aspergillus fumigatus, mikroskopické vyšetření lavážní tekutiny bylo pozitivní jen u 1 z těchto 2 případů.
Souhrnně lze říci, že vyšetření materiálu z dýchacích cest konvenčními mikrobiologickými metodami napomohlo stanovení diagnózy IA pouze u 5 (9,6 %) nemocných z našeho souboru.
Zobrazovací metody
Běžné RTG vyšetření plic bylo provedeno u většiny pacientů z našeho souboru (48; 92,3 %). U 14 (29,1 %) z nich byl snímek v době stanovení diagnózy IA zcela negativní. Ve zbývajících 70,9 % případů pak byl sice RTG snímek patologický, ale obraz byl zcela nespecifický s dominantním nálezem ložiskového postižení plicního parenchymu (tab. 2).
Table 2. Charakter postižení na RTG plic a HRCT plic v době stanovení diagnózy IA. 
Vysoce rozlišovací CT (HRCT) plic bylo provedeno u 42 (80,7 %) infekcí. Na rozdíl od konvenčního snímku bylo abnormální ve všech případech (100 %). HRCT bylo indikováno také u 10 nemocných s negativním nálezem na konvečním snímku plic a ve všech 10 případech byl nález na HRCT patologický. HRCT tak prokázalo vysokou (100%) senzitivitu pro diagnostiku plicních abnormalit při IA a schopnost identifikovat tyto abnormality v době, kdy nález na konvenčním snímku je dosud v normálních mezích.
Na druhou stranu však v době diagnózy měl jen velmi malý počet nemocných obraz podezřelý z angioinvazivní formy IA. Pouze ve 3 (7,1 %) případech byl nalezen obraz „halo“ a u dalších 3 (7,1 %) nemocných známky „air crescent“. U absolutní většiny infekcí (85,8 %) byl nález na HRCT zcela nespecifický a pestrý. HRCT tedy poukázalo na přítomnost plicní patologie, nicméně přineslo relativně malou informaci o možné etiologii procesu (tab. 2).
Galaktomanan (GM)
U 43 invazivních aspergilových infekcí bylo vyšetřeno sérum na přítomnost GM. Za GM pozitivní bylo označeno 41 případů (95,3 %). U zbývajících 25 nemocných byl pozitivní pouze 1 vzorek krve a tak nemohli být označeni za pozitivní. Oba pacienti byli v době odběrů léčeni antimykotiky s účinkem na kmeny aspergilů, což mohlo ovlivnit množství mykotické nálože, respektive množství uvolňovaného GM.
Vedle excelentní senzitivity umožnila pozitivita tohoto antigenu v séru odlišit etiologii nespecifických abnormalit na HRCT. 35 pacientů mělo současně provedeno HRCT a GM byl v séru pozitivní. Pouze ve 4 (11,4 %) případech byl na HRCT obraz charakteristický pro IA. U zbylých 31 (88,5 %) infekcí byl nález na HRCT nespecifický a právě současná pozitivita GM dokázala identifikovat u těchto abnormalit pravděpodobnou aspergilovou etiologii.
Přínosnost jednotlivých metod pro diagnostiku IA
Konvenční diagnostické metody (včetně autopsie) umožnily stanovit diagnózu IA pouze v 15 (28,8 %) případech z našeho souboru. Zavedení detekce GM zásadním způsobem diagnostiku této život ohrožující infekce změnilo: 37 (71,2 %) případů IA zachycených na našem pracovišti bylo stanoveno na základě pozitivity GM, většinou v kombinaci s nálezem abnormality na zobrazovacích metodách (graf 5).
Graph 5. Procento případů IA diagnostikovaných pomocí jednotlivých metod. 
DC – dýchací cesty, HRCT – vysoce rozlišovací CT plic Vedle zvýšení počtu zachycených invazivních aspergilových infekcí umožnilo zavedení GM také zkrácení doby do stanovení diagnózy respektive do zahájení účinné antimykotické léčby. V období do května roku 2003 byla antimykotická léčba zahajována průměrně 15 dní od prvních klinických příznaků (většinou febrilií). Po zavedení detekce GM, tedy od května roku 2003, byla účinná antimykotika podávána průměrně 11 dní od prvních projevů infekce. Detekce GM tedy zkrátila dobu do startu antimykotické léčby průměrně o 4 dny.
Navíc byla pozitivita GM v séru velice často indikátorem k časnému provedení HRCT. Jestliže v období před zavedením GM byla průměrná doba abnormálního nálezu na HRCT 21 dní od rozvoje klinických projevů, po jeho zavedení se tato doba zkrátila na 11 dní.
Léčba
Volba antimykotik a léčebná strategie se v průběhu sledovaného období radikálně změnila. Zatímco do roku 2003 byl používán především konvenční amfotericin B (C-AMB), od této doby byla většina nemocných léčená v primoléčbě vorikonazolem nebo kombinací vorikonazolu a kaspofunginu.
Iniciální léčba vedla souhrnně k dosažení léčebné odpovědi (kompletní a parciální remise) u 18 (34,6 %) infekcí.
Při monoterapii konvenčním amfotericinem B (n = 8), itrakonazolem (n = 6) a kaspofunginem (n = 5) bylo léčebné odezvy v primoléčbě IA dosaženo maximálně u 20 % nemocných. Nejčastěji však byl v monoterapii použit vorikonazol (n = 24), jehož podávání vedlo u 42 % pacientů k léčebné odpovědi. V 6 případech byla pro vysokou rizikovost nemocných (v 80 % případů se jednalo o nemocné po alogenní transplantaci krvetvorné tkáně nebo akutní leukemie u mladých pacientů), a to zejména v roce 2006, jako primární terapie zvolena kombinovaná léčba intravenózním kaspofunginem s perorálním vorikonazolem. Přestože jde o malý počet nemocných, je v případě kombinace procento léčebné odezvy významně vyšší než při monoterapii vorikonazolem nebo kaspofunginem, a to 83 % (graf 6).
Graph 6. Počet případů IA léčených jednotlivými antimykotiky/kombinacemi antimykotik a jejich účinnost při použití v primoléčbě IA. 
SD – stabilizovaný stav choroby při léčbě, CR – kompletní léčebná odezva, PR – částečná léčebná odezva, AMFO B – amfotericin B, ITRA – itrakonazol, CASPO – kaspofungin, VORI – vorikonazol Pro selhání iniciální léčby byla u 21 (40,3 %) případů IA podávána terapie záchranná. Nejčastěji byla zvolena kombinace kaspofunginu s vorikonazolem (n = 9) s 55% léčebnou odezvou a monoterapie vorikonazolem (n = 4) s podobnou odezvou (50%). Ostatní léky a kombinace pak byly použity jen v izolovaných případech (graf 7).
Graph 7. Počet případů IA léčených jednotlivými antimykotiky/kombinacemi antimykotik a jejich účinnost při použití v záchranné léčbě IA 
SD – stabilizovaný stav choroby při léčbě, CR – kompletní léčebná odezva, PR – částečná léčebná odezva, AMFO B – amfotericin B, ITRA – itrakonazol, CASPO – kaspofungin, VORI – vorikonazol, POSA – posakonazol Zavedení nových účinných antimykotik v letech 2002 a 2003 spolu se zvýšeným počtem včasně diagnostikovaných nemocných s IA vedl k výraznému nárůstu finančního objemu za antimykotickou léčbu této infekce. Za 7leté období činila celkem cena antimykotické léčby IA 17,2 milionů Kč. Zatímco v roce 2000 (1 případ IA léčený C-AMB) představovala roční cena antimykotické léčby IA 11 500 Kč, v roce 2006 (22 případů IA léčených novými azoly a echinokandiny) činila tato částka již 6,2 miliónu Kč (graf 8).
Graph 8. Cena za antimykotickou léčbu IA v letech 2000–2006. 
Izolovaný vzestup spotřeby za antimykotickou léčbu v roce 2003, který neodpovídá počtu případů IA v tomto roce, byl způsoben komplikovanou léčbou jediného nemocného s diseminovanou, a navíc s odstupem času relabující formou IA. Tento nemocný byl téměř 200 dní v roce 2003 léčen kombinovanou antimykotickou léčbou azolu s echinokandinem, která vedla ke kompletní léčebné odezvy.
Mortalita
Celková mortalita nemocných ze souboru byla 50,9 % (26 z 51 nemocných). Invazivní aspergilová infekce byla příčinou nebo velmi významným spolupodílejícím se faktorem úmrtí u 16 (31,3 %) pacientů.
Mortalita i výše zmíněná tzv. „attributed“ mortalita byla vyšší u nemocných s prokázanou IA (91,6 % a 83,3 %) ve srovnání s pacienty s pravděpodobnou IA (38,4 % a 12,8 %).
„Attributed“ mortalita také velmi významně klesala v průběhu jednotlivých let a to ze 100 % v roce 2000 na 5 % v roce 2006 (graf 9).
Graph 9. „Attributed“ mortalita nemocných s IA v letech 2000–2006. 
Diskuse
Námi předkládaná práce představuje podle našich znalostí první a nejrozsáhlejší analýzu invazivních aspergilových infekcí u hematoonkologických pacientů v České republice.
Pestrost klinického obrazu této infekce a obtížnost její diagnostiky lze vyčíst z několika popisů případů IA z našeho pracoviště prezentovaných v tab. 3.
Table 3. Soubor kazuistik nemocných s invazivní aspergilózou (IA). 
Z práce je velice dobře patrný významně narůstající počet případů IA na našem pracovišti ve sledovaném 7letém období a situace u nás tak kopíruje epidemiologii invazivních mykóz na světových hematoonkologických pracovištích [11].
Rostoucí výskyt IA na naší klinice lze vysvětlit několika faktory.
Jistě se uplatnil stále vyšší počet provedených nepříbuzenských alogenních transplantací krvetvorné tkáně (2 v roce 2000 až 13 v roce 2006), což vedlo k nárůstu počtu pacientů nejohroženějších IA. Ostatní parametry, které by mohly ovlivnit nárůst případů IA z pohledu spektra nemocných, zůstávají v jednotlivých letech stejné - počet hospitalizací, počet ostatních nemocných mimo alogenní nepříbuzenskou transplantaci krvetvorné tkáně ve skupině vysoce rizikových pacientů (tj. alogenní příbuzenské transplantace, akutní leukemie, ev. autologní transplantace krvetvorné tkáně), stejně tak jako procento sekcí (naopak se od roku 2000 a 2001 mírně snižuje).
Druhým důležitým momentem (zejména v roce 2006), který mohl ovlivnit nárůst případů IA, představují také rozsáhlé stavební úpravy v okolí FN Brno-Bohunice. Na potenciální vliv mykotickými sporami kontaminovaného vnitřního prostředí nemocnice upozorňuje také fakt, že většina případů IA na našem pracovišti (61,5 %) byla nozokomiálního původu. Tato hypotéza, přestože její alespoň částečný vliv je na základě literárních dat pravděpodobný [12], nemůže však být vzhledem k chybění pravidelného aeroskopického monitoringu vnitřního prostředí ve FN Brno-Bohunice jednoznačně potvrzena.
Naopak zásadní význam na zvýšení počtu případů IA (zejména pravděpodobné IA) mělo výrazné zlepšení záchytu jednotlivých případů této infekce po zavedení časné diagnostiky pomocí rutinní detekce GM od roku 2003.
Data pro srovnání epidemiologie IA na ostatních hematoonkologických pracovištích v České republice bohužel nejsou k dispozici. Nicméně se dá předpokládat, že ev. nízké počty případů IA zde mohou být způsobeny možným „poddiagnostikováním“ této závažné infekce, zvláště pokud není jednoznačně vypracovaný a zcela rutinní přístup k sérologické diagnostice IA pomocí detekce GM.
V kontextu s publikovanými pracemi představují nejrizikovější skupinu pro postižení IA pacienti s akutní leukemií (48 % případů) [11]. Z pohledu protinádorové léčby pak nemocní podstupující terapii pro akutní leukemii, respektive alogenní HSCT (52 %) [13].
Naše analýza také potvrdila řadu let známý fakt, že dlouhodobá neutropenie a kortikoterapie mají pro riziko IA velký význam - tyto rizikové faktory byly přítomny u 78,8 %, respektive 59,6 % případů IA [14,15].
Absolutně nejvíce invazivních aspergilových infekcí vzniká po inhalací spor. Proto není překvapením, že většina IA v našem souboru probíhala pod klinickým obrazem plicního postižení (69,2 %), většinou s horečkou nereagující na podávání širokospektrých antibiotik (92,3 %).
Tyto klinické projevy jsou však velice nespecifické.
Konvenční diagnostické metody (včetně stanovení diagnózy ante mortem při autopsii) dokážou v běžné rutinní praxi hematoonkologického pracoviště identifikovat jen velmi malou část případů, a to většinou v již značně pokročilém stadiu [16]. Také v našem souboru dokázaly konvenční mikrobiologické, histologické a radiologické metody identifikovat pouze 15 (28,8 %) případů IA, a to v 5 případech až ante mortem.
Zavedení vysoce rozlišovacího CT plic (HRCT) do algoritmu péče o nemocné s rizikem rozvoje IA výrazně zvýšilo pravděpodobnost časného záchytu této infekce [4]. HRCT dokázalo v našem souboru se 100% senzitivitou zachytit plicní patologii, bohužel jen ve 14,2 % byl detekován obraz popisovaný jako charakteristický pro IA [4]. Tak jen u velmi malé části nemocných mohlo být vysloveno podezření na mykotickou etiologii na základě nálezu na HRCT plic.
Velmi významný pokrok v časné diagnostice IA znamenalo rozšíření detekce galaktomananu (GM) pomocí ELISA metodiky do rutinní praxe [17].
Senzitivita této metody je vysoká při použití cut-off indexu pozitivity 0,5 v rutinním monitoringu minimálně 2-3krát týdně [18]. V našem souboru byla 95,3 %. Nález hraničně pozitivních výsledků u 2 zbylých GM negativních pacientů podporuje potřebu užití sníženého cut-off indexu pozitivity u nemocných, kteří jsou monitorováni v průběhu podávání antimykotik s účinkem na vláknité mykózy (např. profylakticky nebo empiricky) [19]. Oba 2 zmínění pacienti byli v době stanovení diagnózy léčeni antimykotiky s účinkem na kmeny aspergilů.
Pro klíčový význam pravidelného monitoringu GM svědčí pak především fakt, že 71,2 % případů IA na našem pracovišti bylo diagnostikováno pomocí detekce tohoto antigenu.
Pozitivita GM nadto zkrátila dobu do stanovení definitivní diagnózy pravděpodobné IA, respektive zkrátila dobu do zahájení podávání účinné antimykotické léčby, a to o 4 dny ve srovnání s historickými kontrolami. Rovněž často iniciovala časné provedení HRCT a pomohla k diferenciální diagnostice nespecifických abnormalit v plicním parenchymu nalezených při tomto vyšetření.
Jistou limitací metody je možnost falešných pozitivit [17]. Jejich znalost lékařem, který výsledek testu hodnotí, však podle našich zkušeností možnost špatné interpretace výsledku dokáže významně minimalizovat.
V současné době je standardní iniciální léčbou IA ve většině center vorikonazol [6]. Také na našem pracovišti byla monoterapie vorikonazolem nejčastěji používanou léčbou první linie. Přestože procento kompletních a parciálních léčebných odpovědí bylo v našem souboru poněkud menší než ve studii Herbrechta et al (42 % v našem souboru vs 52 % v práci Herbrechta) [20], byla léčba vorikonazolem v monoterapii účinnější než ostatní použitá antimykotika. Velmi zajímavým trendem (i když jde o malý počet nemocných) je však 83 % léčebných odpovědí při použití kombinované antimykotické léčby kaspofunginem s vorikonazolem jako léčby první linie.
Značně komplikovanou je pak záchranná léčba IA u nemocných, u kterých terapie první linie selhala. V našem souboru jsme v této indikaci nejčastěji použili opět kombinaci kaspofunginu s vorikonazolem, a to s léčebnou odpovědí 55 %. Velmi dobrá byla také účinnost monoterapie vorikonazolem (50 %). Nutno však upozornit, že ve většině případů při použití monoterapie vorikonazolem v záchranné léčbě šlo o nemocné, kteří byli léčeni pouze konvenčním amfotericinem B. Pacienti s kombinovanou antimykotickou léčbou byli výrazně častěji „předléčeni“ moderními a účinnými antimykotiky.
Konečně velmi významný momentem vyplývajícím z naší analýzy je změna ve vývoji „attributed“ mortality. Přestože jsme ve sledovaném 7letém období pozorovali výrazný nárůst v prevalenci IA, „attributed“ mortalita významně klesla. Tento nález, jehož hodnota může být do určité míry limitována retrospektivním charakterem analýzy, lze vysvětlit několika fakty. V průběhu let a především pak v roce 2006 se výrazně zvýšilo procentuální zastoupení případů pravděpodobné IA, která je spojena s nižší mortalitou [10]. Zásadní vliv na zlepšení prognózy našich pacientů s IA však mělo zavedení detekce GM a tak zkrácení doby do stanovení diagnózy spolu se zavedením používání nových účinných antimykotik, ev. ve formě jejich kombinace. Tento trend lze pozorovat i na jiných pracovištích v Evropě [7] a bude zajímavé sledovat, zda-li se na našem pracovišti tendence ve výrazném snižování mortality invazivních aspergilových infekcí potvrdí i v následujících letech. Další snížení morbidity, ale i mortality této život ohrožující infekce (alespoň u nejvíce rizikových pacientů) by mohlo přinést rozšíření profylaktického používání nových antimykotik s účinkem na kmeny aspergilů [21,22].
Nesporné zlepšení péče o pacienty s IA v průběhu námi sledovaného období však bylo doprovázeno i výrazným nárůstem finančního objemu spotřebovaného za použitá antimykotika, který se v průběhu 7 let zvýšil o 3 řády (z tisíců Kč na miliony Kč).
Jedním z nejdůležitějších bodů v prevenci IA jako inhalační infekce je úprava vnitřního prostředí hematoonkologických oddělení (vybudování HEPA filtrace a pozitivní přetlak vzduchu) [12]. Přestože rekonstrukce jednotlivých pracovišť je velice nákladná, je ve světle výše uvedených dat otázkou, zda-li v krátkém časovém horizontu cena za antimykotickou léčbu IA nepřekročí částku za tyto úpravy.
Závěr
Invazivní aspergilóza představuje v současné době nejčastější invazivní mykotickou infekci hematoonkologických nemocných. Ve většině případů jde o infekci nozokomiální, a tak úpravy vnitřního prostředí (HEPA filtrace vzduchu a pozitivní přetlak) mohou její incidenci významně snížit. Námi předkládaná práce velmi detailně poukázala na vysokou rizikovost pacientů s akutní leukemií a po alogenní transplantaci krvetvorné tkáně, stejně tak na značnou obtížnost diagnostiky této infekce při použití konvenčních diagnostických metod. Zcela zásadní změnou v diagnostice IA bylo zavedení detekce galaktomananu - nejen je možno zachytit větší počet pacientů s touto infekcí, ale diagnostika je časnější a v kombinaci s časným podáním účinné antimykotické léčby pak můžeme být svědky zlepšování se prognózy této život ohrožující infekce.
Poděkování
Práce byla podpořena IGA MZ ČR NR8452-3/2005.
MUDr. Zdeněk Ráčil
www.fnbrno.cz
e-mail: zracil@fnbrno.cz
Doručeno do redakce: 1. 10. 2007
Přijato po recenzi: 12. 11. 2007
Sources
1. O'Brien SN, Blijlevens NMA, Mahfouz TH et al. Infections in Patients with Hematological Cancer: Recent Developments. Hematology 2003; 2003 : 438-472.
2. Lin SJ, Schranz J, Teutsch SM Aspergillosis case-fatality rate: systematic review of the literature. Clin Infect Dis 2001; 32 : 358-366.
3. Singh N, Paterson DL Aspergillus infections in transplant recipients. Clin Microbiol Rev 2005; 18 : 44-69.
4. Caillot D, Casasnovas O, Bernard A et al. Improved management of invasive pulmonary aspergillosis in neutropenic patients using early thoracic computed tomographic scan and surgery. J Clin Oncol 1997; 15 : 139-147.
5. Maertens J, Theunissen K, Verhoef G et al. Galactomannan and computed tomography-based preemptive antifungal therapy in neutropenic patients at high risk for invasive fungal infection: a prospective feasibility study. Clin Infect Dis 2005; 41 : 1242-1250.
6. Patterson TF Treatment of invasive aspergillosis: Polyenes, echinocandins, or azoles? Medical Mycology 2006; 44 : 357-362.
7. Pagano L, Caira M, Picardi M et al. Invasive Aspergillosis in patients with acute leukemia: update on morbidity and mortality-SEIFEM-C Report. Clin Infect Dis 2007; 44 : 1524-1525.
8. Upton A, Kirby KA, Carpenter P et al. Invasive aspergillosis following hematopoietic cell transplantation: outcomes and prognostic factors associated with mortality. Clin Infect Dis 2007; 44 : 531-540.
9. Ascioglu S, Rex JH, de Pauw B et al. Defining opportunistic invasive fungal infections in immunocompromised patients with cancer and hematopoietic stem cell transplants: an international consensus. Clin Infect Dis 2002; 34 : 7-14.
10. Cornillet A, Camus C, Nimubona S et al. Comparison of epidemiological, clinical, and biological features of invasive aspergillosis in neutropenic and nonneutropenic patients: a 6-year survey. Clin Infect Dis 2006; 43 : 577-584.
11. Pagano L, Caira M, Candoni A et al. The epidemiology of fungal infections in patients with hematologic malignancies: the SEIFEM-2004 study. Haematologica 2006; 91 : 1068-1075.
12. Benet T, Nicolle MC, Thiebaut A et al. Reduction of invasive aspergillosis incidence among immunocompromised patients after control of environmental exposure. Clin Infect Dis 2007; 45 : 682-686.
13. Chamilos G, Luna M, Lewis RE et al. Invasive fungal infections in patients with hematologic malignancies in a tertiary care cancer center: an autopsy study over a 15-year period (1989-2003). Haematologica 2006; 91 : 986-989.
14. Gerson SL, Talbot GH, Hurwitz S et al. Prolonged granulocytopenia: the major risk factor for invasive pulmonary aspergillosis in patients with acute leukemia. Ann Intern Med 1984; 100 : 345-351.
15. Marr KA, Carter RA, Boeckh M et al. Invasive aspergillosis in allogeneic stem cell transplant recipients: changes in epidemiology and risk factors. Blood 2002; 100 : 4358-4366.
16. Hope WW, Walsh TJ, Denning DW Laboratory diagnosis of invasive aspergillosis. Lancet Infect Dis 2005; 5 : 609-622.
17. Aquino VR, Goldani LZ, Pasqualotto AC Update on the contribution of galactomannan for the diagnosis of invasive aspergillosis. Mycopathologia 2007; 163 : 191-202.
18. Maertens JA, Klont R, Masson C et al. Optimization of the cutoff value for the Aspergillus double-sandwich enzyme immunoassay. Clin Infect Dis 2007; 44 : 1329-1336.
19. Marr KA, Balajee SA, McLaughlin L et al. Detection of galactomannan antigenemia by enzyme immunoassay for the diagnosis of invasive aspergillosis: variables that affect performance. J Infect Dis 2004; 190 : 641-649.
20. Herbrecht R, Denning DW, Patterson TF et al. Voriconazole versus amphotericin B for primary therapy of invasive aspergillosis. N Engl J Med 2002; 347 : 408-415.
21. Cornely OA, Maertens J, Winston DJ et al. Posaconazole vs. fluconazole or itraconazole prophylaxis in patients with neutropenia. N Engl J Med 2007; 356 : 348-359.
22. Ullmann AJ, Lipton JH, Vesole DH et al. Posaconazole or fluconazole for prophylaxis in severe graft-versus-host disease. N Engl J Med 2007; 356 : 335-347.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2008 Issue 2-
All articles in this issue
- Sledování protinádorové buněčné imunitní odpovědi u nemocných s renálním karcinomem, porucha proliferace T-lymfocytů
- Stanovení hodnot 24hodinového ambulantního monitorování krevního tlaku odpovídajících kazuálnímu tlaku 130/80 mm Hg
- Faktory se vztahem k hodnotám NT-proBNP u hemodynamicky stabilních pacientů s normální systolickou funkcí levé komory
- Invazivní aspergilové infekce u hematoonkologických nemocných: význam jednotlivých diagnostických metod, léčebných postupů a nástin finanční náročnosti léčby
- Dyslipidemie indukovaná antiretrovirovými léčivy
- Infekce tepenných rekonstrukcí: praktický pohled
- Význam endokanabinoidního systému v regulaci energetické rovnováhy
- Odporúčania pre diagnostiku a liečbu periférneho artériového ochorenia končatín (PAO)
- Každý den u nás umírá zbytečně nejméně 60 osob!
- Kvantifikace pravo-levého zkratu u pacientky s mnohočetnými plicními arteriovenózní malformacemi v rámci hemoragické hereditární teleangiektázie pomocí celotělové scintigrafie s 99mTc-makroagregatem humánního sérového albuminu: kazuistika
- Současné možnosti zobrazení magnetickou rezonancí v kardiologii
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Odporúčania pre diagnostiku a liečbu periférneho artériového ochorenia končatín (PAO)
- Kvantifikace pravo-levého zkratu u pacientky s mnohočetnými plicními arteriovenózní malformacemi v rámci hemoragické hereditární teleangiektázie pomocí celotělové scintigrafie s 99mTc-makroagregatem humánního sérového albuminu: kazuistika
- Faktory se vztahem k hodnotám NT-proBNP u hemodynamicky stabilních pacientů s normální systolickou funkcí levé komory
- Sledování protinádorové buněčné imunitní odpovědi u nemocných s renálním karcinomem, porucha proliferace T-lymfocytů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


