-
Medical journals
- Career
Duální protidestičková léčba
Authors: J. Krupička
Authors‘ workplace: Kardiochirurgické oddělení Nemocnice na Homolce Praha, vedoucí oddělení prim. MUDr. Štěpán Černý, CSc.
Published in: Vnitř Lék 2008; 54(10): 985-991
Category: Reviews
Overview
Aterotrombóza je nejčastější příčinou cerebrovaskulárních a kardiovaskulárních příhod. I přes nesporný pokrok v léčbě zůstává reziduální riziko příliš vysoké. Je potřebné hledat další cesty, kterými se zlepší prognóza pacientů. Podobně jako v léčbě hypertenze nebo dyslipidemie jdeme v současné době cestou kombinací přípravků, které proces trombózy ovlivňují na různých etážích, a tím potencují výsledný efekt. Článek shrnuje současné možnosti duální protidestičkové léčby a její indikace.
Klíčová slova:
duální protidestičková léčba – aterotrombóza – kyselina acetylsalicylová – dipyridamol – clopidogrelÚvod
Na vzniku všech velkých kardiovaskulárních příhod má hlavní podíl trombóza v terénu ateroskleroticky změněných tepen [1,2]. Fyziologický proces trombózy, na kterém se podílejí zejména krevní destičky a jehož primární úlohou je stavění krvácení, se v terénu aterosklerotického plátu stává nežádoucím patofyziologickým procesem vedoucím k obturaci cévy trombem a k ischemizaci postiženého řečiště. Popsaný proces se označuje názvem aterotrombóza.
Aterotrombóza je hlavní příčinou cerebrovaskulárních a kardiovaskulárních příhod [2]. Kardiovaskulární úmrtí tvoří ve vyspělých zemích více než 1/2 všech úmrtí. V roce 2005 byly v ČR z celkového počtu zemřelých (107 938 osob) kardiovaskulární příčiny zodpovědné za 52 % případů, což je dlouhodobě sledovaný trend [3]. Z této skupiny 42 % případů způsobila ICHS (z toho 7 352 úmrtí připadalo na akutní infarkt myokardu). Cerebrovaskulární příhody se na nemocech oběhové soustavy podílely asi 26 %, ateroskleróza byla uvedena v 16 %. Pokud sledujeme dlouhodobý vývoj úmrtnosti na tato onemocnění, je zřejmé, že k nejvýraznějšímu poklesu úmrtnosti dochází při akutním infarktu myokardu (oproti roku 1990 pokles o 65 %) [3].
American College of Cardiology (ACC) v roce 2006 prezentovala výsledky průzkumu REACH (Reduction of Atherotrombosis for Coninued Health), ze kterého vyplývá, že přibližně jeden z 8 pacientů, kteří měli nějakou aterotrombotickou příhodu anebo mají vysoké riziko aterotrombózy, prodělá v průběhu 1 roku velkou kardiovaskulární (KV) příhodu. Sledováni byli pacienti starší 45 let s cerebrovaskulární (CV) příhodou, ischemickou chorobou srdeční (ICHS) anebo is-chemickou chorobou dolních končetin (ICHDK) v anamnéze anebo s nejméně 3 rizikovými faktory. Až 1/2 těchto pacientů měla beta‑blokátor anebo ACE inhibitor, 1/4 měla AT1‑blokátor, 3/4 měli protidestičkovou terapii a 3/4 měli dyslipidemika [4].
Aterotrombóza je tedy významným patofyziologickým mechanizmem, který se uplatňuje i přes zavedenou terapii.
Léčba aterotrombózy
Krevní destičky hrají v patogenezi arteriální ischemie zásadní roli [1,2]. V souvislosti s jejich aktivitou po ruptuře aterotrombotického plátu dochází ke vzniku trombózy plátu, která může vést k omezení nebo úplnému přerušení průtoku krve cévou. Snahou léčby již v primární a o to více v sekundární prevenci je ovlivnění aterotrombózy, zejména pak ovlivnění funkce destiček a zabránění vzniku aterotrombotických příhod. Základními léky jsou kyselina acetylsalicylová, clopidogrel a dipyridamol.
Kyselina acetylsalicylová (ASA) patří mezi inhibitory destičkové cyklooxygenázy, které brání agregaci destiček. ASA po acetylaci serinového rezidua inhibuje cyklooxygenázu COX‑1, která katalyzuje konverzi kyseliny arachidonové na prostaglandin G2 a dále na H2. Dochází k následné blokádě tvorby destičkového tromboxanu A2, což vede k inhibici agregace trombocytů a uvolňování vazokonstrikčních substancí, ADP, serotoninu a destičkových faktorů III a IV. Destičková cyklooxygenáza v takto ovlivněné destičce neregeneruje. Inhibiční efekt jedné dávky ASA trvá, než se do oběhu dostanou nové destičky, tedy asi 5–7 dní [5].
Účinky a profit pacientů při terapii nízkými dávkami ASA jak v primární, tak v sekundární prevenci KV onemocnění jsou prokázané mnoha studiemi. Metaanalýza The Antiplatelet Trialist Collaboration prokázala 25% snížení reinfaktu a úmrtí u pacientů po prodělaném infarktu myokardu, kteří užívali ASA v denní dávce 75–325 mg [4]. Z dalších studií plyne výrazný profit užívaní ASA u vysoce rizikových pacientů: až 34% snížení výskytu infarktu myokardu a náhlé smrti u pacientů se stabilní anginou pectoris (AP) a až 50% snížení výskytu infarktu myokardu a náhlé smrti u pacientů s nestabilní AP (medián sledování 50 měsíců) [5].
Kyselina acetylsalicylová podávaná jednou denně tedy právem patří mezi základní protidestičkový lék v sekundární prevenci [5]. Dávka doporučovaná v prevenci KV příhod se pohybuje v rozmezí 75–325 mg. Prevence CV příhod dovoluje ještě větší rozmezí: 50–325 mg [6,7].
Ticlopidin inhibuje fosfolipázu C a blokuje membránové receptory pro ADP. Tím inhibuje adhezi a degranulaci destiček a v konečné fázi trombogeneze se zpomaluje vazba fibrinové sítě na trombocyt, čímž se brání fixaci trombu [5]. Jeho většímu rozšíření v léčbě aterotrombotických příhod zabránil vysoký výskyt hematologických nežádoucích účinků (závažná neutropenie u 1 % pacientů) a existence bezpečnější léčby (clopidogrel).
Clopidogrel je derivátem tienopyridinu (podobně jako ticlopidin). Clopidogrel ireverzibilně inhibuje aktivaci trombocytů cestou ADP receptoru, který blokuje. Dále blokuje vazbu fibrinogenu na destičky a má mohutný protidestičkový účinek. Počátky inhibice destiček lze v krvi detekovat již za 2 hodiny po požití 400 mg clopido-grelu. Hladiny 25–30% inhibice agregace destiček s ADP je docíleno až 2. den a účinné 40–50% inhibice je dosaženo až po 4 dnech léčby. Z těchto důvodů se při zajištění perkutánní koronární intervence (PCI) se stentem doporučuje užít úvodní dávku 600 mg clopidogrelu [5].
Studie CAPRIE prokázala lepší vliv clopidogrelu (superioritu nad ASA) na ischemické příhody (kombinovaný konečný cíl: ischemická CMP + infarkt myokardu + jakákoliv vaskulární příhoda). Při analýze podskupin (např. samotné ischemické CMP) nebyl rozdíl statisticky signifikantní [6,7]. Navíc farmakoekonomická data jeho podávání nepřejí, i když bezpečnostní profil je i při dlouhodobém podávání velmi dobrý [6,7], lepší než bezpečnostní profil ASA.
Prasugrel, nový thienopyridin, má rych-lejší nástup účinku a větší proti-destičkový účinek než standardní dávky clopidogrelu u zdravých subjektů a u pa-cientů se stabilní ICHS. ASA snižuje proti placebu relativní riziko (RR) ischemických příhod o 20 %, clopidogrel toto riziko sníží o dalších 20 % a prasugrel ve studii TRITON-TIMI 38 snížil relativní riziko (RR) o dalších 20 % [8]. Ovšem za cenu vyšších krvácivých rizik včetně fatálních. Autoři studie věří, že po vyloučení pacientů s předchozí CMP či TIA, s nízkou hmotností a s vyšším věkem bude riziko krvácení přijatelné zejména s ohledem na protidestičkové schopnosti prasugrelu. Ve studii PRINCIPLE-TIMI 44 byla inhibice antiagregace prasugrelem (60 mg) signifikantně vyšší (P < 0,0001) než vysoké dávky clopidogrelu (nasycovaní dávka 600 mg a udržovací dávka 150 mg) [9]. Prasugrel zatím není uvolněn ke klinickému užívání.
Dipyridamol inhibuje vychytávání adenozinu v erytrocytech, krevních destičkách a endoteliálních buňkách. Jeho lokálně zvýšená koncentrace působí na A2 receptor krevních destiček, čímž stimuluje destičkovou adenylátcyklázu, a tak zvyšuje hladinu cAMP v krevních destičkách [5]. Adenozin má i vazodilatační účinky, což je jeden z mechanizmů, kterým dipyridamol vyvolává vazodilataci. Vazodilatace se na úrovni arteriol objevuje již v nízkých protidestičkových dávkách, čímž může vést k steal fenoménu s redistribucí krve mimo ischemickou oblast. Steal fenomén je pozorovaný jen při intravenózním podání a je dosud využíván při zátěžových testech [5,8]. Dipyridamol je v monoterapii indikován v sekundární prevenci CMP/TIA u pacientů, kteří netolerují ASA. Studie ESPS2 prokázala 16% snížení rizika recidivy CMP/TIA dipyridamolem proti placebu [6,7].
Duální protidestičková léčba v prevenci kardiovaskulárních chorob
Duální protidestičková léčba vychází z principu působení 2 přípravků na různých etážích agregace destiček s cílem znásobení protidestičkového působení. V prevenci a léčbě kardiovaskulárních chorob je nyní indikována kombinace ASA + clopidogrel u pacientů po akutním koronárním syndromu (9–12 měsíců) a u pacientů po implantaci stentu (alespoň 1 rok) [10,11].
Studie CHARISMA (Clopidogrel for High Atherotrombotic Risk, Ischemic Stabilization, Management, and Avoidance) byla pokusem přenést duální terapii do primární prevence. Studie srovnávala kombinaci clopidogrelu 75 mg denně s ASA 75–162 mg denně proti samotné ASA. CHARISMA randomizovala 15 603 pacientů průměrného věku 64 let. Asi 80 % pacientů mělo dokumentované KV nemocnění a 20 % mělo jen rizikové faktory. Medián sledovacího období byl 28 měsíců. Výsledky prokázaly, že kombinace ASA + clopidogrel nebyla lepší než samotná ASA v souboru pacientů s klinicky zjevným KV onemocněním či kumulací rizikových faktorů (tab. 1). Mezi symptomatickými pacienty bylo pozorováno 1% snížení absolutního rizika a 12% snížení relativního rizika v primárním konečném cíli (kombinovaný cíl: infarkt myokardu, mozková příhoda, KV úmrtí) [12].
Table 1. CHARISMA: konečné cíle. 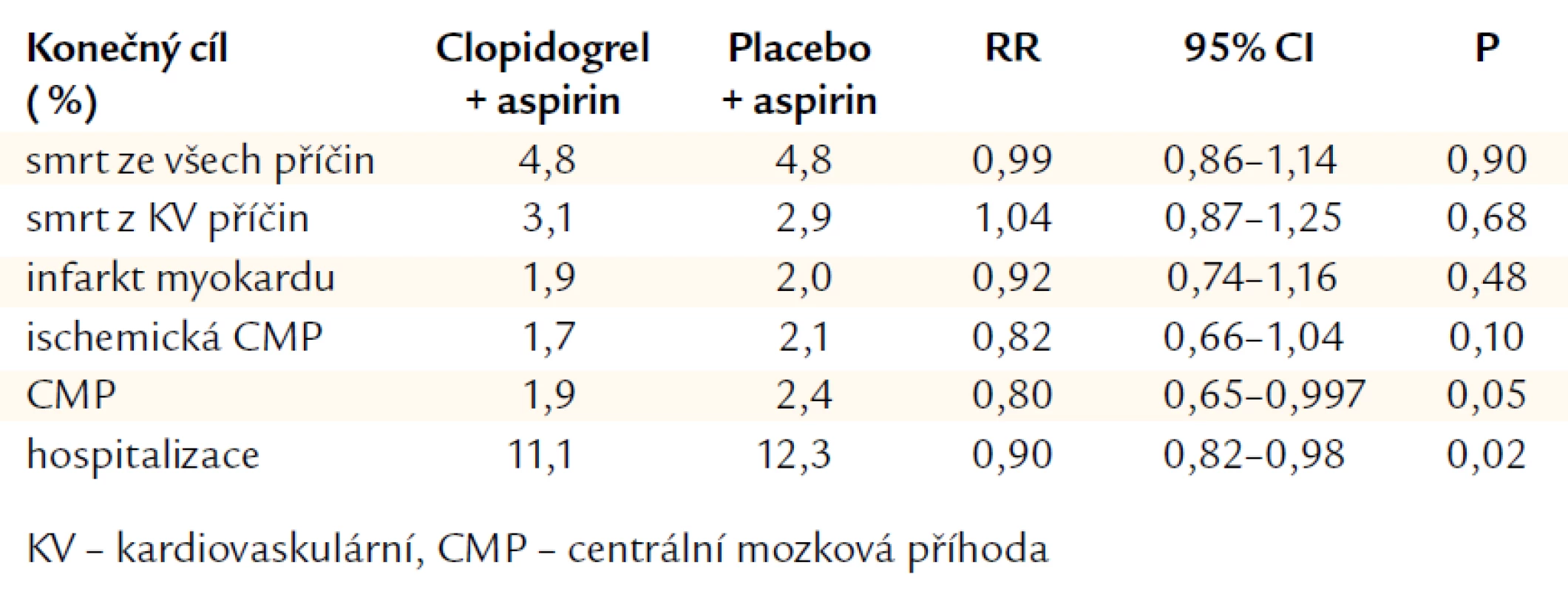
V primární prevenci tedy nemá duální léčba ASA + clopidogrel zatím místo. Analýza pacientů s dokumentovanou aterosklerózou (koronární, cerebrovaskulární, periferní cévy) ukázala statisticky signifikantní 12% snížení definovaných příhod (P = 0,048) [13]. Ukazuje se tedy, že záleží na výši rizika daného pacienta. Vysoce rizikoví pacienti s dokumentovanou aterosklerózou včetně ICHDK mají z duální léčby prospěch, naopak pacienti s rizikem vzniku ICHS z léčby prospěch nemají. Nová post‑hoc analýza ukázala, že přidání clopidogrelu s ASA může riziko KV smrti u pacientů v primární prevenci s mnohočetnými KV rizikovými faktory, ale bez KV symptomů dokonce zvýšit. Jednalo se tedy o čistě primárně preventivní podskupinu (n = 2 289) [17]. Primární kombinovaný koneční cíl se signifikantně nelišil, ale KV úmrtí bylo při kombinaci ASA + clopidogrel významně četnější. V multivariantní analýze to představovalo 72% narůst mortality!
Clopidogrel + ASA není kombinacípro primární prevenci [13]. Odbornéspolečnosti (American College of Cardiology, American Hearth Association/American Stroke Association, EuropeanSociety of Cardiology) se v komentářích ke studii shodly, že současná doporučení ohledně kombinace ASA + clopidogrel po zveřejnění výsledků studie CHARISMA nadále platí [14–16].
Další studie přinášejí data shodující se se studií CHARISMA, resp. s hypotézami ohledně krvácivých komplikací při použití duální protidestičkové léčby. Kombinace ve studii CHARISMA zvýšila riziko krvácení – celkově o 1 % v průběhu 2,5 roku (tab. 2). Analýza uveřejněná v časopise Heart ukázala, že clopidogrel nepřímo ovlivňuje pooperační průběh po koronární chirurgii – signifikantně zvyšuje krevní ztráty a nutnost použít transfuze, prodlužuje dobu strávenou na umělé plicní ventilaci a prodlužuje dobu hospitalizace [18]. Z těchto důvodů je nutné seriózně uvážit podávání protidestičkové, resp. antikoagulační léčby (přínos ze snížení ischemických komplikací vs významné krvácivé komplikace), protože vyšší četnost krvácivých komplikací je spojena s horší prognózou pacienta [19,20].
Table 2. CHARISMA: bezpečnost. 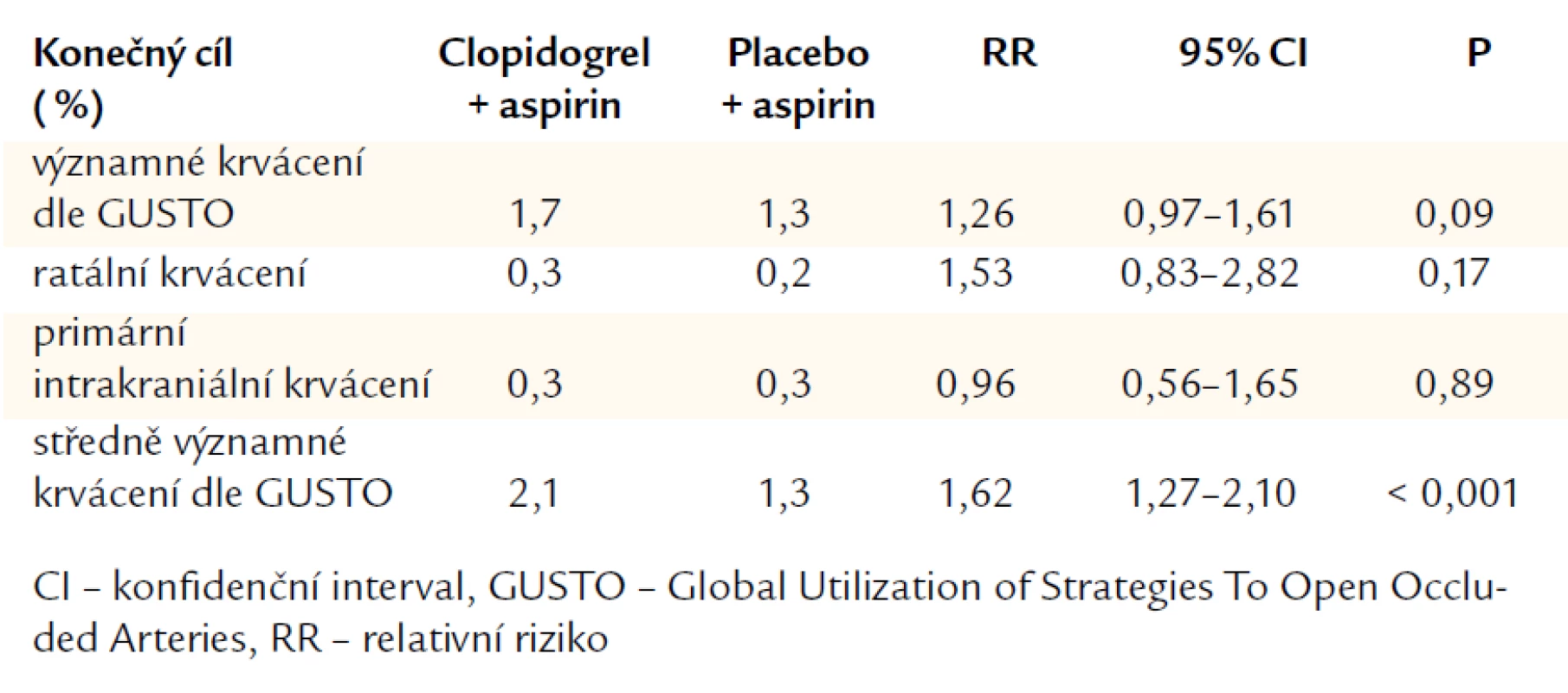
Duální protidestičková léčba u pacientů po perkutánní koronární intervenci s implantovaným stentem
Dlouhodobě řešeným problémem zůstává výskyt pozdních trombotických příhod po implantaci potahovaných (drug‑eluting) stentů (DES). Data z observačních studií podporují teorii, že protrahovaná endotelizace stentu přispívá k jeho trombóze a je ve vztahu k úmrtí pacienta, resp. vzniku infarktu myokardu [21,22]. Pacienti s implantovaným DES jsou ohroženi v případě, že nepokračují s clopidogrelem v 6.–12. měsíci po výkonu.
Nejčastěji zmiňovanou studií je v této souvislosti studie BASKET-LATE (BASKET: Basel Stent Kosten Effektivitats), která sledovala incidenci pozdních klinických příhod vztahujících se k trombóze stentu po vysazení clopidogrelu [23,24]. Studie sledovala 2 skupiny: DES vs bare‑metal stent (BMS). Celkem zařadila 746 pacientů průměrného věku 63 let v případě, že přečkali prvních 6 měsíců (všichni byli na kombinaci aspirin + clopidogrel nehledě na typ stentu) po implantaci stentu bez velké koronární příhody a doba sledování byla 1 rok. Studie ukázala, že po vysazení clopidogrelu se pozdní trombóza stentu 2–3násobně více vyskytla u DES a vedla ke 4násobně vyššímu riziku koronární smrti nebo infarktu myokardu po dobu až 362 dnů po vysazení clopidogrelu.
Dvě meta‑analýzy stentů Cypher (Cypher® Sirolimus-Eluting Coronary Stent – na trhu od roku 2003) a Taxus (TaxusTM Espress2TM Paclitaxel-Eluting Coronary Stent – na trhu od roku 2004) prezentované na TCT 2006 meetingu (Transcatheter Cardiovascular Therapeutic) ukázaly, že DES mají o 0,4 % vyšší riziko trombózy ve stentu u pacientů „z reálného světa“. Rovněž ukázaly, že fenomén trombózy v DES stentu existuje, ale jeho klinický dopad je malý [25,26]. Data analýz byla poskytnuta samotnými výrobci a sponzory. Zajímavostí je jistě fakt, že akutní koronární syndrom (ACS) je jedním z významných rizik trombózy stentu a asi 40 % takových pacientů (s ACS) dostává DES. Přitom tito pacienti v analýzách chybí.
V prosinci roku 2006 uspořádala FDA (US Food and Drug Administration) na základě varovných výsledků výskytu pozdní trombózy stentů diskuzi k bezpečnosti DES stentů. Cílem bylo definovat prediktivní rizikové faktory pro pozdní trombózu stentů a vyhledat příčiny předčasného ukončení doporučené duální léčby ze strany pacientů a další faktory interferující s jejím správným užíváním anebo okolnosti vedoucí k ukončení duální terapie. Hlavní závěry shrnuje tab. 3. FDA (Circulatory Systems Devices Advisory Panel FDA) na základě předložených dat nedoporučila žádné změny současných doporučení DES [27]. Dosud byla doporučována duální antitrombotická léčba v minimálním trvání 1 měsíce po implantaci metalických stentů (bare‑metal), 3 měsíců po implantaci stentů potažených sirolimem (sirolimus-eluting) a 6 měsíců po implantaci paclitaxelových stentů (paclitaxel-eluting). Optimální trvání je alespoň 12 měsíců, pokud pacienti nemají vysoké riziko krvácení [27]. Je také zdůrazňována diskuze s pacientem ohledně trvání duální léčby před implantací DES a v případě, že pacient z jakýchkoliv důvodů neakceptuje 12měsíční podávání duální protidestičkové léčby, měl by být před implantací DES varován [10–11].
Table 3. Hlavní závěry meetingu FDA z prosince roku 2006. 
Duální protidestičková léčba v prevenci akutních ischemických cévních mozkových příchod
Pacienti po CMP/TIA mají roční riziko KV příhody (CMP/TIA, infarkt myokardu) 4–16 %. ASA je lékem volby, ale zabrání pouze 1/4 příhod [7,28]. Z kombinace protidestičkových přípravků v prevenci ischemických mozkových příhod (CMP i TIA) je možná jediná kombinace: ASA + pozvolně se uvolňující (extended release – ER) dipyridamol [7,28,29].
Clopidogrel v kombinaci s ASA dosáhl stejných výsledků jako samotný clopidogrel s tím rozdílem, že při kombinaci bylo více krvácivých komplikací [30]. Výsledky studie MATCH (Management of ATherotrombosis with Clopidogrel in High‑Risk Patients with Recent Transient Ischemic Attack or Ischemic Stroke) pro pacienty s mozkovou příhodou (CMP, TIA) tedy nejsou ve shodě s pozitivním dopadem podávaní clopidogrelu a ASA u pacientů s akutním koronárním syndromem. Přidání clopidogrelu k ASA signifikantně nezlepší prognózu pacientů s anamnézou cerebrovaskulární příhody [7,30].
Naopak přidání dipyridamolu do kombinace k ASA vedlo ke slibným výsledkům, ale důkazy byly jen z 1 studie (ESPS) [28]. Analýza 4 menších studií však ukázala, že kombinace dipyridamol + aspirin vede k jen 3% snížení vaskulárních příhod proti samotnému aspirinu. Proto byla uvedená kombinace v sekundární prevenci cévních příhod po ischemické CMP/TIA zdrojem kritiky [29].
Teprve studie ESPS 2 (European Stroke Prevention Study) jednoznačně prokázala, že fixní kombinace ASA 25 mg + dipyridamol s řízeným uvolňováním 200 mg (Aggrenox®) v dávkování 1–0–1 je prospěšná v sekundární prevenci ischemické CMP/TIA [31]. Studie prokázala snížení rizika opakování CMP o 37 % ve srovnání s placebem, snížení rizika CMP a/nebo úmrtí o 24,4 % ve srovnání s placebem, snížení rizika opakování CMP o 23,1 % ve srovnání s monoterapií ASA. Riziko TIA je nižší o 35,9 % ve srovnání s placebem. Účinnost léku je mimo jiné podmíněna způsobem jeho uvolňování a nelze jej při stejném účinku nahradit kombinací generických substancí. V souhrnu studie ESPS 2 ukázala, že Aggrenox® je 2krát účinnější (v období dvou let zabrání 58 rekurentním příhodám z 1 000 léčených pacientů, zatímco ASA zabrání 29 příhodám) v prevenci opakované cévní mozkové příhody než samotná kyselina acetylsalicylová nebo samotný dipyridamol [29].
Další studií v oblasti sekundární prevence mozkových příhod (CMP i TIA) je studie ESPRIT (European/Australian Stroke Prevention in Reversible Ischaemia Trial) – nezávislá studie nepodporovaná farmaceutickým průmyslem [31]. V průběhu 6 měsíců po ischemické CMP/TIA byli pacienti randomizováni do 2 skupin: ASA + dipyridamol (30–325 mg/den, resp. 200 mg 2krát/den; n = 1 363) vs ASA (n = 1 376). Primární cíl (smrti z KV příčin + nefatální CMP + nefatální infarkt myokardu + velké krvácivé komplikace) se v průběhu 3,5 ± 2,0 roky objevil u 173 pacientů (13 %) léčených kombinací a u 216 pacientů (16 %) léčených samotnou ASA. Výsledky potvrzují, že kombinace ER dipyridamolu a kyseliny acetylsalicylové (Aggrenox®) má v rámci sekundární prevence u pacientů po cévní mozkové příhodě lepší účinky než samotná ASA. Studie ESPRIT prokázala, že oproti nemocným léčeným jen ASA došlo u pacientů, jimž byla podávána kombinace dipyridamolu a ASA, až k 20% snížení rizika smrti z jakékoliv cévní příčiny, k opakování mozkového infarktu, ale také ke snížení rizika infarktu myokardu nebo rozsáhlé krvácivé komplikace.
Výsledky studie ESPRIT posilují postavení Aggrenoxu® v rámci stávajících léčebných postupů, které jsou založeny na protidestičkovém působení. Aggrenox® disponuje dalšími vlastnostmi, které poskytují stěnám cév protitrombotickou ochranu a které dále snižují riziko opakované cévní mozkové příhody. Jeho užití jako léku první volby v prevenci CMP doporučuje řada mezinárodních institucí. Patří k nim např. European Stroke Initiative (EUSI), National Institute of Health and Clinical Excellence (NICE) a American College of Chest Physicians (ACCP) [7,28].
V letošním roce očekávané výsledky studie PRoFESS (první prezentace na Evropském strokovém kongresu v Nice v květnu roku 2008) na více než 20 000 pacientech přinesou data o srovnání duální antiagregace (dipyridamol/ASA) s clopidogrelem. Studie navíc ověřuje účinnost telmi-sartanu v sekundární prevenci CMP po přidání ke standardní protidestičkové terapii.
Léčba dipyridamolem u ICHS
Toto kontroverzní téma zatím nemá jednoznačnou odpověď. Chybí klinická studie primárně zaměřená na dipyridamol ER v kardiologické indikaci, i když v minulosti byl dipyridamol pro své farmakologické účinky používán i jako koronární vazodilatans. Obavy z pozorovaného steal fenoménu a zhoršení anginy pectoris jej vyřadily z dalšího užívání u pacientů s ICHS. Steal fenomén byl ale pozorován pouze po intravenózním podání dipyridamolu, nikoliv po podání v perorální formě. Dávka, po které bylo vzácně pozorováno zhoršení anginózních potíží, byla 400 mg. Neméně důležitá je skutečnost, že steal fenomén byl pozorován s přípravkem bez prodlouženého uvolňování (retardovaná forma léku determinuje výhodnost použití v indikaci sekundární prevence CMP). Ač se dipyridamol osvědčil jako velice výhodný lék do kombinace duální léčby v prevenci rekurence ischemických CMP/TIA, v terapii ICHS již není jeho eventuální využití ani předmětem klinických studií [28,29].
Post‑hoc analýza studie ESPS2 při po-užití dipyridamolu neprokázala zvýšenou incidenci kardiálních příhod, jako jsou angina pectoris, infarkt myokardu, či zvýšenou incidenci úmrtí z ja-kékoliv příčiny [28]. Další studie ESPRIT potvrdila nejen bezpečnost kombinace ASA s dipyridamolem u kardiologických pacientů, ale dokonce prospěch z této kombinace [31]. Přestože se objevují i jiné práce potvrzující pozitivní vliv dipyridamolu (indukce angiogeneze), je nutné konstatovat, že v současné době nemá kombinace ASA s dipyridamolem dostatek přímých klinických dat k použití v kardiologických indikacích [7,9–11]. Na druhé straně není nutné se kombinace ASA a ER dipyridamol obávat u pacientů s ICHS a vysazovat Aggrenox® u pacientů s ICHS, kteří prodělali CMP či TIA.
Malé dávky kyseliny acetylsalicylové
Systematický přehled ukázal, že malé dávky ASA jsou stejně účinné jako vysoké dávky v prevenci KV chorob [32]. Data ukazují, že dlouhodobě účinné preventivní dávky ASA jsou 75–81 mg/den. Vyšší dávky, které jsou obvykle předepisované, nejsou z hlediska prevence lepší a jsou navíc spojeny s vyšším rizikem GIT krvácení. Riziko pacientů v sekundární prevenci zvyšuje tzv. aspirinová rezistence. Ukazuje se, že je nutné na tomto poli zvýšit intenzitu výzkumu a vypracovat metodiku standardizovaných testů s následným individuálním testováním [32]. Riziko rezistence zvyšují vyšší dávky a data ze studie CHARISMA ukazují, že riziko rezistence (klinické selhání léčby) se objevuje i po podání clopidogrelu [33]. V analýze studií se vyšší riziko KV příhod objevilo mezi pacienty s rezistencí (3,8 OD, 95 % CI 2,3–6,1) a bylo nezávislé na dávce ASA, která se pohybovala mezi 80 a 325 mg/den.
V prevenci CMP/TIA jsou doporučovány dávky 50 mg, které jsou v této indikaci stejně účinné jako dávky střední anebo dávky vysoké a přitom mají nižší výskyt nežádoucích účinků (krvácení do GIT, vznik rezistence) [28, 32].
Závěr
Duální protidestičková léčba se stávásoučástí běžné klinické praxe. V současné době existuje dostatek dat z dobře vedených klinických studií, která přesně vymezují indikace duální antiagregace u pacientů s klinicky manifestní aterotrombózou (tab. 4). Protože ale u některých kombinací dochází k větší četnosti krvácivých komplikací, je nutno indikovat duální antiagregaci uvážlivě.
Table 4. Duální protidestičková terapie v sekundární prevenci kardiovaskulárních chorob. 
MUDr. Jiří Krupička, Ph.D.
www.kardiologickaporadna.cz
e‑mail: jiri.krupicka@homolka.cz
Doručeno do redakce: 4. 3. 2008
Přijato po recenzi: 13. 6. 2008
Sources
1. Fejfar Z, Přerovský I. Klinická fyziologie krevního oběhu. 3. přepracované a rozšířené vyd. Praha: Galén 2002.
2. Murray CJL, Lopez AD (eds). Global Burden of Disease. Vol 1. Boston, MA: Harvard University Press 1996.
3. Zemřelí 2005. Zdravotnická statistika Ústavu Zdravotnických Informací a Statistiky ČR. Available online at http://www.uzis.cz.
4. Bhatt DL, Steg PG, Ohman EM et al, on behalf of the REACH Registry Investigators. International prevalence, recognition, and treatment of cardiovascular risk factors in outpatients with atherothrombosis. JAMA 2006; 295 : 180–189.
5. Marek J et al. Farmakoterapie vnitřních nemocí. 3. přepracované vyd. Praha: Grada Publishing 2005.
6. Patrono C, Bachmann F, Baigent C et al. Expert consensus document on the use of antiplatelet agents. The task force on the use of the antiplatelet agents in patiens with atherosclerotic cardiovascular disease of the European Society of Cardiology. Eur Heart J 2004; 25 : 166–181.
7. Sacco RL, Adams R, Albers G et al. Guidelines for Prevention of Stroke in Patients with Ischemic Stroke or Transient Ischemic Attack. A Statement for Healthcare Professionals from the American Heart Association/American Stroke Association Council on Stroke Co-Sponsored by the Council on Cardiovascular Radiology and Intervention. Circulation 2006; 113: e409–e449.
8. Wiviott SD, Braunwald E, McCabe CH et al, TRITON-TIMI 38 Investigators. Prasugrel versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2007; 357 : 2001–2015.
9. Wiviott SD, Trenk D, Frelinger AL et al, for the PRINCIPLE-TIMI 44 Investigators. Prasugrel Compared With High Loading - and Maintenance-Dose Clopidogrel in Patients With Planned Percutaneous Coronary Intervention. The Prasugrel in Comparison to Clopidogrel for Inhibition of Platelet Activation and Aggregation-Thrombolysis in Myocardial Infarction 44 Trial. Circulation 2007; 116 : 2923–2932.
10. Grines CL, Bonow RO, Casey DE Jr et al. Prevention of premature discontinuation of dual antiplatelet therapy in patients with coronary artery stents: A science advisory from the American Heart Association, American College of Cardiology, Society for Cardiovascular Angiography and Interventions, American College of Surgeons, and American Dental Association, with representation from the American College of Physicians. Circulation 2007; 115 : 813–818.
11. King SB, Smith SC, Hirshfeld JW et al. 2007 focused update of the ACC/AHA/SCAI 2005 Guideline Update for Percutaneous Coronary Intervention: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines: (2007 Writing Group to Review New Evidence and Update the 2005 ACC/AHA/SCAI Guideline Update for Percutaneous Coronary Intervention). Circulation 2008; 117 : 261–295.
12. Bhatt DL, Fox KAA, Hacke W et al, for the CHARISMA Investigators. Clopidogrel and aspirin versus aspirin alone for the prevention of atherothrombotic events. N Engl J Med 2006; 354 : 1706–1717.
13. Pfeffer MA, Jarcho JA. The charisma of subgroups and the subgroups of CHARISMA. N Engl J Med 2006; 354 : 1744–1746.
14. American College of Cardiology. Dangers of stopping clopidogrel (Plavix®) for patients with stents and certain other conditions. A public health alert from the American College of Cardiology. Issued March 16, 2005. Available online at www.acc.org.
15. American Heart Association. American Heart Association statement: patient guidance based on results of the CHARISMA trial. Issued march 15, 2006. Available online at www.americanheart.org.
16. ESC statement on the CHARISMA Trial on Clopidogrel (Plavix®): Patients should continue treatment as advised by their physicians. Issued March 17, 2006. Available online at www.escardio.org
17. Purkayastha S, Athanasiou T, Malinovski V et al. Does clopidogrel affect outcome after coronary artery bypass grafting? A meta‑analysis. Heart 2006; 92 : 531–532.
18. Wang TH, Bhatt DL, Fox KA et al. An analysis of mortality rates with dual antiplatelet therapy in the primary prevention population of the CHARISMA trial. Eur Heart J 2007; 28 : 2200–2207.
19. Alexander KP, Chan AY, Roe MT et al. Excess dosing of antiplatelet and antithrombin agents in the treatment of non‑ST‑segment elevation acute coronary syndromes. JAMA 2005; 294 : 3108–3116.
20. Manoukian SV, Feit F, Mehran R et al. Impact of major bleeding on 30-day mortality and clinical outcomes in patients with acute coronary syndromes: an analysis from the ACUITY Trial. J Am Coll Cardiol 2007; 49 : 1362–1368.
21. McFadden EP, Stabile E, Regar E et al. Late thrombosis in drug‑eluting coronary stents after discontinuation of antiplatelet therapy. Lancet 2004; 364 : 1519–1521.
22. Eisenstein EL, Anstrom KJ, Kong DF et al. Clopidogrel use and long‑term clinical outcomes after drug‑eluting stent implantation JAMA. 2007; 297 : 159–168.
23. Pfisterer M, Brunner-LaRocca HP, Buser PT et al, for trhe BASKET-LATE Investigators. Late clinical events after clopidogrel discontinuation may limit the benefit of drug‑eluting stents. J Am Coll Cardiol 2006; 48 : 2584–2591.
24. Kaiser C, Brunner-La Rocca HP, Buser PT et al. BASKET Investigators. Incremental cost‑effectiveness of drug‑eluting stents compared with a third-generation bare‑metal stent in a real-world setting: randomised Basel Stent Kosten Effektivitats Trial (BASKET). Lancet 2005; 366 : 921–929.
25. Colombo A, Corbett SJ. Drug‑Eluting Stent Thrombosis: Increasingly Recognized But Too Frequently Overemphasized. J Am Coll Cardiol 2006; 48 : 203–205.
26. Nordmann AJ et al. Mortality in randomized controlled trials comparing drug‑eluting vs. bare metal stents in coronary artery disease: a meta‑analysis. Eur Heart J 2006; 27 : 2784–2814.
27. US Food and Drug Administration. Circulatory System Devices Panel. Available at http://www.fda.gov/ohrms/dockets /ac/cdrh06.html#circulatory. Accessed December 21, 2006.
28. Norrving B. Dipyridamole with aspirin for secondary stroke prevention. Lancet 2006; 367 : 1638–1639.
29. Diener HC, Darius H, Bertrand-Hardy JM et al. Cardiac safety in the European Stroke Prevention Study 2 (ESPS2). Int J Clin Pract 2001; 55 : 162–163.
30. Fischer M, Davalos A. The MATCH study results in the context of secondary stroke prevention. Stroke 2004; 35 : 2609.
31. ESPRIT Study Group. Aspirin plus dipyridamole versus aspirin alone after cerebral ischaemia of arterial origin (ESPRIT): randomised controlled trial. Lancet 2006; 367 : 1665–1673.
32. Snoep JD, Hovens MMC, Eikenboom JCJ et al. Association of laboratory-defined aspirin resistance with a higher risk of recurrent cardiovascular events: A systematic review and meta‑analysis. Arch Intern Med 2007; 167 : 1593–1599.
33. Campbell ChL, Smyth S, Montalescot G et al. Aspirin Dose for the Prevention of Cardiovascular Disease. JAMA 2007; 297 : 2018–2024.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2008 Issue 10-
All articles in this issue
- Radiofrekvenční katetrová ablace paroxyzmální fibrilace síní konvenční metodou, bezprostřední a dlouhodobé výsledky
- Biomarkery ischemie a nekrózy myokardu v roce 2008
-
Zobrazovací metody v diagnostice viability myokardu.
Část 1. Interpretace nálezů při zobrazování viability myokardu pomocí SPECT a PET - Kolorektální karcinom a diabetes mellitus
- Duální protidestičková léčba
- Hemofilie
- Hemoeliminační metody v léčbě sepse: současný stav
- Izolovaná forma srdeční amyloidózy v podobě počínající infiltrativní kardiomyopatie bez restriktivní fyziologie
- Myopatie a smíšená hyperlipoproteinemie jako první projev systémové AL‑amyloidózy
- Srdeční arytmie při obstruktivní spánkové apnoe
- Zhodnotenie alternatívnych metód pre výpočet LDL cholesterolu
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Duální protidestičková léčba
- Srdeční arytmie při obstruktivní spánkové apnoe
- Hemoeliminační metody v léčbě sepse: současný stav
- Hemofilie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

