-
Medical journals
- Career
Vliv kombinovaného aerobního tréninku na změny autonomní modulace u nemocných po akutním infarktu myokardu
Authors: L. Elbl 1; V. Chaloupka 1; S. Nehyba 1; I. Tomášková 1; F. Jedlička 1; P. Kala 2; J. Schildbeger 2
Authors‘ workplace: Oddělení funkčního vyšetřování FN Brno, pracoviště Bohunice, přednosta doc. MUDr. Václav Chaloupka, CSc. 1; Interní kardiologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jindřich Špinar, CSc., FESC 2
Published in: Vnitř Lék 2005; 51(4): 421-429
Category: Original Contributions
Overview
Cíl práce:
Autonomní dysfunkce je přítomna u většiny nemocných po akutním srdečním infarktu a je charakterizována změnami sympato-vagální balance projevujícími se snížením variability srdeční frekvence (HRV) a sníženou senzitivitou baroreflexu. Předložená práce se zaměřila na vyhodnocení vlivu kombinovaného aerobního tréninku se silovým cvičením na změny modulace autonomního nervového systému z krátkodobého pohledu při vyhodnocení 8týdenního rehabilitačního programu a z dlouhodobého pohledu 12 měsíců po ukončené rehabilitaci.Pacienti a metody:
Autoři zařadili do sledování 81 nemocných (15 žen, 66 mužů) ve věku 58 ± 9 let po přestálém prvním srdečním infarktu. Nemocní byli před a po rehabilitaci a po roce vyšetřeni echokardiograficky, spiroergometrií, byla provedena krátkodobá frekvenční a časové analýza HRV s manévrem leh-stoj-leh. Byly vyhodnoceny ukazatele frekvenční domény: celkový spektrální výkon (TP), komponenta LF (low frequency), HF (high frequency), jejich poměr LF/HF a ukazatel časové domény MSSD (mean squared succesive difference).Výsledky:
Rehabilitační program vedl k signifikantnímu zvýšení hodnot vysokofrekvenční komponenty (HF) vleže (p < 0,01), celkového spektrálního výkonu (TP) vleže (p < 0,05) a komponenty časové analýzy (MSSD) (p < 0,05). Signifikantní změny přetrvávají po roce, navíc došlo ke statisticky významnému poklesu hodnoty nízkofrekvenční komponenty (LF) vleže (p < 0,01), a tím i poklesu indexu LF/HF vleže (p < 0,05). U nemocných s vyšší tréninkovou aktivitou v průběhu roku po rehabilitaci (n = 57) byla po roce nalezena významně vyšší hodnota tolerance zátěže (TZ) a pVO2 (p < 0,05) oproti skupině s malou intenzitou fyzického zatěžování (n = 24). Tato podskupina měla též významně nižší ukazatele variability srdeční frekvence MSSD (p < 0,01), TP (p < 0,05) a index LF/HF vleže (p < 0,02). V podskupině s nižší intenzitou fyzického zatěžování bylo více nemocných s diabetem a s kombinací hypertenze a diabetes, ale méně nemocných s ejekční frakcí (EF) < 50 %. Autoři nalezli negativní vztah mezi přítomností hypertenze a diabetu a ukazateli vagové aktivity, pozitivní korelaci ukazatelů vagové aktivity kardiopulmonální výkonnosti (TZ, pVO2) a nenalezli vztah k EF. Přítomnost hypertenze a diabetu negativně ovlivnila přeladění autonomního nervového systému po rehabilitaci.Závěr:
Kombinovaný aerobní trénink se silovými prvky vedl k pozitivní změně sympato-vagální balance u řady nemocných po srdečním infarktu. Toto přeladění autonomního nervového systému ve prospěch vagové aktivity přetrvává v případě změny životního stylu související s pravidelnou dlouhodobou fyzickou aktivitou i po roce. Faktory ovlivňující změny HRV po infarktu mají komplexní charakter a odrážejí jak poškození vlastní inervace srdce ischemií a nekrózou, velikost infarktového ložiska, dysfunkci levé komory, neurohumorální aktivaci, tak i přítomnost hypertenze a diabetu. Z tohoto důvodu u některých nemocných nemusí k přeladění autonomního nervového systému za podmínek provedeného tréninku dojít.Klíčová slova:
akutní infarkt myokardu – časná rehabilitace – variabilita srdeční frekvenceÚvod
Jak ukázaly některé metaanalýzy a prospektivní studie, může aerobní trénink v rámci časné rehabilitace a následná změna životního stylu významně ovlivnit morbiditu a mortalitu nemocných po akutním srdečním infarktu. Stejně tak byl popsán i snížený výskyt náhlých úmrtí [23,24].
Autonomní dysfunkce je přítomna u většiny nemocných po akutním srdečním infarktu a je charakterizována změnami sympato-vagální balance projevujícími se snížením variability srdeční frekvence (heart rate variability – HRV) a sníženou senzitivitou baroreflexu. Snížení HRV je považováno za nezávislý rizikový faktor náhlé smrti u nemocných po akutním srdečním infarktu a u nemocných s chronickým srdečním selháním [12,14,17,27].
Léčebná strategie u nemocných po akutním srdečním infarktu je mimo jiné založena na farmakologické intervenci pomocí betablokátorů a inhibitorů ACE. Obě skupiny léků mohou příznivě ovlivnit parametry HRV [4,22]. Další doplňující léčebnou strategií je aerobní trénink. Je prokázáno, že i ten může modifikovat sympatovagální kontrolu HRV směrem ke zvýšení tonu parasympatiku [18].
Publikované výsledky o vlivu aerobního tréninku na změny HRV nejsou jednoznačné, není známo, zda trénink ovlivní modulaci autonomního nervového systému (ANS) u nemocných s dysfunkcí levé komory srdeční (LK) a jak dlouho budou tyto změny přetrvávat. Výsledky jsou též ovlivněny odlišnou metodikou použitou k hodnocení HRV.
V předložené práci jsme se zaměřili na vyhodnocení vlivu kombinovaného aerobního tréninku se silovým cvičením na změny ANS z krátkodobého pohledu (vyhodnocení 8týdenního rehabilitačního programu) a z dlouhodobého pohledu 12 měsíců po ukončení rehabilitace.
Soubor nemocných
V letech 2002–2003 jsme zařadili do ambulantního rehabilitačního programu 81 nemocných, kteří byli přijati s diagnózou akutního srdečního infarktu na koronární jednotku. Soubor tvoří 15 žen a 66 mužů po přestálém prvním infarktu ve věku (58 ± 9 let, medián 58 let, 26–80) a jeho charakteristika je uvedena v tab. 1.
Table 1. Charakteristika celé skupiny pacientů. 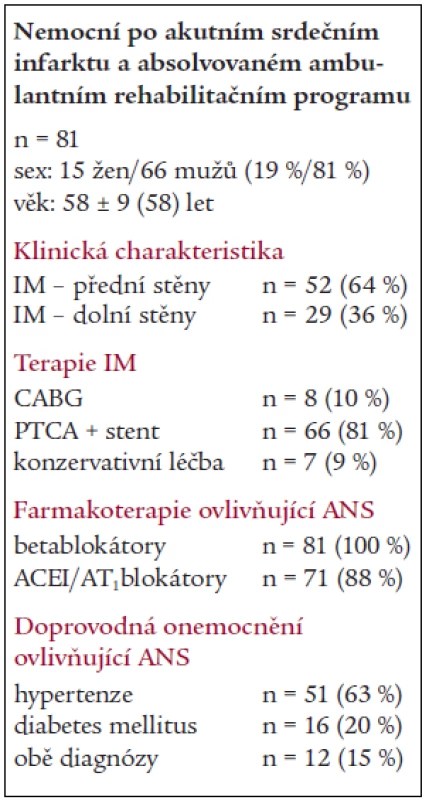
IM – infarkt myokardu, PTCA – perkutánní transluminální koronární angioplastika, CABG – aorto-koronární bypass, ACEI – inhibitory angiotenzin konvertujícího enzymu, ANS – autonomní nervový systém Nemocní byli před zařazením vyšetřeni kompletně echokardiograficky, spiroergometrií a byla provedena krátkodobá analýza HRV. Tato vyšetření byla zopakována po ukončení rehabilitace a s odstupem 12 měsíců.
Metodika
1. Rehabilitační program
Rehabilitační program probíhal 3krát týdně po dobu 8 týdnů. Pacienti absolvovali aerobní cvičení na ergometrech při tepové frekvenci (TF) odpovídající 60–80 % vrcholového příjmu kyslíku (pVO2). Po 2 týdnech od zahájení programu byla zařazena silová cvičení. Nemocní s normální hodnotou ejekční frakce (EF) ≥ 50 % cvičili na úrovni 50 % 1-RM, u nemocných se sníženou EF bylo započato na hodnotě 30 % 1-RM s cílem dosažení 50 % 1-RM (maximální zátěž, kterou je pacient schopen 1krát bez pomoci překonat).
2. Echokardiografické vyšetření
Echokardiografické vyšetření bylo provedeno na přístroji ATL HDI 3000. Byla stanovena ejekční frakce levé komory srdeční metodou dle Simpsona.
3. Spiroergometrie
Spiroergometrické vyšetření bylo provedeno na přístroji Oxycon Delta Jaeger. Pacienti byli zatíženi rampovým testem 20 W/1 min do subjektivního maxima či vzniku symptomů. Stanovili jsme hodnotu pVO2 pro vyhodnocení tréninkového efektu, hodnotu tepového kyslíku (TF-O2) a hodnotu anaerobního prahu (ventilační anaerobní práh) pro určení tréninkové TF. Vyhodnotili jsme klidové a maximální hodnoty tepové frekvence (TF) a krevního tlaku (TK) a zátěžovou toleranci (TZ).
4. Variabilita srdeční frekvence
Variabilita RR intervalu byla hodnocena přístrojem VariaCardio TF4. Aktivita ANS byla hodnocena standardním manévrem leh – stoj – leh. Z každého manévru byly pořízeny EKG-záznamy o délce 300 tepů nebo trvající minimálně 5 minut. Programem byla provedena spektrální analýza RR-intervalů transformací časových rozdílů do frekvenčních hodnot. Takto získané výkonové spektrum je rozděleno na komponenty VLF (very low frequency): 0,02–0,05 Hz, LF (low frequency): 0,05–0,15 Hz a HF (high frequency): 0,15–0,5 Hz.
Pro účel studie jsme vyhodnotili ukazatele ve fázi stoj – leh: LF a HF a jejich poměr LF/HF ve stoje a vleže, hodnoty celkového spektrálního výkonu (TP – total power) vleže a ukazatel MSSD vleže (mean squared succesive difference) jako odraz časové komponenty.
Pásmo komponenty LF odráží baroreflexní aktivitu, a tím vliv obou větví ANS. Pásmo komponenty HF je výhradně ovlivněno vagovou aktivitou a též respirací. Časový ukazatel MSSD odráží aktivitu vagové komponenty ANS [20]. Vyšetření proběhlo za standardizovaných podmínek v klimatizované místnosti dostatečně hlukově i světelně izolované v dopoledních hodinách při ponechané medikaci.
5. Vyhodnocení fyzické aktivity
Pacientům byl při roční kontrole předložen dotazník zaměřený na vyhodnocení zdravotního stavu a fyzické aktivity. Vyhodnotili jsme odpovědi na následující dotazy:
- A. Frekvence tělesného cvičení (aerobní trénink na kole či ergometru):
- a) žádná aktivita
- b) 1–2krát týdně
- c) 3 a vícekrát týdně
- B. Forma tréninku:
- a) individuální
- b) návštěva posilovny nebo podobného zařízení
- c) kontrolovaný (1krát týdně na našem pracovišti pod kontrolou fyzioterapeuta)
- C. Posouzení fyzické aktivity dle Borga [11]
- a) trénink s nízkou intenzitou (Borgova stupnice 11–13)
- b) trénink se střední intenzitou (Borgova stupnice 15)
- c) trénink s vysokou intenzitou (Borgova stupnice 17–19).
6. Statistická analýza dat
Předložené výsledky jsou uvedeny jako průměr ± 1 SD, relativní četnost, interval a medián. Naměřené ukazatele byly srovnány F-testem a párovým a nepárovým Studentovým t-testem. Neparametrické hodnoty byly testovány χ2-testem. Vztahy mezi proměnnými jsme vyhodnotili lineární regresní analýzou, u neparametrických ukazatelů byl použit model vícerozměrné logistické regresní analýzy. Hodnoty p < 0,05 byly považovány za statisticky významné. Použili jsme statistický program NCSS 6.0 (Number Cruncher Statistical Systems, USA).
Výsledky
V tab. 2 jsou shrnuty změny EF a zátěžových ukazatelů po rehabilitaci a při ročním kontrolním vyšetření u celé skupiny nemocných. Z tabulky vyplývá, že po rehabilitaci došlo ke statisticky významnému zlepšení EF, TZ, tepového kyslíku a ukazatelů vrcholové spotřeby kyslíku. U klidové TF je naznačen trend k poklesu. Hodnota zátěžové TF se významně nemění, ale jedná se o hodnotu při vyšším zatížení ve srovnání se vstupním zátěžovým testem. Hodnoty TK nebyly významně ovlivněny. Vyšetření po roce ukazuje, že již nedochází k další změně EF, zůstávají statisticky významně vyšší hodnoty TZ, vrcholového příjmu kyslíku a tepového kyslíku. Mírně se zvýšila zátěžová TF, ale při vyšší TZ, změny TK nejsou opět statisticky významné.
Table 2. Vývoj změn ejekční frakce a zátěžových ukazatelů v celé skupině. 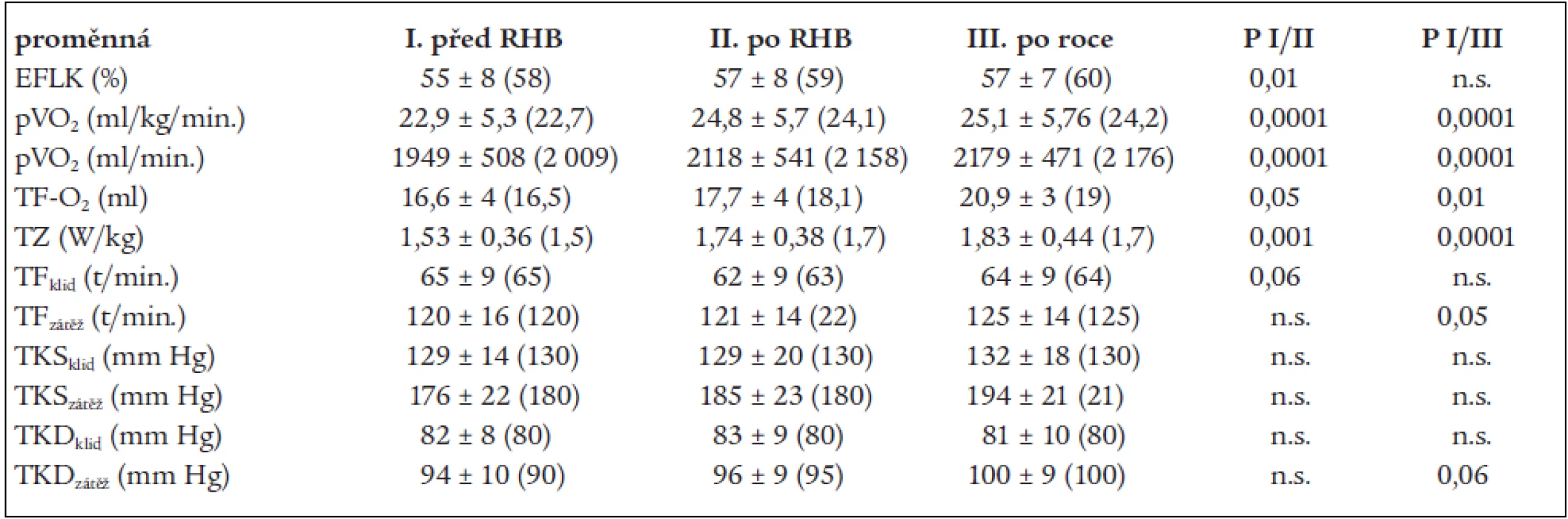
Data jsou uvedena jako průměr ± 1 SD, v závorce medián. EFLK – ejekční frakce levé komory srdeční, pVO2 – vrcholový příjem kyslíku, TF-O2 – tepový kyslík, TZ – tolerance zátěže, TF – tepová frekvence, TKS – systolický krevní tlak, TKD – diastolický krevní tlak Změny HRV jsou uvedeny v tab. 3. Již po ukončení rehabilitačního programu došlo k signifikantnímu zvýšení hodnot vysokofrekvenční komponenty (HF) vleže (p < 0,01), celkového spektrálního výkonu (TP) vleže (p < 0,05) a komponenty časové analýzy (MSSD) (p < 0,05). Tyto změny odrážejí zvýšení vagového tonu. Signifikantní změny přetrvávají po roce, navíc došlo ke statisticky významnému poklesu hodnoty nízkofrekvenční komponenty (LF) vleže (p < 0,01), a tím i poklesu indexu LF/HF vleže (p < 0,05).
Table 3. Vývoj změn ukazatelů variability srdeční frekvence v celé skupině. 
Data jsou uvedena jako průměr ± 1 SD, v závorce medián. LF – nízkofrekvenční komponenta spektrálního výkonu, HF – vysokofrekvenční komponenta spektrálního výkonu, TP – celkový spektrální výkon, MSSD – časová komponenta variability srdeční frekvence Pacienti byli po roce na základě vyplněného dotazníku o pohybové aktivitě rozděleni do 2 podskupin. 30 % nemocných (n = 24) uvedlo fyzickou aktivitu méně než 3krát týdně a zbylých 70 % (n = 57) trénovalo pravidelně 3 a vícekrát týdně. Individuálně trénovalo 43 % (n = 35), organizovaně 25 % (n = 20) a kontrolovaný trénink na našem oddělení absolvovalo 32 % (n = 26) pacientů. Většina pacientů trénovala se střední intenzitou (88 %, n = 71) a jejich trénink vycházel z našich doporučení po ukončení rehabilitace v nemocnici s cílem navázat na tento program. Intenzivnější trénink nad rámec našeho doporučení prováděli jen 2 nemocní (2 %) a trénink s nižší intenzitou 8 nemocných (10 %). Charakteristika obou podskupin je uvedena v tab. 4.
Table 4. Charakteristika podskupin. 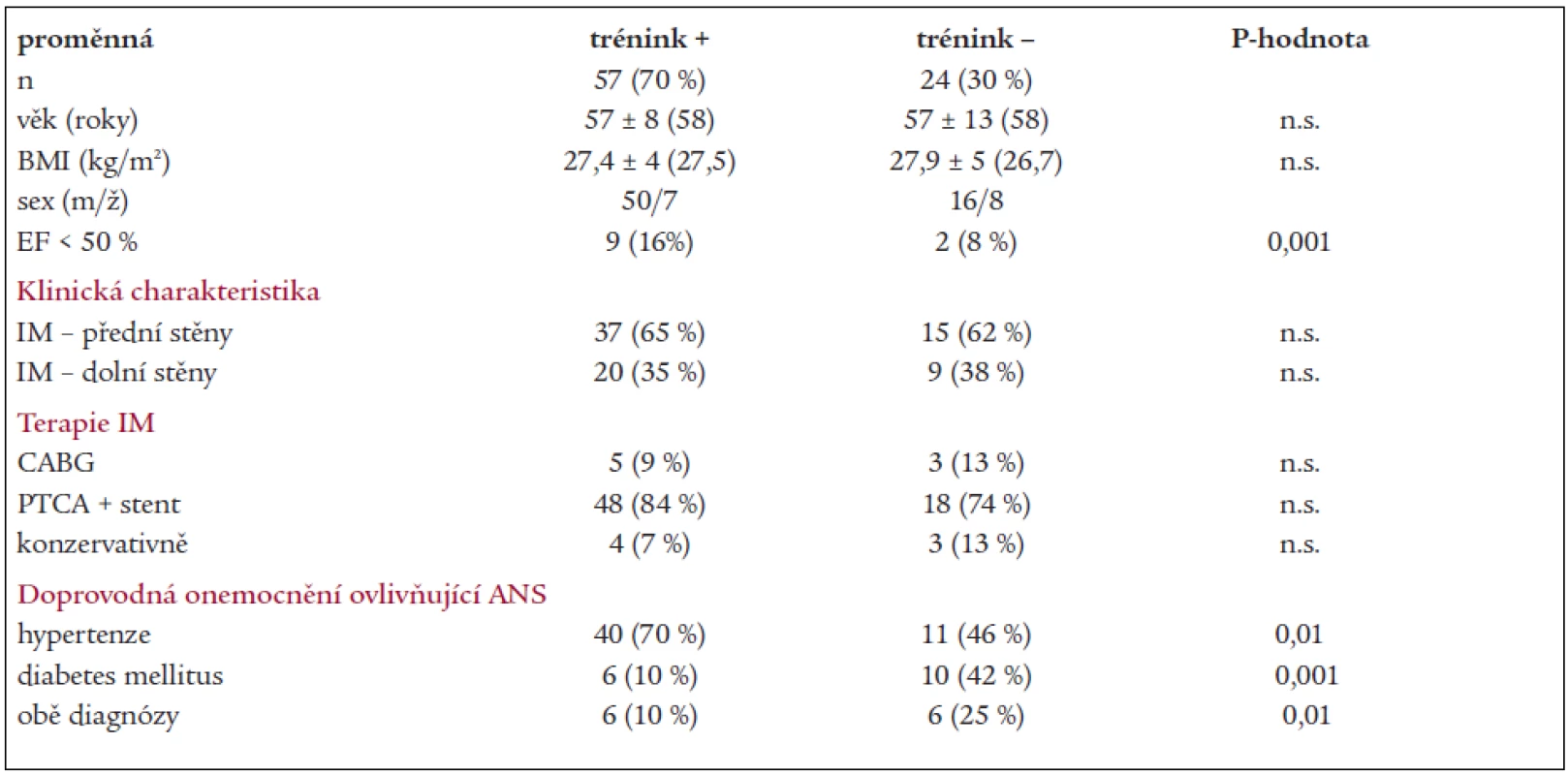
BMI – body mass index, EF – ejekční frakce levé komory, IM – infarkt myokardu, PTCA – perkutánní transluminální koronární angioplastika, CABG – aorto-koronární bypass, ACEI – inhibitory angiotenzin konvertujícího enzymu, ANS – autonomní nervový systém V průběhu roku od ukončení rehabilitace nedošlo u žádného nemocného k recidivě srdečního infarktu či vzniku anginy pectoris.
Mezi pacienty s vyšší tréninkovou aktivitou po rehabilitačním programu bylo více nemocných se sníženou EF pod 50 % (p < 0,001) a s hypertenzí (p < 0,01), méně nemocných s diabetem (p < 0,01). Kombinace obou onemocnění byla častější u nemocných s nižší tréninkovou aktivitou (p < 0,001). Podskupiny se nelišily v zastoupení jednotlivých lokalizací infarktu a v provedené léčbě srdečního infarktu (tab. 4).
Při srovnání výsledků vyšetření po roce od rehabilitačního programu je patrný trend k nižší EF v podskupině s intenzivním tréninkem. Tato podskupina má signifikantně vyšší hodnoty vrcholové spotřeby kyslíku (p < 0,05) a TZ (p < 0,05). Nebyl nalezen rozdíl v hodnotách TF a TK (tab. 5).
Table 5. Srovnání echokardiografických a zátěžových ukazatelů v podskupinách po roce. 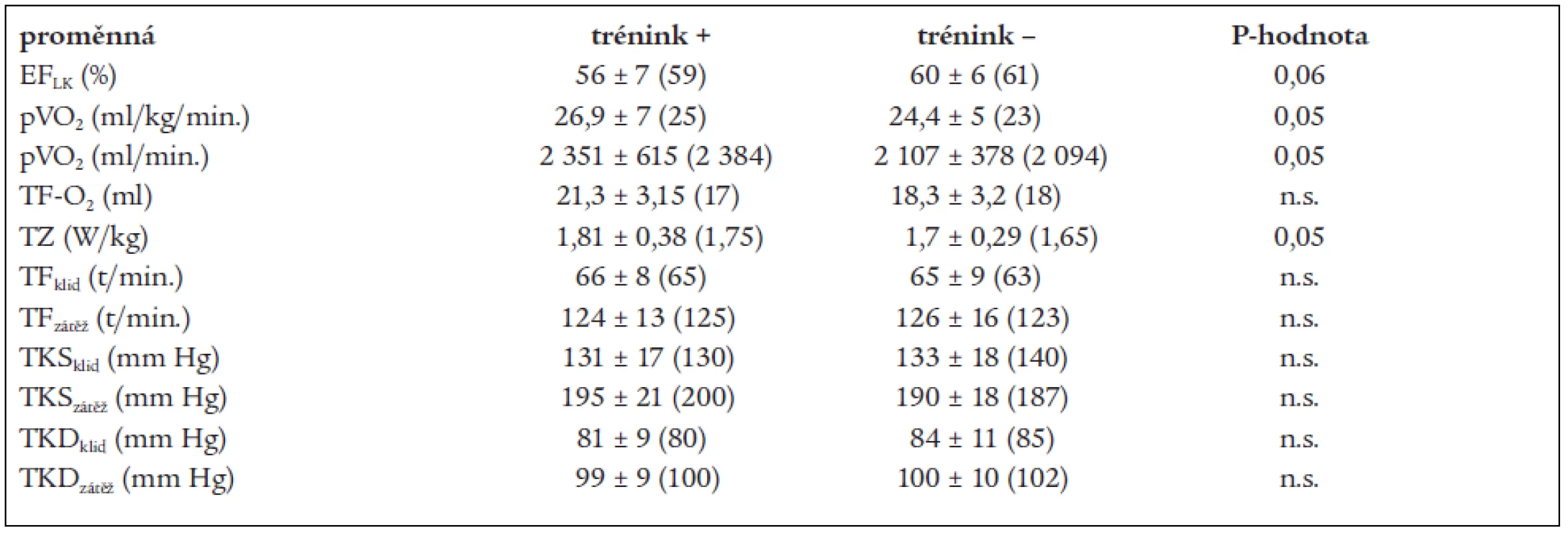
Data jsou uvedena jako průměr ± 1 SD, v závorce medián. EFLK – ejekční frakce levé komory srdeční, pVO2 – vrcholový příjem kyslíku, TF-O2 – tepový kyslík, TZ – tolerance zátěže, TF – tepová frekvence, TKS – systolický krevní tlak, TKD – diastolický krevní tlak Mezi oběma podskupinami byly nalezeny statisticky významné rozdíly v některých ukazatelích HRV. V podskupině s nižší tréninkovou intenzitou byly významně snížené hodnoty MSSD (p < 0,01), celkového spektrálního výkonu (p < 0,05) a indexu LF/HF vleže (p < 0,02). Provedli jsme proto retrospektivní analýzu vývoje těchto ukazatelů od nástupu do rehabilitace. Jak ukazují grafy 1 až 3, celkový spektrální výkon vleže se v podskupinách před a po rehabilitaci významně nelišil, index LF/HF byl po rehabilitaci významně nižší v podskupině s následným intenzivním tréninkem a statisticky významné rozdíly jsou patrné u ukazatele MSSD v průběhu celého sledování. Jinými slovy, skupina, která trénovala po rehabilitačním programu méně intenzivně, měla již v období rehabilitace významně horší ukazatele odrážející vagovou aktivitu.
Graph 1. Srovnání vývoje změn celkového spektrálního výkonu vleže v podskupinách nemocných. 
Graph 2. Srovnání vývoje změn indexu LF/HF vleže v podskupinách nemocných. 
Graph 3. Srovnání vývoje změn MSSD vleže v podskupinách nemocných. 
Zajímalo nás, zda tento fakt mohla ovlivnit trénovanost organizmu či funkce levé komory srdeční. Jak vyplývá z grafu 4, není po rehabilitaci patrný významný rozdíl v EF v podskupinách. Stejně tak není patrný statisticky významný rozdíl ve vrcholovém příjmu kyslíku po rehabilitaci, obě podskupiny vykázaly zlepšení tohoto parametru. Po roce pVO2 v podskupině s nižší tréninkovou intenzitou významně klesá (graf 5).
Graph 4. Srovnání vývoje změn ejekční frakce (EF) levé komory srdeční v podskupinách nemocných. 
Graph 5. Srovnání vývoje změn vrcholové spotřeby kyslíku (<em>pVO<sub>2</sub></em>) v podskupinách nemocných. 
Vzhledem k tomu, že onemocnění jako hypertenze a diabetes mellitus významně modifikují vliv ANS na HRV, provedli jsme analýzu vztahů mezi přítomností těchto onemocnění a ukazateli HRV (tab. 6). Z tabulky je patrné, že existuje negativní vztah mezi těmito onemocněními a ukazateli odrážejícími vagovou aktivitu.
Table 6. Regresní analýza mezi ukazateli variability srdeční frekvence, přítomností hypertenze a diabetu. 
Číselný údaj v tabulce vyjadřuje hodnotu r2, * – p < 0,05. LF – nízkofrekvenční komponenta spektrálního výkonu, HF – vysokofrekvenční komponenta spektrálního výkonu, TP – celkový spektrální výkon, MSSD – časová komponenta variability srdeční frekvence Nenalezli jsme významný vztah mezi ejekční frakcí LK a ukazateli HRV. Pouze hodnoty celkového spektrálního výkonu a MSSD korelovaly významně s věkem, dle očekávání byla tato korelace negativní. Podařilo se prokázat statisticky významné korelace k TZ a vrcholovému příjmu kyslíku (tab. 7).
Table 7. Regresní analýza mezi ukazateli variability srdeční frekvence, ejekční frakcí, věkem a zátěžovými ukazateli po 12 měsících sledování. 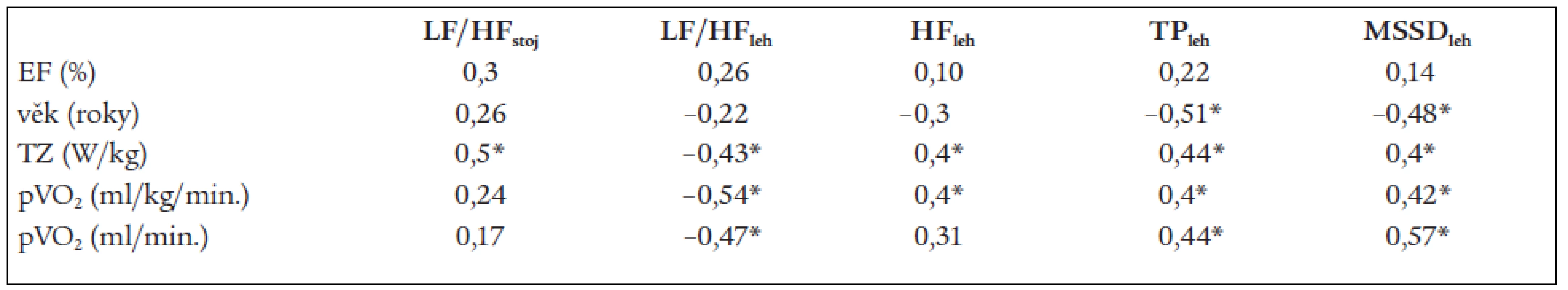
Číselný údaj v tabulce vyjadřuje hodnotu r2, * – p < 0,05. EF – ejekční frakce levé komory, TZ – tolerance zátěže, pVO2 – vrcholový příjem kyslíku Diskuse
Snížená variabilita srdeční frekvence je nezávislý rizikový faktor náhlé srdeční smrti u nemocných po akutním srdečním infarktu. Změny variability odrážejí narušenou sympatovagální balanci ve prospěch aktivity sympatické větve ANS. Opatření vedoucí ke zlepšení prognózy nemocných po infarktu zahrnují podání betablokátorů a inhibitorů ACE. U obou lékových skupin byl prokázán příznivý vliv na modulaci ANS. Betablokátory pozitivně ovlivňují ukazatele vagové aktivity, zatímco u inhibitorů ACE byl prokázán pozitivní vliv jak na celkovou variabilitu, tak i na ukazatele vagové aktivity [4,26]. Experimentální studie na zvířatech prokázaly protektivní vliv zvýšené vagové aktivity po tréninku [10]. Klinické studie již nejsou tak jednoznačné, především v důsledku rozdílů v délce trvání, intenzitě a struktuře tréninkového programu [1,2,6,16,19,30].
Naše výsledky prokázaly příznivý vliv kombinovaného tréninku na změny sympato-vagální balance ve smyslu významného zlepšení ukazatelů odrážejících vagovou aktivitu, které byly doprovázeny zlepšením zátěžové tolerance a vrcholového příjmu kyslíku. Významně se zlepšily jak ukazatele frekvenční domény, tak i ukazatel časové domény. Zlepšení ukazatelů obou domén po rehabilitaci prokázali i jiní autoři [16, 19,30]. Na druhé straně snížení TF po rehabilitaci se současným zlepšením ukazatelů časové domény a bez vlivu na ukazatele frekvenční analýzy prokázali Duru et al [6]. V našem souboru jsme zaznamenali jen trend ke snížení klidové TF, ale významně byla snížena zátěžová tepová odpověď. Domníváme se, že méně významné ovlivnění klidové TF tréninkem je důsledkem léčby betablokátory, které byly v našem souboru podány všem nemocným. Ve studiích, v nichž byl prokázán významný pokles TF po rehabilitaci, bylo obvykle zastoupení nemocných léčených betablokátorem podstatně menší, některé studie sledovaly jen nemocné bez betablokátorů [1,2,6,16]. Při sledování vlivu terapeutických přístupů na změny ukazatelů variability si je nutno uvědomit, že mohou podléhat i jiným vlivům. U nemocných po srdečním infarktu se často popisuje predominace LF komponenty a snížení HF komponenty odrážející hyperaktivitu sympatiku, respektive snížení tonu parasympatiku. Řada indexů prodělává v průběhu 2 až 12 měsíců po akutní příhodě vývoj a může dojít ke spontánnímu upravení hodnot [15]. V některých studiích byl naopak prokázán patologický nález i po 12 měsících od infarktu [1]. Zhoršení nálezu ve smyslu přesunu sympato-vagální balance ve směru k sympatické větvi ANS může odrážet proces remodelace levé komory srdeční [21].
Výsledky po ročním sledování ukázaly na přetrvávající významné zlepšení ukazatelů HRV u pacientů, kteří pokračovali v pravidelném aerobním tréninku. V podskupině s minimálním tréninkem došlo k významnému poklesu těchto ukazatelů. Překvapivým nálezem byly výsledky retrospektivní analýzy parametrů HRV v této podskupině, které byly významně horší ve smyslu převahy sympatické aktivity již před rehabilitací i po jejím ukončení, přičemž ukazatelé kardiopulmonální výkonnosti a funkce LK byly srovnatelné s ostatními pacienty.
Zarážejícím faktem je, že v podskupině méně aktivně trénujících byli nemocní s lepší funkcí LK. Domníváme se, že horší klinický stav podpořený echokardiografickým nálezem dysfunkce LK po infarktu byl větší motivací k následné změně životního stylu a pravidelnému kondičnímu tréninku u řady pacientů z našeho souboru.
Věk koreluje s ukazateli HRV ve smyslu snížení tenze vagové větve, nicméně v podskupinách nebyl nalezen rozdíl ve věku a navíc je prokázáno, že věk nekoreluje s přeladěním ANS aerobním tréninkem u ischemiků [5,29]. Nemáme k dispozici informace týkající se stavu ANS před infarktem, které by mohly též vysvětlit nalezené rozdíly. Některá další onemocnění jsou doprovázena přeladěním ANS. Jedná se především o hypertenzi a diabetes. U obou onemocnění je analýza HRV velmi důležitou metodou k posouzení závažnosti kardiovaskulárních komplikací [8,9, 12,13,25]. V podskupině pacientů méně trénujících po rehabilitaci byl prokázán statisticky významně vyšší výskyt diabetu a kombinace diabetu s hypertenzí. Navíc statistická analýza prokázala významný vztah mezi diabetem a hypertenzí a parametry HRV v celé skupině. Inverzní vztah k ukazatelům vagové aktivity jsme očekávali [25,28].
Dalším problémem je, zda námi použitý rehabilitační program je postačující k přeladění ANS v případě kumulace nepříznivých faktorů eliminujících vagovou aktivitu. Domníváme se, že délka programu používaná v naší praxi zcela odpovídá světovému standardu [24]. Je otázkou, zda stanovená tréninková TF opravdu odrážela 60–80 % vrcholového příjmu kyslíku při plné léčbě betablokátorem [11]. V některých studiích použili autoři aerobní trénink na úrovni 70–80 % pVO2, a to i u nemocných dysfunkcí levé komory [7,24]. Vzhledem k nalezené pozitivní korelaci ukazatelů vagové aktivity k ukazatelům kardiopulmonální výkonnosti je pravděpodobné, že intenzivnější trénink může změny HRV pozitivně ovlivnit.
Zvýšená sympatická aktivita a porušení vagových reflexů jsou nezávislým rizikovým faktorem náhlé srdeční smrti (NSS) u nemocných po srdečním infarktu. Stanovení ukazatelů hodnotících aktivitu ANS má v praxi význam pro rizikovou stratifikaci nemocných. Ve studii ATRAMI hodnoty senzitivity baroreflexu (SBR) < 3 ms/mm Hg a ukazatele časové domény HRV SDNN < 70 ms predikovaly výskyt NSS v průběhu 2letého sledování v 17 % oproti 2 % ve skupině se SBR > 6,1 ms/mm Hg a SDNN > 105 ms [14]. Kombinace ukazatele SBR a časové domény HRV může s vysokou senzitivitou 100 % a specificitou 87 % provést rizikovou stratifikaci NSS [27]. Předpovědní význam pro mortalitu nemocných po srdečním infarktu byl prokázán i u ukazatelů frekvenční analýzy HRV [2,3]. Sami se nemůžeme k této problematice prozatím vyjádřit. V průběhu ročního sledování byl výskyt fatálních nebo závažných komplikací v našem souboru nulový. Svoji roli hraje poměrně malý výskyt rizikových nemocných v souboru na straně jedné, na straně druhé současná léčba akutního srdečního infarktu a taktéž farmakoterapie v rámci sekundární prevence ICHS. V těchto aspektech se námi představený soubor významně liší od jiných prezentovaných studií.
Závěr
V dostupné literatuře nejsou prozatím údaje o vlivu kombinovaného aerobního tréninku se silovým cvičením na přeladění ANS u nemocných po akutním srdečním infarktu. Naše sdělení prokázalo, že u velké řady nemocných k pozitivní změně ANS po rehabilitaci dochází. Toto přeladění ANS ve prospěch vagové aktivity přetrvává v případě změny životního stylu související s pravidelnou dlouhodobou aktivitou i po roce.
Změny ANS po infarktu mají komplexní charakter a odrážejí jak poškození vlastní inervace srdce ischemií a nekrózou, velikost infarktového ložiska, dysfunkci levé komory, neurohumorální aktivaci, tak i přítomnost hypertenze a diabetu. Z tohoto důvodu u některých nemocných nemusí k přeladění ANS za podmínek, které jsme pro rehabilitaci stanovili, dojít.
Změny ANS korelují se zátěžovou tolerancí a vrcholovým příjmem kyslíku. Úroveň aerobního tréninku nad 60 % pVO2 je u rizikových pacientů předpokladem pro vegetativní přeladění.
K významu popsaných změn ANS pro stanovení rizika NSS nebo dalších kardiovaskulárních komplikací se nemůžeme nyní vyjádřit a je předmětem dalšího prospektivního sledování nemocných.
Práce vznikla za podpory výzkumného záměru MZ ČR 00065269705.
doc. MUDr. Lubomír Elbl, CSc.
www.fnbrno.cz
e-mail: lelbl@fnbrno.cz
Doručeno do redakce: 16. 6. 2004
Přijato po recenzi: 10. 8. 2004
Sources
1. Bigger JT, Fleiss JL, Rolnitzky LM et al. Time course of recovery of heart period variability after myocardial infarction. J Am Coll Cardiol 1991; 18 : 1643–1649.
2. Bigger JT, Fleiss JL, Steinman RC et al. Frequency domain measures of heart period variability and mortality after myocardial infarction. Circulation 1992; 85 : 164–171.
3. Bigger JT, Fleiss JL, Rolnitzki LM et al. Frequency domain measures of heart period variability to assess risk late after myocardial infarction. J Am Coll Cardiol 1993; 21 : 729–736.
4. Bonaduce D, Marciano F, Petretta M et al. Effects of converting enzyme inhibition on heart period variability in patients with acute myocardial infarction. Circulation 1994; 90 : 108–113.
5. Bonnemeier H, Uwe KH, Brandes A et al. Circadian profile of cardiac autonomic nervous modulation in healthy subjects: Differing effects of aging and gender on heart rate variability. J Cardiovasc Electrophysiol 2003; 14 : 791–799.
6. Duru F, Candinas R, Dyiekan G et al. Effect of exercise training on heart rate variability in patients with new-onset left ventricular dysfunction after myocardial infarction. Am Heart J 2000; 140 : 157–161.
7. Gassner LA, Dunn S, Piller N. Aerobic exercise and the post myocardial infarction patient: A review of the literature. Heart & Lung 2003; 32 : 258–265.
8. Halamek J, Kara T, Jurak P et al. Variability of phase shift between blood pressure and heart rate fluctuations: a marker of short-term circulation control. Circulation 2003; 108 : 292–297.
9. Hosová J, Jirkovská A, Bouček P et al. Návrh parametrů spektrální analýzy variability srdeční frekvence vhodných pro klinické hodnocení různých stádií diabetické kardiovaskulární autonomní neuropatie. Vnitř Lék 2001; 47 : 682–688.
10. Hull Jr, SS, Vanoli E, Adamson PB et al. Exercise training confers anticipatory protection from sudden death during acute myocardial infarction. Circulation 1994; 89 : 548–552.
11. Chaloupka V, Vaněk P, Juráň F et al. Nemocniční, posthospitalizační a lázeňská rehabilitace u nemocných s ICHS. Cor Vasa 1998; 40: K243–K251.
12. Kaliská G, Szentiványi M, Kmeč P et al. Markery rizika a prevencia náhlej srdcovej smrti u pacientov s komorovou tachykardiou po infarkte myokardu. Vnitř Lék 1999; 45(1): 22–29.
13. Kára T, Souček M. Autonomní nervový systém. In: Souček M, Kára T et al. Klinická patofyziologie hypertenze. Praha: Grada 2002 : 37–98.
14. LaRovere MT, Bigger JT, Marcus FI et al. Baroreflex sensitivity and heart rate variability in prediction of total cardiac mortality after myocardial infarction. Lancet 1998; 351 : 478–484.
15. Lombardi F, Sandrone G, Pernpruner S et al. Heart rate variability as a index of sympathovagal interaction after acute myocardial infarction. Am J Cardiol 1987; 60 : 1239–1245.
16. Lucini D, Milani RV, Costantino G et al. Effects of cardiac rehabilitation and exercise training on autonomic regulation in patients with coronary artery disease. Am Heart J 2002; 143 : 977–983.
17. Lucreziotti S, Gavazzi A, Scelsi L et al. Five–minute recording of heart rate variability in severe heart failure: Correlates with right ventricular function and prognostic information. Am Heart J 2000; 139 : 1088–1095.
18. Malfatto G, Facchini M, Bragato R et al. Short and long term effects of exercise training on the autonomic modulation of heart rate variability after myocardial infarction. Eur Heart J 1996; 17 : 532–538.
19. Malfatto G, Facchini M, Sala L et al. Relationship between baseline sympatho–vagal balance and the autonomic response to cardiac rehabilitation after a first uncomplicated myocardial infarction. Ital Heart J 2000; 1 : 226–232.
20. Malik M et al. Heart rate variability. Standards of measurement, physiological interpretation, and clinical use. Task force of The European society of Cardiology and The American Society of Pacing and Electrophysiology. Eur J Cardiol 1996; 17 : 354–381.
21. Mazzuero G, Lanfranchi P, Colombo R et al. Long-term adaptation of 24-h heart rate variability after myocardial infarction. Chest 1992; 101 : 304–308.
22. Molgaard H, Mickley H, Pless P et al. Effects of metoprolol on heart rate variability in survivors of acute myocardial infarction. Am J Cardiol 1993; 71 : 1357–1359.
23. O’Connor GT, Buring JE, Yusuf S et al. An overview of randomised trials of rehabilitation with exercise after myocardial infarction. Circulation 1989; 80 : 234–244.
24. Oldridge NB, Guyatt GH, Fischer ME et al. Cardiac rehabilitation after myocardial infarction. Combined experience of randomised clinical trials. JAMA 1998; 260 : 945–950.
25. Ruediger H, Seibt R, Scheuch K et al. Sympathetic activation in heart rate variability in male hypertensive patients under mental stress. J Hum Hypertens 2004; 18 : 307–315.
26. Sandrone G, Mortara A, Torzillo D et al. Effect of betablockers (atenolol and metoprolol) on heart rate variability after acute myocardial infarction. Am J Cardiol 1994; 74 : 340–345.
27. Semrád B, Honzíková N, Fišer B. Metody určení rizika náhlé srdeční smrti u nemocných po infarktu myokardu. Cor Vasa 1994; 36 : 295–298.
28. Singh JP, Larson MG, O’Donnell CJ et al. Association of hyperglycemia with reduced heart rate variability (The Framingham Heart Study). Am J Cardiol 2000; 86 : 309–312.
29. Stahle A, Nordlander R, Bergfeldt L. Aerobic group training improves exercise capacity and heart rate variability in elderly patients with a recent coronary event. Eur Heart J 1999; 20 : 1638–1646.
30. Tygesen H, Wettevirk C, Wennerblom B. Intensive home-based exercise training in cardiac rehabilitation increases exercise capacity and heart rate variability. Int J Cardiol 2001; 79 : 175–181.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2005 Issue 4-
All articles in this issue
- Vliv kombinovaného aerobního tréninku na změny autonomní modulace u nemocných po akutním infarktu myokardu
- Pleurální výpotek v interní praxi
- Molekulární patofyziologie pozdních komplikací diabetes mellitus – genetická predispozice k rozvoji diabetických komplikací
- Transplantace kmenových buněk v kardiologii
- Aortální stenóza, skleróza a ateroskleróza
- Je hyperhomocysteinemie stále jen zajímavý, ale diagnosticky nevýznamný nález?
- Jaké jsou znalosti našich lékařů o rizikových faktorech ischemické choroby srdeční? Porovnání se stavem v roce 1991
- Epidemiologická analýza pacientů podstupujících trvalou kardiostimulaci na Interní kardiologické klinice Fakultní nemocnice Brno, pracoviště Bohunice
- Klinický význam mírně zvýšených hodnot α−fetoproteinu v séru u pacientů s chronickou hepatitidou C a B
- Rehabilitace po infarktu myokardu a revaskularizaci u starších nemocných
- Neobvyklý způsob neinvazivní objektivizace ischemie myokardu chladovou zátěží
- Vyučování etiky na lékařské fakultě: cesta od deskriptivní etiky k mravním normám
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Klinický význam mírně zvýšených hodnot α−fetoproteinu v séru u pacientů s chronickou hepatitidou C a B
- Pleurální výpotek v interní praxi
- Aortální stenóza, skleróza a ateroskleróza
- Je hyperhomocysteinemie stále jen zajímavý, ale diagnosticky nevýznamný nález?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

