-
Medical journals
- Career
Pleurální výpotek v interní praxi
Authors: M. Teřl; M. Pešek; A. Tauchman
Authors‘ workplace: Klinika tuberkulózy a respiračních nemocí Lékařské fakulty UK a FN, Plzeň, přednosta prof. MUDr. Miloš Pešek, CSc.
Published in: Vnitř Lék 2005; 51(4): 430-437
Category: Reviews
Overview
Pleurální výpotek je častým problémem interní medicínské praxe. Objevuje se až u 10 % nemocných s interními chorobami. Práce si klade za cíl podat přehled současných, klinicky významných znalostí o patogenezi pleurálního výpotku a diagnostických možnostech. Navazuje přehledem nejdůležitějších příčin a typů pleurálních výpotků a shrnuje stávající terapeutické možnosti. Uzavírá, že základem racionálního přístupu k pacientům s pleurálním výpotkem je řádné stanovení jeho příčin, kdy rozhodujícím nástrojem stále zůstává důsledná analýza pleurální tekutiny. Pokud cílená léčba příčin(y) výpotků selhává, k dispozici dnes jsou, vedle klasické chirurgické léčby, možnosti lokální miniinvazivní léčby fibrinolýzou a pleurodézou.
Klíčová slova:
pleurální výpotek – exsudát – transsudát – rozlišení – léčbaÚvod
Pleurální výpotek představuje abnormální (více než 20 ml) přítomnost tekutiny v pohrudniční dutině.
Pleurální výpotek není nemoc sama o sobě, ale představuje častou komplikaci či projev mnoha nemocí, resp. patologických procesů. Je proto vhodné hovořit o pleurálním syndromu. Klinický lékař si při zjištění pleurálního výpotku musí vždy položit otázku, co je příčinou fluidotoraxu u daného pacienta.
Příčinou může být v zásadě buď zvýšená tvorba nebo snížená resorpce pleurální tekutiny [1].
Rozdílné dílčí mechanizmy vzniku výpotku podmiňují jeho lokalizaci, dynamiku a rozsah tvorby, především však jeho složení.
Fyziologie a patogeneze tvorby pleurální tekutiny
Pleura je tenká serózní blána, tvořená jemnou elastickou vrstvou vaziva, pokrytého vrstvou plochých mezotelových buněk. Virtuální prostor mezi viscerální (poplicnice) a parietální (pohrudnice) pleurou je fyziologicky vyplněn malým množstvím (cca 15 ml) lubrikační tekutiny s obsahem bílkovin menším než 15 g/l, což pomáhá spoluvytvářet negativní intrapleurální tlak (asi –3 cm H2O na konci klidného výdechu a –6 cm H2O na konci klidného nádechu) [10]. Inervovaná je zejména parietální pleura (proto mívá pleurální bolest většinou somatický charakter). Krevní zásobení obou listů pleury pochází u člověka především ze systémové cirkulace, pouze viscerální pleura je zásobována zčásti i z cév malého oběhu [8]. Je zajímavé, že u většiny savců je viscerální pleura (poplicnice) téměř výhradně živena pouze z malého oběhu a dále, že u některých velkých savců pleurální dutina během intrauterinního života zaniká, obliteruje (slon, nosorožec, hroch) [40]. Míza z pohrudnice je drénována do mízních cév hrudní stěny, mediastina a bránice, míza z poplicnice je drénována do mízních cév mediastina.
Mechanizmus a dynamika tvorby pleurální tekutiny nejsou dodnes přesně známy [3,5,28]. Většina dosavadních nálezů podporuje teorii, že existuje rovnováha mezi sekrecí i resorpcí tekutiny především z parietální pleury. Sekrece (asi 50 ml/24 hod.) se děje z krevních vlásečnic nejvíce v oblasti kupuly a resorpce pak mízními cévami v diafragmatické a mediastinální oblasti. Kapacita této lymfatické drenáže je značná – ještě při asi 10násobném zvýšení filtrovaného množství se objem pleurální tekutiny udržuje v normě. Teprve tehdy, přesáhne-li tvorba maximální možnosti lymfatické drenáže (což je asi 700 ml/den), vzniká pleurální výpotek [3]. Ten může samozřejmě vzniknout i tehdy, je-li nějakým způsobem omezena lymfatická drenáž [32].
Za patologických okolností dochází k nadměrné tvorbě nebo sníženému vstřebávání tekutiny v pohrudniční dutině, mechanizmy se přitom mohou kombinovat. Ve většině klinických situací se především uplatňuje nadměrná tvorba. V zásadě vzniká buď transsudát nebo exsudát [1,19,20].
Transsudát vzniká tehdy, dochází-li k nadměrné produkci tekutiny transsudací, t.j. v důsledku zvýšeného filtračního tlaku v cévách pleury, tedy buď v důsledku zvýšeného hydrostatického tlaku (nejčastěji při kardiálním selhávání, ať již pravo - či levostranném) nebo sníženého onkotického tlaku (stavy spojené s hypalbuminemií – nefrotický syndrom, malnutrice, jaterní cirhóza atp). Příčiny tedy bývají „systémové“, cévy pleury jsou intaktní a propouští málo buněk a velkých molekul, zatímco malé molekuly i neporušenou cévní stěnou dobře procházejí. Transsudát proto bývá často oboustranný a jeho vzhled i složení jsou dosti uniformní, blíží se séru.
Exsudát vzniká tehdy, dochází-li k nadměrné produkci tekutiny exsudací, t.j. zavzetím pleury a jejích cév do patologického procesu, ať již zánětlivé, traumatické nebo tumorózní povahy.
Příčiny tedy bývají lokální, cévy pleury jsou různě narušeny a propouštějí hodně buněk a velkých molekul z krve. Složení exsudátu je dále ovlivněno typem patologického procesu (např. spotřebou glukózy při některých zánětech, aktivní sekrecí jiných složek, např. LDH, atp).
Exsudáty proto bývají častěji jednostranné, obsahují větší množství bílkovin, ev. jiných (velkých) molekul a větší množství buněk. Vzhled i složení exsudátu tak bývají značně různorodé a vzdalují se séru.
Diagnostika příčin(y) pleurálního výpotku
Odvíjí se od znalosti anamnézy a aktuálního stavu pacienta. Znalost přítomnosti některých chorob velmi přibližuje odhalení příčiny fluidotoraxu (např. malignity prsu, plic, ledvin, onemocnění kardiovaskulární, ledvin, jater, systémové autoimunity atp.). Významnou nápovědu rovněž představuje zjištění oboustranného pleurálního výpotku (tab. 1) a dále výpotku i v jiných serózních dutinách (polyserositis) či spolupřítomnost otoků (anasarka).
Table 1. Základní diagnostické rozdíly transsudát versus exsudát. 
Analýza pleurálního výpotku
„Zlatým standardem“ určení etiologie výpotku je provedení hrudní punkce (torakocentézy) s následnou analýzou získané tekutiny [22,23,25]. Významnou pomoc při lokalizaci optimálního místa a hloubky vpichu dnes představuje sonografické vyšetření.
Zásadou diagnostického postupu je odlišení transsudátu od exsudátu. Přitom je dobré si uvědomit, že některé stavy mohou být komplikovány vznikem obou (např. plicní embolie je v 80 % provázena vznikem exsudátu, ve 20 % vznikem transsudátu, podobně pak pankreatitida, jaterní cirhóza, ale i některé nádory aj.).
Základem je smyslové posouzení (zvláště makroskopický vzhled) spolu se stanovením hustoty, cytologická a základní biochemická analýza (tab. 1).
Makroskopický vzhled výpotku
Všímáme si barvy, transparence a viskozity. Transsudáty se vzhledem blíží vodě, resp. séru, exsudáty se tomuto vzhledu v různé míře vzdalují. Transsudáty proto bývají tzv. serózní, t.j. čiré, slámově žluté.
Žlutozelená barva bývá u výpotku při revmatoidní artritidě a někdy u výpotku při zánětech slinivky břišní. Zvýšeně viskózní výpotek bývá u maligního mezoteliomu (zvýšená koncentrace hyaluronové kyseliny). Výpotek černé barvy bývá u aspergilové infekce, urinotorax se projevuje zápachem výpotku po moči. Zbytky potravy ve výpotku bývají přítomny po perforaci jícnu. Hemoragické výpotky bývají nejčastěji traumatického a nádorového původu. Hustá, zkalená, eventuelně páchnoucí tekutina bývá přítomna při hnisavých zánětech pohrudnice. Výpotek mléčně zkalený (chylózní) bývá při přítomnosti chylomikronů s vysokým obsahem triglyceridů (chylotorax při alteraci ductus thoracicus) nebo většího množství cholesterolu (pseudochylotorax u tuberkulózy, myxedému aj) [1].
Cytologický charakter výpotku
Cytologický obraz transsudátu je chudý na počet buněk (méně než 1 000–5 000/ml), ale pestrý v druhovém zastoupení, s dominujícím obsahem mezotelií a lymfocytů a v menší míře dalších buněčných druhů (granulocyty, makrofágy aj).
Cytologický obraz exsudátu naproti tomu dokládá zmnožení počtu buněk, z nichž některé mohou být až diagnostické (tab. 2), zejména u nádorových exsudátů. Pro nádorové výpotky, pokud nezjistíme vlastní nádorové buňky, bývá typická převaha mezotelií, někdy atypických a/nebo záplava erytrocytů. U parapneumonických výpotků bývá zmnožení zánětlivých buněk (neutrofilních granulocytů, později lymfocytů, u virových onemocnění také aktivovaných „obrovských“ monocytů – virocyty). Při vzniku empyému se buňky (především granulocyty) ve velké míře rozpadají a jsou podstatou hnisu. Převaha lymfocytů ve výpotku dříve nejčastěji značila jeho tuberkulózní etiologii, dnes jakýkoli chronický zánět. Přítomnost zvýšeného počtu eozinofilních granulocytů lze pozorovat u hojících se zánětů („červánky uzdravení“), parazitárních onemocnění a plicního infarktu, někdy se objevují po opakovaných punkcích pleurální dutiny, pravděpodobně jako důsledek opakované traumatizace. Eozinofily se ve zvýšené míře objevují rovněž u jiných traumatických výpotků (např. po kontuzi hrudníku, u pneumotoraxu aj).
Table 2. Základní cytologické obrazy výpotku a jejich nejčastější příčiny. 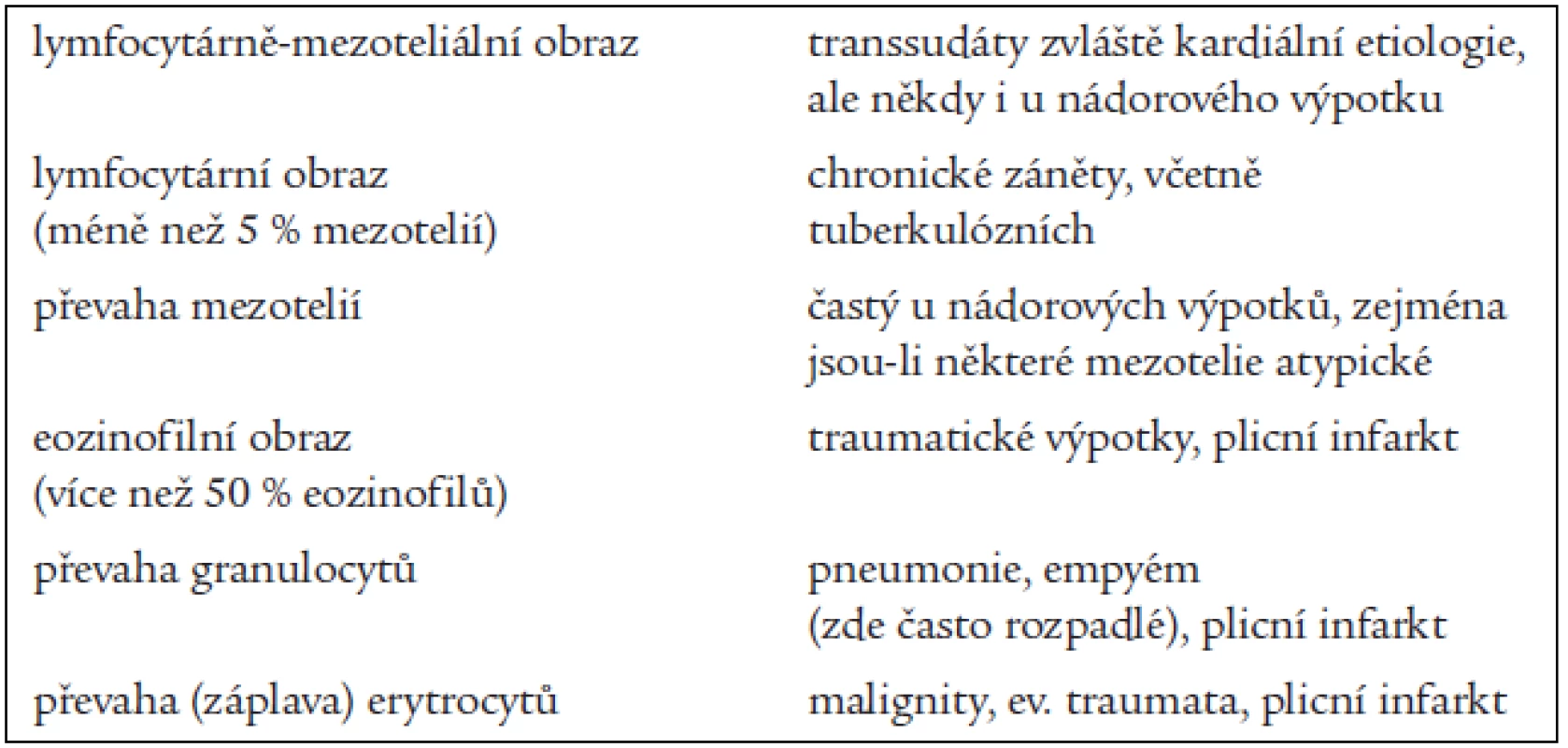
Základní biochemie výpotku
Základní biochemické vyšetření v řadě případů dopomůže k rozlišení transsudátu od exsudátu (tab. 1 a 3) [6,19].
Table 3. Pomocná diagnostická kritéria transsudát versus exsudát (tzv. Lightova kritéria se týkají celkové bílkoviny a LDH). 
Transsudát obsahuje malé množství bílkovin (do 30 g/l), naopak obsah glukózy a iontů je analogický séru. Exsudáty naopak obsahují větší množství bílkovin (nad 30 g/l) a obsah glukózy bývá snížen.
Obsah celkové bílkoviny může být arteficiálně zvýšen i u transsudátu vlivem diuretické léčby – mluvíme o tzv. pseudoexsudátu [7,13].
Specifická váha (hustota) výpotku se odvíjí především od obsahu makromolekul bílkovin. Hranice mezi transsudátem a exsudátem je asi 1015.
Při posuzování hustoty výpotku je třeba zohlednit skutečnost, že řada hustoměrů není cejchována na teplotu těla (37 °C), ale na teplotu v místnosti – tj. 21 °C. V takovém případě je nutno na každé 3 °C rozdílu teplot přičíst hustotu 0,001. (Není vhodné vyčkat ochlazení výpotku na teplotu místnosti, neboť dojde k vysrážení ev. bílkovin.)
V nejasných případech je při biochemické analýze vhodné porovnávat zastoupení sledovaných složek ve výpotku a v séru. Z principu odlišného mechanizmu vzniku transsudátu versus exsudátu vychází tzv. Lightova kritéria, porovnávající obsah celkové bílkoviny a LDH ve výpotku a séru [17]. Velké molekuly bílkovin, včetně enzymů, do transsudátů pronikají špatně, a proto zde jejich množství nedosahuje ani poloviny jejich obsahu v séru [19]. K dalším pomocným kritériím pak patří porovnávání hodnot cholesterolu [43] a bilirubinu [27] (tab. 3). Spolehlivost uvedených kritérií se při komplexním posouzení blíží 100 % [6,7,16,17].
K dalšímu rozlišení exsudátů pak vedou speciální laboratorní vyšetření (tab. 4).
Table 4. Speciální laboratorní vyšetření výpotku. 
Snížená hodnota pleurální glukózy bývá u tuberkulózy, revmatoidní artritidy, empyému, lupusové pleuritidy a u pleuritidy doprovázející perforaci jícnu. Dále u maligních pleuritid, kde je snížení množství glukózy a snížení pH pleurální tekutiny sdruženo se špatnou prognózou. Obecně nízké hodnoty pleurální glukózy a s ní spojené nízké pH pleurální tekutiny bývá důsledkem intenzivního anaerobního metabolizmu leukocytů, bakterií či nádorových buněk.
Zvýšení hodnot triglyceridů může být spolu s přítomností chylomikronů klíčovým nálezem pro diagnózu chylotoraxu. V tuberkulózních výpotcích bývá zjišťována zvýšená aktivita adenozindeaminázy, cholesterolu a lyzozymu. Vysoká aktivita amylázy se nachází v pohrudničních výpotcích, které komplikují pankreatitidy, pseudocysty pankreatu a ruptury jícnu. Při rupturách jícnu se však prokazuje izoenzym amylázy přítomný ve slinách, na rozdíl od průkazu amylázy pankreatické u afekcí slinivky břišní.
Dříve se prováděla tzv. Éterová zkouška – při přidání chylózního výpotku (obsahuje vysoké procento tuků) k éteru dojde k jeho „vyčeření“, kdy se původně opaleskující výpotek vyjasní.
Tam, kde se ani opakovaným vyšetřením pohrudničního výpotku nedaří zjistit jeho příčinu a ani ostatní klinické vyšetřování ji neodhalí, je na místě biopsie pleury. Přednost před necílenou punkční biopsií a/nebo před torakotomií má dnes videoasistovaná torakoskopie s cíleným bioptickým odběrem pleury a přilehlých tkání [21].
I přes využití moderních vyšetřovacích metod se příčina vzniku pohrudničních výpotků nepodaří zjistit asi u 10 % nemocných [1,30].
Nejčastější pleurální výpotky
Pleurální výpotek se objevuje u každého asi desátého pacienta s interními chorobami.
Nejčastější příčinou je kardiální selhávání – u asi 40 % výpotků. Z nekardiálních výpotků jsou časté výpotky zánětlivé (parapneumonické) – asi u 25 %, na třetím místě pak (asi u 20 %) výpotky nádorové (graf 1).
Graph 1. Graf četnosti příčin výpotků. 
Ostatní příčiny se podílejí na vzniku zbývajících cca 15 % výpotků.
V praxi se asi u každého desátého výpotku, navzdory použití všech zmiňovaných vyšetřovacích metod, jeho příčinu nepodaří zjistit [25,30].
Výpotky kardiální etiologie
Transsudát se objevuje obvykle při selhávání levé srdeční komory (ICHS, hypertenze, kardiomyopatie) a nebo při mitrálních vadách. Příčinou jeho vzniku bývá městnání v malém oběhu, zvyšující filtrační tlak v kapilárách plic a poplicnice [44]. To může vést jednak ku vzniku plicního edému (intersticiálního až alveolárního), jednak pleurálního výpotku cestou přes viscerální pleuru. Často se různě výrazný (chronický) plicní edém a výpotek kombinují. Důvody, proč někteří pacienti s levostranným kardiálním selháváním inklinují více k tvorbě plicního edému a jiní k tvorbě výpotku, nejsou přesně známy. Spočívají nejspíše v individuálních odlišnostech podílu velkého vs malého oběhu v poplicnici [5,8,40].
Pohrudniční výpotek se však může objevit i při selhávání pravé srdeční komory, tj. při městnání v žilách velkého oběhu. Zvýšený žilní tlak vede ke zvýšení filtračního tlaku v kapilárách především pohrudnice a navíc interferuje s lymfatickou drenáží.
Někdy bývá výpotek přítomen při oboustranném kardiálním selhávání.
Při vyšetření se více než polovina kardiálních výpotků manifestuje oboustranně, při jednostranné manifestaci bývá lokalizován častěji vpravo. Někdy bývá uložen v interlobární štěrbině a imponuje tak jako tzv. pseudotumor, který ustupuje po diuretické léčbě [1,35].
Součástí rentgenového obrazu kardiálního výpotku bývá rozšíření či jiné anomálie srdečního stínu.
Zánětlivé (parapneumonické) pohrudniční výpotky
Komplikují především bakteriální pneumonie. Z klinického hlediska se dělí na výpotky parapneumonické bez infekce (nekomplikované) a parapneumonické výpotky s infekcí doloženou kultivačním vyšetřením pleurálního výpotku (zánětlivé výpotky komplikované) a dále empyém hrudníku (hnisavý zánět pohrudnice) [1,37].
Podezření na komplikovaný výpotek či empyém by mělo být vysloveno vždy, když teplota nemocného léčeného pro (pleuro)pneumonii trvá déle než 48 hodin od začátku antibiotické terapie. Nejčastějším příčinným agens těchto výpotků jsou pneumokoky, klebsiely, pseudomonády, stafylokoky a hemofilus. Méně časté jsou výpotky u tzv. „atypických“ agens (chlamydie, mykoplazmata, ev. legionely) a virových infekcí, u nichž většinou není k dispozici možnost kultivačního průkazu. Anaerobní flóra se objevuje zpravidla u starších a neurologických nemocných a u alkoholiků (aspirace). Na její přítomnost lze usuzovat tehdy, má-li odebraný výpotek výrazný zápach.
Tuberkulózní (tbc) amykotické výpotky jsou u nás vzácné [18]. Při nejasném exsudátu, i při nepřítomnosti plicního nálezu, je však vhodné zvláště na možnost TBC etiologie pomýšlet a indikovat příslušná vyšetření. Kromě již uvedené cytologie a laboratorních vyšetření může k diagnóze přispět přímý kultivační průkaz mykobakteria tuberkulózy (MTB) nejlépe v sedimentu z velkého množství výpotku. Naopak spolehlivost jinak velmi citlivé metody polymerázové řetězové reakce (PCR) je ve výpotku snižována přítomností inhibitorů polymerázy. Někdy k diagnóze vede až cílená pleurální biopsie s průkazem specifické granulační tkáně a/nebo mikrobiologické vyšetření takto získaného vzorku.
Nádorové výpotky
Představují dnes téměř čtvrtinu pleurálních výpotků. Vznikají buď přímým šířením z regionálních malignit (nejčastěji plíce a prs), nebo metastázováním ze vzdálených malignit (nejčastěji pohlavní orgány a lymfomy) [26] a nebo se jedná o primární maligní mezoteliom.
Prakticky každý maligní tumor (vyjma některých nádorů CNS) může způsobit nádorovou pleuritidu [1].
V řadě klinických případů (asi 30 %) se primární tumor nepodaří nalézt.
Někdy je rozlišováno mezi tzv. maligním a paramaligním nádorovým výpotkem [31].
Klasický maligní nádorový výpotek je způsoben infiltrací pleury nádorovým procesem, a proto často (ne však vždy) nacházíme při cytologickém vyšetření výpotku maligní elementy.
Paramaligní výpotky jsou způsobeny jinými důsledky tumoru (např. zánět za stenózou, blokáda lymfatické drenáže), a proto maligní elementy při cytologickém vyšetření punktátu nenacházíme.
Nádorové pohrudniční výpotky tak představují diagnostický problém, neboť jen asi polovina z nich obsahuje nádorové buňky.
Pro klinickou praxi se doporučuje považovat výpotek za maligní tehdy, je-li opakovaně (!) hemoragický a naše svědomí je v souhlase s „best clinical judgement“.
Při pH maligního výpotku nižším než 7,2 a obsahu glukózy nižším než 3,0 mmol/l bývá prognóza quo ad vitam velmi špatná [31].
Další, v interní praxi důle#ité příčiny výpotků
Výpotky u onemocnění ledvin
Nejčastějším ledvinným onemocněním sdruženým s tvorbou výpotku (transsudátu) bývá nefrotický syndrom, méně často akutní glomerulonefritida.
Výpotky mohou doprovázet uremii a peritoneální dialýzu – složení výpotku se zde blíží složení dialyzační tekutiny.
Hydronefróza bývá spojena s výskytem tzv. urinotoraxu, kdy moč prosakuje retroperitoneálně až do pleurální dutiny.
U hemodialyzovaných pacientů se může objevit hemoragický výpotek jako komplikace antikoagulační léčby [1].
Výpotky u gastrointestinálních onemocnění
Nejčastěji se objevují u jaterní cirhózy. Na vzniku se podílí jednak hypalbuminemie, jednak pasáž ascitické tekutiny do pleurální dutiny a mívá tedy charakter transsudátu [12].
Pankreatitida, zvláště akutní, bývá provázena výpotkem charakteru exsudátu. Výpotek bývá většinou levostranný, často hemoragický, někdy „natrávený“ – nahnědlý díky enzymatické aktivitě. Na jejím průkazu (amylázy) spočívá i diagnóza [29].
Podstatně vzácnější jsou výpotky související s perforací jícnu [38] (rovněž zvýšení amyláz, ovšem slinného typu) či žlučníku.
U závažných onemocnění tenkého střeva (Crohnova nemoc, Whippleova choroba) [9], spojených se sekundární malnutricí s hypalbuminemií, se objevují pleurální výpotky charakteru transsudátu, často v rámci anasarky.
Iatrogenní výpotky
Nejčastěji komplikují kanylaci podklíčkové žíly [2]. Upozorní na ně časová souvislost kanylace s objevením se výpotku, jeho hemoragický charakter anebo charakter blížící se typu podávané parenterální léčby. Někdy bývá RTG obraz fluidopneumotoraxu.
Iatrogenní výpotky nejasného mechanizmu vzniku se dále objevují při chronické medikaci nitrofurantoinem, metotrexátem, amiodaronem a jinými léky, známými častěji ve spojitosti se vznikem plicních fibróz [1,32].
Výpotek při plicní embolii a infarktu
Pomineme-li nádorovou a parapneumonickou etiologii, je po kardiální příčině nejčastější interní diagnózou, provázenou objevením se výpotku. Na rozdíl od kardiální příčiny bývá častěji charakteru exsudátu, někdy hemoragického, jindy s převahou granulocytů, často eozinofilních.
Výpotky u diabetiků
Pleurální výpotek může provázet vzácně se vyskytující komplikaci inzulinové léčby – inzulinový edém [14].
Mnohem častěji se však na tvorbě výpotků podílejí četné důsledky vlastního onemocnění diabetem. Tak např. při stejném stupni levostranné srdeční slabosti se pleurální výpotky vyskytují několikrát častěji u diabetiků [15]. Významnou roli zde zřejmě sehrává diabetická mikroangiopatie.
Výpotek při systémových autoimunitních onemocněních
Nejčastěji provází revmatoidní artritidu a systémový lupus erytematodes. Souvislost výpotku se základním onemocněním je podporována v prvém případě velmi nízkou hladinou glukózy, v druhém ev. přítomností diagnostických LE buněk.
Ostatní příčiny výpotků v interní praxi
Na základě literárních údajů a vlastních zkušeností uvádíme dále možnost pleurálního výpotku, často jako prvou manifestaci, u dosud nepoznaného myxedému, brániční hernie, subdiafragmatického abscesu, v rámci Dresslerova (po infarktu myokardu) a Meigsova (při benigním tumoru ovaria) syndromu, u Wegenerovy granulomatózy.
Blíže zde nerozvádíme příčiny hemotoraxu a chylotoraxu, které se objevují nejčastěji ve spojitosti s již známými malignitami nebo posttraumaticky, a většinou patří do kompetence onkologů a chirurgů.
Terapie pleurálních výpotků
Léčebné postupy závisejí na původu výpotku.
Transsudát provázející městnavé srdeční selhání se léčí ovlivněním základní kardiovaskulární choroby a diuretiky; je-li kardiální selhávání důsledkem dechové nedostatečnosti při některých plicních onemocněních, také dlouhodobou oxygenoterapií či podpůrnou ventilací.
Transsudáty nekardiální etiologie léčíme opět ovlivněním základní choroby a diuretiky.
Evakuační punkce a/nebo drenáž se provádí až při neúspěšnosti konzervativní léčby a/nebo v naléhavých situacích. K drenáži transsudátů, u kterých nehrozí pro nízký obsah bílkovin jejich ucpání, lze použít i tenkých katétrů [39]. V nejzazších případech lze i zde zvážit možnost pleurodézy (viz dále).
Parapneumonické výpotky se zpravidla daří sanovat spolu s původní příčinou antibiotiky a protizánětlivou léčbou.
Zvláštní skupinu tvoří zánětlivé výpotky opouzdřené, které sestávají z více kolekcí zánětlivé tekutiny, které jsou odděleny fibrinovými septy. Zde zpravidla není možno hrudní drenáží odstranit veškerou zánětlivou tekutinu [37]. Léčbou volby je lokální fibrinolytická léčba podáním nejčastěji streptokinázy (obvykle se podává v dávce 250 000 IU ve 40 ml FR, zpravidla 3krát, po aplikaci se drén uzavře na 4–6 hod.) [1,42]. Fibrinolytické účinky vedou k odstranění sept mezi jednotlivými kolekcemi tekutiny, která může být úspěšně odsáta, aniž vzniknou rozsáhlé, ventilaci plíce omezující pohrudniční srůsty. Při anamnéze předchozí léčby streptokinázou (embolizace, IM) je tato léčba relativně kontraindikována, ev. je nutno provést kožní test. V případě přetrvávání či progrese opouzdřené pleuritidy nebo již vytvořených rozsáhlých pleurálních adhezí přichází v úvahu chirurgická léčba tzv. dekortikace plíce – odstranění pachypleurální tkáně [45]. Tato vazivová masa nejenže brání plnému rozvíjení plíce a omezuje dýchací exkurze, ale často také obsahuje fokus perzistujícího pyogenního ložiska.
Empyém. V terapii se uplatňuje podávání antibiotik podaných podle výsledků aerobních i anaerobních kultivací a dále drenáž pohrudniční dutiny (silným drénem!) s odsáváním zánětlivé tekutiny a výplachy 0,025 % persterilem. Později rovněž fibrinolýza, ev. dekortikace plíce.
Nádorové pohrudniční výpotky patří k obrazu pokročilých nádorových onemocnění. Jejich léčení záleží na léčitelnosti nádorů, kterých jsou důsledkem. Chemosenzitivní nádory (malobuněčný karcinom plic, rakovina mléčné žlázy, hematologické malignity, nádory zárodečných žláz) jsou dobře léčitelné chemoterapií, podobně tak bývají senzitivní i výpotky, které je provázejí. U nádorů chemorezistentních (některé nemalobuněčné karcinomy plic, karcinom ledviny, maligní mezoteliom) se při neúspěchu celkové léčby provádí tzv. pleurodéza s cílem vytvoření aseptického zánětu pleury a následně plošných pleurálních adhezí, zamezujících tvorbě výpotku. Nejčastěji se aplikuje talek (asi 5 g sterilního prášku), a to buď zavedeným drénem, ev. chirurgicky z malé torakotomie či torakoskopicky [31,36]. Většinou méně účinnými alternativami talkové pleurodézy jsou mechanická abraze pleury, aplikace tetracyklinových antibiotik, krve a některých cytostatik (bleomycin, mepacrin), ev. cytokinů (IL-2).
Při rychlém doplňování výpotku je po selhání uvedených postupů na místě odsávací drenáž. Někdy je možné indikovat pleuroperitoneální shunt, kterým se tekutina z pohrudniční dutiny přelévá do dutiny břišní, odkud se resorbuje do systémového oběhu [33]. Tato paliativní léčebná metoda se provádí na odděleních hrudní chirurgie.
Hemotorax a chylotorax patří zpravidla do péče chirurgů.
Závěr
Pleurální výpotek je častým problémem interní medicínské praxe. Základem přístupu k pacientovi s pleurálním výpotkem je snaha o co nejexaktnější diagnózu jeho příčin(y), umožňující cílenou léčbu. Cestou k zjištění příčin(y) je, v kontextu aktuálního klinického stavu, především důsledná analýza pleurální tekutiny.
V řešení svízelných situací se uplatňují moderní metody zásahů do pleurální dutiny, poskytované v našich podmínkách nejčastěji na specializovaných pracovištích oboru TRN a hrudní chirurgie.
as. MUDr. Milan Teřl, Ph.D.
www.fnplzen.cz
e-mail: terl@fnplzen.cz
Doručeno do redakce: 17. 5. 2004
Přijato po recenzi: 7. 6. 2004
Sources
1. Albert RK, Spiro SG, Jett JR. Comprehensive Respiratory Medicine. Barcelona: Mosby 1999.
2. Baumgartner FJ, Rayhanabad J, Bongard FS et al. Central venous injuries of the subclavian-jugular and innominatecaval confluences. Tex Heart Inst J 1999; 26(3): 177–181.
3. Black LF. The pleural space and pleural fluid. Mayo Clin Proc 1972; 47(7): 493–506.
4. Bone RC, Dantzker DR, George RB et al. Pulmonary and Critical Care Medicine. St. Louis: Mosby 1997; 1–3 vol.
5. Broaddus VC, Wiener-Kronish JP, Staub NC. Clearence of lung edema into the pleural space of volume - loaded anesthetized sheep. J Appl Physiol 1990; 68(6): 2623–2630.
6. Burgess LJ, Maritz FJ, Taljaard JJ. Comparative Analysis of the Biochemical Parameters Used to Distinguish Between Pleural Transudates and Exudates. Chest 1995; 107(6): 1604–1609.
7. Cragun WH. Pleural Effusion Prediction Failures. Chest 2002; 122(5): 1505–1506.
8. Čihák R, Grim M. Anatomie 2. 2nd ed. Praha: Grada 2002.
9. Dutly F, Altwegg M. Whipple’s Disease and „Tropheryma whippelii.“ Clin Microbiol Rev 2001; 14(3): 561–583.
10. Ganong WF. Přehled lékařské fyziologie. Jinočany: H+H 1995.
11. Hegglin R. Diferenciální diagnostika vnitřních chorob. 11. ed. (1. ed–CZ). Praha: Avicenum 1972.
12. Hoefs JC. Serum protein concentration and portal pressure determine the ascitic fluid protein concentration in patients with chronic liver disease. J Lab Clin Med 1983; 102(2): 260–273.
13. Chakko SC, Caldwell SH, Sforza PP. Treatment of congestive heart failure. Its effect on pleural fluid chemistry. Chest 1989; 95(4): 798–802.
14. Chelliah A, Burge MR. Insulin edema in the twenty-first century: review of the existing literature. J Investig Med 2004; 52(5): 104–108.
15. Chertow BS, Kadzielawa R, Burger AJ. Benign pleural effusions in long-standing diabetes mellitus. Chest 1991; 99(5): 1108–1111.
16. Joseph J, Badrinath P, Basran GS et al. Is albumin gradient or fluid to serum albumin ratio better than the pleural fluid lactate dehydroginase in the diagnostic of separation of pleural effusion? BMC Pulm Med 2002; 2 : 1.
17. Joseph J, Badrinath P, Basran GS et al. Is the pleural fluid transsudate or exudate? A revisit of the diagnostic criteria. Thorax 2001; 56(11): 867–870.
18. Křepela K. Tuberkulóza dětí a dorostu a její diferenciální diagnostika. Praha: Maxdorf 1995.
19. Light RW, Macgregor MI, Luchsinger PC et al. Pleural effusions: the diagnostic separation of transudates and exudates. Ann Intern Med 1972; 77(4): 507–513.
20. Light RW. Pleural diseases. 3. ed. Baltimore: Williams and Wilkins 1995.
21. Loddenkemper R. Thoracoscopy – state of the art. Eur Respir J 1998; 11(1): 213–221.
22. Loddenkemper R, Fabel H, Konietzko N et al. Diagnostisches Vorgehen beim Pleuraerguss. Pneumologie 1994; 48 : 278–280.
23. Loddenkemper R. Klinische Untersuchungenvervahren beim Pleuraerguss. Atemw-Lungenkrkh 1991; 17 : 308–314.
24. Lopez M, Fleisher T, DeShazo RD. Use and Interpretation of Diagnostic Immunologic Laboratory Tests. JAMA 1999; 268(20): 2970–2990.
25. Marel M, Štastný B, Melínová L et al. Diagnosis of pleural effusions. Expirience with clinical studies, 1986 to 1990. Chest l995; 107(6): 1598–1603.
26. Matýšková M, Krahulcová E, Bulíková A at al. Pohrudniční výpotek při plazmacelulární leukemii. Vnitř Lék 1995; 41(7): 467–469.
27. Meisel S, Shamiss A, Thaler M et al. Pleural fluid to serum bilirubin concentration ratio for the separation of transudates and exudates. Chest 1990; 98(1): 141–144.
28. Miserocchi G. Physiology and pathofysiology of pleural fluid turnover. Eur Respir J 1997; 10(1): 219–225.
29. Namazi MR, Mowla A. Massive right–sided hemorrhagic pleural effusion due to pancreatitis; a case report. BMC Pulm Med 2004; 4(1): 1.
30. Nolte D. Manuale pneumologicum. Diesenhofen: Dustri–Verlag Dr. Karl Feistle 1992.
31. Pešek M et al. Bronchogenní karcinom. 1. ed. Praha: Galén 2002.
32. Pešek M, Šimeček C. Chemický zánět pohrudnice po methotrexatu podávaném v kombinaci s jinými cytostatiky. Stud Pneumol Phtiseol Cechosl 1985; 45(5): 371–373.
33. Petrou M, Kaplan D, Goldstraw P. The management of recurrent malignant pleural effusions: the complementary role of talc pleurodesis and pleuroperitoneal shunting. Cancer 1995; 75(3): 801–805.
34. Pettersson T, Froseth B, Riska H et al. Concentration of hyaluronic acid in pleural fluid as a diagnostic aid for mallignant mesothelioma. Chest 1988; 94(5): 320–324.
35. Pilinová A, Bohut V, Voslářová Z et al. Fluidothorax s převážnou lokalizací v interlobiu a subpulmonálně u nemocné s renální insuficiencí. Stud Pneumol Phtiseol Cechoslov 1987; 47(4): 242–245.
36. Rodriguez-Panadero F, Antony VB. Pleurodesis. State of the art. Eur Respir J 1997; 10(7): 1648–1654.
37. Sahn SA. Management of complicated parapneumonic effusions. Am Rev Respir Dis 1993; 48(3): 813–817.
38. Scheinin SA, Wells PR. Esophageal Perforation in a Sword Swallower. Tex Heart Inst J 2001; 28(1): 65 – 68.
39. Singh K, Loo S, Bellomo R. Pleural drainage using central venous catheters. Crit Care 2003; 7(6): 191 – 194.
40. Starck D. Vergleichende Anatomie der Wirbeltiere auf evolutionsbiologischer Grundlage. 3. ed. Berlin: Springer 1982.
41. Stites DP, Terr AI. Základní a klinická imunologie. Praha: Victoria 1994.
42. Taylor RFM, Rubens MB, Pearson MC et al. Intrapleural streptokinase in the management of empyema. Thorax 1994; 49 : 856–859.
43. Valdés L, Pose A, Suarez J et al. Cholesterol: a useful parameter for distinguishing between pleural exudates and transudates. Chest 1991; 99(5): 1097–1102.
44. Wiener-Kronish JP, Matthay MA, Callen PW et al. Relationship of pleural effusions to pulmonary hemodynamics in patients with congestive heart failure. Am Rev Respir Dis 1985; 132(6): 1253–1256.
45. Zatloukal P, Fiala P, Votruba J et al. Pneumologie. 1. ed. Praha: Karolinum/ Galén 2001.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2005 Issue 4-
All articles in this issue
- Vliv kombinovaného aerobního tréninku na změny autonomní modulace u nemocných po akutním infarktu myokardu
- Pleurální výpotek v interní praxi
- Molekulární patofyziologie pozdních komplikací diabetes mellitus – genetická predispozice k rozvoji diabetických komplikací
- Transplantace kmenových buněk v kardiologii
- Aortální stenóza, skleróza a ateroskleróza
- Je hyperhomocysteinemie stále jen zajímavý, ale diagnosticky nevýznamný nález?
- Jaké jsou znalosti našich lékařů o rizikových faktorech ischemické choroby srdeční? Porovnání se stavem v roce 1991
- Epidemiologická analýza pacientů podstupujících trvalou kardiostimulaci na Interní kardiologické klinice Fakultní nemocnice Brno, pracoviště Bohunice
- Klinický význam mírně zvýšených hodnot α−fetoproteinu v séru u pacientů s chronickou hepatitidou C a B
- Rehabilitace po infarktu myokardu a revaskularizaci u starších nemocných
- Neobvyklý způsob neinvazivní objektivizace ischemie myokardu chladovou zátěží
- Vyučování etiky na lékařské fakultě: cesta od deskriptivní etiky k mravním normám
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Klinický význam mírně zvýšených hodnot α−fetoproteinu v séru u pacientů s chronickou hepatitidou C a B
- Pleurální výpotek v interní praxi
- Aortální stenóza, skleróza a ateroskleróza
- Je hyperhomocysteinemie stále jen zajímavý, ale diagnosticky nevýznamný nález?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

