-
Medical journals
- Career
Efekt a tolerancia kombinovanej liečby fludarabinom s cyklofosfamidom u chorých s chronickou lymfocytovou leukémiou
Authors: E. Tóthová; A. Kafková; T. Guman; M. Fričová; N. Štecová; E. Švorcová; M. Hlebašková
Authors‘ workplace: Klinika hematológie a onkohematológie Lekárskej fakulty UPJŠ a FNsP, Košice, Slovenská republika, prednosta prof. MUDr. Elena Tóthová, CSc.
Published in: Vnitř Lék 2005; 51(1): 31-35
Category: Original Contributions
Overview
Úvod:
Kombinovanou liečbou fludarabinom s cyklofosfamidom (FLU-CY) môžeme dosiahnuť vyšší počet kompletných remisií, pokles minimálnej reziduálnej choroby, a tak aj pravdepodobnosť dlhšieho prežívania chorých s chronickou lymfocytovou leukémiou (B-CLL). Cieľom našej práce bolo vyhodnotenie efektu tejto kombinovanej liečby a posúdenie jej toxicity u chorých s predtým neliečenou B-CLL.Materiál a metódy:
Od mája roku 1999 do decembra roku 2003 dostalo FLU-CY liečbu 57 pacientov s pokročilou B-CLL. FLU sme podávali v dennej dávke 30 mg/m2 3 dni po sebe a cyklofosfamid v dávke 300 mg/m2 takisto v 3 po sebe nasledujúcich dňoch. Cykly intravenóznej chemoterapie (CHT) sme opakovali každých 28 dní, iba v prípade výraznej myelosupresie bol interval medzi cyklami CH dlhší. Odpoveď na liečbu a toxicitu chemoterapie sme hodnotili podľa NCI-WG (National Cancer Institute – Sponsored Working Group) kritérií. Minimálna reziduálna choroba bola detekovaná imunofenotypovým vyšetrením u chorých s dosiahnutou kompletnou remisiou (CR).Výsledky:
Odpoveď na liečbu sme dosiahli u 86 % chorých (95 % CI 80,6–94,7), a kompletnú remisiu sme potvrdili u 39 % chorých. V čase analýzy bolo ešte stále 18/22 pacientov v kompletnej remisii. Medián sledovania bol 19 (rozpätie 8–36) mesiacov. Reziduálna choroba pretrvávala u 4 pacientov s CR. Liečba bola sprevádzaná myelosupresiou, III. a IV. stupeň trombocytopénie bol u 3 (5,2 %) pacientov a neutropénia stupeň III/IV u 6 chorých (10,5 %). Ťažké infekcie sprevádzali liečbu v 24,0 %, dvaja pacienti (3,5 %) zomreli, 1 na pseudomonádovú sepsu a 1 na progresiu CLL.Záver:
Kombinovanú liečbu fludarabinom s cyklofosfamidom považujeme za vysoko efektívnu u predtým neliečenej B-CLL v porovnaní s konvenčnou liečbou alebo s monoterapiou s fludarabinom.Kľúčové slová:
chronická lymfocytová leukémia – fludarabin – cyklofosfamid – remisia – toxicitaÚvod
Purínové analógy (PA) – fludarabin monofosfát (FLU), cladribin (2-CDA) a 2’deoxycoformycin (DCF) – reprezentujú skupinu cytotoxických liekov, ktoré majú pozoruhodne vysokú účinnosť v liečbe nízkomalígnych lymfoproliferatívnych ochorení [12, 21,23]. V liečbe chronickej lymfocytovej leukémie (B-CLL) sa z nich najčastejšie uplatňuje fludarabin monofosfát (FLU). Ako uvádzajú klinické štúdie fázy II u predliečených chorých s B-CLL, kde sa FLU podávala ako záchranná terapia, bola dosiahnutá celková liečebná odpoveď od 12 do 57 % a percento kompletnej remisie od 0–29 %. Medián prežívania u pacientov, ktorí odpovedali na liečbu bol 29 mesiacov, u refraktérnych 9 mesiacov [3,5,12,21]. U chorých predtým neliečených bolo dosiahnutých liečbou FLU až 80 % celkových odpovedí s podielom kompletnej remisie od 25 do 60 % [1,2,3, 7,18]. Lepšie výsledky sa očakávajú od kombinácie FLU s alkylačnými látkami. Kombinovaná liečba FLU s cyklofosfamidom (CY) môže zvýšiť percento kompletných remisií (CR), minimalizovať reziduálnu chorobu (MRD) a je predpoklad aj dlhšieho prežívania chorých s B-CLL [10,13,15,23].
Cieľom našej práce bolo vyhodnotiť efekt a toxicitu kombinovanej liečby fludarabinu s cyklofosfamidom v tzv. FLU-CY režime u pacientov s doposiaľ neliečenou B-CLL.
Pacienti a metódy
Pacienti
V období od mája roku 1999 do októbra roku 2003 bolo zaradených do štúdie 57 chorých. Charakteristiky pacientov uvádzame v tabuľke 1. Všetci chorí spĺňali diagnostické kritériá B-CLL podľa NCI-WG (National Cancer Institute – Sponsored Working Group). Klinické štádium sme určovali podľa Raiovej klasifikácie vždy pred zaradením do liečby [17]. Dvadsaťpäť chorých bolo v klinickom štádiu I a II a 32 chorých štádiu III a IV (Rai). Pacienti, ktorí boli v štádiu I, boli zaradení do liečby až po dôkaze aktívneho ochorenia (zdvojovací čas lymfocytov, CD 38 expresia, chromozómové abnormality, difúzna infiltrácia kostnej drene), masívnej splenomegálie, bulky lymfadenopatie, rekurentných infekcií, poklesu hmotnosti > 10 % počas 6 mesiacov, alebo febrilít súvisiacich s CLL. Tí chorí, ktorí mali performance status 3 alebo 4 podľa WHO, alebo aktívnu infekciu, boli zo štúdie vylúčení. Imunofenotypovým vyšetrením boli všetci chorí CD5, CD19, CD20 a CD23 pozitívni s dokázanou monoklonalitou povrchového membránového receptora pre ľahké reťazce. Pozitivitu CD 38 malo 71 % chorých v štádiu I, 39 % chorých v štádiu II, 42 % chorých v štádiu III a 61 % chorých v IV. štádiu (Rai). 38 % chorých malo dokázanú nepriaznivú cytogenetiku.
Table 1. Charakteristika súboru chorých. 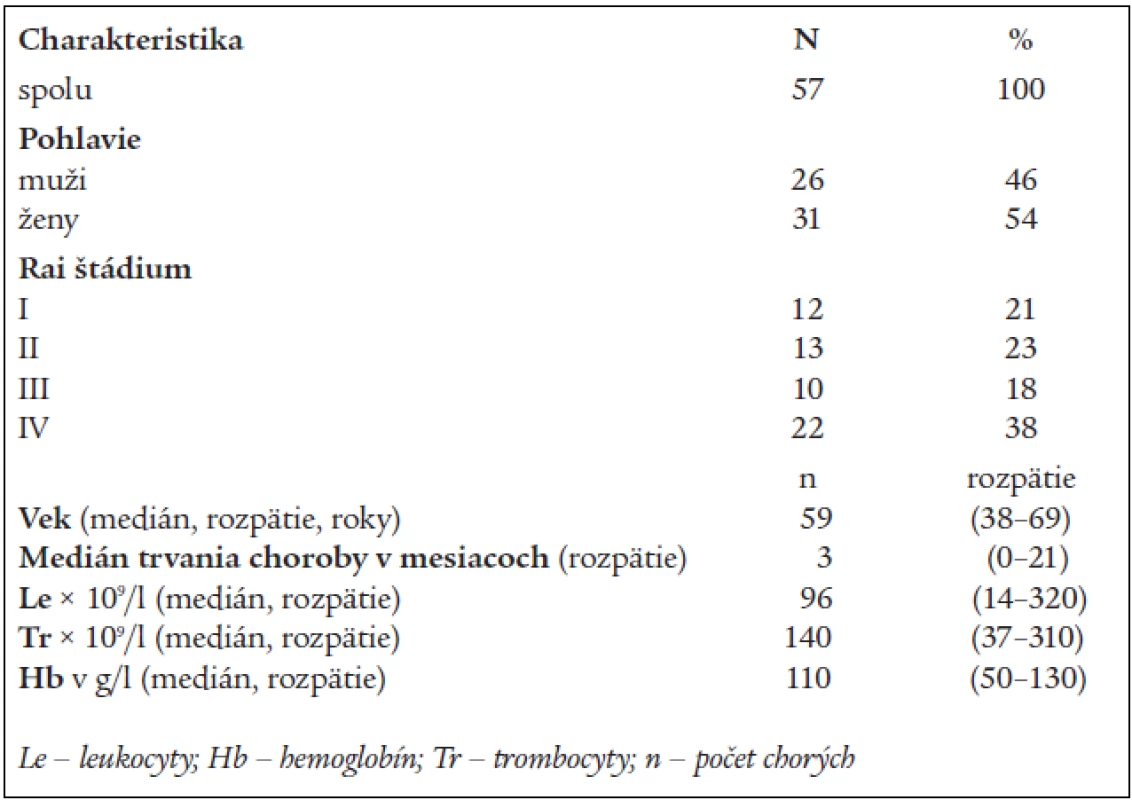
Liečebný postup
Kombinácia cytostatického režimu (FLU-CY) pozostávala z aplikácie FLU v dennej dávke 30 mg/m2 v 2-hodinovej intravenóznej infúzii 3 dni po sebe a z CY v dennej dávke 300 mg/m2 v intravenóznej infúzii aplikovanej takisto v 3 po sebe nasledujúcich dňoch. Cykly chemoterapie sme opakovali každých 28 dní. U pacientov s hematologickou toxicitou (trombocytopénia < 50 × 109/l a/alebo neutropénia 1 × 109/l), alebo pri vzniku ťažkej infekcie sme podávali cytostatiká v intervale dlhšom ako 28 dní, v rozpätí od 2 do 3 mesiacov, až do vyhovujúcej úpravy hematologických parametrov. Pacienti boli liečení až do dosiahnutia maximálnej odpovede alebo toxicity, ktorá ďalšiu aplikáciu FLU-CY liečby nedovoľovala. Ak sme po 3 cykloch chemoterapie nedosiahli ani parciálnu remisiu choroby, alebo sme zaznamenali progresiu ochorenia, liečbu sme predčasne ukončili. Erytrocyty sme podávali chorým pri symptomatickej anémii, alebo profylakticky, ak hladina hemoglobínu poklesla na 75 g/l. Koncentráty trombocytov (Tr) boli pacientom administrované profylakticky vždy pri poklese Tr na < 20 × 109/l. Všetky krvné produkty boli ožiarené. S cieľom prevencie hyperurikémie dostávali chorí alopurinol (300 mg denne). Nepodávali sme profylakticky antibiotiká, virostatiká, hemopoetické rastové faktory (G-CSF) alebo antiemetiká. G-CSF bol podávaný iba vtedy, ak mal pacient aktívnu infekciu a pri poklese granulocytov pod 1 × 109/l.
Kritéria odpovede na liečbu
Odpoveď na liečbu sme hodnotili podľa kritérií NCI Working Group pre CLL [4,5]. Za kompletnú remisiu (CR) sme považovali chýbanie symtómov, organomegálie a úpravu hematologických parametrov (počet granulocytov > 1,5 × 109/l; trombocytov > 100 × 109/l; hemoglobínu > 110 g/l), normálnu celularitu kostnej drene (KD) s počtom lymfocytov < 30 %. Biopsiu KD sme robili 2 mesiace po dôkaze klinickej CR. Bioptická vzorka, podobne aj aspirát z KD musela byť normocelulárna s < 30 % lymfocytov, s chýbaním lymfoidných nodulov. Ak pacient spĺňal kritériá CR, ale v bioptickej vzorke z KD perzistovali lymfoidné noduly, bol klasifikovaný ako nodulárna parciálna odpoveď (nPR). Za parciálnu remisiu (PR) sme považovali ≥ 50% ústup zväčšených lymfatických uzlín, sleziny, pečene ako aj zmeny v periférnej krvi (PK), ktoré nezodpovedali CR. Pacienti, ktorí nedosiahli kritériá CR, nPR alebo PR, boli klasifikovaní jako nonresponderi (NR).
Vyhodnotenie minimálnej reziduálnej odpovede (MRD)
MRD sme hodnotili u chorých s dosiahnutou CR a to imunofenotypovým vyšetrením PK a KD pomocou flowcytometrie, dual color technikou [19,21,22].
MRD bola definovaná ako koexpresia CD5/CD19 na B-lymfocytoch spolu s dôkazom monoklonality povrchových ľahkých reťazcov na CD5 pozitívnych B-lymfocytoch. Za fenotypovú CR sme považovali nález < 10 % celkovej lymfocytovej populácie s koexpresiou CD5/CD19 s monotypovou prítomnosťou ľahkých reťazcov. Pomer kappa : lambda alebo lambda : kappa > 3 : 1 sme považovali za monotypovú expresiu ľahkých reťazcov [23].
Štatistická analýza
Vzorky boli hodnotené použitím štatistickej významnosti na hladine alfa = 0,05. Za štatisticky signifikantné sme považovali zvýšenie počtu CR od 20 % po FLU ako primoterapii do 45 % po FLU-CY režime. Významnosť rozdielov bola hodnotená pomocou Mann-Whitney testu [5,6]. Analýza rozdielov v % pacientovej odpovede bola vyhodnotená χ2 testom. Interval pre pravdepodobnosť odpovede (95 %) bol určovaný metódou podľa Duffy a Satner [6]. Doba ochorenia bez progresie (PFS) a krivky celkového prežívania (OS) boli vyhodnotené metódou Kaplana a Meiera [12] a porovnané medzi skupinou responderov log-rank testom. PFS bola udaná ako čas od dosiahnutia CR alebo PR po FLU-CY liečbe až do relapsu ochorenia. Celkové prežívanie (OS) bolo merané od 1. dňa liečby po úmrtie pacienta, alebo po deň, kedy sme hodnotili výsledky liečby.
Výsledky
V súbore 57 chorých s B-CLL bolo 26 mužov a 31 žien. Medián doby od diagnózy po liečbu bol 3 mesiace (rozpätie 0–12 mesiacov).
Odpoveď na liečbu
Celkové sme podali 253 cyklov kombinovanej chemoterapie (CHT). Každý z hodnotených pacientov dostal najmenej 2 cykly CHT. Medián FLU-CY cyklov bol 4 (rozpätie 2–6). Výsledky liečby sú prezentované v tabuľke 2.
Table 2. Výsledky liečby pacientov s B-CLL kombináciou FLU-CY. 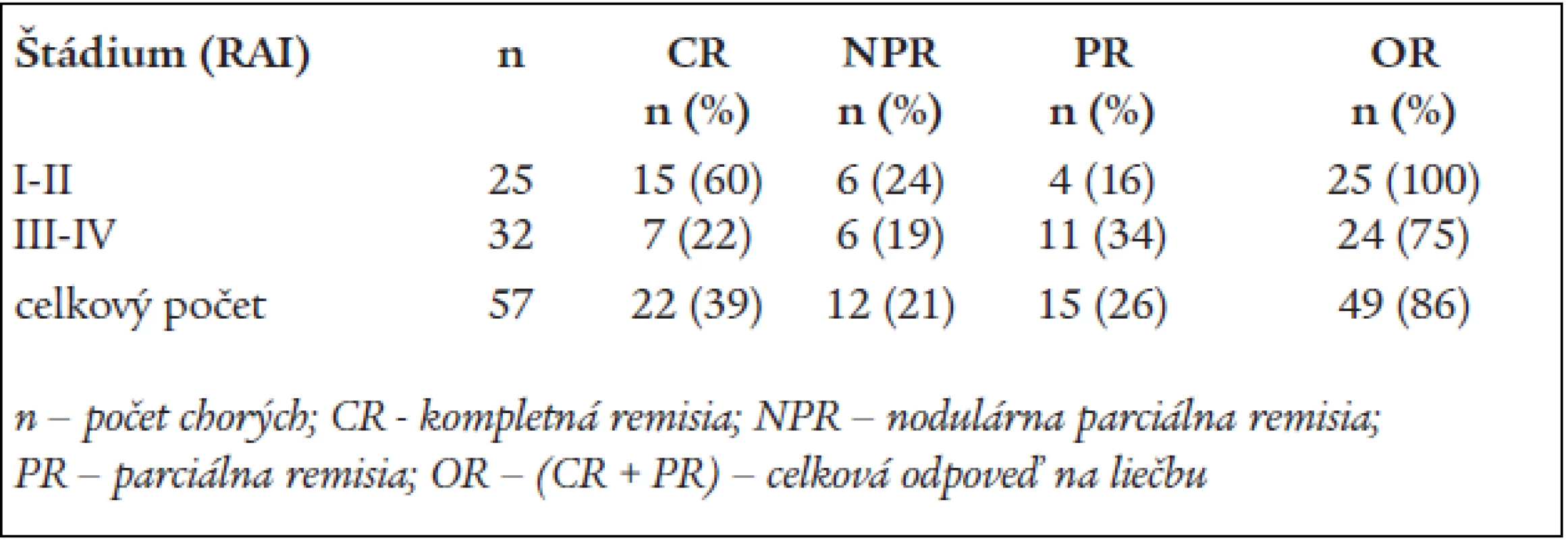
Celkovú odpoveď na liečbu (OR) sme dosiahli u 49 chorých (86 %). Kritériá CR splnilo 22 chorých (39 %) (95 % CI 19,2–39,1 %), 8 chorí po FLU-CY nedosiahli žiadnu odpoveď a boli hodnotení ako nonresponderi. Kompletnú remisiu sme dosiahli u 2/3 pacientov (60 %) v štádiu I a II (Rai), menej odpovedali chorí v štádiách III a IV (21,8 %; p = 0,6). Celkový počet remisií v skupinách bol 100 % a 75 % (p = 0,05). Väčšina CR bola pozorovaná po mediáne 4 cyklov chemoterapie (rozpätie 3–6). V čase analýzy bolo 18/22 (82 %) chorých ešte stále v CR. Medián trvania CR bol 19 mesiacov (rozpätie 8–36). Medián PFS nebol ešte dosiahnutý. Štatistický významný rozdiel bol v mediáne prežívania medzi pacientami s odpoveďou na liečbu a nonrespondermi (29 a 9 mesiacov; p < 0,01). Imunofenotypové zhodnotenie v PK a KD bolo urobené u 22 pacientov s CR. MRD bola dokázaná iba u 4 chorých.
Toxicita
Toxicita FLU-CY liečby je vyhodnotená v tabuľke 3 a 4. Najčastejšie zaznamenaným vedľajším účinkom CHT bola myelosupresia. FLU-CY režim spôsobil neutropéniu u 18 (31,5 %) pacientov, avšak stupeň toxicity 3 a 4 bol pozorovaný iba u 6 pacientov (10,5 %). Iba v piatich cykloch z 253 cyklov sme použili ako podpornú liečbu G-CSF. Trombocytopénia sa vyskytla u 8 chorých (14 %) v 19 cykloch liečby u 3 pacientov sme aplikovali trombocytové koncentráty. V 1 prípade sme zaznamenali (po 3. cykle CHT) autoimúnnu hemolytickú anémiu. Nehematologická toxicita pozostáva predovšetkým z infekcií (24 %). Pneumóniu sme potvrdili u 5 pacientov (8,7 %), reaktiváciu herpes zoster u 2 pacientov, a u 2 pacientov bolo zvracanie 3. a 4. stupňa podľa WHO a bola podaná antiemetická liečba. Horúčku nejasnej genézy (FUO) mali 3 pacienti (5,3 %). Oportúnne infekcie sme v našom súbore nezaznamenali. Dvaja pacienti (3,5 %) zomreli 2 a 8 mesiacov od začiatku FLU-CY liečby. Z nich 1 na pseudomonádovú sepsu a u 1 pacienta sme zaznamenali progresiu ochorenia.
Table 3. Hematologická toxicita FLU-CY terapie u chorých s B-CLL. 
Table 4. Nehematologická toxicita FLU-CY liečby u 57 pacientov s B-CLL. 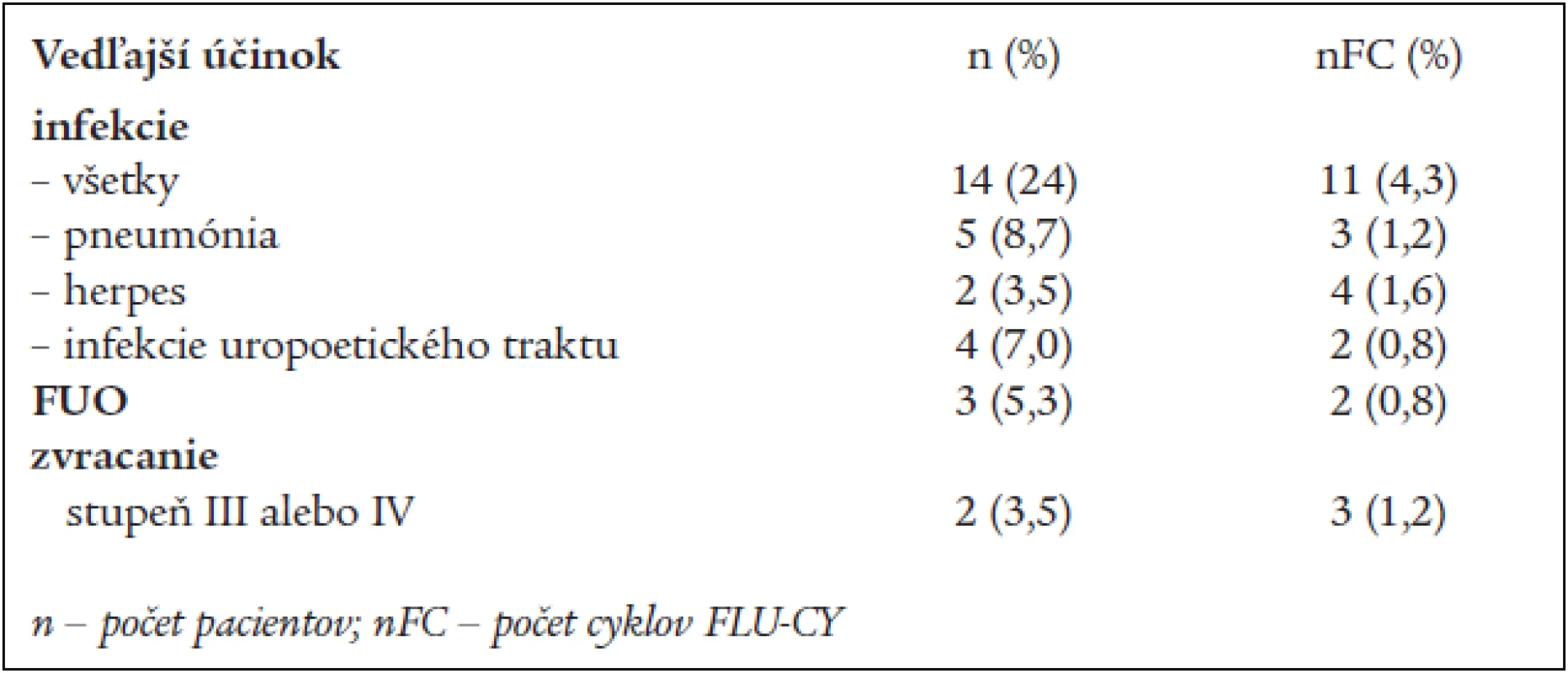
Diskusia
Fludarabin ako nádejný PA sa začal uplatňovať v protinádorovej liečbe od začiatku 90. rokov 20. storočia. Tento purínový analóg sa častejšie presadzuje v liečbe nízkomalígnych lymfoproliferatívnych ochorení (včítane B-CLL) vďaka svojej selektívnej aktivite k lymfoidným bunkám a schopnosti indukovať apoptózu [7,14]. Výsledky publikovaných randomizovaných štúdií ukazujú, že liečení s FLU dosahujú vyšší počet remisií ako aj dlhšie prežívanie, v porovnaní s konvenčnou liečbou [7,8,9,18]. Podľa dlhodobej analýzy publikovanej Keatingom a spol. [12] je výrazne vyjadrená závislosť liečebnej odpovede a celkovej doby prežívania od množstva predošlej CHT, odpovede na alkylačné látky a štádia ochorenia [21]. S cieľom dosiahnutia lepších výsledkov sa začali používať v liečbe CLL kombinácie s fludarabinom. Pridanie prednisonu do liečby s FLU ukázalo na dobrú terapeutickú účinnosť, avšak percento kompletných remisií ako aj OS sa neodlišuje od výsledkov dosiahnutých monoterapiou s FLU. Navyše bol zaznamenaný vyšší výskyt oportúnnych infekcií, zvlášť listerových a pneumocystových [12,18,23]. Rovnako kombinácia s chlorambucilom neviedla k zlepšeniu liečebných výsledkov [24]. V literatúre je málo prác, ktoré sa venujú kombinovanej liečbe FLU s cyklofosfamidom u neliečenej B-CLL [9,11,21]. Podobne ako O’Brien a spol. [15] a Flinn a spol. [8], aj v našom súbore sme dosiahli uvedenou kombináciou vysoké percento celkových odpovedí na liečbu, zvlášť u chorých s včasnejšími štádiami ochorenia. Mechanizmus pôsobenia FLU určuje jeho hlavný metabolit – F-Ara-ATP. Tento metabolit po inkorporácii do vznikajúcich reťazcov DNA bráni zahájeniu „primingu“ syntézy DNA a elongácii DNA reťazca. Uvedený metabolit je aj potentným inhibítorom opravy DNA. Inkorporácia aktívneho 5-trifosfátu fludarabinu do RNA vedie k ukončeniu jej syntézy, čo spolu s tvorbou oligonukletidových fragmentov prispieva k apoptóze buniek.
Tieto mechanizmy môžu byť vysvetlením efektu FLU práve u CLL, kde väčšina neoplastickej populácie aktívne neproliferuje a nereplikuje DNA [14,16,23].
Záver
Kombinovaná liečba fludarabinu s cyklofosfamidom je odrazom synergizmu oboch cytostatík (FLU + CY) v toxicite na lymfocyt. Výsledky tejto kombinovanej liečby u B-CLL sú lepšie ako bolo pozorované po konvenčnej liečbe alebo po monoterapii s fludarabinom.
Vývoj monoklonových protilátok s aktivitou oproti antigénom na povrchu CLL buniek (Rituximab, Alemtuzumab) otvoril významnú cestu chemoimunoterapii [20]. Výsledky prvých klinických štúdií kombinácie FLU-CY s pridaním monoklonovej protilátky anti-CD20 (95 % celkových odpovedí na liečbu s podielom 69 % kompletných remisií) u predtým neliečených chorých s B-CLL to dokazujú.
Sources
1. Anaissie EJ, Konotoyiannis DP, O’Brien S et al. Infections in patients with chronic lymphocytic leukemia treated with fludarabine. Ann Intern Med 1998; 129 : 559–556.
2. Bellosillo B, Villamor N, Colomer D. In vitro evaluation of fludarabine in combination with cyclophosphamide and/or mitoxantrone in B-cell chronic lymphocytic leukemia. Blood 1999; 94 : 2836–2843.
3. Brugiatelli M, Claisse JF, Lenormand B et al. Long term clinical outcome of B-cell chronic lymphocytic leukemia patients in clinical remission phase evaluated at phenotypic level. Br J Haematol 1997; 97 : 113–118.
4. Cheson BD, Benet JM, Rai KR. Guidelines for clinical protocols for chronic lymphocytic leukemia: Recommendation of the National Cancer Institute-Sponsored Working Group. Am J Hematol 1989; 29 : 152–163.
5. Cheson BD, Benett JM, Grever M et al. National Cancer Institute-Sponsored Working Group Guidelines for chronic lymphocytic leukemia: Revised guidelines for diagnosis and treatment. Blood 1996; 87 : 4990–4997.
6. Duffy DR, Santner TJ. Confidencie intervals for binomial parameter based on multistage tests. Biometrics 1987;47 : 81–93.
7. Esteve J, Villamor A, Colomer D. Stem cell transplantation for chronic lymphocytic leukemia: Different outcome after autologous and disease status. Leukemia 2002; 15 : 441–445.
8. Flinn W, Byrd J, Morrison C et al. Fludarabine and cyclophosphamide with filgrastim support in patients with previously untreated indolent lymhoid malignancies. Blood 2000; 96 : 71–75.
9. Frewin R, Turner D, Tighe M. Combination therapy with fludarabine and cyclophosphamide as salvage treatment in lymphoproliferative disorders. Br J Haematol 1999; 104 : 612–613.
10. Hallek M, Schmitt B, Wilhelm M. Fludarabine plus cyclophosphamide is an efficient treatment for advanced chronic lymphocytic leukemia (CLL): Results of a Phase II study of the German CLL Study Group. Br J Haematol 2001;114 : 342–348.
11. Johnston JB, Verburg L, Shore T et al. Combination therapy with nucleoside analogs and alkylating agents. Leukemia 1994; 8 (suppl. 1): 104–143.
12. Leporrier M, Chevret S, Carin B et al. Randomized comparison of fludarabine, CAP, and CHOP in 938 previously untreated stage B and C chronic lymphocytic leukemia patients. Blood 2001; 98 : 2319–2325.
13. Marota G, Bigazzi C, Lenoci M et al. Low-dose fludrarabine and cyclophosphamide in elderly patients with B-cell chronic lymphocytic leukemia refractory to conventional therapy. Hematologia 2000; 85 : 1268–1270.
14. Morrison VA, Rai KR, Peterson BL et al. Impact of therapy with chlorambucil, fludarabine or fludarabine plus chlorambucil on infections in patients with chronic lymphocytic leukemia: Intergroup Study Cancer and Leukemia Group B 9011. J Clin Oncol 2001; 19 : 3611–3621.
15. O’Brien SM, Kantarjian HM, Cortes J et al. Results of fludarabine and cyclophosphamide combination regimen in chronic lymphocytic leukemia. J Clin Oncol 2001; 19 : 1414–1420.
16. Plunkert W. Fludarabine: Pharmacokinetics, mechanism of action, and rationales for combination therapies. Semin Oncol 1993; 20 : 2–12.
17. Rai KR, Berledis BS, Peterson BL et al. Fludarabine compared with chlorambucil as primary therapy for chronic lymphocytic leuekmia. A Engl J Med 2000; 343 : 1750–1757.
18. Robak T, Kasznicki M. Alkylating agents and nucleoside analogues in the treatment of B-cell chronic lymhocytic leukemia. Leukemia 2002; 16 : 1015-1017.
19. Robak T, Blondski JZ, Kasznicki M et al. Cladribine combined with cyclophosphamide is highly effective in the treatment of chronic lymphocytic leukemia. Hematology J 2002; 3 : 244–250.
20. Rosenwald A, Alizadeh AA, Widhopk G et al. Relation of gene expression phenotype to immunoglobulin mutation genotype in B cell chronic lymphocytic leukemia. J Exp Med 2001; 194 : 1639–1647.
21. Tothova E, Kafkova A, Fricova M et al. Fludarabine combined with cyclophosphamid is highly effective in the treatment of chronic lymphocytic leukemia. Neoplasma 2003; 50 (6): 433–437.
22. Van Den Neste E, Loviaux I, Michalux JL et al. Phase I/II study of 2-chloro-2’ - -deoxyadenosine with cyclophosphamide in patients with pretreated B-cell chronic lymphocytic leukemia and indolent non -
Hodgkin’s lymphoma. Leukemia 2000; 14 : 1136–1142.
23. Vášová I, Penka M, Hájek R et al. Nová
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2005 Issue 1-
All articles in this issue
- Odkaz sira Williama Oslera
- Myelodysplastický syndrom v novém tisíciletí. Jak klasifikovat a jak léčit nemocné?
- Efekt a tolerancia kombinovanej liečby fludarabinom s cyklofosfamidom u chorých s chronickou lymfocytovou leukémiou
- Naše zkušenosti s novou organizací péče o nemocné s akutním krvácením do horní části trávicího traktu
- Silový trénink u nemocných po akutním infarktu myokardu se sníženou ejekční frakcí levé komory srdeční
- Úvod do problematiky metabolického syndromu
- Metabolický syndrom a sympatický nervový systém: je obstrukční spánková apnoe klíčem k pochopení?
- Diabetes mellitus a metabolický syndrom
- Hypertenze jako součást metabolického syndromu
- Obezita a metabolický syndrom
- Dyslipidemie u metabolického syndromu
- Hypertenze a hyperurikemie
- Role pohybové léčby a tělesné zdatnosti v prevenci a léčbě metabolického syndromu
- Akutní infarkt myokardu u pacienta s anamnézou infekční endokarditidy
- Extramedulární plazmocytom štítné žlázy - vzácná příčina solitární uzlové strumy s hypertyreózou
- Jaterní postižení při deficitu alfa−1−antitrypsinu
- Akutní myokarditida manifestující se obrazem transmurálního infarktu myokardu provázená akutním renálním selháním
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Jaterní postižení při deficitu alfa−1−antitrypsinu
- Myelodysplastický syndrom v novém tisíciletí. Jak klasifikovat a jak léčit nemocné?
- Hypertenze a hyperurikemie
- Extramedulární plazmocytom štítné žlázy - vzácná příčina solitární uzlové strumy s hypertyreózou
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

