-
Medical journals
- Career
Nanočástice stříbra připravené zelenou syntézou a synergický účinek s antibiotikem jako základ nanokonstruktu pro léčbu bakteriálních infekcí
Authors: M. Čížek 1,3; K. Sehnal 1,3,4; M. Dočekalová 3,4; M. Staňková 3,4; M. Gargulák 1,3; B. Hosnedlová 3,4; B. Ruttkay-Nedecký 1,4; R. Kizek 1,2,3,4
Authors‘ workplace: Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta, Ústav humánní farmakologie a toxikologie , Přednosta: Doc. MVDr. Pavel Suchý, Ph. D. 1; Wroclaw Medical University, Wroclaw, Polsko, Ústav biomedicínských a environmentálních analýz , Přednosta: prof. Dr. hab. Halina Milnerowicz, MD, Ph. D. 2; Prevention Medicals, s. r. o., Oddělení výzkumu a vývoje, Vedoucí: Ing. Miroslav Dosoudil 3; Mendelova univerzita v Brně, Zahradnická fakulta, Ústav vinohradnictví a vinařství, Vedoucí: doc. Ing. Mojmír Baroň, Ph. D. 4
Published in: Prakt. Lék. 2019; 99(4): 154-159
Category: Of different specialties
Overview
Cíl: Cílem projektu je navrhnout a ověřit nanokonstrukt jako inovativní nástroj pro efektivní zacílení na bakteriální buňku.
Metodika: Konstrukt SPIONs/Au/NPs/AB1/GF/AgNPsGS/APO/ATB je tvořen: A – stříbrná nanočástice, která byla připravena zelenou syntézou z rostlinných extraktů (AgNPsGS); B – apoferitin (APO) s enkapsulovaným antibiotikem (ATB); C – superparamagnetická zlatá nanočástice modifikovaná grafenovým listem a protilátkou (SPIONs/Au/NPs/AB1/GF).
Výsledky: Nejlepší antibakteriální efekt k S. aureus byl pozorován u AgNPsGS4 (Thymus serpyllum): 0,4 µg/ml. Efektivita enkapsulace antibiotika do nanometrické struktury apoferitinu byla okolo 15 % aplikované koncentrace. V přítomnosti nanokonstruktu byla zaznamenána dramatická inhibice S. aureus. Biologický efekt nanotransportérů spočívá ve dvou hlavních mechanismech. AgNPsGS indukují vznik reaktivních kyslíkových radikálů (ROS reactive oxygen species), což následně vede k poškození buněčné membrány bakteriální buňky a k destrukci prokaryotické nukleové kyseliny. Kromě efektu AgNPsGS se uplatňuje i účinek enkapsulovaného ATB, který se podílí na léčbě bakteriální infekce a který lze vhodně zvolit podle typu infekčního onemocnění. Dále svou roli také sehrává významný synergický efekt AgNPsGS a ATB.
Závěr: Díky inovativnímu a funkčnímu spojení účinku AgNPsGS a ATB dochází ke vzniku jedinečného terapeutického nanosystému pro cílenou terapii vážných bakteriálních infekcí.
Klíčová slova:
apoferitin – antibiotiká – nanokonstrukt – bakteriální inhibice – AgNPs – zelená syntéza
ÚVOD
Efektivita boje proti bakteriálním infekčním onemocněním se v důsledku fenoménu bakteriální rezistence na používaná antibiotika a antibakteriální chemoterapeutika každým rokem snižuje. Hlavním problémem je jejich značná spotřeba především v zemědělství u hospodářských zvířat, ale i v humánní medicíně. Jen v České republice bylo v roce 2010 spotřebováno téměř 70 tun antibiotik a antibakteriálních chemoterapeutik.
Novou a inovativní možností v boji s rezistentními patogeny je využití nanomateriálů s antibakteriálním efektem. Nanotechnologický přístup je významnou strategií pro získání nových nástrojů a postupů pro překonání bakteriální infekce i rezistence. Hledají se také nové látky, jež vykazují výrazné antibakteriální vlastnosti. V současnosti se vychází především z vývoje nových typů syntetických struktur, z možnosti použití nově objevených sloučenin, z využití biologických agens (jako jsou viry) a antibakteriálních peptidů a nanočástic.
Zelená syntéza snižuje spotřebu chemikálií, zlepšuje biodostupnost částic, usnadňuje modifikaci povrchu nanočástic a také výrazně zvyšuje jejich efekty na cílové bakteriální buňky. Za účelem dalšího zlepšení vlastností AgNPs se přistupuje k zelené syntéze nanočástic využívající zejména vnášení biologických molekul ze živých organismů. V celé řadě studií byly prokázány významné antibakteriální efekty AgNPs. Úprava a modifikace povrchu AgNPs přináší další výrazné zlepšení jejich antibakteriální aktivity. V našem konceptu přicházíme s využitím modifikovaných zlatých nanočástic (C) a stříbrných nanočástic získaných zelenou syntézou (A) v kombinaci s vhodně zvoleným konvenčním antibiotikem uzavřeným v nanoproteinovém transportéru (B). Protein apoferitin je znám svou schopností samoorganizace v závislosti na změně pH. Této význačné vlastnosti bylo využito pro zhotovení nanokonstruktu. Dutina apoferitinu má velikost řádově několik nanometrů, a proto zde mohou být nízkomolekulární sloučeniny uzavřeny v nezanedbatelných koncentracích. Jako modelová struktura pro enkapsulaci antibiotika byl vybrán doxorubicin. Cílem této práce je ukázat nové trendy v personalizované medicíně využívající nástrojů molekulární biologie a nanotechnologií.
METODIKA
Chemikálie
Všechny chemikálie byly zakoupeny v Merck KGaA (Darmstadt, Německo) v analytické kvalitě. Pro přípravu extraktů zelenou syntézou byly sbírány rostliny v botanické zahradě FaF VFU Brno.
Přístroje a měření
U všech připravených stříbrných nanočástic bylo změřeno spektrum na přístroji UV-3100PC Spectrophotometer (VWR, USA). Velikost částic a ζ-potenciál byly určeny pomocí analyzátoru dynamického rozptylu světla Malvern Zetasizer (Nano ZS, Malvern Instruments Ltd., Velká Británie). Fluorescenční spektra byla získána na multifunkčním fluorimetru Tecan Infinite F50 (Tecan, Švýcarsko). Excitační vlnová délka doxorubicinu byla 480 nm. Pro gelovou elektroforézu byl použit elektroforetický zdroj VWR E 0322-VWR-230V (VWR, USA) a mini vertikální elektroforetický systém (VWR, USA). Po dokončení elektroforézy byl gel obarven pomocí stříbra podle zavedeného protokolu. Metoda DOT BLOT byla provedena tak, že na NC45 nitrocelulózovou membránu (SERVA Electrophoresis GmbH, Německo) byl za sníženého tlaku napipetován 1 µl protilátky (1 mg/ml) DHM96 (SCIE PLAS, Velká Británie). Po uschnutí byla membrána zablokována promýváním po dobu 40 minut v 1% BSA a v PBS na rotátorové míchačce (30 otáček za minutu, 84 ° 10 s a vibrace 5 ° 5 s). Membrána byla poté třikrát promyta PBS [Tween 20 (0,05%)], a následně vložena do protilátky značené zlatem (1 mg/ml) a míchána 1 hodinu na rotátorové míchačce.
Při testování MIC byl nejdříve naředěn vzorek zvoleného mikroorganismu na OD 0,1 při vlnové délce 600 nm pomocí sterilního LB média. Do každé jamky mikrotitrační destičky bylo napipetováno 250 µl připraveného naředěného mikroorganismu a do každé jamky přidáno 50 µl testovaného vzorku. Podmínky měření byly nastaveny na 18 hodin, odečet absorbance probíhal každých 30 minut. Vzorky byly protřepávány v intervalu 30 minut po dobu 5 spři frekvenci 50 Hz, teplotě 35 °C a vlnové délce 600 nm.
Vyhodnocení dat
Základní statistické vyhodnocení bylo provedeno nástroji v laboratorním informačním systému LADYS (Česká republika).
VÝSLEDKY
Všechny vzorky rostlin byly přeneseny na Petriho misky a umístěny do sušárny na 24 h při 60 °C. Následně byly homogenizovány v třecí misce na jemný prášek. Připravený materiál (15 g) byl smíchán s 500 ml destilované vody o teplotě 80 °C. Extrakce probíhala po dobu 24 h za stálého míchání. K takto připraveným extraktům byl přidán 0,1 M roztok dusičnanu stříbrného (v poměru 1 : 1) a směs byla promíchávána na magnetické míchačce po dobu 24 hodin. Byly vybrány čtyři extrakty, které vykazovaly největší antimikrobiální efekt a obsahovaly nejvíce polyfenolických látek: AgNPsGS1 (výchozí extrakt: semena Coffea arabica L.), AgNPsGS2 (výchozí extrakt: list Camellia sinensis L.), AgNPsGS3 (výchozí extrakt: nať Allium cepa L.) a AgNPsGS4 (výchozí extrakt: nať Thymus serpyllum L.).
Byl navržen nanotechnologický konstrukt pro specifické zacílení na Staphylococcus aureus a vytvořený nanotransportér byl následně studován biofyzikálními a mikrobiologickými metodami. Nanokonstrukt je složen ze tří samostatných částí (obr. 1). Část A nanokonstruktu představuje stříbrnou nanočástici připravenou zelenou syntézou s výraznými antibakteriálními účinky. AgNPsGS byly dále modifikovány EDC/NHS [1-ethyl-3-(3-dimethylaminopropyl)karbodiimid/N-hydroxysukcinimid] polymerem. Část B nanokonstruktu se skládá z apoferitinu s modelově enkapsulovaným doxorubicinem. Část C nanokonstruktu je tvořena superparamagnetickými zlatými nanočásticemi (SPIONs/Au/NPs), které byly modifikovány polymerem EDC/NHS. Na povrch SPIONs/Au/NPs byla následně navázána protilátka anti-protein A (AB1) sloužící k zacílení k povrchovému proteinu A na buněčné membráně S. aureus. Dále byl povrch SPIONs/Au/NPs modifikován grafenovými listy (GF), které byly navrženy pro vazbu toxických sloučenin produkovaných S. aureus. Propojení mezi jednotlivými částmi nanokonstruktu bylo uskutečněno opět vazbou polymerem EDC/NHS.
Image 1. Schéma antibakteriálního nanotransportéru pro senzitivní a specifické zacílení na bakteriální buňky S. aureus
Nanotransportér je tvořen ze tří samostatných celků: Stříbrná nanočástice syntetizovaná zelenou syntézou (AgNPsGS) (A), apoferritinová klec s uzavřeným antibiotikem (APO/ATB) (B), zlatá superparamagnetická částice SPION modifikovaná grafenovým listem a protilátkou (SPIONs/Au/NPs/GF/AB1) (C). Jednotlivé části jsou spojeny vazebným polymerem EDC/NHS.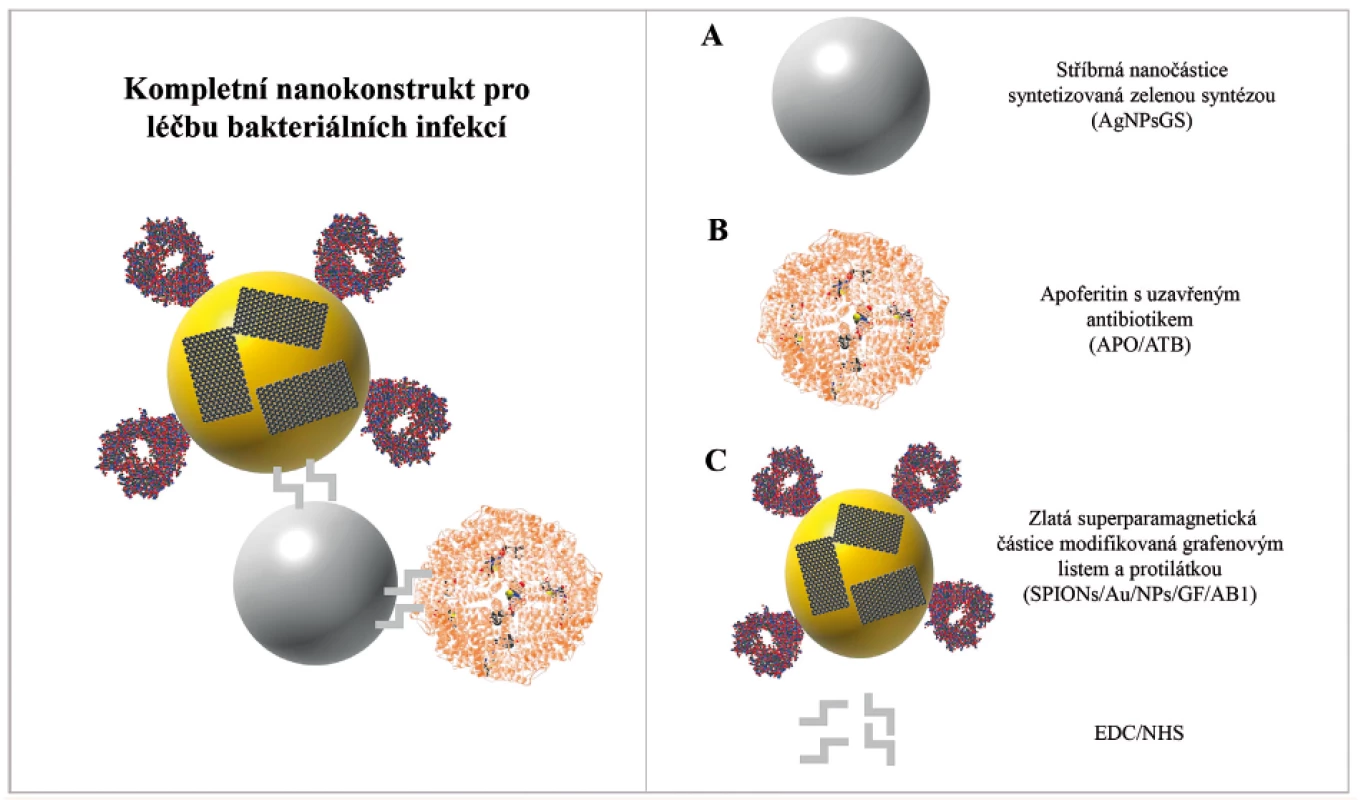
Sledování bakteriálního růstu v přítomnosti AgNPsGS
Všechny nasyntetizované nanočástice jevily výrazné antimikrobiální účinky tvorbou inhibičních zón. AgNPsGS1, AgNPsGS2 a AgNPsGS3 vykazovaly stejné výsledky, kdy se velikost zóny pohybovala kolem 3 mm/µg AgNPsGS. Největší antibakteriální účinek se projevil u AgNPsGS4, u něhož inhibice dosáhla 5 mm/µg AgNPsGS4. Z celé řady studií je známé, že AgNPs mají výrazné antibakteriální vlastnosti (3, 18). Antibakteriální účinek precipitovaných AgNPs byl studován i v naší studii. Spektrofotometrickou studií byly zaznamenávány růstové křivky bakteriální kultury S. aureus v průběhu 18 h.
Apoferitinový transportér
V experimentu bylo sledováno chování apoferitinu při různých hodnotách pH. V kyselém pH docházelo k otevírání apoferitinové struktury, zatímco v bazickém prostředí k jeho samoorganizování. V navrhovaném modelovém uspořádání bylo využito výrazných fyzikálně-chemických vlastností doxorubicinu, který byl v koncentraci 10 µm za stálého míchání po dobu 30 minut postupně uzavírán (změnou pH ‒ od kyselého k zásaditému) do dutiny apoferitinu. Množství uzavřeného antibiotika bylo stanoveno vzhledem k výrazným fluorescenčním vlastnostem doxorubicinu. Fluorescenční analýza enkapsulovaného doxorubicinu v apoferitinu prokázala úspěšnost enkapsulace okolo 15 %. Tohoto výsledku lze využít pro navrhování dalších nanokonstruktů, které budou obsahovat terapeuticky využívaná antibiotika (penicilin, amoxicilin, vankomycin apod.).
Testování kompletního nanotransportéru
Pro nalezení nejúčinnějšího konceptu byly spojeny všechny tři části konstruktu vazbou polymeru EDC/NHS v různých variantách. Byla stanovena efektivita vazby jednotlivých součástí konstruktu. Efektivita navázání AgNPsGS4 ke zbylým částem konstruktu byla kolem 15 %. Jednotlivé varianty konstruktu byly podrobeny biofyzikálnímu i mikrobiologickému testování. Pro důkaz vazby protilátky na SPIONs/Au/NPs byla použita metoda DOT BLOT, která spočívá ve specifické vazbě protilátky anti-proteinu A na protein A (S. aureus), který je značen zlatými nanočásticemi (AuNPs). Výsledná tečka vzniká agregací zlatých částic v místě vazby. Jako kontrola byl použit protein A. Na obrázku 2 jsou výsledky testovaných nanokonstruktů. Z výsledků jasně vyplývá, že u všech námi vytvořených konstruktů byla potvrzena modifikace povrchu SPIONs/Au/NPs protilátkou. Metodou DOT BLOT lze stanovit protein A i v množství 40 ng/ml.
Image 2. Shrnutí přípravy a vlastností jednotlivých části komplexního nanokonstruktu
Řádek 1: Příprava nanokonstruktu s magnetickými vlastnosti. SPION nanočástice pokryté zlatem jako výchozí část nanokonstruktu. Typická fotografie disperze nanočástic SPIONs/Au/NPs; grafenu (GF) a SPIONs/Au/NPs/GF; Fotografie po interakci s magnetem po 20 s SPIONs/Au/NPs.
Řádek 2: Ukazuje jednotlivé části a modely nanokonstruktu, které byly testovány.
Řádek 3: Typický vzhled jednotlivých připravených typů konstruktu.
Řádek 4: Typické dot blot analýzy jednotlivých testovaných nanokonstruktů: K – kontrola, M – testovaný nanokonstrukt, N – negativní kontrola.
Řádek 5: Typické časové průběhy pseudoperoxidázové reakce pro jednotlivé testované nanokonstrukty.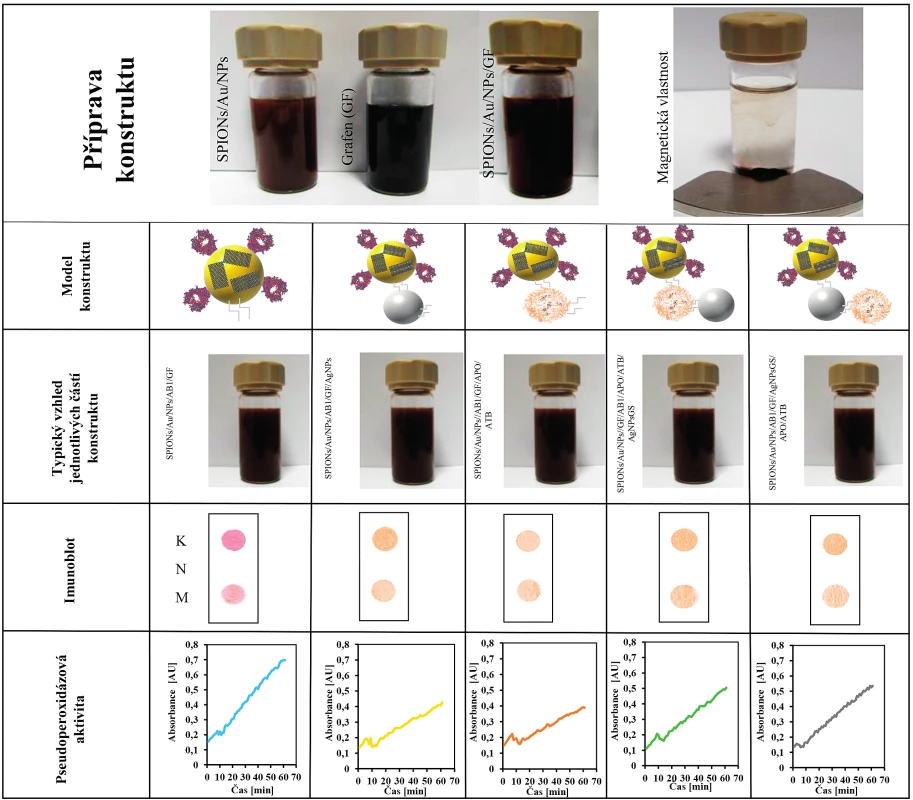
Charakterizace, funkčnost a účinnost navrženého nanoantibiotického konstruktu pro cílenou terapii antibakteriálních infekcí byla testována in vitro (obr. 3): u části C složené ze SPIONs/Au/NPs s navázanou protilátkou (AB1) a grafenem (GF), jejího spojení s částí B (apoferitin s enkapsulovaným doxorubicinem) a A (AgNPs), spojení částí B a A a samozřejmě i celého finálního konstruktu (A + B + C).
Image 3. Růstové křivky S. aureus po aplikaci různých částí konstruktu
Objem S. aureus 50 μl, celkový objem 300 μl. Měřeno po dobu 18 hodin a hodnoty byly odečítány v intervalu 30 minut, při 37 °C. Získané typické růstové křivky v přítomnosti testovaných nanokonstruktů. Část C (SPIONs/Au/NPs – bez modifikací a SPIONs/Au/NPs/AB1/GF – modifikovaná) nevykazovala žádné antibakteriální efekty, které nebyly z podstaty této části ani očekávány. V přítomnosti antibakteriálně aktivních látek nanokonstruktu a celého nanokonstruktu však byla zaznamenána dramatická inhibice (přes 90 %) na bakteriální kulturu S. aureus.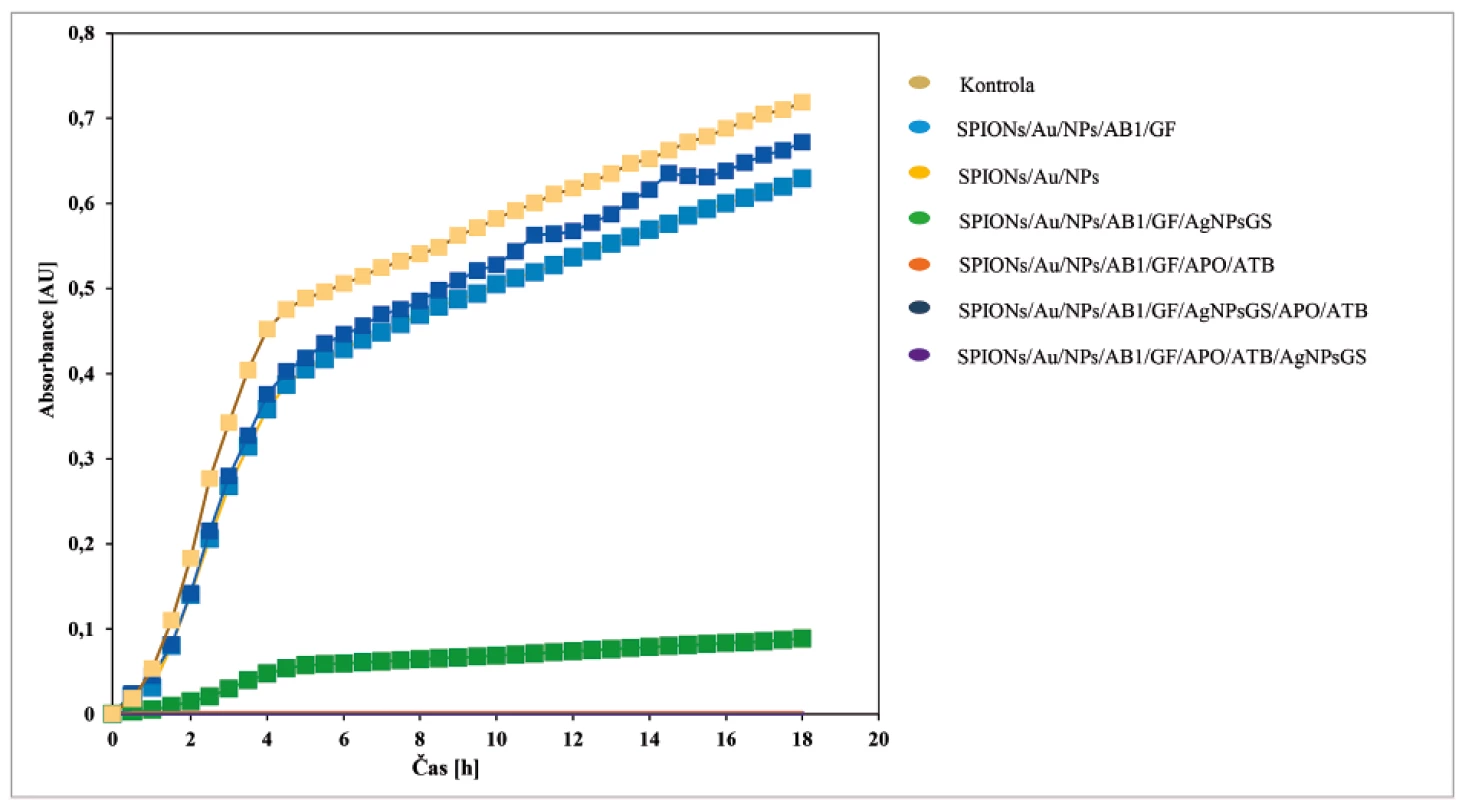
DISKUZE
Pokroky v léčbě bakteriálních infekcí jsou významné. Se současnou antibiotickou krizí význam využití nanotechnologických přístupů dále narůstá. V posledních letech se pozornost výzkumných týmů soustřeďuje na nanočástice stříbra a ve světové literatuře se objevuje i informace o vzniku zcela nového odvětví nanomedicíny zaměřeného na nanoantibiotika (19). V Nature Nanotechnology byla publikována práce, která popisuje možnosti jak ukotvit nanočástice stříbra silnou chemickou vazbou na různých materiálech, jako např. na plastech, kovech či textiliích, čímž lze zvýšit antibakteriální účinnost stříbrných nanočástic (20). V naší práci byl vytvořen nanokonstrukt s multifunkčními mechanismy antibakteriální aktivity – nanoantibiotikum. Nanokonstrukt byl cíleně zaměřen na cílový organismus S. aureus imunologickou vazbou na mebránový protein A pomocí specifické protilátky. Tento mechanismus je dlouhodobě využíván v biotechnologických aplikacích (21, 22). Další části nanokonstruktu jsou navrženy tak, aby působily destruktivně na bakteriální buňku. Zde bylo využito dosud známých antibakteriálních mechanismů stříbrných nanočástic (23, 24). Biogenní stříbrné nanočástice působí silně baktericidně různými mechanismy (15). Stříbrné nanočástice proniknou bakteriální buněčnou stěnou, kde se vážou na bakteriální DNA, ribozomy a proteiny. Po jejich aplikaci dochází ke konstantnímu prostupu iontů stříbra do bakteriální buňky a vazbě na bakteriální DNA (8). Ačkoliv syntéza nanočástic běžnou chemickou cestou dosahuje dobrých výsledků, využití zelené syntézy přináší celou řadu již výše uvedených dalších výhodných vlastností. Mikroorganismy se časem evolučně adaptují na selekční tlak antibioticky působících agens včetně nanočástic stříbra. To znamená, že mohou vznikat i kmeny rezistentní vůči AgNPs. Polyfunkční nanočástice mohou zvýšit jejich účinnost aditivním efektem. Za účelem minimalizace rizika vzniku bakteriální rezistence na AgNPs se nanočástice funkcionalizují pomocí různých, dle potřeby cíleně vybraných, antibiotik. Pravděpodobnost rezistence na takto individualizovaný a mnohostranný přípravek je nízká. Další významnou výhodou této funkcionalizace je možnost snížení dávky antibiotika, a tudíž i jeho případné toxicity na lidský organismus, čímž do boje proti bakteriálním infekcím umožňuje zapojit i toxičtější antibiotická léčiva. Nanočástice je možné zaměřit na infikované místo, čímž se snižuje jejich negativní dopad na lidské buňky. Synergická antibakteriální účinnost AgNPs a antibiotik byla pozorována nejen u S. aureus, ale i u Escherichia coli a Pseudomonas aeruginosa, a to již při extrémně nízkých koncentracích (25). Navržený nanokonstrukt, který byl vytvořen, je funkcionalizován antibiotikem, které se uvolní z apoferitinu až při nízkém pH. Antibiotikum působí svým vlastním specifickým mechanismem, který je podpořen synergickým účinkem stříbrných nanočástic připravených zelenou syntézou.
ZÁVĚRY PRO KLINICKOU PRAXI
Nejvýhodnějšími vlastnostmi nanomateriálů připravených zelenou syntézou je kromě jejich antimikrobiální aktivity i jejich snadná příprava, stabilita v čase a nízké výrobní náklady. Tvorba komplexů nanočástic kovů nebo polokovů s polymerními látkami nebo různými nosiči jejich antimikrobiální vlastnosti prokazatelně zvyšuje (26, 27). Synergický efekt biogenních stříbrných nanočástic a antibiotika uzavřeného v „apoferitinové kleci“ měl výrazný inhibiční efekt. Očekáváme, že rychle rostoucí zájem o nanotechnologická řešení založená na kovových nanočásticích nejen povzbudí a stimuluje výzkum v této vysoce aktuální oblasti. Věříme, že tento rychle rostoucí zájem přinese i zcela nové zásadní poznatky nejen v dnes klíčových oblastech bak-teriální rezistence a terapie bakteriálních (super)infekcí (28).
Práce byla podpořena projektem CA COST Action CA15114 a LTC18002 3D ANTIMICROB.
Konflikt zájmů: žádný.
prof. Ing. René Kizek, PhD., DrSc., MBA
Farmaceutická fakulta, VFU Brno
Palackého tř. 1946/1, 612 00 Brno
e-mail: kizek@sci.muni.cz
Sources
1. Wall BA, Mateus A, Marshall L, et al. Drivers, dynamics and epidemiology of antimicrobial resistance in animal production. Rome: Food and Agriculture Organization of the United Nations, 2016.
2. Hera A, Koutecká L, Dorn D, Pokludová L. Spotřeba antibiotik a antiparazitik ve veterinarní medicíně v ČR v letech 2003–2008. Věstník ÚSKVBL 2009; 333–338.
3. Durán N, Durán M., de Jesus MB, et al. Silver nanoparticles: a new view on mechanistic aspects on antimicrobial activity. Nanomedicine 2016; 12(3): 789–799.
4. Naika HR, Lingaraju K, Manjunath K, et al. Green synthesis of CuO nanoparticles using Gloriosa Superba L. extract and their antibacterial activity. J Taibah Univ Sci 2015; 9(1): 7–12.
5. Rónavári A, Kovács D, Igaz N, et al. Biological activity of green-synthesized silver nanoparticles depends on the applied natural extracts: a comprehensive study. Int J Nanomed 2017; 12 : 871–883.
6. Cowan MM. Plant products as antimicrobial agents. Clin Microbiol Rev 1999; 12(4): 564–582.
7. Brüssow H. Infection therapy: the problem of drug resistence – and possible solutions. Microb Biotechnol 2017; 10(5): 1041–1046.
8. Bahar AA, Ren D. Antimicrobial peptides. Pharmaceuticals 2013; 6(12): 1543-15–75.
9. Sharma VK, Yngard RA, Lin Y. Silver nanoparticles: green synthesis and their antimicrobial activities. Adv Coll Int Sci 2009; 145(1–2): 83–96.
10. Iravani S. Green synthesis of metal nanoparticles using plants. Green Chem 2011; 13(10): 2638–2650.
11. Chaloupka K, Malam Y, Seifalian AM. Nanosilver as a new generation of nanoproduct in biomedical applications. Trends Biotechnol 2010; 28(11): 580–588.
12. Kumar A, Vemula PK, Ajayan PM, John G. Silver-nanoparticle-embedded antimicrobial paints based on vegetable oil. Nat Mater 2008; 7(3): 236–241.
13. Ruttkay-Nedecky B, Skalickova S, Kepinska M, et al. Development of new silver nanoparticles suitable for materials with antimicrobial properties. J Nanosci Nanotechnol 2019; 19(5): 2762–2769.
14. Singh P, Kim YJ, Zhang D, Yang DC. Biological synthesis of nanoparticles from plants and microorganisms. Trend Biotech 2016; 34(7): 588–599.
15. Ruozi B, Veratti P, Vandelli MA, et al. Apoferritin nanocage as streptomycin drug reservoir: technological optimization of a new drug delivery system. Int J Pharmacol 2017; 518(1–2): 281–288.
16. Čížek M, Gargulák M, Sehnal K, a kol. Nanočásticemi modifikovaný apoferritinový nanotransportér pro cílený transport cytostatik. Klin Onkol 2019; 32(3): 197–200.
17. Wray W, Boulikas T, Wray VP, Hancock R. Silver staining of proteins in polyacrylamide gels. Anal Biochem 1981; 118(1): 197–203.
18. Zheng K, Setyawati MI, Leong DT, Xie J. Antimicrobial silver nanomaterials. Coord Chem Rev 2018; 357 : 1–17.
19. Huh AJ, Kwon YJ. „Nanoantibiotics“: A new paradigm for treating infectious diseases using nanomaterials in the antibiotics resistant era. J Control Release 2011; 156(2): 128–145.
20. Panáček A, Kvítek L, Smékalová M, et al. Bacterial resistance to silver nanoparticles and how to overcome it. Nat Nanotechnol 2018; 13(1): 65–71.
21. Medintz IL, Uyeda HT, Goldman ER, Mattoussi H. Quantum dot bioconjugates for imaging, labelling and sensing. Nat Mater 2005; 4(6): 435–446.
22. Betzig E1, Patterson GH, Sougrat R, et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science 2006; 313(5793): 1642–1645.
23. Morones JR, Elechiguerra JL, Camacho A, et al. The bactericidal effect of silver nanoparticles. Nanotechnology 2005; 16(10): 2346–2353.
24. Marambio-Jones C, Hoek EMV. A review of the antibacterial effects of silver nanomaterials and potential implications for human health and the environment. J Nanopart Res 2010; 12(5): 1531–1551.
25. Hemeg HA. Nanomaterials for alternative antibacterial therapy. Int J Nanomed 2017; 12 : 8211–8225.
26. Chudobova D, Nejdl L, Gumulec J, et al. Complexes of silver(I) ions and silver phosphate nanoparticles with hyaluronic acid and/or chitosan as promising antimicrobial agents for vascular grafts. Int J Mol Sci 2013; 14(7): 13592–13614.
27. Kopel P, Chudobova D, Cihalova K, a kol. Antibakteriální přípravek na bázi oxidu grafenu a redukovaného oxidu grafenu s obsahem nanočástic kovů a polokovů. Ú. p. vlastnictví, Česká republika: Mendelova univerzita v Brně, 1–6.
28. Tao Y, Li M, Ren J, Qu X Metal Nanoclusters: Novel probes for diagnostic and therapeutic applications. Chem Soc Rev 2015; 44(23): 8636–8663.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2019 Issue 4-
All articles in this issue
- Rizikové faktory pádů hospitalizovaných pacientů
- Trendy a koreláty obezity českých adolescentů ve vztahu k socioekonomickému statusu rodin mezi lety 2002–2018
- Nanočástice stříbra připravené zelenou syntézou a synergický účinek s antibiotikem jako základ nanokonstruktu pro léčbu bakteriálních infekcí
- Názory občanů České republiky na vybrané aspekty činnosti všeobecných praktických lékařů – 2018
- Zaměstnanecké benefity z pohledu zdravotnických pracovníků ambulantní sféry
- Péče o pacienty s lymfedémem v České republice – úvod do problematiky
- Komparace zdravotní gramotnosti u vybraných skupin obyvatelstva
- Hippokratova přísaha a aktuální lékařské sliby
- Ceny Josefa Hlávky za rok 2018 uděleny
- Před 140 lety se narodil prof. PhDr. et MUDr. Vojtěch Suk, DrSc. (1879–1967), zakladatel Přírodovědeckého ústavu v Brně
- Stipendium nabízí až jeden milion korun průkopníkům a zkušeným profesionálům v oblasti paliativní péče
- Co byste měli vědět o rakovině prsu
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Rizikové faktory pádů hospitalizovaných pacientů
- Hippokratova přísaha a aktuální lékařské sliby
- Péče o pacienty s lymfedémem v České republice – úvod do problematiky
- Zaměstnanecké benefity z pohledu zdravotnických pracovníků ambulantní sféry
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

