-
Medical journals
- Career
Akútne renálne zlyhanie a akútne obličkové poškodenie
Authors: L. Slezáková 1,2; Ľ. Polaščín 1; Ľ. Gašpar 2
Authors‘ workplace: Dialyzačné stredisko Bratislava, B. Braun Avitum s. r. o., Bratislava Vedúci lekár: MUDr. Ľubomír Polaščín 1; I. interná klinika Lekárskej fakulty Univerzity Komenského a Univerzitnej nemocnice Bratislava Prednostka: doc. MUDr. Soňa Kiňová, PhD. 2
Published in: Prakt. Lék. 2018; 98(1): 3-11
Category: Various Specialization
Overview
Akútne renálne zlyhanie a akútne obličkové poškodenie predstavujú jeden z najzávažnejších medicínskych problémov. Vyžadujú spoluprácu špecialistov, často aj náročnú nemocničnú starostlivosť na jednotkách intenzívnej starostlivosti (vrátane mimotelovej eliminačnej liečby). Pacienti postihnutí týmto ochorením majú vysokú pravdepodobnosť rozvoja chronického ochorenia obličiek v budúcnosti, taktiež vysokú úmrtnosť a v prípade prežitia môžu mať závažné komplikácie a následky. V snahe uľahčiť nám starostlivosť o takýchto pacientov boli vytvorené odporúčania KDIGO (Kidney Disease: Improving Global Outcomes) v roku 2012. V nasledujúcom texte približujeme súčasnú definíciu, epidemiológiu, rizikové faktory, klasifikáciu, diagnostiku a liečbu ochorenia.
Klíčová slova:
akútne renálne zlyhanie – akútne obličkové poškodenie – diagnostika – liečbaÚVOD
Akútne renálne zlyhanie predstavuje nielen jeden z najzávažnejších nefrologických problémov, ale aj jeden z najzávažnejších medicínskych problémov, na ktoré sa aj v súčasnosti sústreďuje pozornosť lekárov a výskumníkov. Postupne pribúdajúce poznatky o vzniku, rozvoji, priebehu, diagnostike, liečbe, komplikáciách a následkoch ochorenia viedli k tomu, že v roku 2012 došlo k predefinovaniu pojmu akútne renálne zlyhanie a k vytvoreniu pojmu akútne obličkové poškodenie pracovnou skupinou KDIGO (Kidney Disease: Improving Global Outcomes), ako aj k vytvoreniu novej klasifikácie ochorenia a odporúčaní (tzv. guidelines) pre diagnostiku a liečbu ochorenia, ktoré sa snažíme priblížiť v nasledujúcom texte.
Ochorenie je mimoriadne zaujímavé nielen z pohľadu lekára – či už praktického lekára, internistu, nefrológa alebo intenzivistu, ale je nesmierne závažné aj z pohľadu postihnutého jedinca. Okrem toho, že pacienti hospitalizovaní s akútnym obličkovým poškodením alebo až akútnym renálnym zlyhaním môžu vyžadovať finančne a technicky náročnú nemocničnú starostlivosť aj na jednotkách intenzívnej starostlivosti (vrátane mimotelovej eliminačnej liečby), majú vysokú pravdepodobnosť rozvoja chronického ochorenia obličiek v budúcnosti, taktiež vysokú úmrtnosť a v prípade prežitia môžu mať závažné fyzické, psychické alebo sociálne dôsledky vyžadujúce komplexnú starostlivosť vrátane ambulantnej starostlivosti praktického lekára. Včasná diagnostika, diferenciálna diagnostika a nimi podmienená adekvátna terapia sú základnými piliermi na ovplyvnenie morbidity a mortality týmto ochorením postihnutých pacientov.
DEFINÍCIA AKÚTNEHO RENÁLNEHO ZLYHANIA A AKÚTNEHO OBLIČKOVÉHO POŠKODENIA
História názvu a definície akútneho renálneho zlyhania siaha až do roku 1802, kedy William Heberden prvýkrát použil názov „ischuria renalis“ ako vtedajšie pomenovanie akútneho renálneho zlyhania (8). Na začiatku 20. storočia bolo akútne renálne zlyhanie, vtedy označované ako „Akútna Brightova choroba“, opísané Williamom Oslerom ako dôsledok toxínov, tehotenstva, popálenín, traumy alebo operácií obličiek v jeho knihe Textbook for Medicine v roku 1909. Počas prvej svetovej vojny bol syndróm pomenovaný ako „vojnová nefritída“ (6) a bol pod týmto názvom uvedený vo viacerých publikáciách. Syndróm bol v zabudnutí až do druhej svetovej vojny, kedy Bywaters a Beall publikovali ich prácu o Crush syndróme (3). Za zavedenie pojmu „akútne renálne zlyhanie“ sa zaslúžil Homer W. Smith, ktorý tento pojem uviedol v kapitole „Akútne renálne zlyhanie spojené s traumou“ v jeho knihe The kidney-structure and function in health and disease v roku 1951. Nanešťastie, precízna biochemická definícia akútneho renálneho zlyhania nebola navrhnutá a nebol ani vytvorený konsenzus, ktorý by určil diagnostické kritériá alebo klinickú definíciu akútneho renálneho zlyhania, čo vyústilo do vytvorenia viacerých rozličných definícií. Prieskum literatúry odhalil až 35 rôznych definícií akútneho renálneho zlyhania (16).
Koncept akútneho renálneho zlyhania sa najmä v posledných rokoch podrobil zásadným zmenám. V starších učebniciach bolo akútne renálne zlyhanie charakterizované ako náhly, často reverzibilný pokles funkcie obličiek, teda náhle vzniknutá neschopnosť obličiek odstraňovať z organizmu splodiny metabolizmu, spojená s retenciou dusíkatých a kyslých katabolitov a vedúca k poruche normálneho zloženia vnútorného prostredia, niekedy s klinickým syndrómom urémie (anorexia, nauzea, zvracanie, hnačky, známky hemoragickej diatézy, polyneuritída, psychické zmeny až uremická kóma). V týchto tradičných učebnicových textoch sa pri akútnom renálnom zlyhaní zdôrazňoval najzávažnejší stupeň akútne vzniknutej renálnej dysfunkcie. Rastúce poznatky však ukazujú, že i relatívne mierne akútne poškodenie obličiek či porucha ich funkcie sa spája s vážnymi klinickými dôsledkami a prispieva nezávisle na základnom ochorení k nemocničnej mortalite a morbidite. Aj z týchto dôvodov bol termín akútne renálne zlyhanie nahradený pojmom akútne obličkové poškodenie (z angl. acute kidney injury – AKI). Termín AKI nahradil tradičné „akútne renálne zlyhanie“ s cieľom zdôrazniť dynamickú povahu ochorenia, ktoré začína dlho predtým, ako je ho možné zistiť štandardnými laboratórnymi metódami. Inými slovami, pojem AKI zahŕňa široké spektrum renálnej dysfunkcie od mierneho zvýšenia sérového kreatinínu (funkčnej poruchy) až po anurické zlyhanie obličiek (štrukturálne poškodenie) vyžadujúce mimotelové eliminačné metódy. Termín tiež vyjadruje kontinuum prognózy, kedy aj malý vzostup sérového kreatinínu je nezávisle spojený s horšou mortalitou, ktorá sa proporcionálne zvyšuje s pokročilosťou dysfunkcie obličiek. Definícia ochorenia sa stále vyvíja a bude závisieť na vyhodnotení nových biomarkerov dysfunkcie a poškodenia obličiek. Aj keď sú dobre známe limitácie konvenčných ukazovateľov renálnej dysfunkcie (neskorá detekcia, nepresný odhad miery renálneho poškodenia), stále tvoria zmeny sérového kreatinínu a diurézy základ definície AKI (30).
AKI je podľa odporúčaní KDIGO Clinical Practice Guideline for Acute Kidney Injury z roku 2012 definované splnením jednej z nasledujúcich podmienok:
- vzostup kreatinínu v sére o ≥ 26,5 μmol/l (≥ 0,3 mg/dl) v priebehu 48 hodín
- vzostup kreatinínu v sére ≥ 1,5-krát oproti východzej (základnej) hodnote, ktorá je známa alebo predpokladaná z predchádzajúcich 7 dní
- diuréza < 0,5 ml/kg/h za 6 hodín
Názvom akútne renálne zlyhanie sa pomenúva len akútne obličkové poškodenie s poklesom glomerulovej filtrácie pod 15 ml/min/1,73 m2 alebo potreba liečby nahrádzajúcej obličkové funkcie (z angl. renal replacement therapy – RRT) (18).
EPIDEMIOLÓGIA
Výskyt akútneho renálneho zlyhania v jednotlivých štúdiách závisí od sledovanej populácie a použitých kritérií. V závislosti na definícii akútne renálne zlyhanie postihuje od 1 % do 25 % pacientov hospitalizovaných na jednotkách intenzívnej starostlivosti a vedie k mortalite 15–60 % (2, 19, 31).
Incidencia AKI stúpa v priebehu rokov. Súčasná metaanalýza ukázala, že celková incidencia AKI je celosvetovo vysoká. Analýza preskúmala 312 štúdií, pričom 95 % údajov bolo z hospitalizácií a hlavne z oblasti starostlivosti o kriticky chorých pacientov. Incidencia AKI bola 21,6 % u dospelých a 33,7 % u detí (26). Incidencia AKI vo všeobecnosti stúpa s vekom pacienta, pričom najvyšší výskyt AKI s potrebou adekvátnej dialyzačnej liečby je vo vekovej skupine 70–79 rokov (29).
Diabetici, hypertonici a onkologickí pacienti majú zvýšené riziko vzniku akútneho renálneho zlyhania. U diabetikov bol pozorovaný 2–3-násobne vyšší výskyt akútneho renálneho zlyhania (23). V štúdii skúmajúcej riziko vzniku AKI u diabetikov s komorbiditami bol zistený až 8-násobne vyšší výskyt akútneho renálneho zlyhania, pričom toto riziko bolo potencované obezitou, anamnézou predchádzajúceho akútneho renálneho zlyhania, kongestívnym srdcovým zlyhávaním, chronickou obličkovou chorobou a hypertenziou (12). Tiež bolo zistené, že pacienti s diabetom užívajúci perorálne antidiabetiká majú o 30 % a diabetici na inzulíne až o 70 % vyššie riziko vzniku AKI po chirurgickom výkone (17). Hypertonici majú približne 2-násobne vyššie riziko vzniku AKI (14). AKI vzniká asi u 25 % onkologických pacientov, 1-ročné riziko vzniku AKI u týchto pacientov je 17,5 % a 5-ročné riziko 27,0 %, vyššie je u pacientov so vzdialenými metastázami v čase stanovenia diagnózy a u pacientov s rakovinou obličiek, pečene a s mnohopočetným myelómom (15). Kriticky chorí onkologickí pacienti majú najvyššie riziko vzniku AKI (incidencia 54 %) (20).
V Českej republike nám údaje o výskyte zlyhania obličiek poskytuje Ústav zdravotníckych informácií a štatistiky ČR. V Zdravotníckej ročenke Českej republiky 2015 uvádza, že v roku 2015 zomrelo v Českej republike na zlyhanie obličiek 344 mužov (6,6 na 100 000 mužov) a 409 žien (7,6 na 100 000 žien) (32).
Informácie o výskyte akútneho renálneho zlyhania v Slovenskej republike nám poskytujú údaje Národného centra zdravotníckych informácií. Podľa posledných dostupných informácií bolo náhle zlyhanie obličiek v roku 2016 v Slovenskej republike zaznamenané u 1816 pacientov (pričom od roku 2007 ich počet vzrástol o viac ako 700 prípadov), z toho bolo 644 (35,46 %) úmrtí. Bol zaznamenaný aj počet pacientov s náhlym zlyhaním obličiek podľa príčin zlyhania (graf 1) (24).
Graph 1. Percentuálne zastúpenie jednotlivých príčin náhleho zlyhania obličiek v roku 2016 v Slovenskej republike 
RIZIKOVÉ FAKTORY
Rizikové faktory AKI rozdeľujeme na neovplyvniteľné a ovplyvniteľné. Zaradenie konkrétnych rizikových faktorov do jednotlivých skupín je uvedené v tabuľke 1 (7).
Table 1. Rizikové faktory akútneho obličkového poškodenia 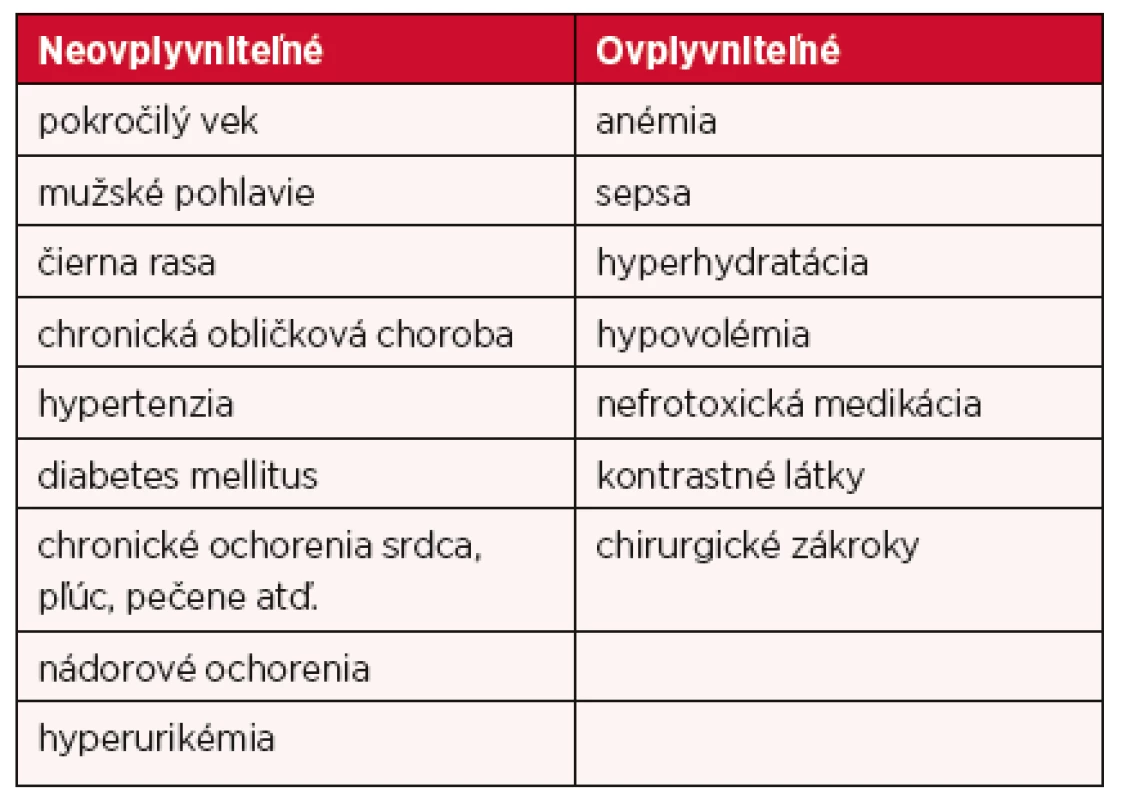
ETIOPATOGENÉZA
Príčiny AKI tradične rozdeľujeme do troch kategórií:
- prerenálne
- renálne
- postrenálne
AKI z prerenálnych príčin predstavuje 40–80 % všetkých prípadov, je teda najčastejšie. Môže byť definované ako náhle výrazné zníženie funkcie obličiek v dôsledku renálnej hypoperfúzie. Hypoperfúzia obličiek vyvoláva rad kompenzačných mechanizmov s cieľom zachovať homeostázu vnútorného prostredia. Za normálnych podmienok zostáva v dôsledku renálnej autoregulácie prietok krvi obličkou i glomerulová filtrácia konštantná v relatívne širokom rozmedzí. Pokles renálnej perfúzie spojený s poklesom systémového krvného tlaku pod 80 mm Hg vedie k aktivácii kompenzačných mechanizmov – zvýšenej sympatikotónii, sekrécii katecholamínov, aktivácii renín-angiotenzín-aldosterónového systému a zvýšenej sekrécii antidiuretického hormónu. Všetky tieto mechanizmy môžu spôsobiť vazokonstrikciu vas afferens i vas efferens a tým redukciu prietoku plazmy glomerulom a kapilárneho tlaku. Glomerulová filtrácia zostáva spočiatku zachovaná v dôsledku zníženia cievnej rezistencie v aferentnej arteriole (myogénny reflex a tubuloglomerulový spätný mechanizmus). Súčasne lokálne pôsobiace renálne vazodilatátory (prostaglandíny a kiníny) čiastočne vyrovnávajú vazokonstrikčné účinky. Hlavné mechanizmy vedúce k prerenálnej forme AKI sú:
- zníženie efektívneho intravaskulárneho objemu
- znížený srdcový výdaj
- poruchy intrarenálnej hemodynamiky
- renovaskulárna obštrukcia
Konkrétne príčiny AKI prerenálnej etiológie sú uvedené v tabuľke 2 (28, 30).
Table 2. Príčiny AKI prerenálnej etiológie 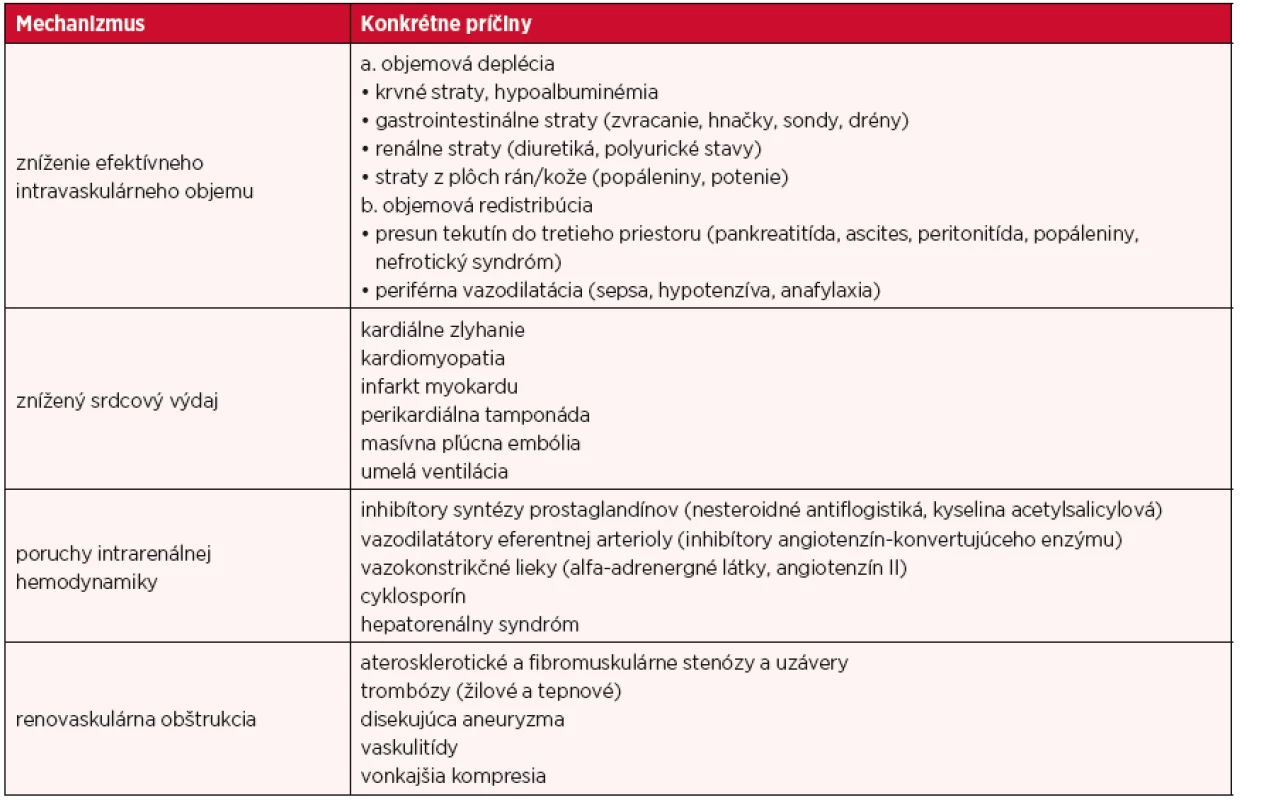
Renálne príčiny AKI zahŕňajú širokú skupinu ochorení postihujúcich rôzne časti nefrónu: glomeruly, tubuly, vaskulatúru alebo interstícium. Predstavujú 10–50 % prípadov. Jedným z významných patogenetických mechanizmov je akútna tubulárna nekróza, ďalšími kľúčovými mechanizmami sú poruchy mikrocirkulácie obličiek, aktivácia intrarenálnej zápalovej a imunitnej odpovede a v neposlednom rade aj neurohormonálne mechanizmy. Treba tiež uviesť, že mnoho patomechanizmov vzniku AKI z renálnych príčin je ešte neobjasnených, a tiež, že mnohé tieto mechanizmy sa môžu kombinovať aj s patogenetickými mechanizmami prerenálnych príčin AKI. Renálne príčiny AKI sú uvedené v v tabuľke 3 (28, 30).
Table 3. Renálne príčiny AKI 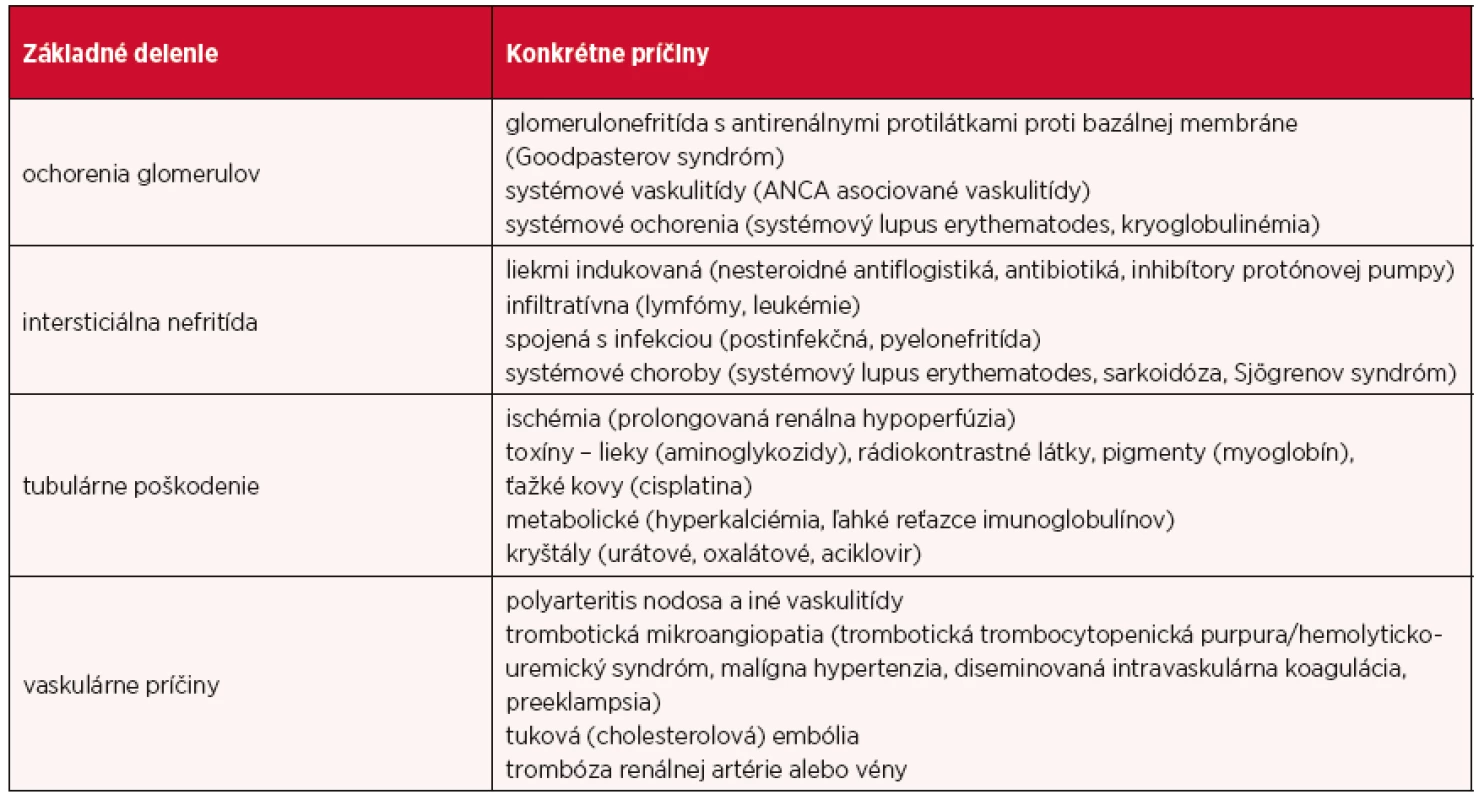
ANCA – anti-neutrophil cytoplasmic antibodies, teda protilátky proti neutrofilným leukocytom Postrenálne AKI vzniká obštrukciou vývodných močových ciest, je najmenej časté. Prekážka v urodynamike vyvolá vzostup tlaku nad obturovaným miestom. V prvých hodinách po uzávere vytvára postihnutá oblička hyperosmolárny moč s nízkym obsahom sodíka. Aferentné arterioly sú dilatované účinkom prostaglandínov a je zvýšený prietok krvi obličkou. Neskôr sa prietok krvi obličkou zníži a klesne aj glomerulová filtrácia. Iniciálny mierny pokles glomerulovej filtrácie je dôsledkom zvýšeného hydrostatického tlaku nad miestom obštrukcie. Po uvoľnení obštrukcie sa prietok krvi obličkou, ale aj glomerulová filtrácia rýchlo vracia k pôvodným hodnotám. I krátkodobá obštrukcia trvajúca niekoľko hodín môže viesť k akútnemu, potenciálne reverzibilnému, poškodeniu obličiek. Stane sa tak predovšetkým pri obojstrannej obštrukcii či postihnutí solitárnej obličky. Vzácna nie je ani reflexná anúria druhej obličky pri renálnej kolike. Dlhodobá obštrukcia vedie k významnej tlakovej hydronefróze s poškodením renálneho parenchýmu. Podobné zmeny, naviac často komplikované dlhodobou infekciou, nastávajú pri ťažkej refluxovej nefropatii. Postrenálne príčiny AKI sú bližšie uvedené v tabuľke 4 (28, 30).
Table 4. Postrenálne príčiny AKI 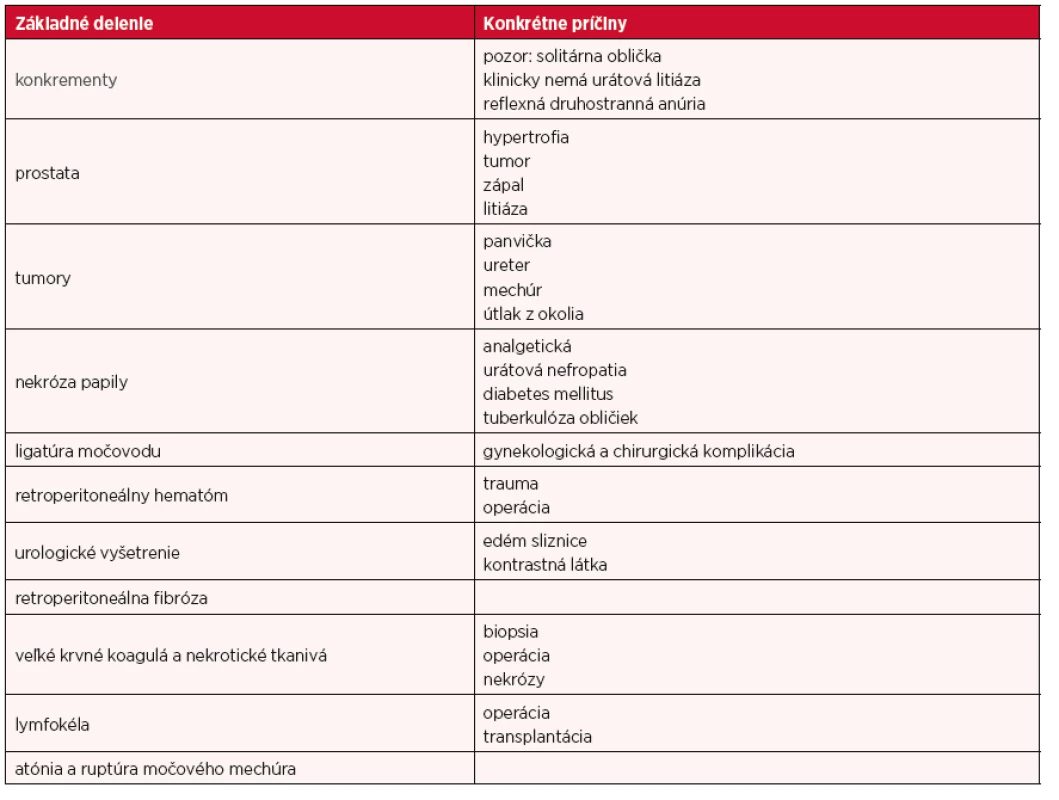
Príčiny AKI sa v rozvojových krajinách líšia od príčin v rozvinutých krajinách. Hlavnými príčinami AKI v rozvojových krajinách sú infekčné ochorenia (malária, leptospiróza, horúčka dengue a hnačka), gynekologické ochorenia a toxické mechanizmy (uhryznutie hadom, pavúkom alebo uštipnutie hmyzom) (4).
KLASIFIKÁCIA AKÚTNEHO OBLIČKOVÉHO POŠKODENIA
Aktuálna klasifikácia AKI pochádza z roku 2012. Bola vytvorená pracovnou skupinou KDIGO. Klasifikácia rozpoznáva tri štádiá ochorenia podľa koncentrácie kreatinínu v sére a diurézy (tab. 5) (18).
Table 5. Klasifikácia AKI podľa KDIGO (2012) 
DIAGNOSTIKA
Diagnostické minimum AKI tvorí rovnako ako u iných ochorení podrobný odber anamnestických údajov od pacienta alebo jeho príbuzných a známych a fyzikálne vyšetrenie orientované najmä na zhodnotenie stavu hydratácie pacienta.
V osobnej anamnéze pátrame po prípadných ochoreniach obličiek v minulosti, po prítomnosti niektorých komorbidít (diabetes mellitus, hypertenzia, kardiálne ochorenia, ochorenia pečene a pľúc, onkologické ochorenia, infekcie a ďalšie), po prekonaných operáciách a traumách. V rodinnej anamnéze sledujeme výskyt ochorení obličiek u príbuzných pacienta. Liekovú anamnézu zameriavame na užívanie nefrotoxickej medikácie (nesteroidné antiflogistiká, inhibítory angiotenzín-konvertujúceho enzýmu a ďalšie) a prípadnú expozíciu toxickým látkam (etylénglykol, ťažké kovy). Hľadáme aj vyvolávajúce faktory (hypotenzia, hypovolémia, zvracanie, hnačky, krvácanie, popáleniny, polyúria). Nesmierne dôležité je zistenie údajov o diuréze a vzniku jej prípadných zmien. Náhle vzniknutá anúria vedie k podozreniu na obštrukciu vývodných močových ciest, embóliu do renálnych tepien alebo akútnu glomerulonefritídu. Postupný pokles diurézy môže značiť striktúru uretry alebo obštrukciu rozpínajúcou sa prostatou.
V rámci objektívneho vyšetrenia je kľúčové vyhodnotenie kardiovaskulárneho systému, stavu volémie a bilancie tekutín. Pozornosť treba venovať výskytu petéchií, purpury alebo livedo reticularis, ktoré sú klinickými vôdzkami k zápalovým, autoimunitným a vaskulárnym príčinám AKI. Prítomnosť uveitídy a skleritídy môže sprevádzať intersticiálnu nefritídu a nekrotizujúcu vaskulitídu. Ťažká hypertenzia koexistujúca s AKI môže znamenať renovaskulárne ochorenie, glomerulonefritídu, vaskulitídu alebo ateroembóliu. Vyšetrenie brucha sa zameriava na prítomnosť retencie a vnútrobrušnej hypertenzie. Bolesti v bedrách môžu sprevádzať renálnu artériovú alebo žilovú oklúziu alebo parenchýmové ochorenie s distenziou renálneho puzdra (pyelonefritída, ťažká glomerulonefritída). Kolikovité bolesti môžu upozorniť na obštrukciu ureterov.
Základom diagnostiky AKI naďalej zostáva biochemické vyšetrenie krvi a moču. Tradičným ukazovateľom funkcie obličiek je monitoring hladín kreatinínu v sére spoločne so sledovaním hodinovej diurézy. Hodnota kreatinínu v sére je však ovplyvnená radom nerenálnych faktorov: vekom, pohlavím, svalovou hmotou a svalovým metabolizmom, stavom hydratácie, príjmom bielkovín či medikáciou. Nezanedbateľným problémom je aj skutočnosť, že kreatinín v sére odráža stav renálnych funkcií až po dosiahnutí ustáleného stavu, teda s oneskorením 2–3 dni. Druhým tradičným ukazovateľom je hladina urey v sére. Hodnota urey však môže byť zvýšená u pacientov s krvácaním do gastrointestinálneho traktu, pri zvýšenom prívode bielkovín alebo naopak neprimerane nízka pri pokročilom hepatálnom ochorení alebo malnutrícii (30).
Z laboratórnych vyšetrení si v súčasnosti zasluhuje pozornosť stanovovanie biomarkerov AKI v sére alebo v moči. Jedná sa o viaceré molekuly, ktoré sú ešte stále predmetom výskumu a majú potenciál byť novými včasnými ukazovateľmi funkčného alebo štrukturálneho poškodenia obličiek. K najviac skúmaným biomarkerom AKI patria cystatín C, albumín v moči, N-acetyl-β-D-glukózaminidáza (N-acetyl-β-D-glucosaminidase – NAG), molekula obličkového poškodenia-1 (kidney injury molecule-1 – KIM-1), interleukín-18 (IL-18), pečeňový proteín viažuci mastné kyseliny (liver fatty acid-binding protein – L-FABP). Najsľubnejším sa v súčasnosti stal neutrofilný lipokalín asociovaný so želatinázou (neutrophil gelatinase-associated lipocalin – NGAL) (13).
Zo zobrazovacích metód je na prvom mieste ultrasonografické vyšetrenie používané najmä na vylúčenie postrenálnej príčiny ochorenia, ale aj na posúdenie už existujúceho ochorenia obličiek (napr. malé zvraštené obličky = chronické ochorenie obličiek). Vyhodnotenie perfúzie dopplerometrickým vyšetrením či kontrastom zvýraznené sonografické vyšetrenie môže byť prínosné v diferenciálnej diagnostike AKI, predovšetkým u pacientov po transplantácii obličiek alebo pri predpoklade anúrie v dôsledku kortikálnej nekrózy, či pri podozrení na ischémiu vyvolanú embolizáciou renálnych tepien. Vyšetrenie však môže byť technicky obtiažne a vyžaduje skúseného vyšetrujúceho. Nález obojstranne zväčšených obličiek a AKI môže byť známkou infiltrácie obličiek (niektoré lymfómy, leukémie). Niekedy môže byť nápomocné aj CT alebo MR vyšetrenie (nefrolitiáza, trombóza) (30).
Renálna biopsia predstavuje metódu diagnostiky predovšetkým ochorení obličiek postihujúcich glomeruly s pravdepodobnosťou stanovenia diagnózy 95 % a výskytom život ohrozujúcich komplikácií v menej než 1 % prípadov. Biopsia obličky a jej indikácia spadá do kompetencií nefrológa. Z klinického hľadiska je pri akútnom renálnom zlyhaní vhodná u takých pacientov, u ktorých pripadá do úvahy zmena terapie na základe výsledku biopsie. Indikácie renálnej biopsie sú:
- nefrotický syndróm u dospelých (u prepubertálnych detí len v prípade prítomnosti hematúrie)
- akútne renálne zlyhanie po vylúčení obštrukcie, poruchy perfúzie a akútne tubulárne nekrózy
- systémové ochorenia s postihnutím obličiek (v prípade diabetes mellitus len pri atypickej manifestácii)
- proteínúria > 1 g/deň
- izolovaná mikroskopická hematúria
- nevysvetliteľné chronické ochorenie obličiek
- familiárne renálne ochorenie (34)
LIEČBA
Liečbu AKI môžeme vo všeobecnosti rozdeliť do dvoch základných kategórií bez ohľadu na vyvolávajúcu príčinu, nakoľko niekedy je ťažké stanoviť jednu konkrétnu príčinu (možnosť kombinácie viacerých príčin ochorenia). Jedná sa o farmakologickú liečbu a liečbu nahrádzajúcu funkciu obličiek. Ak sa nám však príčinu podarí stanoviť, je samozrejme na mieste v liečbe postupovať podľa tejto vyvolávajúcej príčiny.
Včasná korekcia prerenálnych príčin stojí v prvej línii všetkých opatrení. Jej cieľom je dosiahnutie dostatočného prietoku obličkou a zaistenie adekvátneho perfúzneho tlaku. Odporúčania KDIGO sa venujú trom veľmi diskutovaným problémom: voľbe tekutín, vazopresorov a fyziologických cieľov v rámci resuscitácie a stabilizácie obehu (25). Izotonické kryštaloidy sú považované za roztoky prvej voľby. Koloidné roztoky sú často používané s cieľom rýchlejšieho obnovenia efektívneho cirkulujúceho objemu. Veľa štúdií a analýz však stále intenzívne upozorňuje na renálne riziká syntetických koloidných roztokov, predovšetkým u septických pacientov. O albumíne ako o plazmaexpandére je možné uvažovať u pacientov s cirhózou pečene komplikovanou spontánnou bakteriálnou peritonitídou alebo hepatorenálnym syndrómom. Základným vazopresorom, ktorý je v klinickej praxi využívaný na korekciu hypotenzie u stavov so zníženou systémovou cievnou rezistenciou (typicky sepsa), je noradrenalín. V minulosti rozšírený názor, že noradrenalín je liekom, ktorý vzhľadom k svojej vazokonstrikčnej aktivite zhoršuje funkciu obličiek, je dnes definitívne vyvrátený. Naopak, u pacientov v sepse so systémovou vazodilatáciou a porušenou renálnou autoreguláciou môže noradrenalín reálny krvný prietok zvýšiť. Protokolizovaný hemodynamický manažment (najmä titrácia tekutín a vazoaktívnych látok na dosiahnutie preddefinovaných parametrov hemodynamiky a tkanivovej oxygenácie) je okrem liečby septických stavov odporúčaný aj v perioperačnej starostlivosti u vysoko rizikových skupín pacientov (vek nad 60 rokov, emergentné výkony, významné komorbidity) (22).
Z ďalších farmakologických liečebných možností sa KDIGO odporúčania venujú používaniu diuretík. KDIGO odporúča nepoužívať diuretiká na prevenciu AKI a na liečbu AKI s výnimkou manažmentu tekutinového preťaženia (18). Používanie kľučkových diuretík u AKI je veľmi častou liečebnou intervenciou indikovanou z dôvodu súčasného objemového preťaženia v snahe zvrátiť prognosticky menej priaznivé oligurickoanurické zlyhanie do neoligurického alebo s úmyslom redukcie metabolicky náročnej reabsorpcie solútov a obmedziť prípadnú intratubulárnu obštrukciu udržaním prietoku moču (22).
V rámci farmakologických opatrení treba tiež spomenúť liečbu sprievodných komplikácií AKI, teda hyponatriémie, acidózy a asi najviac obávanej hyperkaliémie. Hyperkaliémia je poruchou iónového hospodárenia, ktorá môže ohrozovať činnosť srdcového svalu s hrozbou akútnej zástavy srdca. Je preto nutné poznať farmakologické možnosti jej ovplyvnenia, ktoré uvádza aj s ich dávkovaním a nástupom účinku tabuľka 6 (27).
Table 6. Farmakologické možnosti liečby hyperkaliémie 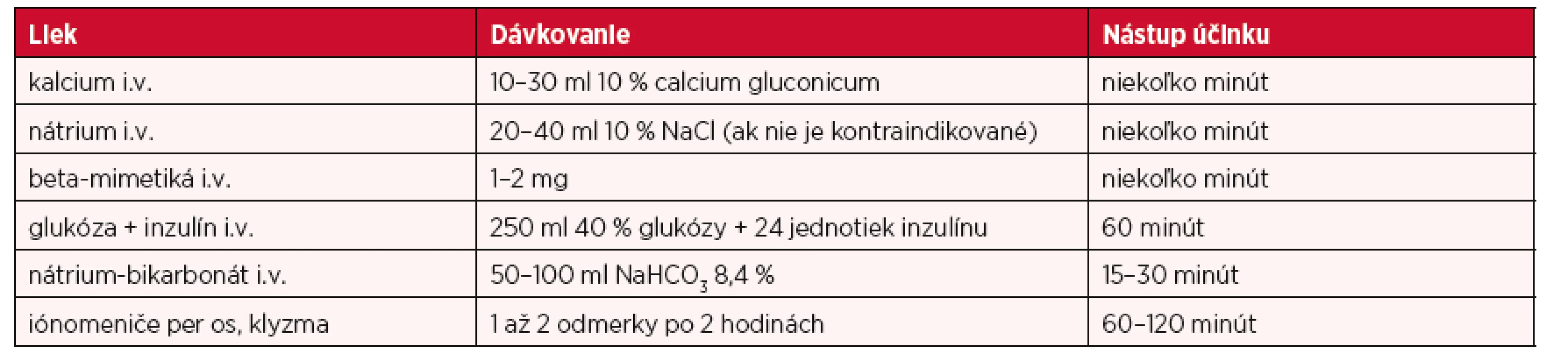
Pri liečbe nahrádzajúcej funkciu obličiek (renal replacement therapy – RRT) je vo všeobecnosti veľmi dôležité jej načasovanie. Otázka vhodného zahájenia a ukončenia RRT u pacientov s AKI zostáva stále nezodpovedaná. Podľa KDIGO treba RRT bezprostredne zahájiť v prípade život ohrozujúcich zmien v tekutinovej, elektrolytovej a acidobázickej rovnováhe. Pri rozhodovaní o zahájení RRT treba zvážiť širší klinický kontext – prítomnosť stavov, ktoré môžu byť prostredníctvom RRT modifikované, a skôr trend laboratórnych výsledkov ako vychádzať z izolovaných jednotlivých hodnôt urey a kreatinínu. RRT treba ukončiť, pokiaľ už neexistuje jej ďalšia potreba – buď z dôvodu dostatočného stupňa zotavenia renálnych funkcií, alebo z dôvodu, že pokračovanie v RRT už nie je v súlade s cieľmi liečby (18). Napomôcť v správnom načasovaní zahájenia RRT u pacientov s AKI nám môžu všeobecne známe indikácie založené na krajných situáciách vyžadujúcich RRT. Indikácie na zahájenie RRT u pacientov s AKI uvádza tabuľka 7 (34). Treba však pripomenúť, že nie je možné brať tieto indikačné kritériá ako ultimátum zahájenia RRT. Sú síce použiteľné u mnohých pacientov s AKI, ale niekedy môže včasnejšie zahájenie RRT priaznivo ovplyvniť terapeutický výsledok a prognózu. Na druhej strane, treba vziať do úvahy aj riziká a komplikácie plynúce z použitia RRT. RRT zahŕňa nasledujúce metódy:
- extrakorporálne (mimotelové) eliminačné metódy
- peritoneálna dialýza
- transplantácia obličky
Table 7. Indikácie na zahájenie liečby nahrádzajúcej funkciu obličiek u pacientov s AKI 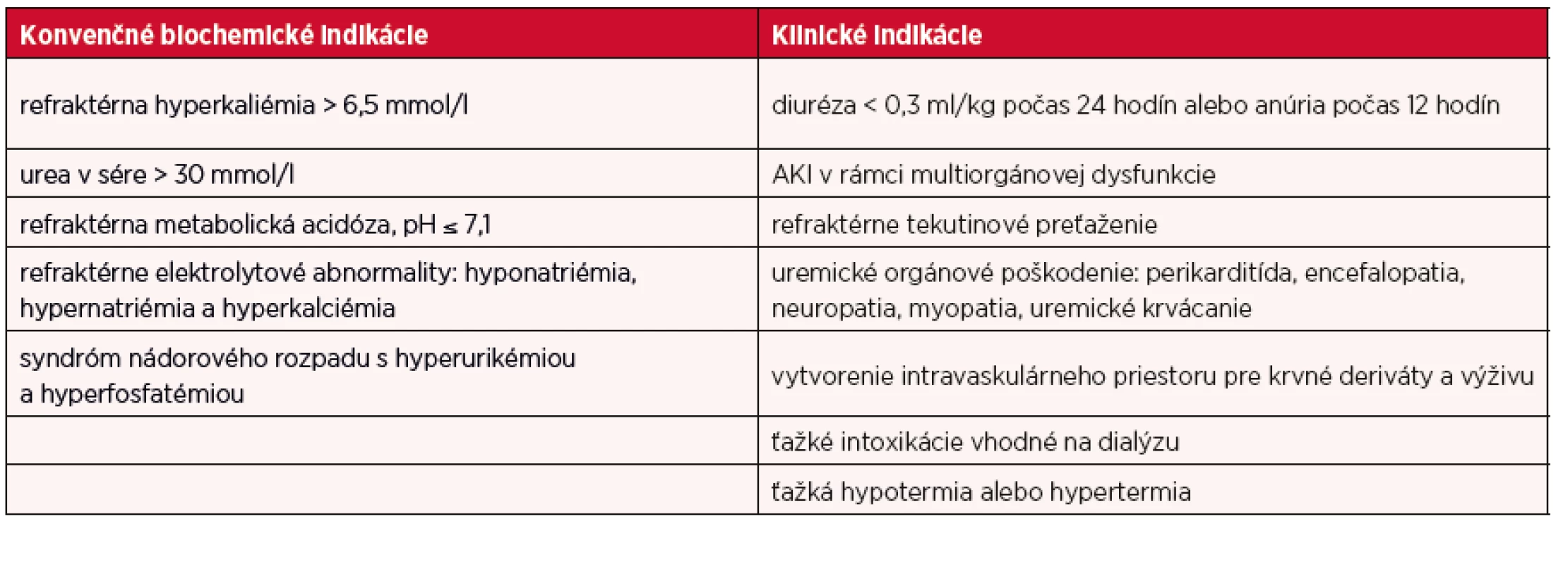
Table 8. Najčastejšie nefrotoxické príčiny AKI 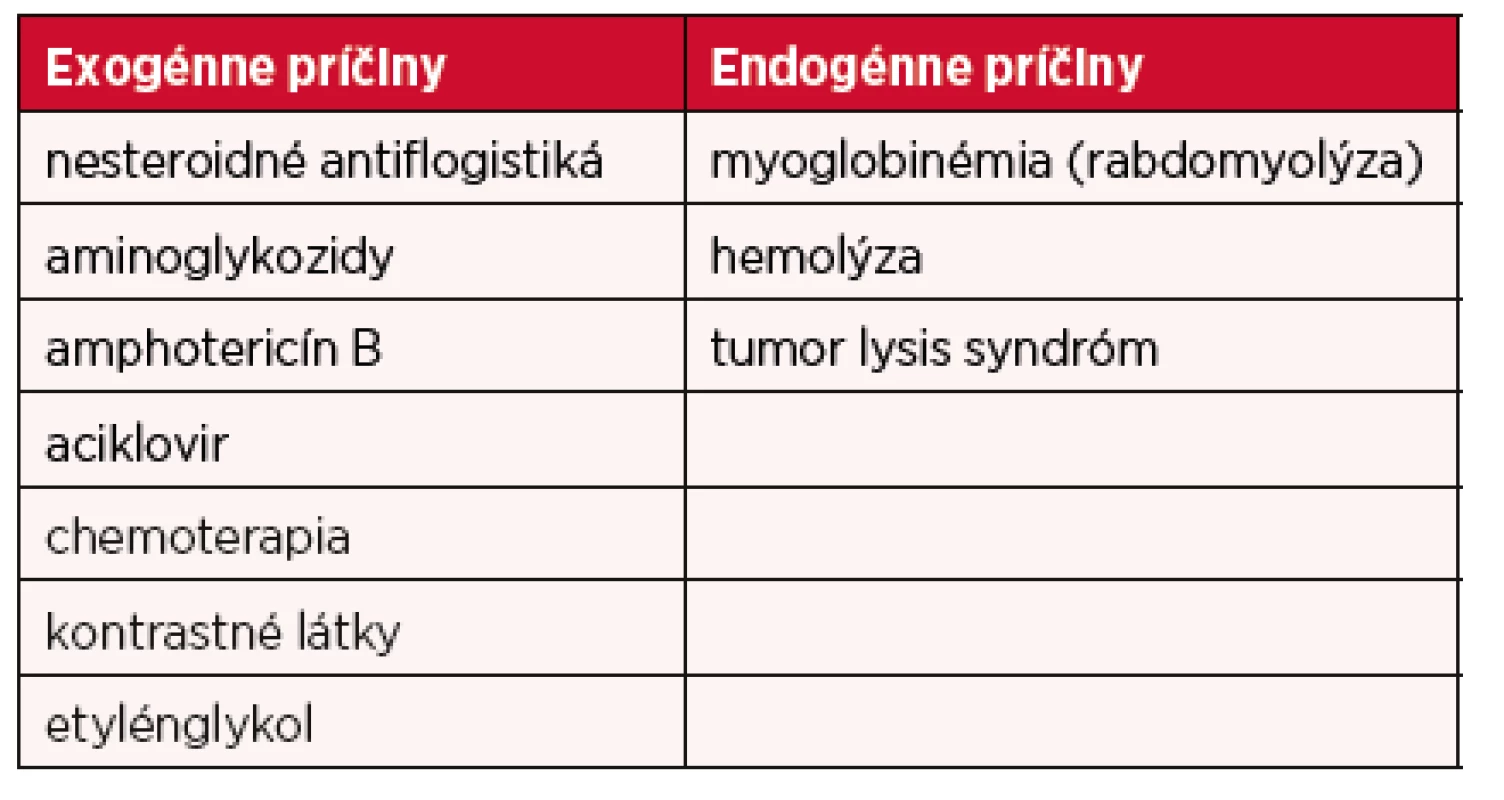
Pri AKI využívame najmä mimotelové eliminačné metódy a raritne akútnu peritoneálnu dialýzu.
Mimotelové eliminačné metódy znamenajú liečebné využitie postupov, pri ktorých sa odstraňujú látky, ktoré v danú chvíľu organizmus nie je schopný vylúčiť iným spôsobom. Pri renálnom zlyhaní nahrádzajú eliminačné metódy iba vylučovaciu funkciu obličiek. Táto náhrada je neporovnateľne kvalitatívne horšia než za fyziologických okolností, ale stačí na udržanie života. Eliminácia je vždy len čiastočná a spektrum odstraňovaných látok je omnoho užšie ako pri fyziologickom vylučovaní obličkami. Eliminačné metódy tiež nie sú selektívne, čo znamená, že spolu s katabolitmi sú zároveň odstraňované aj látky, ktoré sú pre telo potrebné (niektoré vitamíny, aminokyseliny) (30). Podľa fyzikálno-chemických princípov, ktorými mimotelové metódy RRT očisťujú krv, sa delia na hemodialýzu, hemodiafiltráciu a hemofiltráciu.
Hemodialýza využíva polopriepustnú membránu, ktorej póry prepúšťajú solúty do určitej molekulovej hmotnosti a neprepúšťajú krvné elementy. Solúty cez membránu prechádzajú predovšetkým na princípe difúzie a len z menšej časti na princípe filtrácie (konvekcie). Pri difúzii je hnacou silou rozdielny koncentračný gradient solútov na obidvoch stranách membrány. Pri filtrácii je hnacou silou rozdielny tlakový gradient na obidvoch stranách membrány. Filtráciou sa podľa tlaku presúva cez membránu hlavne voda. Spolu s vodou sú tiež strhávané niektoré solúty. Niektoré látky sú eliminované z krvi tým, že sú k membránam z určitých materiálov adsorbované. Pri hemofiltrácii je do dialyzátoru (hemofiltra) privádzaná len krv a nie dialyzačný roztok. Pretože difúzna zložka má podstatný význam pre očisťovanie krvi najmä od malých solútov, je potrebné jej chýbanie kompenzovať. Deje sa to tak, že filtrácia je oproti hemodialýze podstatne vyššia. Pohybuje sa v hodnotách 30–100 litrov za procedúru. Aby toto množstvo vody prešlo membránou a prenieslo so sebou dostatočne veľké množstvo solútov potrebné na účinné očisťovanie krvi, používajú sa vysokoprietokové („high-flux“) membrány s podstatne väčšími pórmi ako pri bežnej hemodialýze. Odstránené množstvo tekutín sa pacientovi hradí substitučným roztokom tak, aby procedúra odstránila len vodu, ktorá bola pre pacienta nadbytočná, napr. 1–4 litre. Vďaka využívaniu vysokopriepustných membrán a filtrácii odstraňuje hemofiltrácia v porovnaní s hemodialýzou lepšie látky s väčšou molekulovou hmotnosťou. Intenzita odstraňovania nízkomolekulových látok je však menšia. Preto bola vyvinutá hemodiafiltrácia, ktorá je kombináciou hemofiltrácie a hemodialýzy (27). Najdôležitejšou súčasťou dialýzy je dialyzátor, pretože v ňom prebieha vlastné očisťovanie krvi. Dialyzačná membrána v ňom uložená oddeľuje 2 kompartmenty: krvný (kompartment, ktorým preteká krv) a dialyzačný (kompartment, ktorým preteká dialyzačný roztok). Nutnou súčasťou dialýzy je dialyzačný prístroj (obr. 1).
Hlavnou podmienkou mimotelových eliminačných metód je zabezpečenie kvalitného cievneho prístupu umožňujúceho vysoké prietoky krvi, ktoré sú potrebné na dosiahnutie požadovanej dialyzačnej dávky. Optimálny cievny prístup zaistí prívod krvi s objemom 200–500 ml za minútu do dialyzátoru, t. j. 50–150 litrov krvi v priebehu štandardnej dialyzačnej procedúry trvajúcej 4–5 hodín (33). KDIGO navrhuje zahájiť RRT u pacienta s AKI prostredníctvom netunelizovaného dialyzačného katétra (18). Ďalšou podmienkou je zabrániť zrážaniu krvi v mimotelovom obehu prostredníctvom antikoagulačnej liečby, výnimkou sú pacienti s krvácavými prejavmi. Najviac používanou systémovou antikoaguláciou v súčasnosti je antikoagulácia nefrakcionovaným alebo nízkomolekulovým heparínom a regionálna citrátová antikoagulácia. Voľba konkrétneho antikoagulancia závisí na jeho bezpečnosti, efektivite, praktickosti použitia a cene (22).
Akútna peritoneálna dialýza je jednou z možností očisťovania krvi u pacientov s akútnym renálnym zlyhaním. Podľa súčasných odporúčaní Medzinárodnej spoločnosti pre peritoneálnu dialýzu (International Society for Peritoneal Dialysis – ISPD) z roku 2014 je akútna peritoneálna dialýza indikovaná u dospelých pacientov len vtedy, ak nie sú iné dialyzačné metódy dostupné, resp. u pacientov, u ktorých ich nemožno použiť. Príčinou je technický pokrok v oblasti iných mimotelových eliminačných metód s použitím nových biokompatibilných membrán a dialyzačných roztokov s hydrogénuhličitanom sodným, ktoré sú účinné u hemodynamicky nestabilných pacientov. U detských pacientov sa peritoneálna dialýza využíva často pre jej výhody (5, 11). K absolútnym kontraindikáciám akútnej peritoneálnej dialýzy patrí akútna peritonitída, peritoneálna fibróza, omfalokéla, gastroschíza, diafragmatická hernia, extrofia močového mechúra, malígne ochorenie vnútrobrušných orgánov a nekrotizujúca enterokolitída (35). Relatívnou kontraindikáciou akútnej peritoneálnej dialýzy je nedávna vnútrobrušná operácia, mykotická peritonitída, celulitída brušnej steny, ťažká hyperkaliémia, nestabilné respiračné zlyhanie, edém pľúc, ťažká kachexia, AKI počas tehotenstva, ťažký gastroezofágový reflux a nefunkčnosť peritoneálnej dialýzy (1). Výhodou akútnej peritoneálnej dialýzy je technická nenáročnosť metódy, väčšia hemodynamická stabilita, nie je potrebná antikoagulácia a cievny prístup. Nevýhodou je menší clearance urey a kreatinínu a riziko peritonitídy.
PREVENCIA NEFROTOXICITY
Prevencia predstavuje významnú časť práce praktického lekára a má nezastupiteľné miesto aj v prípade AKI. Štúdia zameraná na prevenciu AKI preukázala, že takmer 1/3 prípadov AKI sa dá zabrániť adekvátnou lekárskou starostlivosťou. Pre obmedzené liečebné možnosti AKI je v súčasnosti práve prevencia jedinou dostupnou možnosťou redukcie krátkodobých aj dlhodobých následkov AKI (37). Látky s nefrotoxickým pôsobením je nutné indikovať veľmi uvážlivo, vždy v kontexte rozvahy prínos/riziko. Najčastejšie nefrotoxické príčiny AKI uvádza tabuľka 8 (30). Okrem sledovania a redukcie nefrotoxickej medikácie (nesteroidné antiflogistiká, inhibítory angiotenzín-konvertujúceho enzýmu, antibiotiká, inhibítory protónovej pumpy a ďalšie) treba na možnosť vzniku AKI myslieť aj pri vyšetreniach s aplikáciou kontrastných látok. Výskyt kontrastom indukovaného AKI totiž v posledných rokoch stúpol (pravdepodobne kvôli vyššiemu počtu kontrastných vyšetrení), preto sa tejto problematike venujeme podrobnejšie.
Kontrastom indukované AKI (z angl. contrast-induced acute kidney injury – CI-AKI) je závažnou komplikáciou intravaskulárneho podania kontrastnej látky pri rôznych vyšetreniach (CT, angiografia, katetrizácia srdca a ďalšie). Podľa Európskej spoločnosti pre urogenitálnu rádiológiu je definované ako vzostup sérového kreatinínu o ≥ 25 % bazálnej hodnoty alebo o ≥ 44 μmol/l (0,5 mg/dl) do 3 dní od intravaskulárnej aplikácie kontrastnej látky pri absencii inej etiológie ochorenia (9). CI-AKI sa objavuje asi u 30 % pacientov podstupujúcich vyšetrenie s jódovou kontrastnou látkou a je považované za tretiu najčastejšiu príčinu AKI u hospitalizovaných pacientov (10). Incidencia CI-AKI vo všeobecnej populácii je menej ako 2 %, avšak u pacientov s chronickou obličkovou chorobou a diabetom je zhruba 50% (21). Práve diabetes mellitus a preexistujúce poškodenie obličiek sú považované za hlavné rizikové faktory vzniku CI-AKI, ďalšími rizikovými faktormi sú hypertenzia, kongestívne srdcové zlyhávanie, vysoký vek, dehydratácia, hemodynamická instabilita, používanie nefrotoxickej medikácie a podanie veľkého množstva kontrastnej látky alebo podanie vysokoosmolárnej kontrastnej látky, novými rizikovými faktormi sú metabolický syndróm, prediabetes a hyperurikémia. V rámci preventívnych nefarmakologických opatrení je na prvom mieste vyhodnotenie rizika vzniku CI-AKI a skríning preexistujúceho poškodenia obličiek prostredníctvom vyšetrenia renálnych funkcií u pacientov, ktorí majú podstúpiť vyšetrenie s intravaskulárnym podaním kontrastnej látky. Za hraničnú hodnotu pre vznik klinicky významného rizika vzniku CI-AKI KDIGO považuje hodnotu eGFR < 45 ml/min/1,73 m2. Ďalším opatrením je zváženie iných zobrazovacích vyšetrovacích metód u pacientov vo zvýšenom riziku vzniku CI-AKI a používanie izoosmolárnych a nízkoosmolárnych jódových kontrastných látok v najnižších možných dávkach. Z farmakologických opatrení je na prvom mieste dostatočná hydratácia prostredníctvom izotonických kryštaloidov, odporúča sa i.v. podávanie izotonického roztoku NaCl alebo NaHCO3 (18). V literatúre môžeme nájsť rôzne dávkovanie a dĺžku podávania, najčastejšie sa však stretávame so schémou 1–3 ml/kg/h 1–12 hodín pred a 1 ml/kg/h 6 hodín po vyšetrení v prípade fyziologického roztoku, v prípade roztoku bikarbonátu je najpoužívanejšou schéma 3 ml/kg/h 1 hodinu pred a 1 ml/kg/h 6 hodín po vyšetrení (38). Stále diskutovaná ostáva téma voľby roztoku, v recentne publikovanej štúdii na pacientoch podstupujúcich angiografiu sa zistilo, že periprocedurálne i.v. podávanie fyziologického roztoku je z hľadiska prevencie CI-AKI zrovnateľné s podávaním bikarbonátu (36). Diskutovaná a skúmaná je aj otázka podávania N-acetylcysteínu, závery doposiaľ vykonaných štúdií sú však rozporuplné. KDIGO odporúča spolu s i.v. kryštaloidmi podávať aj N-acetylcysteín p.o. u pacientov vo zvýšenom riziku vzniku CI-AKI pre jeho nízku cenu a málo nežiaducich účinkov (18). Okrem týchto opatrení bolo a je skúmaných viacero liečiv, ktoré by potenciálne mohli redukovať výskyt CI-AKI (napr. statíny, trimetazidín, kyselina askorbová a ďalšie), avšak štúdie s týmito liekmi tiež zatiaľ nepriniesli jednoznačné výsledky a odporúčania.
ZÁVER
Akútne obličkové poškodenie a akútne renálne zlyhanie predstavujú jeden z najzávažnejších medicínskych problémov, jednak pre diagnostické obtiaže, jednak pre terapeutické intervencie, ale aj možné komplikácie a následky. Odporúčania KDIGO sa nám snažia napomôcť v manažmente pacienta s AKI, avšak stále ešte chýba mnoho výsledkov štúdií, ktoré by mohli priniesť užitočné informácie pre diagnostiku (najmä biomarkery AKI), liečbu (najmä farmakologickú, ale aj liečbu nahrádzajúcu funkciu obličiek) a prevenciu nefrotoxicity u rizikových pacientov. Ostáva nám veriť, že výsledky týchto štúdií nám v budúcnosti prinesú potrebné odpovede, a tak bude ochorenie zvládnuteľné spoluprácou viacerých špecialistov vrátane praktického lekára.
Stret záujmov: žiadny.
ADRESA PRO KORESPONDENCI:
MUDr. Laura Slezáková
Dialyzačné stredisko Bratislava, B. Braun Avitum s.r.o.
Hlučínska 3, 831 03 Bratislava, SR
e-mail: laura.guzikova@gmail.com
Sources
1. Ansari N. Peritoneal dialysis in renal replacement therapy for patients with acute kidney injury. Int J Nephrol 2011; doi:10.4061/2011/739794
2. Brivet FG, Kleinknecht DJ, Loirat P, Landais PJ. Acute renal failure in intensive care units-causes, outcome, and prognostic factors of hospital mortality; a prospective, multicenter study. French Study Group on Acute Renal Failure. Crit Care Med 1996; 24(2): 192–198.
3. Bywaters EGL, Beall D. Crush injuries with impairment of renal function. Br Med J 1941; 1(4185): 427–432.
4. Cerdá J, Bagga A, Kher V, Chakravarthi RM. The contrasting characteristics of acute kidney injury in developed and developing countries. Nat Clin Pract Nephrol 2008; 4(3): 138–153.
5. Cullis B, Abdelraheem M, Abrahams G, et al. ISPD Guidelines/recommendations: peritoneal dialysis for acute kidney injury. Perit Dial Int 2014; 34(5): 494–517.
6. Davies F, Weldon R. A contribution to the study of „war nephritis“. Lancet 1917; 1(4873): 118–120.
7. Ding X, Ronco C. Acute kidney injury: from diagnosis to care. Basel: Karger 2016.
8. Eknoyan G. Emergence of the concept of acute renal failure. Am J Nephrol 2002; 22(2–3): 225–230.
9. European Society of Urogenital Radiology. Non-renal adverse reactions (on line) (cit. 2017-12-30). Dostupné na: http://www.esur.org/guidelines/
10. Fähling M, Seeliger E, Patzak A, Persson PB. Understanding and preventing contrast-induced acute kidney injury. Nat Rev Nephrol 2017; 13(3): 169–180.
11. Gaião S, Finkelstein FO, de Cal M, et al. Acute kidney injury: are we biased against peritoneal dialysis? Perit Dial Int 2012; 32(3): 351–355.
12. Girman CJ, Kou TD, Brodovicz K, et al. Risk of acute renal failure in patients with Type 2 diabetes mellitus. Diabet Med 2012; 29(5): 614–621.
13. Charlton JR, Portilla D, Okusa MK. A basic science view of acute kidney injury biomarkers. Nephrol Dial Transplant 2014; 29(7): 1301–1311.
14. Chittineni H, Miyawaki N, Gulipelli S, Fishbane S. Risk for acute renal failure in patients hospitalized for decompensated congestive heart failure. Am J Nephrol 2007; 27(1): 55–62.
15. Christiansen CF, Johansen MB, Langeberg WJ, et al. Incidence of acute kidney injury in cancer patients: a Danish population-based cohort study. Eur J Intern Med 2011; 22(4): 399–406.
16. Kellum JA, Levin N, Bouman C, Lameire N. Developing a consensus classification system for acute renal failure. Curr Opin Crit Care 2002; 8(6): 509–514.
17. Kheterpal S, Tremper KK, Heung M, et al. Development and validation of an acute kidney injury risk index for patients undergoing general surgery: results from a national data set. Anesthesiology 2009; 110(3): 505–515.
18. Kidney Disease: Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group. KDIGO Clinical Practice Guideline for Acute Kidney Injury. Kidney Int Suppl. 2012; 2(1): 1–138.
19. Liano F, Pascual J. Epidemiology of acute renal failure: a prospective, multicenter, community-based study. Madrid Acute Renal Failure Study Group. Kidney Int 1996; 50(3): 811–818.
20. Libório AB, Abreu KL, Silva GB Jr, et al. Predicting hospital mortality in critically ill cancer patients according to acute kidney injury severity. Oncology 2011; 80(3-4): 160-166.
21. Manske CL, Sprafka JM, Strony JT, et al. Contrast nephropathy in azotemic diabetic patients undergoing coronary angiography. Am J Med 1990; 89(5): 615–620.
22. Matějovič M. KDIGO doporučení pro akutní poškození ledvin 2012 – komentovaný výběr z doporučení. Anest Intenziv Med 2012; 23(5): 264–274.
23. Mittalhenkle A, Stehman-Breen CO, Shlipak MG, et al. Cardiovascular risk factors and incident acute renal failure in older adults: the cardiovascular health study. Clin J Am Soc Nephrol 2008; 3(2): 450–456.
24. Národné centrum zdravotníckych informácií. Nefrologická starostlivosť a liečba nahrádzajúca funkciu obličiek v SR 2016. Bratislava: Národné centrum zdravotníckych informácií 2017.
25. Prowle JR, Echeverri JE, Ligabo EV, et al. Fluid balance and acute kidney injury. Nat Rev Nephrol 2010; 6(2): 107–115.
26. Susantitaphong P, Cruz DN, Cerda J, et al. World incidence of AKI: a meta-analysis. Clin J Am Soc Nephrol 2013; 8(9): 1482–1493.
27. Teplan V. Praktická nefrologie. 2. zcela přepracované a doplněné vydání. Praha: Grada Publishing 2006.
28. Teplan V. Nefrologické minimum pro klinickou praxi. Praha: Mladá fronta 2013.
29. Teplan V. Nefrologie vyššího věku. Praha: Mladá fronta 2015.
30. Tesař V, Viklický O. Klinická nefrologie. 2. zcela přepracované a doplněné vydání. Praha: Grada Publishing 2015.
31. Uchino S, Kellum JA, Bellomo R, et al. Acute renal failure in critically ill patients: a multinational, multicenter study. JAMA 2005; 294(7): 813–818.
32. Ústav zdravotnických informací a statistiky ČR. Zdravotnická ročenka České republiky 2015. Praha: ÚZIS ČR 2016.
33. Viklický O, Rajnochová-Bloudíčková S. Současné možnosti léčby nezvratného selhání ledvin. Vnitř. Lék. 2013; 59(8): 747–751.
34. Viklický O, Tesař V, Dusilová Sulková S, a kol. Doporučené postupy a algoritmy v nefrologii. Praha: Grada Publishing 2010.
35. Walters S, Porter C, Brophy D. Dialysis and pediatric acute kidney injury: choice of renal support modality. Pediatr Nephrol 2009; 24(1): 37–48.
36. Weisbord SD, Gallagher M, Jneid H, et al. Outcomes after Angiography with Sodium Bicarbonate and Acetylcysteine. N Engl J Med 2017; Nov 12. doi: 10.1056/NEJMoa1710933. (Epub ahead of print).
37. Yamout H, Levin ML, Rosa RM, et al. Physician Prevention of Acute Kidney Injury. Am J Med 2015; 128(9): 1001–1006.
38. Zhang B, Liang L, Chen W, et al. The efficacy of sodium bicarbonate in preventing contrast-induced nephropathy in patients with pre-existing renal insufficiency: a meta-analysis. BMJ Open 2015; 5(3): e006989.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2018 Issue 1-
All articles in this issue
- Současný pohled na otravu oxidem uhelnatým v České republice
- Násilie a agresia pri výkone povolania v zdravotníckych zariadeniach
- Akútne renálne zlyhanie a akútne obličkové poškodenie
- Hodnocení nutričního příjmu pacientů po endoskopické gastroplikaci
- Pacient má rodinu! Individualizovaná péče v systemickém pojetí
- Zdravotní gramotnost je i u mladých vysokoškoláků stále velmi nízká
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Akútne renálne zlyhanie a akútne obličkové poškodenie
- Násilie a agresia pri výkone povolania v zdravotníckych zariadeniach
- Současný pohled na otravu oxidem uhelnatým v České republice
- Pacient má rodinu! Individualizovaná péče v systemickém pojetí
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career