-
Medical journals
- Career
Primární prevence v onkologii
Authors: P. Klener
Authors‘ workplace: Přednosta: prof. MUDr. Marek Trněný, CSc. ; 1. interní klinika 1. LF, VFN a ÚHKT, Praha
Published in: Prakt. Lék. 2011; 91(9): 512-516
Category: Reviews
Overview
Výskyt nádorových onemocnění v celosvětovém měřítku neustále narůstá. Stává se proto podnětem pro preventivní opatření, která by mohla výskyt nádorů omezit. Primární prevence nádorů zahrnuje předně identifikaci faktorů spojených s rozvojem nádorového onemocnění. Tyto rizikové faktory jsou stručně shrnuty. Primární prevence může být orientována jednak na faktory zevního a pracovního prostředí, jednak na úpravu životního stylu. Je to především:
- zanechání kouření,
- omezení konzumace alkoholu,
- omezení přejídání, a
zanechání nezdravých životních návyků.
Protektivní význam mají též různé přírodní látky z potravy. Dieta bohatá na ovoce a zeleninu má protektivní účinky díky účinku rozmanitých substancí jako jsou- luteolin,
- resveratrol,
- lycopen a další.
Chemoprotektivní účinek byl nalezen také u jiných látek, jako jsou- retinoidy,
- nesteroidní antirevmatika,
- antihormony,
- deltanoidy, a
- inhibitory alfa-reduktázy.
Je zmíněn jejich profylaktický účinek u různých druhů maligních nádorů.Klíčová slova:
zhoubné nádory, primární prevence, rizikové a protektivní faktory, chemoprevence.Úvod
Nádorová onemocnění patří k nejčastějším příčinám úmrtí a jejich výskyt neustále narůstá (1), jak je patrno z obr. 1. Ačkoliv moderní medicína umožňuje dnes relativně včasnou diagnostiku a nové léčebné metody i úspěšnější léčbu, je evidentní, že je třeba vyvinout maximální úsilí, jak vzniku nádorového onemocnění předejít. To je hlavní náplní tzv. primární prevence, která se opírá jednak o nové poznatky v patogenezi nádorového procesu, jednak o analýzy vlivu nejrůznějších rizikových faktorů na výskyt různých druhů zhoubných nádorů.
Image 1. Incidence a mortalita na zhoubné nádory v ČR v letech 1977–2007 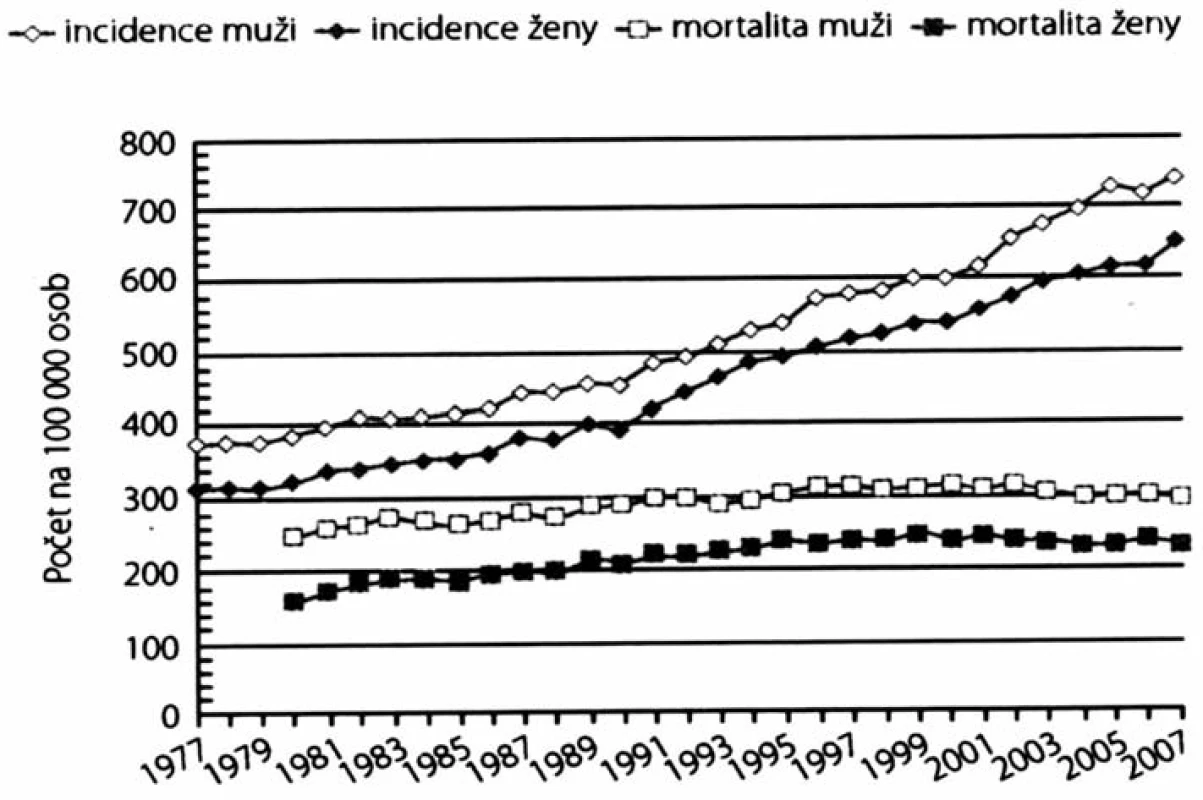
K pochopení principů preventivních opatření je nutná znalost rizikových faktorů kancerogeneze.
I. Rizikové faktory
Faktory, které se podílejí na vzniku zhoubného bujení, jsou značně různorodé (2). Kromě kouření, způsobu života, stravovacích návyků, se na vzniku zhoubných nádorů spolupodílejí faktory fyzikální, chemické a biologické. Jejich společnou vlastností je působení genetických změn, na jejichž podkladě dochází k aktivaci onkogenů, nebo inaktivaci antionkogenů.
V přehledu uvádíme rizikové faktory v tab. 1.
Table 1. Rizikové faktory ovlivňující vznik zhoubných nádorů 
Kouření
se považuje za jeden z vyvolávajících činitelů nádorového bujení až u 30 % všech zhoubných nádorů. Nikotin sám sice není kancerogenní, ale tabákový kouř obsahuje více než 40 kancerogenních látek. Hlavním kancerogeny jsou
- benzpyren, a
- nitrosaminy.
Kromě opakovaně prokázaného vlivu na vznik bronchogenního karcinomu se předpokládá podíl kouření při vzniku karcinomů
- dutiny ústní,
- žaludku,
- pankreatu,
- močového měchýře.
Kancerogenní účinky byly prokázány po požívání alkoholu.
Zvýšená konzumace tzv. tvrdého alkoholu přispívá ke vzniku karcinomu dutiny ústní, laryngu a nepřímo též ke vyššímu výskytu hepatocelulárního karcinomu vznikajícího na podkladě alkoholické cirhózy.
Omezené pití vína může mít naopak protektivní účinek, jak bude zmíněno dále.
Způsob výživy
a vztah nutričních faktorů ke vzniku nádorů ke již po desetiletí předmětem usilovného studia (3). Odhaduje se, že se podílí na vzniku nádorů až 30 %. Údaje se opírají o výsledky studií tzv. nutriční epidemiologie, která porovnává incidenci nádorů ve vztahu ke způsobu výživy.
Mezi prokázané rizikové faktory patří obezita u karcinomu endometria, prsu a prostaty (v tukové tkáni se konvertuje androstendion na estron).
Podobně zvyšuje riziko u těchto nádorů nadměrný příjem tuků s vysokým obsahem nasycených mastných kyselin. Nadměrný příjem tuků je i rizikovým faktorem pro vznik kolorektálního karcinomu. Vede totiž ke zvýšené produkci žluči (žlučové kyseliny mají kancerogenní účinek).
Nedostatečný přívod vitaminů zejména A, C a E přináší zvýšené riziko vzniku bronchogenního karcinomu.
Nevhodný způsob přípravy potravy; jde zejména o pečení na otevřeném ohni nebo zvýšenou konzumaci uzených potravin obsahujících větší množství kancerogenů. Riziko vyplývající z konzumace červeného masa pro vznik kolorektálního karcinomu nebylo spolehlivě doloženo (4).
Z fyzikálních faktorů
je největším rizikem ionizující záření. Ohroženi jsou zejména pracující se zdroji ionizačního záření, horníci v uranových dolech.
Ultrafialové záření, respektive ultrafialová část spektra slunečního záření má kancerogenní účinky závislé na vlnové délce. V pásmu B (290–320 nm) má toto záření schopnost přímého poškození DNA.
Mezi chemické kancerogeny
patří těžké kovy (Cd, Be, Co, Ni), dále arsen, polycyklické aromatické uhlovodíky (benzpyren, methylcholantren, aj.) obsažené v dehtu, v tabákovém kouři a v průmyslových exhalacích. Mezi kancerogeny endogenního původu počítáme některé steroidní hormony, především estrogeny (u karcinomu prsu) a androgeny (u karcinomu prostaty).
Biologické faktory
jsou představovány především DNA i RNA viry (5). V omezeném měřítku mohou vznik nádorů podpořit i některé bakterie.
Z RNA virů (retrovirů) se připisuje význam viru HTLV-1 při vzniku T-leukémií a lymfomů.
Z DNA virů se uplatňují papilomaviry při vzniku karcinomu děložního hrdla a hepadna viry (HBV – virus hepatitidy B) při vzniku karcinomu jater.
Z bakterií Helicobacter pylori spolupůsobí při vzniků maltomů žaludku a karcinomu žaludku.
II. Protektivní faktory
Znalost protektivních faktorů je mimořádně důležitá pro primární prevenci nádorových onemocnění. Lze je shrnout přibližně do 4 okruhů (tab. 2).
Table 2. Protektivní faktory omezující vznik nádorového bujení 
Způsob života
V primární prevenci mohou mít protektivní účinek především některé nutriční faktory. Je to zejména dostatek vlákniny, jako protektivní faktor vzniku kolorektálního karcinomu. Vlákninou rozumíme jednak různé nefermentovatelné polysacharidy (celulóza, lignin), jednak částečně fermentovatelné hydroslubilní součásti (pektiny, hemicelulóza). Zatímco nerozpustné polysacharidy adsorbují různé kancerogeny v potravě, zkracují tranzitní čas průchodu tráveniny střevem a snižují tak expozici alimentárním kancerogenům, fermentabilní komponenty stimulují bakteriální flóru, snižují pH a brání nadměrnému vzniku genotoxických fecapentaenů. Vlákninu obsahuje především ovoce, zelenina, obilniny celozrnné pečivo, aj.
Ovoce a zelenina jsou navíc důležitým zdrojem vitaminů. Vitamíny A, C a E mají antioxidační účinky a mohou tak rušit mutagenní účinky kyslíkových radikálů.
Dostatek fyzické aktivity se rovněž považuje za protektivní faktor, neboť omezuje vznik obezity, významného rizikového faktoru (6).
Ochrana před ozářením spočívá u ionizujícího záření v používání ochranných pomůcek a pečlivé kontrole dozimetrických údajů. Ultrafialovému záření se lze chránit omezením nadměrného slunění a používáním slunečních krémů s ochranným faktorem.
Protektivní látky v potravinách
Protektivní účinky se studují preklinicky i klinicky u mnoha desítek přirozených látek, obsažených v různých potravinách. Tyto látky ovlivňují metabolismus kancerogenů a omezují jejich biologické účinky. Mohou např. blokovat aberantně aktivované signální dráhy, většina však působí jako antioxidanty. Obzvláště vysoký obsah antioxidantů se nachází v zeleném čaji.
Z nápojů byly protektivní účinky popsány u vína, přisuzované obsahu resveratrolu (7). Přírodní antioxidant, který se vyskytuje ve vysokém množství v rajčatech, melounu a papáje je lycopen (8). Flavonoidy (luteolin) a fytoestrogeny (genistein) se nacházejí v listové zelenině (9, 10). Betaglukany obsažené v houbách mohou příznivě ovlivnit protinádorovou imunitu (11).
V tab. 3 je přehled výskytu těchto protektivních látek v různých druzích potravin. Většina z těchto látek má synergický účinek s protinádorovou chemoterapií. Proto konzumace těchto potravin může být užitečná i u již vzniklého a léčeného nádorového onemocnění.
Table 3. Preventivní látky v potravinách 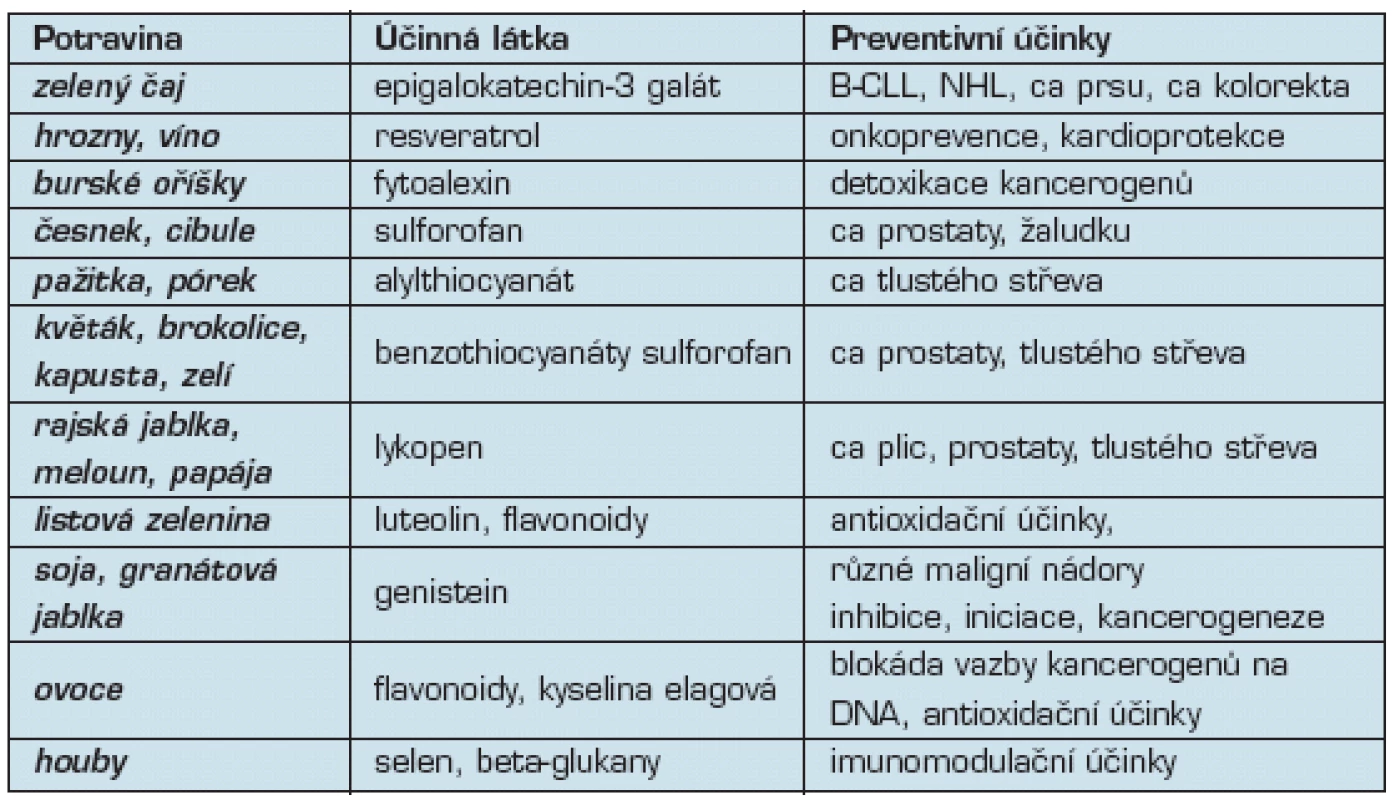
Očkování
Prokazatelný preventivní účinek mají i profylaktické vakcíny u nádorů, při jejichž vzniku se uplatňují viry (12). Je to vakcína proti hepatitidě B, snižující velmi podstatně riziko vzniku hepatocelulárního karcinomu. Dále je to vakcína, respektive vakcíny proti papilomavirům (HPV).
Papilomaviry jsou onkogenní viry odpovědné za vznik
- téměř 70 % karcinomů děložního čípku,
- 59 % karcinomů vulvy a vaginy, a
- 25 % karcinomů ORL oblasti.
Papilomaviry typu 6 a 11 způsobují papilomatózu laryngu a condylomata accuminata. Profylaktické vakciny mohou toto onkogenní působení HPV eliminovat (13).
K dipsozici jsou dvě vakcíny Je to
- Cervarix, divalentní vakcína (genotypy 16 a 18), a
- Gardasil - tetravalentní vakcína (genotypy 6, 11, 16 a 18).
Obě vakcíny jsou silně imunogenní a z hlediska příjemce bezpečné.
Chemoprevence
Chemoprevencí rozumíme použití přirozených nebo syntetických látek za účelem prevence vzniku nádoru a/nebo zpomalení, zastavení či zvratu již započatého kancerogenního procesu. Kancerogeneze je složitý vícestupňový proces, ve kterém může organismus poruchu regulačních a proliferačních mechanismů v mnoha případech upravit sám. Pokud obranné mechanismy selžou, dochází k vývoji maligní léze od lokální prekancerózy po metastazující vysoce maligní nádor. Tento proces může trvat leta a vyžadovat řadu klíčových mutací nádorových buněk.
První pokusy o využití chemopreventiv se datují do počátku 70. let minulého století s použitím retinoidů (14, 15, 16).
Retinoidy
jsou přirozené nebo syntetické deriváty retinolu (vitamín A). Mají mnohostranné biologické účinky zejména
- antiproliferační,
- diferenciační, a
- proapoptotické.
Do buňky pronikají difúzí, v cytoplasmě účinkem izomeráz vznikají jejich deriváty, které po průniku do jádra se váží na specifické receptory RAR (Obr. 2 ). Klasické retinoidy se váží na RAR, rexinoidy na RXR a zjednodušeně řečeno, regulují pak expresi řady cílových genů (17).
Image 2. Mechanismus chemoprotektivního účinku retinoidů a rexinoidů Legenda: RA – retinoid acid, RAR – retinoid acid receptor, C-RARE – retinoid acid response element 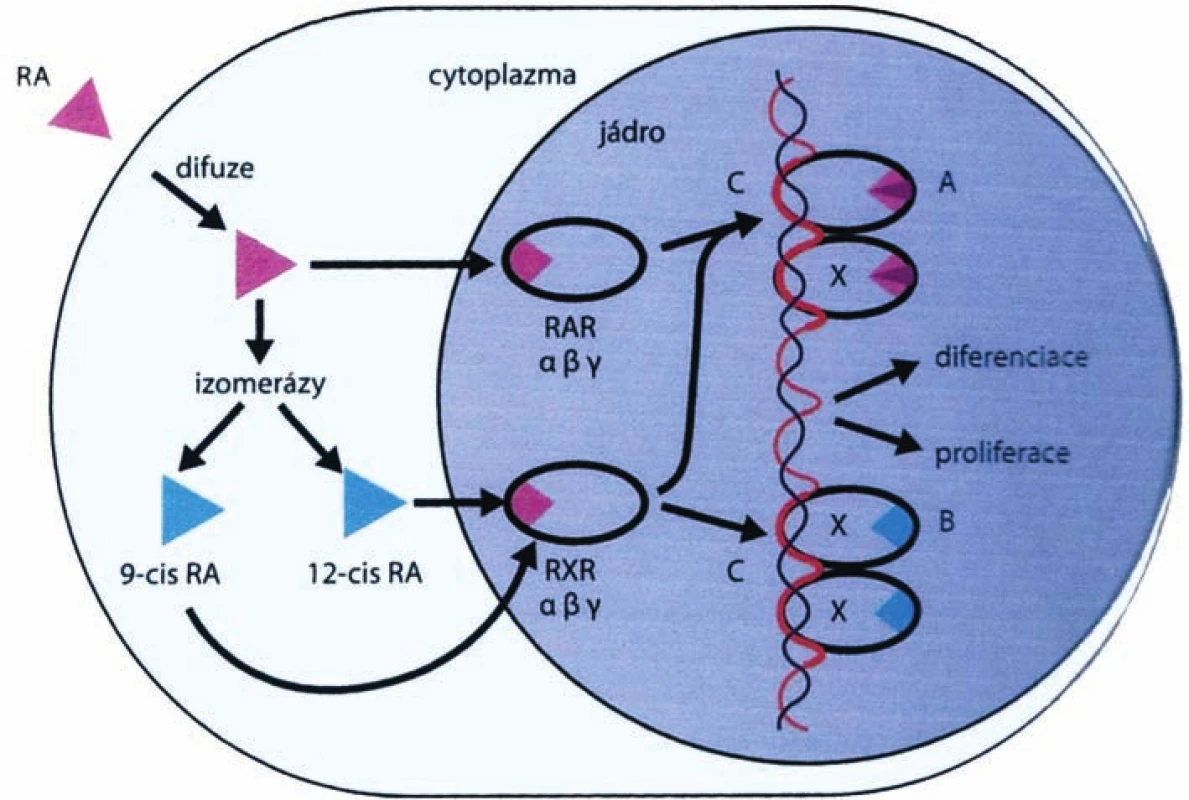
Chemoprotektivní účinky byly popsány u karcinomu prsu, prostaty a močového měchýře s přípravky fenretinid a isotretinoin, diferenciační účinky se využívají v léčbě akutní promyelocytární leukémie, kde se používá tretinoin (Vesanoid) (18). Z rexinoidů se v praxi osvědčil pouze bexaroten (Targetin) v léčbě kožních lymfomů.
Nesteroidní antirevmatika (NSAID)
vykazují své účinky převážně inhibicí cyklooxigenázy (COX) (19). Na chemoprotektivní účinky se po prvé poukázalo na základě výsledků epidemiologických studií, které prokázaly, že nemocní pravidelně užívající NSAID např. pro revmatoidní artritidu, vykazovali signifikantně nižší incidenci kolorektálního karcinomu.
Ve tkáních některých nádorů (karcinom prsu, kolorekta) byla zjištěna vysoká koncentrace prostaglandinů, které mají stimulační účinky na premaligní a maligní buňky (20). Zvýšená koncentrace prostaglandinů je důsledkem zvýšené aktivity COX v nádorové tkáni. COX má dvě izoformy:
- COX1, a
- COX2.
Exprese COX2 bývá často indukována za patologických okolností, např. v premaligních lézích s mutací genu APC. Zvýšená exprese COX2 pak vede k nadprodukci biologicky aktivních eikosanoidů a ke zvýšené expresi dalších látek podporujících kancerogenezi (21, 22).
Většina používaných NSAID působí inhibici obou izoforem COX. NSAID se převážným nebo selektivním inhibičním účinkem na COX2 jsou nimesulid (Aulin) celecoxib (Celebrex) meloxicam (Metcam).
Antiestrogeny a inhibitory aromatáz
U karcinomu prsu se v léčbě využívají přípravky blokující účinnost hormonů podílejících se na vzniku nádoru. Tyto inhibitory mají nejen léčebný ale také preventivní účinky. Jedná se zejména o antiestrogeny, vhodněji označované jako SERM (selective estrogen receptor modulators), popřípadě SERD (selective estrogen down regulators) (23).
Nejrozšířenějším SERM je tamoxifen, který eliminuje stimulační účinek estrogenů na epitel prsní žlázy. Kromě toho tamoxifen indukuje syntézu některých antiproliferačních cytokinů (např. TGF-beta) a naopak snižuje koncentraci stimulačních faktorů (IGF-1).
Podobné účinky mají i jiné přípravky SERM (raloxifen, arzoxifen). SERD na rozdíl od SERM nemají současný agonistický estrogenní účinek, který může být odpovědný za stimulaci epitelu dělohy s rizikem vzniku karcinomu.
Inhibitory aromatáz (anastrozol, letrozol) rovněž blokují tvorbu estrogenů. Vykazují vyšší účinnost než antiestrogeny a snižují riziko vzniku kontralaterálního karcinomu prsu.
Inhibitory 5-alfa reduktázy
Při vzniku karcinomu prostaty má klíčový význam metabolit testosteronu 5-alfa-dihydrotestosteron s vysokou afinitou k androgenním receptorům. Dihyrotestosteron vzniká z testosteronu účinkem 5-alfa-reduktázy (24). Mezi inhibitory tohoto enzymu patří finasterid (Proscar), který je schopen redukovat prevalenci karcinomu prostaty až o 25 %. Omezuje jak vznik intraepiteliální neoplazie, tak i vznik agresívních forem karcinomu prostaty.
Podobným inhibitorem s delším biologickým poločasem je dutasterid (Avodart, Tamsulosin) (25).
Deltanoidy
Deltanoidy jsou deriváty vitaminu D3, cholekalciferolu. Ten vzniká endogenně v kůži ze 7-dehydrocholesterolu účinkem UV-B záření a je následně hydroxylován v játrech a v ledvinách na aktivní formu vitaminu D3 – kalcitriol. Kromě jeho regulační funkce pro metabolismus vápníku a fosfátů se prokázalo, že kalcitriol vykazuje antiproliferační, antiangiogenní a antimetastatické účinky (26)
Z epidemiologických studií vyplynulo, že intenzita slunečního záření negativně koreluje s prevalencí některých nádorů, a to karcinomů
- prostaty,
- prsu,
- ovaria, a
- kolorekta.
Tato protektivní role slunečního záření je zprostředkována právě chemoprotektivním účinkem kalcitriolu (27, 28).
Jiné chemopreventivní látky
Existuje mnoho dalších látek schopných modifikovat nebo omezovat rozvoj nádorového bujení. Jsou to např. různá antioxidancia vychytávající volné radikály (vitamin E, N-acetylcystein, L-karnitin, aj.). Kyslíkové radikály mohou totiž působit jako sekundární promotory vzniku mutací, které vedou k indukci onkogenů. Studují se také účinky selenu, který zvyšuje aktivitu různých antioxidačních enzymů (29).
Závěr
Preventivní a protinádorové účinky všech výše zmíněných přípravků a opatření byly klinicky i experimentálně opakovaně ověřeny, i když nezaručují stoprocentní ochranu před vznikem nádorového bujení. Naproti tomu na internetu a v jiných médiích jsou propagovány desítky (možná stovky) nejrůznějších přípravků a metod se „zaručeným“ protinádorovým účinkem. Jde o neprověřené, většinou sice neškodné, ale v podstatě neúčinné přípravky, za které nemocní zcela neúčelně utrácejí značné finanční obnosy. Před těmito „potravními doplňky“ je třeba důsledně varovat.
Prof. MUDr. Pavel Klener, DrSc.
1. interní klinika VFN
U nemocnice 2
120 26 Praha 2
E-mail: pavel.klener@ruk.cuni.cz
Sources
1. Dušek, L., Mužík, J., Gelnarová, E. et al. Cancer incidence and mortality in the Czech Republic. Klin. Onkol. 2010, 23, p. 311-324.
2. Klener, P. Kancerogenní faktory. In: Klener P: Klinická onkologie. Praha: Galén, 2002, s. 40-46.
3. Donaldson, M.S. Nutrition and cancer: A review of the evidence for anti-cancer diet. Nutr. J. 2004, 3, p. 1186-1201.
4. Alexander, D., Weed, D., Cushing, C. et al. Meta-analysis of prospective study of red meat consumption and colorectal cancer. Eur. J. Cancer. Prev. 2011, 20, p. 293-307.
5. Boccardo, E., Villa, L.L. Viral origin of human cancer. Curr. Med. Chem. 2007, 14, p. 2526-2739.
6. Calle, E.E., Rodriguez, C., Walker-Thurmond, K. et al. Overweight, obesity and mortality from cancer in a prospectively studied cohort of US adults. N. Engl. J. Med 2003, 348, p. 1625-1638.
7. Huang, X., Zhu, H.L. Resveratrol and its analogues: promising antitumor agents. Anticancer Agents Med. Chem. 2011, 11, p. ,479-490.
8. Basu, A., Imrhan, V. Tomatoes versus lycopene in oxidative stress and carcinogenesis: Conclusion from clinical trials. Eur. J. Clin. Nutr. 2007, 61, p. 295-303.
9. López-Lázaro, M. Distribution and biological activities of the flavonoid luteolin. Mini Rev. Med. Chem. 2009, 9, p. 31-59.
10. Potter, J.D., Steinmetz, K. Vegetables, fruit and phytoestrogens as preventive agents. IARC Sci. Publ. 1996, 139, p. 61-90.
11. Borechers, A.T., Stem, J.S., Hackman, R.M. et al. Mushrooms, tumors, and immunity. Proc. Soc. Exp. Biol. Med. 1999, 221, p. 281-293
12. Andersen, M.H., Sørensen, R.B., Schrama, D. Cancer treatment:the combination of vaccination with other therapies. Cancer Immunol. Immunother. 2008, 57, p. 1735-1743.
13. Sláma, J. Očkování proti HPV. Klin. Farmakol. Farm. 2008, 22, s. 153-155.
14. Kellof, G.I., Boone, C.W., Crwell, J.A. et al. New agents for cancer chemoprevention. J. Cell. Biochem. 1996, 26, p. 28-36.
15. Rahul Amin, A.R.M., Kucuk, O., Khuri, F.R. et al. Perspectives for cancer prevention with natural compounds. J. Clin. Oncol. 2009, 22, p. 2712-2725.
16. Amin, A.R., Kucuk, O., Khuri, F.R. et al. Perspectives for cancer prevention with natural compounds. J. Clin. Oncol. 2009, 27, p. 2712-2725.
17. Gerattini, E., Gianni, M., Terao, M. Retinoids as differentiating agents in oncology: a network of interactions with intracellular pathways as the basis for rational therapeutic combinations. Curr. Pharm. Des. 2007, 13, p. 1375-1400.
18. Nowak, D., Stewart, D., Koeffler, H.P. Differentiation therapy of leukemia: 3 decades of development. Blood 2009, 113, p. 3655-3665.
19. Fujimura, T., Ohta, T., Oyama, K. et al. Cyclooxygenase-2 (COX-2) in carcinogenesis and selective COX-2 inhibitors for chemoprevention in gastrointestinal cancers. J. Gastrointest. Cancer. 2007, 38, p. 78-82.
20. Rao, C.V., Reddy, B.S. NSAIDs and chemoprevention. Curr. Cancer. Drug. Targets. 2004, 4, p. 29-42.
21. Rizzo, M.T. Cyclooxygenase-2 in oncogenesis. Clin. Chim. Acta 2011, 11, p. 671-687.
22. Lanas, A., Ferrandez, A. NSAIDs and the colon. Curr. Opin. Gastroenterol. 2009, 25, p. 44-49.
23. Bauman, C.K., Castiglione-Gertsch, M. Clinical use of selective estrogen receptor modulators and down regulators with main focus on breast cancer. Minerva Gynecol. 2009, 61, p. 517-539.
24. Sarvis, J.A., Thomson, T.M. Prostate cancer chemoprevention: update of the prostate cancer prevention trial findings and implication for clinical practice. Curr. Oncol. Rep. 2008, 10, p. 529-532.
25. Nickel, J.C., Gilling, P., Tammela, T.L. et al. Comparison of dutasteride and finasteride for treating benign prostatic hyperplasia: The enlarged prostate international comparator study (EPICS). BJU Int. 2011, 108, p. 388-394.
26. Goodwin, P.J., Ennis, M., Pritchard, K.I. et al. Prognostic effects of 25-hydroxyvitamin D levels in early breast cancer. J. Clin. Oncol. 2009, 27, p. 3757-3763.
27. Agoston, E.S., Hatcher, M.A., Kensler, T.W. et al. Vitamin D as anti-cancer agents. Anticancer Agents Med. Chem. 2006, 6, p. 53-71.
28. Spina, C.S., Tangpricha, V., Uskokovic, M. et al. Vitamin D and cancer. Anticancer Res. 2006, 26, p. 2515-2524.
29. Brozmanová, J. Selén a rakovina. Od prevencie k liečbe. Klin. Onkol. 2011, 24, s. 171-179.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2011 Issue 9-
All articles in this issue
- Demodikóza
- Glomus tumor prstu
- Sto rokov alergénovej imunoterapie, prvý rok sublingválnej tabletovej formy Oralair
-
Základy kognitivní, afektivní a sociální neurovědy
IX. Altruismus - Primární prevence v onkologii
- Ortostatická hypotenzia
- Celoživotní vzdělávání všeobecných praktických lékařů v ČR a nová pravidla ČLK
-
Program Zdraví 2020
Budoucnost evropské zdravotní politiky - Pohled mladých českých praktiků na specializační vzdělávání – dotazníkový výzkum
- Interakce alkoholu a jiných látek: komplikovaný problém
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Ortostatická hypotenzia
- Glomus tumor prstu
- Demodikóza
- Interakce alkoholu a jiných látek: komplikovaný problém
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

