-
Medical journals
- Career
Netuberkulózní mykobakteriózy
Authors: I. Hricíková; M. Šterclová; M. Vašáková
Authors‘ workplace: Primářka: doc. MUDr. Martina Vašáková, PhD. ; Fakultní Thomayerova nemocnice s poliklinikou, Praha ; Přednosta: prof. MUDr. Jiří Homolka, DrSc. ; Pneumologická klinika 1. LF UK
Published in: Prakt. Lék. 2011; 91(3): 144-147
Category: Of different specialties
Overview
Netuberkulózní mykobaktéria (NTM) jsou v poslední době stále častěji identifikována jako původci onemocnění u člověka. Onemocnění NTM je granulomatózní zánětlivé onemocnění postihující u dospělé populace převážně plíce. V klinickém obraze dominuje kašel, pocení a hubnutí. Klíčové postavení v diagnostice a později i léčbě má bakteriologické vyšetření sputa, případně materiálu získaného při bronchoskopii nebo plicní biopsii. Léčba NTM je zahajována po splnění všech kritérií pro diagnózu – existující klinické příznaky, odpovídající radiologický nález a průkaz netuberkulózních mykobakterií ve vyšetřovaném materiálu. Léčba je obvykle dlouhodobá a spočívá v podání kombinace antibiotik a chemoterapeutik.
Klíčová slova:
netuberkulózní mykobaktéria, plicní mykobakterióza, diagnostická kritéria, kombinovaná terapie.Úvod
Mykobakterióza je granulomatózní, zánětlivé onemocnění vyvolané netuberkulózními mykobaktériemi (NTM), postihující u dospělé populace převážně plíce. Etiologickým agens jsou mykobaktérie, které jsou všudypřítomné. Najdeme je ve vodě (sladké i slané), vodovodním potrubí, studních, akváriích, hlíně, prachu, dále je můžeme izolovat z peří, srsti a sekretů domácích zvířat a domácích i volně žijících ptáků. Přesto dosud nebyl evidován přenos mykobakterií ze zvířete na člověka nebo přenos interhumánní (1, 5). V současné době je identifikováno více než 150 NTM a u více než 50 z nich byla již prokázána příčinná souvislost s onemocněním člověka.
Přenos probíhá
- inhalací infekčního aerosolu,
- deglutinací cestou ústní sliznice, nebo
- kontaktem s infekčním materiálem cestou kožních oděrek.
Zatím co expozice těmto mikrobům je všeobecná, onemocnění jinak zdravých jedinců je vzácné.
Předpokládá se, že existují specifické faktory, které ovlivňují vnímavost jedince k infekci. Bylo pozorováno, že větší pravděpodobnost onemocnění netuberkulózní mykobakteriózou mají nemocní s preexistujícím plicním onemocněním (2). Mezi nejčastější z nich patří
- plicní tuberkulóza,
- plicní fibróza,
- cystická fibróza,
- bronchiektázie,
- chronická obstrukční plicní nemoc,
- pneumokoniózy, především silikóza.
Predispozici k plicním mykobakteriózám představují i deformity hrudníku (pectus excavatum). Také všeobecně platí, že častěji nemocí způsobenou NTM onemocní muži, kuřáci, s abúzem alkoholu a chronickou obstrukční plicní nemocí v anamnéze.
S infekcí NTM se setkáváme častěji u imunokompromitovaných nemocných včetně osob infikovaných virem HIV. Kromě výše zmíněné skupiny nemocných se zřejmými predispozicemi existuje řada nemocných, kteří onemocní NTM, aniž by měli v anamnéze jakýkoliv z výše zmíněných predisponujících faktorů. Literatura zmiňuje tzv. syndrom lady Windermere, který zahrnuje fibronodulární bronchiektázie lokalizované do linguly a středního bronchu s pozitivním průkazem M. avium komplex ve sputu u žen středního a vyššího věku. Genetickým mapováním v rodinách i v celé populaci bylo prokázáno, že vnímavost k mykobakteriálním infekcím může být i geneticky podmíněná.
Mykobakteriózou bývá v dospělé populaci nejčastěji postiženo dýchací ústrojí, u dětí a nemocných s HIV pozitivitou je časté i postižení lymfatických uzlin, u HIV pozitivních často vidíme diseminovanou formu a postižení kůže (5). Tato forma je popsaná i u nemocných s abnormalitou interleukinu 12 (IL-12) a receptoru pro interferon gama (INF-gama).
Klasifikace NTM
Rod Mycobacterium zahrnuje aerobní, většinou tyčinkovité, obvykle slabě G+ bakterie. Základní charakteristikou je acido-, alkali-, a alkoholorezistence, která je dána především stavbou buněčných stěn s vysokým obsahem lipidů a vosků. Viditelné kolonie na kultivačních médiích lze v závislosti na druhu pozorovat za 2 dny až 8 týdnů.
V roce 1874 Hansen objevil první acidorezistentní mikroorganismus – původce lepry. Původce tuberkulózy byl objeven Kochem v roce 1882. V roce 1896 Lehmann a Neumann poprvé použili rodový název Mycobacterium, protože TB bacily vytvářely na povrchu tekutých půd blanky vzhledem připomínající plísně. V té době byl Koch přesvědčen, že existuje pouze jediný typ mykobaktéria, ale byly zjištěné četné rozdíly mezi bacily izolovanými ze skotu, lidí nebo ptáků.
V padesátých letech 20. století se stále častěji začaly objevovat informace o atypických mykobaktériích. V roce 1955 se Runyon pokusil o první třídění netypických mykobaktérií, a to dle pigmentace (tab. 1) (9).
Table 1. Klasifikace mykobakterií dle Runyona 
Další dělení rozděluje mykobaktéria na rychle a pomalu rostoucí. Rychle rostoucí mykobaktéria se vyznačují několikadenním růstem v kultivačním médiu, řadíme k nim:
- M. fortuitum,
- M. abscessus,
- M. chelonei,
- M. smegmatis,
- M. mucogenicum,
- M. gondii (4).
Tzv. pomalu rostoucí mykobakterie zastupuje
- M. avium intracellulare complex (MAC),
- M. kansasii,
- M. marinum.
Mezi mykobaktéria, která mají minimální klinický význam, se řadí
- M. gordonae,
- M. gastri,
- M. flavescens,
- M. smegmatis,
- M. terrae (3, 6).
Diagnóza
Diagnóza mykobakteriózy se opírá o zhodnocení klinických symptomů, patologický rentgenový nález a izolaci mykobakterií ve vyšetřovaném materiálu.
V klinickém obraze dominuje
- únava,
- celková slabost,
- váhový úbytek,
- subfebrilie,
- kašel, většinou suchý, ale při bronchiektáziích často purulentní s příměsí krve a pocení.
Průběh a příznaky onemocnění NTM mohou být ještě modifikovány současně probíhajícím plicním onemocněním. Postižení lymfatických uzlin je u dospělé populace vzácné. Bývá přítomno u nemocných imunokompromitovaných, často na podkladě HIV infekce. U dětí je časté jednostranné postižení uzlin v orofaciální oblasti. Při diseminovaných formách dominuje, kromě postižení lymfatických uzlin, postižení kůže, kostí, měkkých tkání, zažívacího traktu, jater a sleziny.
Fyzikální vyšetření je necharakteristické, může odrážet poslechový nález preexistujícího plicního onemocnění. V rentgenovém obraze nalezneme tenkostěnné dutiny v apikálních a předních segmentech horních plicních laloků, dále pak infiltráty a nodulární stíny v různých oddílech plicních křídel (obr. 1), pro onemocnění MAC je typické postižení středního laloku a linguly (7). HRCT hrudníku často potvrdí bronchiektázie (obr. 2). Postižení pleury s výpotkem je vzácné (1, 3).
Image 1. Zadopřední skiagram hrudníku. Oboustranné nodulární postižení u pacientky s aviární plicní mykobakteriózou 
Image 2. CT hrudníku. Bronchiektázie a kaverna u pacienta s plicní mykobakteriózou – M. avium 
Klíčové postavení v diagnostice a později v léčbě má bakteriologické vyšetření sputa, bronchiálního výplachu nebo aspirátu při bronchoskopii. Diagnóza může být potvrzena kultivací NTM v tkáni při transbronchiální (TBB) nebo plicní biopsii. Diagnosticky je výtěžný i histologický nález granulomatózní léze nebo acidorezistentních tyček a doplněný minimálně o jeden pozitivní výsledek kultivace sputa či bronchiálního výplachu na NTM.
Vyšetřovaný materiál je odeslán k vyšetření přímou mikroskopií, dále je dekontaminovaný materiál očkován na 1–2 pevné půdy a stejný počet tekutých půd, nebo se inokuluje do půd některého z automatických detekčních systémů. Molekulárně genetickou techniku založenou na průkazu mikrobiální DNA lze užít v diagnostice M. avium komplex, M. kansasii, M. gordonae (8). Při mikrobiologickém vyšetření biologického materiálu na NTM požadujeme i vyšetření citlivosti na antituberkulotika a antibiotika.
Léčba
Léčba onemocnění způsobeného NTM je podle posledních doporučení Americké hrudní společnosti (ATS) indikovaná po splnění kritérií pro diagnózu nemoci (tab. 2). Pokud je vysloveno podezření na NTM a nejsou splněna všechna kritéria pro zahájení terapie, je pacient nadále sledován po stránce klinické, rentgenové a mikrobiální (3). Řada NTM je rezistentní na základní antituberkulotika (AT). Citlivost bývá zachována ze základních antituberkulotik (AT) na
Table 2. Diagnostická kritéria onemocnění NTM 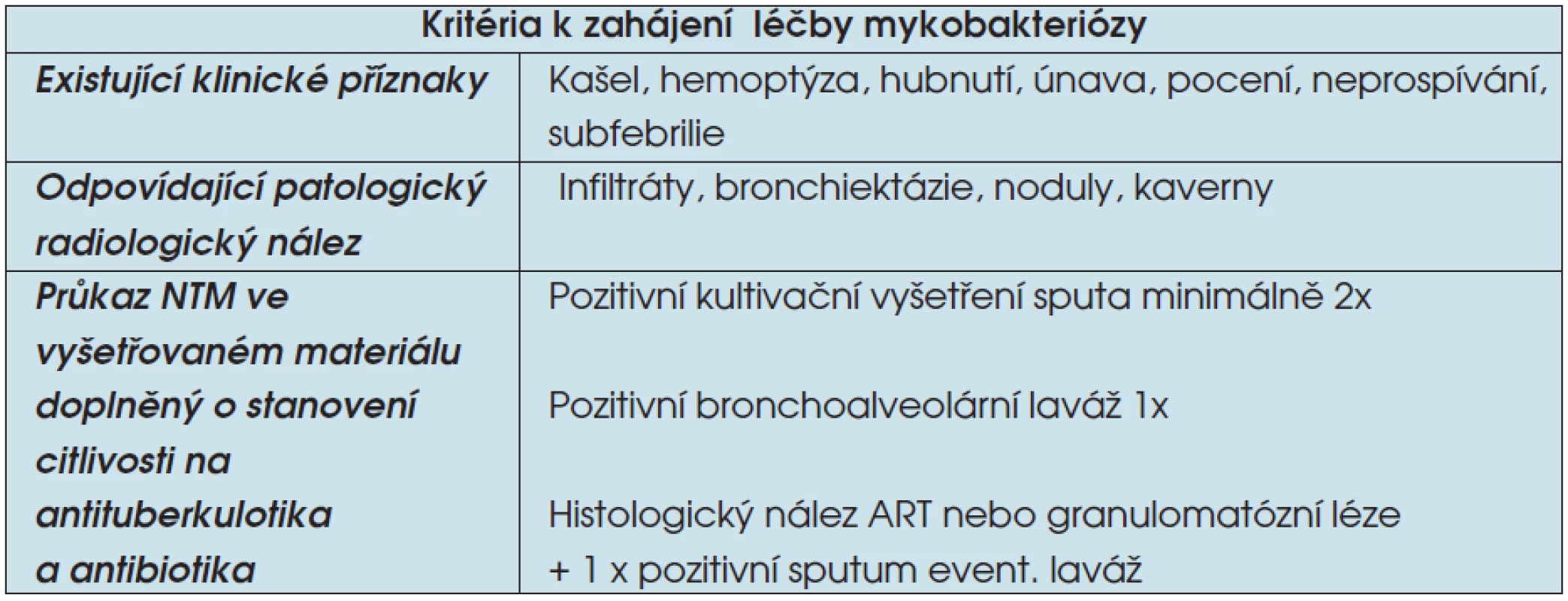
Legenda: ART – acidorezistentní tyčky - streptomycin (STM),
- rifampicin (RIF),
- etambutol (EMB);
z ostatních antibiotik (ATB) na
- aminoglykosidy,
- makrolidy,
- chinolony,
- clofazimin,
- cykloserin.
Základem léčby je kombinovaná chemoterapie účinnými AT, při rezistenci na některé z nich je kombinace doplněna antibiotiky dle výsledků testů lékové citlivosti in vitro.
Další variantou je terapie dle doporučení American Thoracic Society – ATS (tab. 3). Léčba je zahajována nejméně trojkombinací léků, tím se vyvarujeme vzniku rezistence na podávané preparáty. Léčba trvá obvykle ještě 12 měsíců po dosažení kultivační negativity sputa.
Table 3. Doporučené kombinace léků pro léčbu onemocnění způsobených NTM dle ATS 
Pro konkrétní NTM lze použít stanovené léčebné kombinace. V léčbě plicní mykobakteriózy vyvolané MAC je dle ATS doporučována empirická kombinace claritromycin (1 000 mg/den), rifampicin (600 mg/den) a etambutol (25 mg/kg/den, po 2 měsících 15 mg/kg/den).
V případě rozsáhlého onemocnění s kavitami je vhodné úvodní terapii doplnit o 2 až 3 měsíce podávaný streptomycin nebo amikacin (obr. 3).
Image 3. Zadopřední skiagram hrudníku. Rozsáhlé plicní postižení s kavitami u plicní mykobakteriózy – M. avium 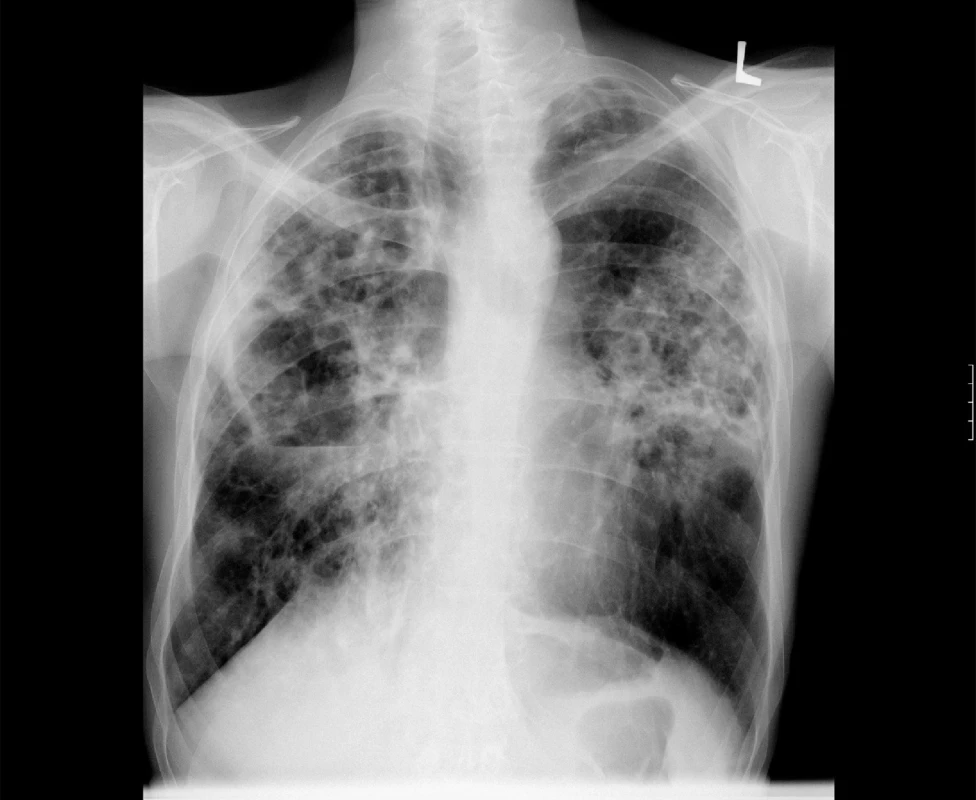
Po dosažení kultivační negativity je nutné pokračovat v léčbě dalších 12 měsíců. U diseminované formy, která bývá často u HIV pozitivních pacientů, je doporučena dlouhodobá, někdy až celoživotní léčba (1). U NTM vyvolané M. kansasii doporučuje kombinaci rifampicin (600 mg/den), etambutol (25 mg/kg/den, po 2 měsících 15 mg/kg/den) a izoniazid (300 mg/den). Léčba musí trvat po dosažení kultivační negativity sputa alespoň ještě 12 měsíců. Pokud by došlo ke zkrácení této doby, hrozí nebezpečí relapsu. Pokud je kmen na rifampicin rezistentní, je optimální léčba citlivou trojkombinací složenou z claritromycinu, etambutolu, streptomycinu, sulfamethoxazolu, případně chinolonového antibiotika (1, 3).
Léčba mykobakterióz vyvolaných rychle rostoucími mykobakteriemi – M. fortuitum, M. chelonei, M. abscessus není jednoznačně stanovena. Tato mykobaktéria se vyznačují vysokou rezistencí na základní AT. Doporučené lékové kombinace vycházejí z výsledků zachované lékové citlivosti, kdy nejčastěji jsou aplikovány
- aminoglykosidy (při rozsáhlém plicním postižení a těžkém klinickém stavu),
- makrolidy,
- fluorochinolony,
- sulfonamidy,
- clofazimine.
Celková délka léčby by měla zahrnovat dobu do dosažení negativity sputa a pak ještě 12 měsíců po opakované kultivační negativitě sputa. V průběhu medikamentózní léčby je nutné monitorování renálních funkcí a jaterních testů (10). Vzhledem k délce podávání léčby a kombinaci preparátů se zvyšuje riziko vzniku nežádoucích účinků podávaných léků, gastrointestinálních potíží, postižení zrakového nervu při podávání etambutolu, ototoxicity při podávání aminoglykosidů (11).
Chirurgická léčba je indikovaná u pacientů s lokalizovanou plicní lézí, hlavně u rozpadových forem s přetrvávající kavernou (předejdeme pozdějšímu vzniku aspergilomu v perzistující kaverně). Také je plicní resekce indikována při jednostranném nálezu, který je na medikamentózní léčbu zcela rezistentní a dále progreduje.
U krčních lymfadenitid je součástí léčby též chirurgická intervence, při které se odstraňuje celá skupina postižených uzlin. Každý chirurgický výkon je třeba krýt kombinací antimykobakteriálních preparátů (1, 5).
Profylaxe
V profylaxi mykobakteriózy vyvolané MAC u pacientů s AIDS se uplatňuje buď samotný rifabutin v dávce 300 mg denně, nebo klaritromycin 500 mg 2x denně. Jinou alternativou je podávání azitromycinu 1 200 mg 1x týdně buď v monoterapii, nebo v kombinaci s rifabutinem (1). Profylaxe je plně indikována u všech nemocných s AIDS, u kterých je počet CD4 pozitivních T lymfocytů nižší než 50 buněk.
Závěr
Onemocnění způsobená NTM v poslední době diagnostikujeme stále častěji. Lze předpokládat souvislost tohoto jevu se zvyšujícím se počtem imunokompromitovaných pacientů. Mezi nejčastější vyvolavatele onemocnění řadíme
- M. kansasii,
- MAC,
- M. xenopi,
- M. malmoense.
- M. abscessus je častěji identifikováno u pacientů s cystickou fibrózou (12).
Zásadní postavení v diagnóze NTM má kromě radiologického nálezu a klinických obtíží bakteriologické vyšetření sputa s identifikací kmene a stanovením citlivosti na antituberkulotika a antibiotika. Léčbu zahajujeme po splnění všech kritérií pro diagnózu onemocnění NTM:
- odpovídající RTG nález,
- klinické obtíže,
- pozitivní bakteriologický nález.
Pokud nejsou splněna všechna tato kritéria, je nadále pacient sledován. Léčba onemocnění způsobeného NTM probíhá buď podle doporučení ATS, nebo vychází z výsledků citlivosti in vitro. Pacient pro své okolí není infekční, jeho izolace není nutná, tudíž není nutné vyhledávat kontakty. Onemocnění podléhá povinnému hlášení mykobakterióz.
MUDr. Ivana Hricíková
Pneumologická klinika FTNsP
Vídeňská 800
140 59 Praha 4
E-mail: ivana.hricikova@ftn.cz
Sources
1. American Thoracic Society. Diagnosis and treatment of disease caused by nontuberculosis mycobacteria. Am. J. Respi.r Crit. Care Med. 2 (Suppl.), S1-S25.
2. Aksamit, T. Mycobacterium avium complex pulmonary disease in patients with preexisting lung disease. Clin. Chest. Med. 2002, 23, p. 643-653.
3. Griffith, D., Aksamit, T., Brown-Elliot, A. An official ATS/IDSA statement: Diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases. Am. J. Respir. Crit. Care Med. 2007, 175, p. 367-416.
4. Daley, C.l., Griffith, D. Pulmonary disease caused by rapidly growing mycobacteria. Clin. Chest. Med. 2002, 23, p. 623-632.
5. Chetchotisakd, P., Mootsikapun, P., Anunnatsiri, S. et al. Disseminated infection due to rapidly growing mycobacteria in immunocompetent hosts presenting with chronic lymphadenopathy: a previously unrecognized clinical entity. Clin. Infect. Dis. 2000, 30, p. 29-34.
6. Waller, E., Roy, A., Brumble, L. The expanding spectrum of mycobacterium avium complex-associated pulmonary disease. Chest 2006, 130, p. 1234-1243.
7. D’arienzo, P., Giampalma, E., Lavecchia, M. et al. Role of HRCT in the identification of atypical pulmonary mycobacteriosis. Radiol. Med. 2002, 103, p. 158-170.
8. Votava, M., Horváth, R., Denis, M. Polymerázová řetězová reakce v mikrobiologické diagnostice. Prakt. Lék. 2000, 11, s. 632-634.
9. Zatloukal, P., Fiala, P., Votruba, J. a kol. Pneumologie. Praha: Galén a Karolinum 2001, s. 107-109.
10. Hricíková, I., Šterclová, M., Bártů, V. Netuberkulózní plicní mykobakterióza - naše zkušenosti. Kazuistiky v alergologii, pneumologii a ORL, 2007, 4, s. 20-21.
11. Bártů, V. Diagnostika a léčba plicních mykobakterióz. Respirace 2003, 2, s. 36-39.
12. Griffith, D. Emergence of nontuberculous mycobacteria as pathogen in cystic fibrosis. Am. J. Respir. Crit. Care Med. 2003, p. 810-812.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2011 Issue 3-
All articles in this issue
-
Základy kognitivní, afektivní a sociální neurovědy
III. Agrese a násilné chování - Primární prevence nemocí: současná úskalí a šance
- Kouření a výživa
- Současné trendy péče o dítě s orofaciálním rozštěpem
- Jak je vnímáno nutriční složení pokrmů našimi smysly
- Netuberkulózní mykobakteriózy
- Informovanost mužů o prevenci onemocnění prostaty
- Telefonický kontakt v péči o nemocné s osteoartrózou
- Vztah mezi lékařem a pacientem v kontextu institutu „dříve projevená přání pacientů“
- Hazard u dětí a dospívajících
- Případ krční lymfadenopatie
-
Základy kognitivní, afektivní a sociální neurovědy
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Netuberkulózní mykobakteriózy
- Případ krční lymfadenopatie
- Současné trendy péče o dítě s orofaciálním rozštěpem
- Kouření a výživa
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

