-
Medical journals
- Career
DNA analýza a histologické podtypy karcinómu endometria
Authors: E. Radzo 1; P. Sýkora 1; Ľudovít Danihel 2; V. Šišovský 2; Vanda Repiská 1
Authors‘ workplace: Univerzita Komenského, Bratislava, Slovenská republika Lekárska fakulta ; Ústav lekárskej biológie, genetiky a klinickej genetiky Prednosta: doc. MUDr. D. Böhmer, Ph. D. 1; Ústav patologickej anatómie Prednosta: prof. MUDr. Ľ. Danihel, Ph. D. 2
Published in: Prakt. Lék. 2010; 90(3): 171-173
Category: Of different specialties
Overview
Úvod:
Celkový počet karcinómov endometria (CaE) má celosvetovo narastajúci trend. Podstatnú časť CaE tvorí endometrioidný histologický podtyp. Vo všeobecnosti má dobrú prognózu, ako aj liečbu. Serózny histologický podtyp CaE tvorí menšiu časť karcinómov endometria. Má horšiu prognózu a diagnostikuje sa v neskorších štádiách ochorenia. Vzhľadom na prognózu serózneho CaE je potrené a užitočné identifikovať tento podtyp karcinómov aj v zmiešaných typoch CaE.Materiál a metódy:
Analyzovali sme tkanivo endometria – skupinu tvorilo 24 pacientok; pacientky boli vo veku od 44 do 88 rokov. Histologický diagnostický nález skúmaných vzoriek bol od jednoduchej hyperplázie bez atypie buniek po endometrioidný CaE s výrazným prenikaním do myometria. Vzorky sme analyzovali priamym sekvenovaním, ako aj restrikčnou analýzou.Výsledky:
Vo všetkých vzorkách od 24 pacientok s karcinómom endometria alebo prekanceróznou léziou sme identifikovali polymorfizmus CCC/CGC Pro72Arg v exóne 4. Pomer homozygotných a heterozygotných polymorfizmov bol 14 : 10. Výsledky naznačujú, že môže ísť o zmiešané typy karcinómu endometria.Kľúčové slová:
endometrium, karcinogenéza, TP53, DNA polymorfizmus.Úvod
Celkový počet a prevalencia prípadov karcinómov endometria (CaE) má celosvetovo narastajúci trend (6). CaE je štvrtý najčastejší malígny nádor a zároveň, najbežnejšia gynekologická malignita u žien (16).
Podstatnú časť CaE tvorí endometrioidný histologický podtyp (Obr. 1). Predpokladá sa, že endometrioidný podtyp CaE vzniká na podklade hyperplázie endometria (HE). Hyperplázia endometria sa môže vyskytovať v podobe jednoduchej HE bez atypie buniek až po komplexnú HE s prítomnou atypiou buniek. Niektorí autori zaraďujú medzi HE aj dobre diferencovaný karcinóm endometria (13, 11). Endometrioidný histologický podtyp CaE sa vyskytuje u žien väčšinou v období perimenopauzy. Má nižší malígny potenciál, invázia do myometria je často minimálna a prienik do lymfatických priestorov je zriedkavejší. Vo všeobecnosti má dobrú prognózu, ako aj liečbu (8).
Image 1. Neprítomnosť expresie p53 v endometrioidnom CaE. Imunohistochemické vyšetrenie s protilátkou proti p53. ABC-Px, 100x 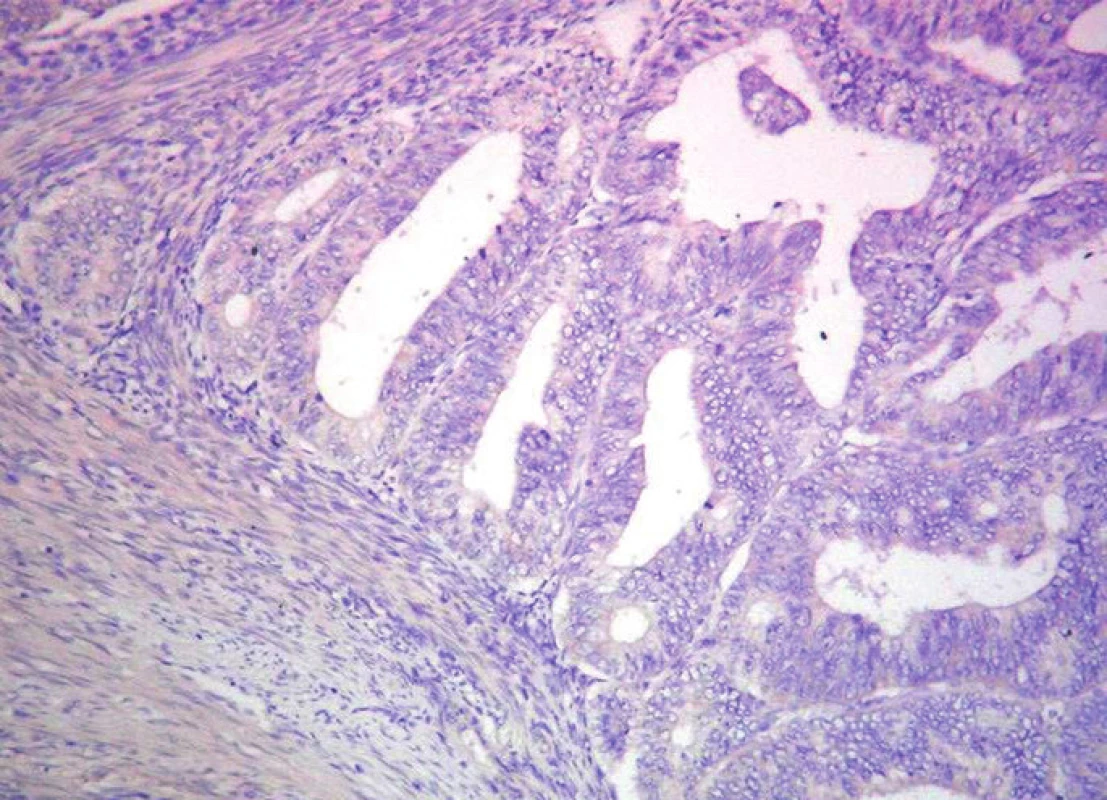
Serózny histologický podtyp CaE (Obr. 2) tvorí menšiu časť karcinómov endometria. Serózny podtyp CaE je spájaný s výraznou mortalitou a zároveň s nevýraznými klinickými prejavmi v skorom štádiu ochorenia (3). Serózny histologický podtyp CaE sa vyskytuje väčšinou u starších žien. Má vyšší malígny potenciál, infiltrácia myometria je rýchlejšia a hlbšia a nádor má vyšší sklon k lymfogénnej propagácii. Vo všeobecnosti má horšiu prognózu a diagnostikuje sa v neskorších štádiách ochorenia (7).
Image 2. Serózny CaE. Pravidelne silne pozitívna expresia p53. Monoklonová myšia protilátka proti p53. ABC-Px, 200 x 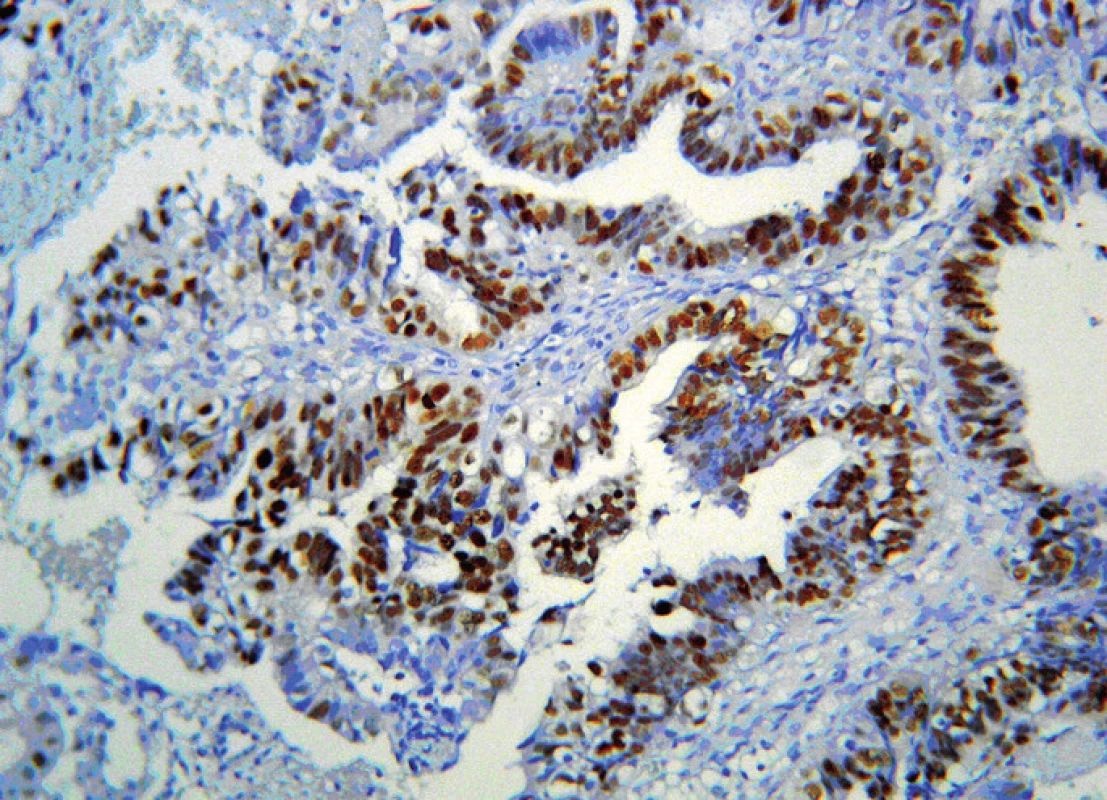
V súčasnosti boli v endometriu opísané aj atypické žľazové štruktúry, v ktorých boli identifikované mutácie v tumorsupresorovom géne TP53 a sú spájané so seróznym intraepiteliálnym karcinómom endometria (4). Mutácie v géne TP53 a nadmerná expresia proteínu p53 v endometriálnej glandulárnej dysplázii (EmGD) podporuje názor, že EmGD súvisí so seróznym CaE a môže byť jeho prekancerózou. Pri porovnaní EmGD a serózneho CaE je v obidvoch prípadoch prítomné progresívne zvýšenie genetických porúch (12).
Mutácia alebo delécia tumorsupresorového génu TP53 je najčastejšia genetická mutácia v ľudských karcinómoch. Mutácia už jednej alely naruší pôsobenie takto kódovaného p53. Zníži sa jeho schopnosť viazať sa na DNA a predĺži sa jeho životnosť. Zároveň stráca schopnosť navodiť apoptózu bunky. Mutácie boli identifikované v približne 15 % CaE, pričom 75 % mutácií TP53 sa nachádzalo v endometriálnej intraepitaliálnej neoplázii, ktorá sa pokladá za prekurzor serózneho CaE (7, 14). Vznik serózneho CaE môže nastať aj ďalšími mechanizmami, vrátane rozvoju z endometrioidného podtypu CaE (9).
Vzhľadom na prognózu serózneho CaE je potrené a užitočné identifikovať tento podtyp karcinómov aj v zmiešaných typoch CaE. DNA analýza génu TP53 môže pomôcť identifikovať prítomnosť serózneho CaE, vzhľadom k tomu, že mutácie TP53 sa vyskytujú hlavne v seróznom CaE a v karcinómoch endometria s vysokým stupňom histologickej diferenciácie (G III).
V súčasnosti sa DNA analýza nevyužíva v rutinnej diagnostike, avšak prínos pre diferenciálnu diagnostiku, a tým aj liečbu CaE, by mohol byť už v blízkej budúcnosti.
Materiál a metódy
Analyzovali sme tkanivo endometria – skupinu tvorilo 24 pacientok; pacientky boli vo veku od 44 do 88 rokov. Histologický diagnostický nález skúmaných vzoriek bol od jednoduchej hyperplázie bez atypie buniek po endometrioidný CaE s výrazným prenikaním do myometria (Tab. 1). DNA sme izolovali z 25 mg tkaniva endometria odobratého do sterilnej skúmavky, izolačným kitom (Qiagen, QIAamp DNA Mini Kit).
Table 1. Charakteristika súboru 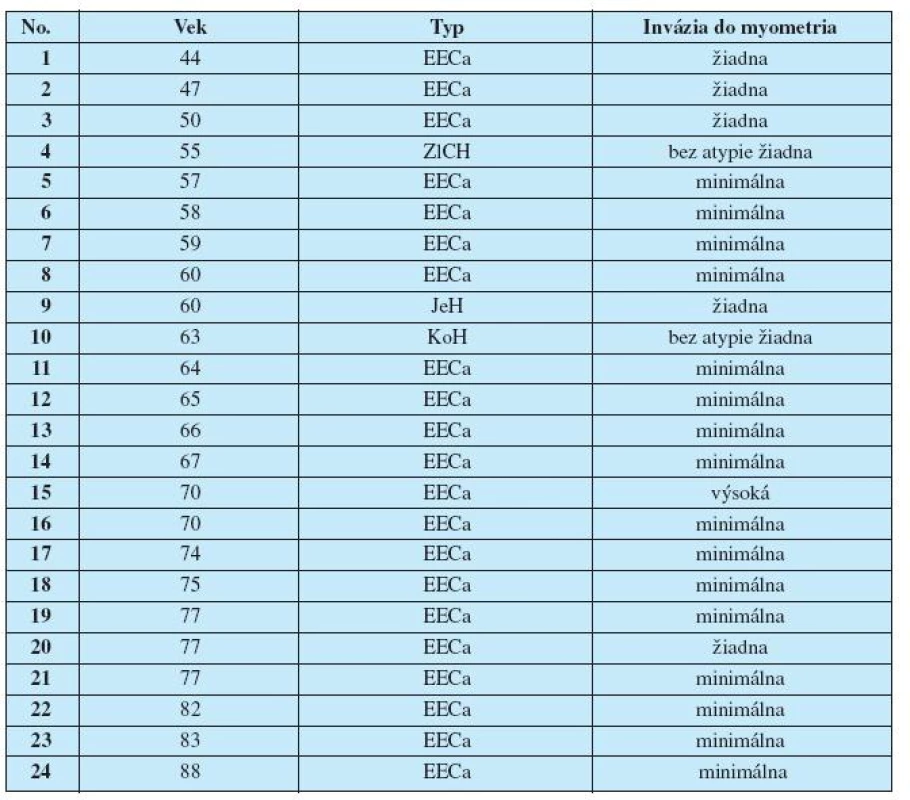
Legenda: EECa – Endometrioidný karcinóm, ZlCH – Žľazová cystická hyperplázia endometria, KoH – Komplexná hyperplázia endometria, JeH – Jednoduchá hyperplázia endometria. Sledovaný úsek génu TP53 sme namnožili pomocou polymerázovej reťazovej reakcie (PCR). Amplifikácia prebehla na termálnom cyklery Eppendorf Mastercycler v 30 cykloch (denaturácia 96 °C, 2 min., denaturácia 94 °C, 15 s, hybridizácia 20 s, gradient 50–65 °C, syntéza 72 °C, 30 sek., záverečná syntéza 72 °C, 10 min.)
Vzorky sme sekvenovali na genetickom analyzátore ABI PRISMTM 310 Genetic Analyzer, ktorý využíva kapilárnu elektroforézu s použitím ABI TMDNA sequencing kitu (Applied Biosystems). Priamym sekvenovaním sme analyzovali exóny 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 génu TP53 (Tab. 2).
Table 2. Primery použité na amplifikáciu kódujúcich oblastí génu TP53. 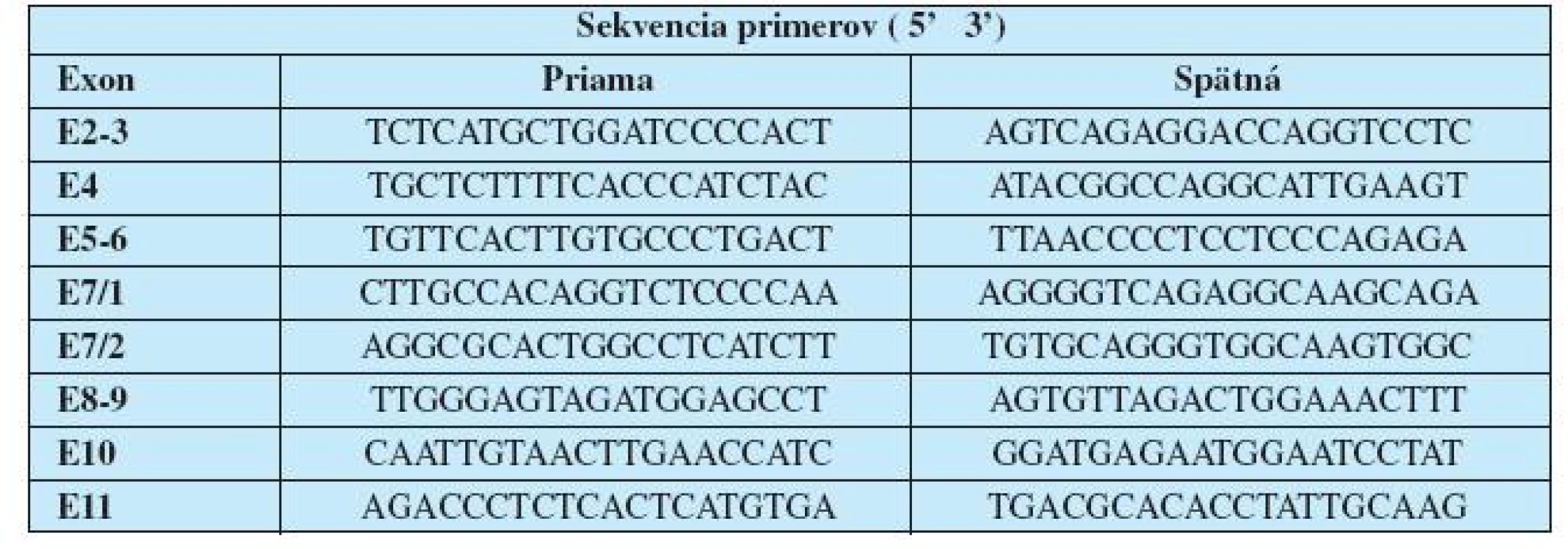
Vzorky sme otestovali restrikčnou analýzou s použitím restrikčnej endonukleázy BtgI. Štiepna reakcia prebiehala 16 hod. pri 37 °C a inaktivácia enzýmu 20 min. pri 80 °C.
Výsledky a diskusia
Gén TP53 (Exóny 2, 3, 4, 5, 6, 7, 8, 9, 10, 11) bol analyzovaný priamym sekvenovaním vo všetkých vzorkách od 24 pacientok s karcinómom endometria alebo prekanceróznou léziou. Identifikovali sme polymorfizmus CCC/CGC Pro72Arg v exóne 4 (Obr. 3). Pomer homozygotných a heterozygotných polymorfizmov bol 14 : 10.
Image 3. Polymorfizmus CCC/CGC Pro72Arg v exóne 4 (vľavo homozygotný typ, vpravo heterozygotný typ) 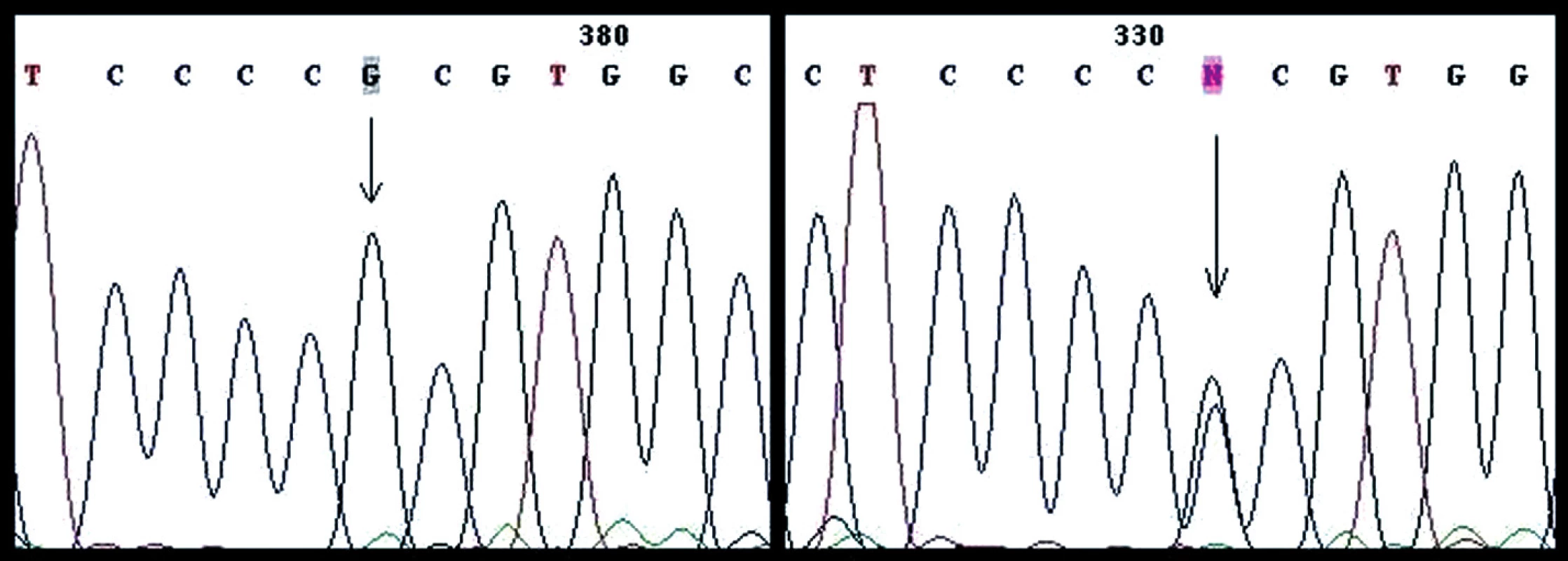
Pri všetkých skúmaných vzorkách sme zopakovali analýzu polymorfizmu pomocou restrikčného enzýmu BtgI. Výsledky z restrikčnej analýzy boli totožné s výsledkami, ktoré sme získali priamym sekvenovaním. Identifikovali sme rovnaké zastúpenie polymorfizmov CCC/CGC v kodóne 72 (exón 4) v prekanceróznych léziách aj v karcinómoch endometria.
Výsledky naznačujú, že môže ísť o zmiešané typy CaE. Môže byť prítomná zložka glandulárnej dysplázie endometria, prípadne zložka serózneho CaE v skúmaných vzorkách karcinómu endometria.
Autori v štúdii o inaktivácii génu TP53 pri chronickej lymfocytárnej leukémii opisujú, že pri poškodení jednej alely TP53 tvoria pacienti nezávislú prognostickú podskupinu. Prežívanie týchto pacientov je podstatne horšie v porovnaní s pacientmi, ktorí majú deléciu ATM, alebo nemutovaný IgVH bez sprievodných vysokorizikových abnormalít. Pred liečbou chronickej lymfocytárnej leukémii odporúčajú DNA analýzu, pretože identifikovanie nových porúch TP53 môže skvalitniť liečbu (10). DNA analýza pri našich pacientkách bola realizovaná v krátkom časovom období pre vyhodnotenie vplyvu mutácii v géne TP53 na prežívanie pacientok. Avšak, v súčasnosti vytvárame prospektívnu databázu údajov pre získanie nových poznatkov o vplyve genetických zmien na karcinóm endometria.
V Talianskej štúdii boli pozorované pacientky s karcinómom prsníka a vplyv mutovaného génu TP53 na ich prežívanie. Mutácie v géne TP53 boli pozorované v tkanive nádoru a zároveň aj v tkanive lymfatických uzlín. Pacientky s prítomnou mutáciou v géne TP53 mali skrátené obdobie prežívania (1), pričom výsledky poukazujú, že mutácia TP53 môže mať podobný vplyv pri karcinóme prsníka ako pri chronickej lymfocytárnej leukémii.
Pri skupine žien s karcinómom prsníka, ktoré boli skúmané v Iráne, bola pozorovaná súvislosť s výskytom tohto karcinómu a zmenami v géne TP53. Polymorfizmus v géne TP53 v kodóne 72 bol signifikantne spojený s výskytom karcinómu prsníka. Autori uvádzajú, že polymorfizmus v géne TP53 môže meniť riziko karcinómu prsníka u žien v Iráne (5).
Mutácie p53 sa javia ako dôležité pri konverzii relatívne pokojného atrofického endometria na intraepiteliálnu formu serózneho karcinómu. Mutácie p53 dávajú základ pre akumuláciu ďalších genetických zmien v súvislosti s karcinogenéznym procesom (15).
Gén TP53 sa vyskytuje často mutovaný aj v endometriálnej glandulárnej dysplázii. Tieto mutácie naznačujú, že EmGD je prekancerózou serózneho CaE. Mutácia v géne TP53 je pravdepodobne jeden z najdôležitejších faktorov na začiatku karcinogenézy pri seróznom CaE (4).
Endometriálna glandulárna dysplázia, ktorá sa môže vyskytovať v našich vzorkách, je silný kandidát na prekanceróznu léziu, ktorá nie je maligná, ale znamená zvýšené riziko pre vznik serózneho intraepiteliálneho karcinómu endometria (2).
Naďalej bude potrebné sledovať genetické zmeny v CaE, pričom výsledky DNA analýzy môžu pomôcť porozumieť procesu karcinogenézy z hľadiska molekulárno-biologickej podstaty, a zároveň môžu spresniť diferenciálnu diagnostiku karcinómov endometria.
Poďakovanie
Táto práca bola podporená Ministerstvom zdravotníctva Slovenskej republiky v rámci projektu Imunohistochemická a molekulovo-genetická analýza karcinómu endometria 2007/28-UK-05.MUDr. Edward Radzo
Ústav lekárskej biológie, genetiky a klinickej genetiky LF UK
Sasinkova 4
811 08 Bratislava
Slovenská republika
E-mail: mudr.edwardradzo@gmail.com
Sources
1. Bonafe, M., Ceccarelli, C., Farabegoli, F. et al. Retention of the p53 codon 72 arginine allele is associated with a reduction of disease-free and overall survival in arginine/proline heterozygous breast cancer patients. Clin. Cancer. Res. 2003, 9(13), p. 4860-4864.
2. Fadare, O., Zheng, W. Endometrial glandular dysplasia: morphologically and biologically distinctive putative precursor lesions of type II endometrial cancers. Diagn. Pathol. 2008, 8, p. 3–6.
3. Chambers, J.T., Merino, M., Kohorn, E.I. et al. Uterine papillary serous carcinoma. Obstet. Gynecol. 1987, 69, p. 109–113.
4. Jia, L., Liu, Y., Yi, X. et al. Endometrial glandular dysplasia with frequent p53 gene mutation: a genetic evidence supporting its precancer nature for endometrial serous carcinoma. Clin. Cancer. Res. 2008, 14, p. 2263–2269.
5. Kazemi, M., Salehi, Z., Chakosari, R.J. TP53 codon 72 polymorphism and breast cancer in northern Iran. Oncol. Res. 2009, 18(1), p. 25-30.
6. Kouji, B., Megumi, Y., Yusuke, K. et al. Endometrial cancer as a familial tumor: pathology and molecular carcinogenesis. Current Genomics 2009, 10, p. 127-132.
7. Lax, S.F., Kendall, B., Tashiro, H. et al. The frequency of p53, K-ras mutations, and microsatellite instability differs in uterine endometrioid and serous carcinoma: evidence of distinct molecular genetic pathway. Cancer 2000, 88, p. 814-824.
8. Lax, S.F. Molecular genetic pathways in various types of endometrial carcinoma: from a phenotypical to a molecular-based classification. Virchows Arch. 2004, 444(3), p. 213-223.
9. Lomo, L., Nucci, M.R., Lee, K.R. et al. Histologic and immunohistochemical decision-making in endometrial adenocarcinoma. Mod. Pathol. 2008, 21, p. 937-942.
10. Malcikova, J., Smardova, J., Rocnova, L. et al. Monoallelic and biallelic inactivation of TP53 gene in chronic lymphocytic leukemia: selection, impact on survival, and response to DNA damage. Blood 2009, 114(26), p. 5307-5314.
11. Mutter, G.L. Endometrial intraepithelial neoplasia (EIN): will it bring order to chaos? The Endometrial Collaborative Group. Gynecol. Oncol. 2000, 76, p. 287–290.
12. Oluwole, F., Wenxin, Z. Insights into endometrial serous carcinogenesis and progression. Int. J. Clin. Exp. Pathol. 2009, 2, p. 411-432.
13. Silverberg, S.G., Kurman, R.J. (eds.) Atlas of tumor pathology, 3rd Series, Fascicle 3. Washington, DC: Armed Forces Institute of Pathology 1992, p. 13–14.
14. Tashiro, H., Isacson, C., Levine, R. et al. p53 gene mutations are common in uterine serous carcinoma and occur early in their pathogenesis. Am. J. Pathol. 1997, 150, p. 177-185.
15. Vogelstein, B., Kinzler, K.W. p53 function and dysfunction. Cell 1992, 70, p. 523-526.
16. Zaino, R.J. Endometrial hyperplasia and carcinoma. In: Haines M, Taylor CW, Fox H, Wells M, eds. Haines & Taylor Obstetrical and Gynaecological Pathology. Edinburgh: Churchill Livingstone, 5th ed. 2003, p. 445-446.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2010 Issue 3-
All articles in this issue
-
Evoluce a evoluční teorie pro lékaře
III. O vzniku života - Nepříznivé tendence ve vývoji zdravotního stavu obyvatelstva ČR
- Infekce virem hepatitidy C a metabolický syndrom
- Nozokomiální nákazy
- Komorbidita migrény a epilepsie
- Bazocelulárny karcinóm kože – najvýznamnejšie rizikové a prognostické parametre ochorenia v klinickej praxi
- Promořenost hantaviry ve dvou oblastech s přírodními ohnisky hantavirů
- DNA analýza a histologické podtypy karcinómu endometria
- Několik poznámek k lázeňské léčbě revmatických chorob
- Uvědomování v prevenci a léčbě
- Aseptická meningitida jako projev primoinfekce HIV
-
Evoluce a evoluční teorie pro lékaře
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nozokomiální nákazy
- Komorbidita migrény a epilepsie
- Aseptická meningitida jako projev primoinfekce HIV
- Bazocelulárny karcinóm kože – najvýznamnejšie rizikové a prognostické parametre ochorenia v klinickej praxi
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

