-
Medical journals
- Career
Nastaly nějaké změny v epidemiologii a terapii chronické hepatitidy B?
Authors: J. Stránský 1; J. Kynčl 2
Authors‘ workplace: I. interní klinika FNKV a 3. LF UK, Praha Přednosta: prof. MUDr. Jiří Horák, CSc. 1; Státní zdravotní ústav Praha Odbor epidemiologie infekčních nemocí Vedoucí: MUDr. Jitka Částková, CSc. 2
Published in: Prakt. Lék. 2009; 89(7): 357-360
Category: Reviews
Overview
Přehledný článek o některých novějších poznatcích v epidemiologii a léčbě chronické hepatitidy B perorálními nukleosidovými a nukleotidovými analogy povolenými v Evropské Unii a vhodných doporučení k léčbě.
Klíčová slova:
chronická hepatitida B, léčba analogy.Úvod
Infekce virem hepatitidy B (HBV) je závažný problém zdravotnictví na celém světě. Infekce HBV má přirozený klinický a sérologický vývoj, který je všeobecně dobře znám. U většiny chronicky infikovaných osob mají titry HBV DNA v séru klesající tendenci v čase. Průběh onemocnění, možné následky a komplikace byly opakovaně popsány, stejně jako epidemiologie, šíření infekce v populaci, léčba a prevence (1, 2).
Avšak průběh onemocnění a terapie se v posledních 10–15 letech přece jen změnily zdokonalením vyšetřovacích metod v molekulární biologii a rozšířením protivirové léčby interferony o stále stoupající počet perorálních nukleosidových analogů.
Cílem tohoto sdělení je upozornit na některé novější poznatky z klinického průběhu onemocnění a závěrů ze studií na velkém počtu nemocných léčených protivirovou léčbou.
V posledních letech byla upravena terminologie hepatitidy B – rozlišuje se sérokonverze HBeAg na anti-HBe a samotná ztráta HBeAg (bez vytvoření anti-HBe) a obdobně sérokonverze HBsAg na anti-HBs a ztráta HBsAg (bez vytvoření anti-HBs), protože protilátky se mohou tvořit někdy opožděně. Proto se také přestal užívat termín „anti-HBe pozitivní chronická hepatitida B“ a místo něho se používá zásadně HBeAg pozitivní nebo HBeAg negativní chronická hepatitida B (3).
Cílem léčby není dosahovat sérokonverze HBeAg, ale předcházet komplikacím (cirhóze a hepatocelulárnímu karcinomu – HCC).
Podstatnou změnou v epidemiologii infekce HBV je zjištění, že se v poslední dekádě významně změnil poměr mezi případy HBeAg pozitivní a negativní chronické hepatitidy B. Zatímco před 10 lety převládaly chronické hepatitidy HBeAg pozitivní nad negativními, nyní je to právě naopak (30 : 70) (4-6). To souvisí nejen s přirozeným vývojem infekce HBV, ale také s tím, že se neustále rozšiřuje populace mutovaných virů, která v současné době převažuje nad wild typem HBV.
Mutace jsou vyvolány exogenními tlaky, jako je léčba interferonem alfa, nukleosidovými nebo nukleotidovými analogy, podáním specifického imunoglobulinu proti hepatitidě B nebo mutacemi uniklými při vakcinaci proti HBV. Mutace vedou ke snížení nebo zablokování exprese HBeAg převážně v precore nebo core oblasti, ale také v genu X nebo v obalu viru (pre-S). Nejznámější a v praxi důležitá je mutace polymerázy HBV DNA v lokusu YMDD při dlouhodobé léčbě lamivudinem (7).
Inaktivní nosičství HBsAg
Bezpříznakoví nosiči HBsAg byli v minulosti definováni jako nemocní bez jakýchkoli klinických příznaků onemocnění jater, sérologicky HBeAg negativní a anti-HBe pozitivní, s trvale normální aktivitou ALT a AST, histologicky bez nálezu chronické hepatitidy, případně jen s nespecifickými nebo jen mírnými změnami hepatocytů a portobiliárních prostorů. Měli opakovaně nízkou hodnotu virémie, nebo HBV DNA nebyla prokazatelná ve standardních hybridizačních esejích. Byli považováni za nosiče HBsAg s dobrou prognózou, kteří nemají být léčeni interferonem (8, 9). Avšak u 20–30 % osob s bezpříznakovým nosičstvím může nastat v průběhu sledování (ale také diagnosticky uniknout) spontánní reaktivace hepatitidy B nebo superinfekce jiným hepatotropním virem (HCV, HDV). Opakované reaktivace mohou způsobit progresivní jaterní poškození i jaterní dekompenzaci (10).
Počátkem tohoto tisíciletí doporučil workshop amerického National Institute of Health užívat pro asymptomatické nebo bezpříznakové nosiče přesnější termín „inaktivní nosičství HBsAg“ pro nemocné, jejichž hodnota HBV DNA v séru je pod 105 kopií/ml (11). Pokroky v molekulární biologii vedly k vývoji kvalitativní polymerázové řetězové reakce (PCR) umožňující detekci hodnot HBV DNA v séru na 103 kopií/ml. V dalším vývoji bylo možno kvantifikovat HBV DNA v séru pod 200 kopií/ml.
Ve Francii byl u 85 inaktivních nosičů HBsAg medián HBV DNA v séru 1 300 kopií/ml a HBV DNA byla u 98 % těchto nosičů pod 105 kopií/ml a zůstala v průběhu sledování stabilní. Histologické léze byly ve všech případech mírné (12).
Podle hodnot HBV DNA lze odlišit inaktivní nosiče HBsAg od pacientů s chronickou hepatitidou B, protože průměrná hodnota HBV DNA byla u inaktivních nosičů významně nižší než u HBeAg-negativní chronické hepatitidy B (p<0,005). Pro potvrzení inaktivního nosičství HBsAg (pokud je hodnota HBV DNA pod 105 kopií/ml) je užitečné opakované stanovení HBV DNA alespoň 2x v intervalu 4 měsíců (13).
V recentní studii z Indie mělo přibližně 21 % HBeAg-negativních pacientů s trvale normální aktivitou ALT a hodnotou HBV DNA ≥ 105 kopií/ml signifikantní histologickou fibrózu. Definovat „inaktivní nosičství HBV“ jen podle trvale normální aktivity ALT a hodnoty viremie do 105 kopií/ml bez provedení jaterní biopsie může vést u inaktivních nosičů HBV k přehlédnutí závažného onemocnění jater. Naproti tomu pacienti s trvalým nebo intermitentním zvýšením aktivity ALT mají významně vyšší viremii i histologické skóre fibrózy, a to jak HBeAg pozitivní, i HBeAg negativní (14). HBeAg-negativní pacienti s mírně zvýšenou aktivitou ALT jsou většinou muži starší 35 let, mají nižší viremii a vyšší prevalenci signifikantního histologického onemocnění (15). Většina uvedených autorů doporučuje dlouhodobé a pečlivé sledování inaktivních pacientů po celý život.
Vyloučení HBsAg
Ani po vymizení HBsAg ze séra, které je spolehlivým ukazatelem definitivního vyloučení HBV, nelze s jistotou vyloučit další progresi chronické hepatitidy B. Na počátku 90. let bylo prokázáno, že i když je pacient už HBsAg negativní, může HBV DNA přetrvávat v játrech (16). Po sérokonverzi HBsAg na anti-HBs byla zjištěna HBV DNA v játrech za 2 měsíce ještě v 58 %, za 6 měsíců v 31 %, ale za 12 měsíců jen v 15 %, což znamená, že u většiny HBsAg-negativních pacientů virová replikace progresivně klesá (17).
Za 1 rok po vyloučení HBsAg má 88 % pacientů normální aktivitu ALT, což předpovídá dobrou prognózu nemocného, pokud již nemá v době vyloučení HBsAg dekompenzovanou cirhózu nebo HCC (18). Po spontánním vyloučení HBsAg zřetelně ustupují nekroticko-zánětlivé změny, jaterní fibróza se většinou nezmění, ale může se i zmenšit. Avšak pokud má pacient jaterní cirhózu, anamnézu perinatální infekce a pozitivita HBsAg trvá déle než 30 let, zvyšuje se riziko HCC asi na 10 % (19).
Definitivnímu vyloučení HBsAg může výjimečně předcházet excerbace hepatitidy s mnohonásobným zvýšením aktivity ALT (podobně jako je to při sérokonverzi HBeAg na anti-HBe), ale většinou se laboratorně nezachytí (20).
Komplikace
Nejvážnější komplikací chronické hepatitidy B je jaterní cirhóza a HCC. Je známo, že hodnota HBV DNA v séru je ukazatelem úrovně replikace HBV, ale také účinnosti protivirové léčby. Výsledky z velkých studií u asijských pacientů s infekcí HBV (N=3 233) ukázaly, že při průměrné době sledování téměř 47 měsíců byl průměrný věk pro sérokonverzi HBeAg 35 roků a pro vznik komplikací 57 roků. Pacienti s aktivitou ALT od 0,5–1,0 horního limitu normálních hodnot měli významně vyšší riziko vzniku komplikací, které bylo stejné jako u těch pacientů, kteří měli hodnoty ALT 1-2x vyšší, než je horní limit normálu (obojí p<0,0001) při porovnání s aktivitou ALT pod 0,5 limitu normální hodnoty.
Celkem 43,6 % pacientů s komplikacemi mělo hodnoty HBV DNA v séru pod 1,42 x 105 kopií/ml. Zvýšené riziko komplikací a kratší přežití měli muži ve vyšším věku, s příznaky chronického onemocnění jater, nízkým albuminem a zvýšeným alfa-fetoproteinem na počátku sledování. Z této práce lze uzavřít, že protrahovaná i nízká hodnota virémie a mírně zvýšená aktivita ALT (mezi 0,5–2,0 horního limitu normálu) způsobuje u asijských pacientů zákeřné a progredující poškození jater, které vede ke vzniku komplikací. Proto je doporučena dlouhodobá protivirová léčba s cílem maximálně suprimovat viremii i po sérokonverzi HBeAg (21).
Hepatocelulární karcinom
HCC je komplikací nejzávažnější. Na Tchaj-wanu byl u 3 653 HBsAg pozitivních pacientů ve věku 30–65 roků zhodnocen vztah mezi HBV DNA v séru a vznikem HCC. Během sledování po dobu 11,4 roků pozorovali 164 případů HCC a 346 úmrtí. Incidence HCC vzrůstala s hodnotou HBV DNA v séru na počátku studie a kumulativní incidence byla 1,3–14,9 %. Biologický gradient HCC závisel na hodnotách HBV DNA v séru a zůstal signifikantní (p<0,001) i po přizpůsobení na pohlaví, věk, kouření cigaret, konsumpci alkoholu, stav HBeAg, aktivitu ALT a přítomnost jaterní cirhózy na počátku studie. Největší riziko HCC měli pacienti s trvalým zvýšením HBV DNA v séru ≥ 10 000 kopií/ml.
HBV DNA je dynamický parametr, který může posloužit jako hlavní předpovědní rizikový faktor pro vznik HCC bez ohledu na to, zda je HBeAg pozitivní nebo negativní, aktivitu ALT nebo přítomnost jaterní cirhózy (22).
V recentní studii z Hong-Kongu sledovali autoři 298 pacientů s chronickou hepatitidou B v průměru 108 měsíců a zjišťovali věk, v němž došlo k vyloučení HBsAg. Medián vyloučení HBsAg byl 49,6 roků a jen u 7 pacientů vznikl HCC (2,4 %). Kumulativní riziko HCC bylo vyšší u osob 50letých a starších oproti jedincům do 50 roků (p=0,004). Ze sedmi zjištěných HCC mělo 6 cirhózu, všichni byli muži v průměrném věku 69 roků a medián mezi vyloučením HBsAg a vznikem HCC byl 43,5 měsíců.
Trvale normální aktivitu ALT mělo 82 % pacientů. Autoři uzavřeli, že i po vyloučení HBsAg přetrvává replikace HBV na nízké úrovni, ale u osob mladších 50 let bylo jen nízké riziko vzniku HCC (23).
Protivirová léčba chronické hepatitidy B
Je známa již 30 let, ale v posledních 10 letech nastal v léčbě dramatický pokrok. Byly užity dva přístupy:
- prvním je definovaná a ohraničená léčba standardním a pegylovaným interferonem alfa trvající 4-12 měsíců,
- druhým přístupem je dlouhodobá kontinuální léčba perorálními analogy.
Léčba pegylovaným interferonem alfa navodí dlouhodobou remisi onemocnění u jedné třetiny HBeAg pozitivních pacientů, ale kratší remisi u osob bez HBeAg. Výsledky protivirové léčby interferonem jsou obecně známy a byly široce publikovány. Některé perorální nukleosidové analogy navozují supresi HBV při dlouhodobé léčbě a zlepšují biochemickou a histologickou aktivitu ve vysokém procentu u pacientů s pozitivním HBeAg nebo bez HBeAg, ale obojí léčba je drahá (24).
Nukleosidové a nukleotidové analogy
Lamivudin
Prvním perorálním nukleosidovým analogem byl lamivudin v optimální dávce 100 mg/den. Po jednoroční léčbě dosud neléčených pacientů nastalo podstatné zlepšení biochemických, virologických a histologických výsledků; sérokonverze HBeAg na anti-HBe byla v 17 % (25). Jeho výhodou je výborná snášenlivost, bezpečnost, možnost léčit i pokročilá onemocnění jater a významně snižuje riziko jaterní dekompenzace a vzniku HCC (26).
Nevýhodou je vznik genotypové mutace v lokusu YMDD (tyrosin, methionin, aspartát, aspartát). Při dlouhodobé léčbě vzniká rezistence v 49–70 % případů a zpravidla ji provází mnohonásobné zvýšení aktivity ALT. Je často podáván v asijsko-pacifické oblasti pro vysokou účinnost a přijatelnou cenu (27).
Dlouhodobá léčba lamivudinem snižuje riziko pozdních komplikací i u pacientů bez pokročilého onemocnění. Při léčbě trvající téměř 90 měsíců u 124 HBeAg pozitivních pacientů byla zjištěna mutanta YMDD v 76 %, ale nemocní s mutantou měli menší riziko vzniku cirhózy a HCC (p=0,024) a větší snížení HBV DNA v séru (p=0,001) než kontroly. Přestože vznik mutanty snižuje účinek léčby lamivudinem, byly výsledky léčby u mutovaných jedinců stále lepší než u kontrol (28).
Lamivudin byl opakovaně kombinován s léčbou pegylovaným interferonem alfa-2a nebo alfa-2b, ale oba léky účinkují lépe, pokud jsou podány samostatně (29). Podává se i v prevenci rekurence infekce HBV při transplantacích jater. Může být užitečný i u některých případů akutní hepatitidy B po transplantacích orgánů nebo při hrozící fulminantní hepatitidě B.
Přehled léků povolených k léčbě chronické hepatitidy B ve státech Evropské Unie je v tab. 1.
Table 1. Perorální analogy povolené v EU na léčbu chronické hepatitidy B 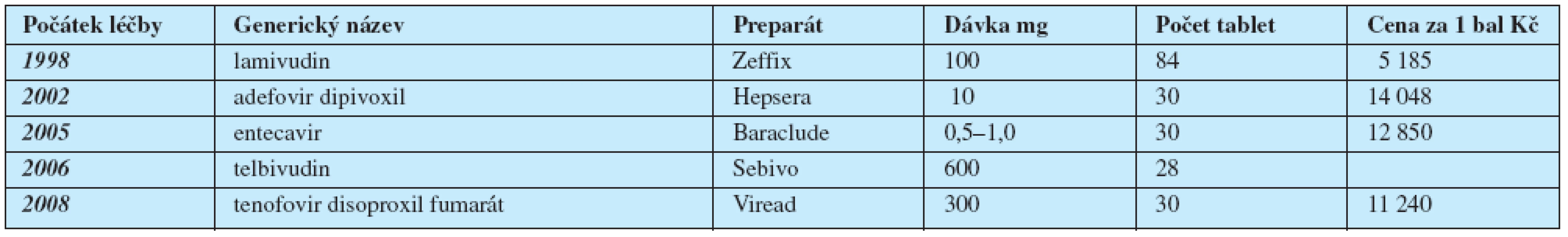
Adefovir
Adefovir dipivoxil (ADV) je nukleotidový analog odvozený od adenosinmonofosfátu, podává se v dávce 10 mg/den. V první zveřejněné studii byl podán 515 pacientům s pozitivním HBeAg a HBV DNA v séru v dávkách 10 nebo 30 mg/den a porovnán s placebem. Ve 48. týdnu měli pacienti léčení ADV významně větší histologické zlepšení při porovnání s placebem (p<0,001), snížení koncentrace HBV DNA v séru (p<0,001) nebo pokles pod 400 kopií/ml, častěji normalizaci ALT (p<0,001) a sérokonverzi HBeAg v závislosti na dávce (p<0,049 a p<0,01). Léčba byla dobře snášena, pouze při dávce 30 mg byl přechodný vzestup kreatininu v séru (30).
Ve studii u 185 HBeAg-negativních a HBV DNA pozitivních pacientů dostalo stejnou léčbu ADV 10 mg/den 123 náhodně vybraných pacientů a 62 placebo. Po 48. týdnech léčby měli léčení pacienti významné zlepšení histologického nálezu (p<0,001), snížení koncentrace HBV DNA v séru (p<0,001) a pokles aktivity ALT (p<0,001) oproti placebu. Léčba byla dobře snášena (31). Krátce poté bylo prokázáno, je ADV účinný i při léčbě rezistentní mutace YMDD vzniklé po lamivudinu. Lamivudin i ADV nyní slouží jako referenční léky, s nimiž je porovnávána účinnost nových protivirových preparátů.
Entecavir
Je odvozen od deoxyguaninu pro léčbu HBeAg pozitivních i negativních pacientů a podává se v dávce 0,5 mg/den, při prokázané rezistenci na lamivudin v dávce 1,0 mg/den. Účinnost entecaviru byla porovnána ve dvou velkých studiích s lamivudinem. U 725 HBeAg pozitivních pacientů nastalo po 48 týdnech léčby významné histologické (p=0,009) a virologické zlepšení (p<0,001), aktivita ALT rovněž významně poklesla (p=0,02) při porovnání s lamivudinem (32).
U 648 HBeAg-negativních pacientů nastalo po 52 týdnech léčby významné histologické (p=0,01) a virologické zlepšení (p<0,001), aktivita ALT se snížila (p=0,045). Průměrné snížení HBV DNA v séru bylo v obou studiích obdobné (p<0,001) ve prospěch entecaviru při porovnání s lamivudinem. Nebyla zjištěna žádná rezistence na entecavir (33). Entecavir byl účinnější u HBeAg pozitivních i negativních osob než lamivudin.
Telbivudin
V čínské studii byl podáván telbivudin v dávce 600 mg/den per os 52 týdnů a porovnán s lamivudinem v dávce 100 mg/den 1370 pacientům HBeAg pozitivním i negativním. Léčebná odpověď byla významně vyšší u telbivudinu než u lamivudinu (p=0,005) a rovněž i histologická odpověď (p=0,01). Po telbivudinu byla větší suprese HBV DNA v séru a menší stupeň rezistence než u lamivudinu. Pokles aktivity ALT a AST byl častější při léčbě lamivudinem (34).
Tenofovir DS
Tenofovir disoproxil fumarát byl podáván 641pacientům s chronickou hepatitidou B v dávce 300 mg/den a porovnán s účinností adefovir dipivoxilu v dávce 10 mg/den. Z 375 HBeAg-negativních pacientů mělo ve 48. týdnu 93 % hodnotu HBV DNA v séru pod 400 kopií/ml, což bylo významně více než u jedinců léčených adefovirem (p<0,001), ale histologický rozdíl nebyl významný, stejně jako aktivita ALT.
Z 266 HBeAg pozitivních pacientů mělo ve 48. týdnu 76 % hodnotu HBV DNA v séru pod 400 kopíí/ml, což bylo významně více než u jedinců léčených adefovirem (p<0,001), ale histologické zlepšení bylo u obou léků podobné a aktivita ALT se normalizovala častěji u osob léčených tenofovirem (p=0,03); sérokonverze HBeAg byla také častější, ale nevýznamná. Lze uzavřít, že u kompenzované infekce HBV byl tenofovir účinnější než adefovir dipivoxil (35).
Závěr
Protivirová léčba chronické infekce HBV je velkým pokrokem medicíny v posledních 30 letech. Indikace k léčbě vychází z kombinace 3 kritérií: hodnoty HBV DNA, aktivity ALT a histologického nálezu. Pokud je hodnota HBV DNA nad 2 000 IU/ml (což je asi 10 000 kopií/ml) a/nebo zvýšená aktivita ALT, nebo jsou v biopsii těžší zánětlivé změny a/nebo fibróza, měl by být pacient léčen. U HBeAg pozitivní infekce je vhodné pokusit se o sérokonverzi HBeAg buď pegylovaným interferonem alfa, nebo perorálními analogy (pegylovaný interferon vytlačil standardní formu interferonu alfa). Léčba není indikována u inaktivních nosičů s trvale normální hodnotou ALT a HBV DNA do 1 000 IU/ml, neboť je u nich jen malé riziko progrese onemocnění a komplikací.
Perorální analogy suprimují HBV DNA hlouběji než pegylovaný interferon, ale liší se v rezistenci. Jsou účinné u pacientů, kteří předtím neodpověděli na interferon, zpomalují fibrózu jater, oddalují dekompenzaci a zlepšují přežití. Snížení kovalentně vázané cirkulární DNA (cccDNA), která je odpovědná za přetrvávání infekce HBV v játrech, je podobné po sérokonverzi HBeAg pozitivního pacienta jak při spontánní, tak interferonem navozené nebo indukované perorálními analogy.
Pro prevenci komplikací (jaterní cirhóza, HCC) je podstatné a rozhodující, aby hodnota HBV DNA v séru během léčby byla co nejnižší a udržela se na této úrovni i po skončení léčby a současně aby byla co nejnižší aktivita aminotransferáz, nejlépe v dolní polovině normálního rozmezí. Při léčbě analogy se doporučuje kontrolovat virémii každé 3 měsíce.
Na rozdíl od interferonu mají perorální analogy jen mírné a přijatelné nežádoucí účinky i při dlouhodobé léčbě. Rezistence na interferon není známa, ale je častá u perorálních analogů (vysoká u lamivudinu a nízká u tenofoviru). Mezi analogy může nastat zkřížená rezistence, což znamená, že rezistence na jeden lék vylučuje podání druhého léku. Obecně nukleotidy jsou účinné při rezistenci na nukleosidy a naopak. U dosud neléčených pacientů není doporučena protivirová kombinovaná léčba jako terapie počáteční.
Po dosažení sérokonverze HBeAg má léčba pokračovat ještě 6 měsíců i déle, aby se negativní HBeAg udržel trvale. Pacienti s dekompenzovanou cirhózou mají být léčeni ve spolupráci s transplantačním centrem (3, 36). Sledování osob s pozitivním HBsAg v séru by mělo být celoživotní.
Léčba speciálních skupin nemocných a kombinovaná léčba přesahuje možnosti tohoto informativního článku. Zdá se však téměř jisté, že se splnila předpověď významného britského hepatologa prof. Geoffrey Dusheika, vyslovená již před 10 lety v časopisu Lancet (37).
doc. MUDr. Jaroslav Stránský, CSc.
I. interní klinika FN KV a 3. LF UK
Šrobárova 50
100 34 Praha 10
E-mail: int1sec@fnkv.cz
Sources
1. Ganem, D., Prince, A.M. Hepatitis B virus infection – natural history and clinical consequences. N. Engl. J. Med. 2004, 350, p. 1118-1129.
2. Lavanchy, D. Hepatitis B virus epidemiology, disease burden, treatment, and current and emerging prevention and control measures. J. Viral Hepat. 2004, 11, p. 97-107.
3. Marcellin, P., Dusheiko, G., Zoulim, F. et al. EASL Clinical Practise Guidelines: management of chronic hepatitis B. J. Hepatol. 2009, 50, p. 227-242.
4. Hadziyannis S.J., Vassilopoulos, D. Hepatitis B e antigen-negative chronic hepatitis B. Hepatology 2001, 34, p. 617-624.
5. Funk, M.L., Rosenberg, D.M., Lok A.S. World-wide epidemiology of HBeAg-negative chronic hepatitis B and associated precore and core promoter variants. J. Viral Hepat. 2002, 9, p. 52-61.
6. Zarski, J.P., Marcellin, P., Leroy, V. et al. Characteristics of patients with chronic hepatitis B in France: predominant frequency of HBe antigen negative cases. J. Hepatol. 2006, 45, p. 355-360.
7. Locarnini, S., McMillan, J., Bartholomeusz, A. The hepatitis B virus and common mutants. Sem. Liv. Dis. 2003, 23, p. 5-20.
8. Hoofnagle, J.H., Shafritz, D.A., Popper, H. Chronic type B hepatitis and the „healthy“ HBsAg carrier state. Hepatology 1987, 7, p. 758-763.
9. Fattovich, G. Natural history and prognosis of hepatitis B. Sem. Liv. Dis. 2003, 23, p. 47-58.
10. Perillo, R. Acute flares in chronic hepatitis B: the natural and unnatural history of an immunologically mediated liver disease, Gastroenterology 2001, 120, p. 1009-1022.
11. Lok, A., Heathcote, J., Hoofnagle, J. Management of hepatitis B 2000: summary of a workshop. Gastroenterology 2001, 120, p. 1828-1853.
12. Martinot-Peignoux, M., Boyer, N., Colombat, M. et al. Serum hepatitis B virus DNA levels and liver histology in inactive HBsAg carriers. J. Hepatol. 2002, 36, p. 543-546.
13. Seo, Y., Yoon, S., Truong, B.X. et al. Serum hepatitis B virus DNA levels differentiating inactive carriers from patients with chronic hepatitis B. Eur. J. Gastroenterol. Hepatol. 2005, 17, p. 753-757.
14. Kumar, M., Sarin, S.K., Hissr, S. et al. Virologic and histologic festures of chronic hepatitis B virus-infected asymptomatic patients with persistently normal ALT. Gastroenterology 2008, 134, p. 1376-1384.
15. Tsang, F.S.Y., Trinh, H., Garcia, R.T. et al. Significant prevalence of histologic disease in patients with chronic hepatitis B and mildly elevated serum alanine aminotransferase levels. Clin. Gastroenterol. Hepatol. 2008, 8, p. 569-574.
16. Tanaka, Y., Esumi, M., Shikata, T. Persistence of hepatitis B virus DNA after serological clearance of hepatitis B virus. Liver 1990, 10, p. 6-10.
17. Loriot, M., Marcellin, P., Talbodec, N. et al. Demostration of hepatitis B DNA by polymerase chain reaction in the serum after spontaneous or therapeutically induced HBeAg to anti-HBe or HBsAg to anti-HBs seroconversion in patients with chronic hepatitis B. Hepatology 1992, 15, p. 32-36.
18. Arase, Y., Ikeda, K., Suzuki, F. et al. Long term outcome after hepatitis B surface antigen seroclearance in patients with chronic hepatitis B. Am. J. Med. 2006, 119, E9-E16.
19. Ahn, S.H., Park, Y.N., Park, J.Y. et al. Long-term clinical and histological outcomes in patients with spontaneous hepatitis B surface antigen seroclearance. J. Hepatol. 2005, 42, p. 188-194.
20. Adachi, H., Kaneko, S., Matsushita, E., et al. Clearance of HBsAg in seven patients with chronic hepatitis B. Hepatology 1992, 16, p. 1334-1337.
21. Yuen, M.F., Yuan, H.J., Wong, D.K. et al. Prognostic determinants for chronic hepatitis B in Asians: therapeutic implications. Gut 2005, 54, p. 1610-1614.
22. Chen, C.J., Yang, H.I., Su, J. et al. Risk of hepatocellular carcinoma across a biological gradient of serum hepatitis B virus DNA level. J. Amer. Med. Assoc. 2006, 295, p. 65-73.
23. Yuen, M.F., Wong, D.K.H., Fung, J. et al. HBsAg seroclearance in chronic hepatitis B in Asian patients: replicative level and risk of hepatocellular carcinoma. Gastroenterology 2008, 135, p. 1192-1199.
24. Hoofnagle, J.H., Doo, E., Liang, T. J. et al. Management of hepatitis B: summary of a clinical research workshop. Hepatology 2007, 45, p. 1056-1075.
25. Dienstag, J.L., Schiff, E.R., Wright, T.L. et al. Lamivudine as initial treatment for chronic hepatitis B in the United States. N. Engl. J. Med. 1999, 341, p. 1256-1263.
26. Liaw, Y.F., Sung, J.J.Y., Chow, W.C. et al. Lamivudine for patients with chronic hepatitis B and advanced liver disease. N. Engl. J. Med. 2004, 351, p. 1521-1531.
27. Liaw, Y.F., Leung, N., Guan, R. et al. Asian-Pacific consensus statement on the management of chronic hepatitis B: a 2005 update. Liver Internat. 2005, 25, p. 472-489.
28. Yuen, M.F., Seto, W.K., Chow, D.H. et al. Long-term lamivudine therapy reduces the risk of long-term complications of chronic hepatitis B infection even in patients without advanced disease. Antiviral Therapy 2007, 12, p. 1295-1303.
29. Marcellin, P., Lau, G. K.K., Bonino, F. et al. Peginterferon alfa-2a alone, lamivudine alone, and the two in combination in patients with HBeAg-negative chronic hepatitis B. N. Engl. J. Med. 2004, 351, p. 1206-1217.
30. Marcellin, P., Chang, T.T., Lim, S.G. et al. Adefovir dipivoxil for the treatment of hepatitis B e antigen-positive chronic hepatitis B. N. Engl. J. Med. 2003, 348, p. 808-816.
31. Hadziyannis, S., Tassopoulos, N.C., Heatcote, E.J. et al. Adefovir dipivoxil for the treatment of hepatitis B e antigen-negative chronic hepatitis B. N. Engl. J. Med. 2003, 348, p. 800-807.
32. Chang, T.T., Gish, R.G., de Man, R. et al. A comparison of entecavir and lamivudine for HBeAg-positive chronic hepatitis B. N. Engl. J. Med. 2006, 354, p. 1001-1010.
33. Lai, C.L., Shouval, D., Lok, A.S. et al. Entecavir versus lamivudine for patients with HBeAg-negative chronic hepatitis B. N. Engl. J. Med. 2006, 354, p. 1011-1020.
34. Lai, C. L., Gane, E., Liaw, Y. F. et al. Telbivudine versus lamivudine in patients with chronic hepatitis B. N. Engl. J. Med. 2007, 357, p. 2576-2588.
35. Marcellin, P., Heathcote, E.J., Buti, M. et al. Tenofovir disoproxil fumarate versus adefovir for chronic hepatitis B. N. Engl. J. Med. 2008, 359, p. 2442-2455.
36. Dienstag, J.L. Drug therapy: hepatitis B virus infection. N. Engl. J. Med. 2008, 359, p. 1486-1500.
37. Dusheiko, G. A pill a day, or two, for hepatitis B ? Lancet 1999, 353, 1032-1033.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2009 Issue 7-
All articles in this issue
- Změny v postgraduálním vzdělávání posudkových lékařů
- Pochybení a omyly v lékařské praxi
- Nastaly nějaké změny v epidemiologii a terapii chronické hepatitidy B?
- Vliv časné nutriční podpory a fyzioterapie během akutního onemocnění u geriatrických pacientů
- Názory praktických lékařů na činnost lékařské posudkové služby
- Usnadnění práce lékaře při použití formalizovaných českých hypertenzních doporučení
- Léčba závislosti na kanabinoidech
- Regionální migrující osteoporóza – diferenciálně diagnostický problém
- Prevencia artériovej trombózy (artériotromboprofylaxia) v klinickej praxi
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Regionální migrující osteoporóza – diferenciálně diagnostický problém
- Pochybení a omyly v lékařské praxi
- Léčba závislosti na kanabinoidech
- Prevencia artériovej trombózy (artériotromboprofylaxia) v klinickej praxi
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

