-
Medical journals
- Career
Současné možnosti a problémy antiretrovirové terapie
Authors: L. Machala; D. Jilich
Authors‘ workplace: Primářka: MUDr. Hana Roháčová, Ph. D. ; AIDS centrum, Infekční klinika FN Bulovka, Praha
Published in: Prakt. Lék. 2008; 88(2): 71-77
Category: Reviews
Overview
Zavedení antiretrovirové terapie do klinické praxe přineslo výrazné zkvalitnění a prodloužení délky života osob s HIV infekcí. V současné době jsou v klinickém užívání léky ze 4 různých skupin a řada dalších nadějných přípravků je v různém stádiu klinického výzkumu. Zásadními problémy současné antiretrovirové terapie je jednak častý výskyt závažných nežádoucích účinků a také poměrně snadný vznik rezistence. Základní podmínkou úspěchu antiretrovirové terapie je dobrá spolupráce lékaře a pacienta, založená na bedlivém sledování rozvoje nežádoucích účinků lékařem a maximální adherencí k terapii ze strany pacienta. Od vývoje nových antiretrovirových léku jsou očekávány přípravky méně toxické, odolnější ke vzniku rezistence a v neposlední řadě také levnější, protože pro vysokou cenu těchto léků má k antiretrovirové terapii v současné době přístup ve světě pouze asi 25 % všech lidí, kteří by tuto léčbu potřebovali
Klíčová slova:
HIV, AIDS, terapie, rezistence, nežádoucí účinky.Úvod
Během dvaceti let, které uplynuly od roku 1987, kdy byl do klinické praxe zaveden první antiretrovirový lék zidovudin, prošla antiretrovirová terapie prudkým vývojem a její možnosti se výrazně zlepšily (1, 2). Pokrok antiretrovirové terapie je nesporný, podařilo se výrazně zkvalitnit a prodloužit život většiny pacientů s HIV infekcí; např. se odhaduje se, že jen v USA přinesla tato léčba osobám s HIV infekcí 3 milióny roků života a uchránila před HIV infekcí nejméně 2 900 novorozenců matek s HIV infekcí. Přes tyto úspěchy však dosud nelze považovat výsledky antiretrovirové terapie za uspokojivé – základními problémy zůstávají jednak vysoký výskyt nežádoucích účinků (NÚ) a také častý vznik rezistence; v neposlední řadě ovšem také vysoká ekonomická náročnost antiretrovirové terapie – je smutnou skutečností, že pro vysokou cenu léků má v rozvojových zemích, kde žije nejvíce lidí postižených touto nemocí, přístup k léčbě antiretrovirotiky jen asi čtvrtina všech potřebných (3, 4).
Virostatika užívaná k léčbě HIV infekce
Zidovudin byl prvním lékem ze skupiny nukleosidových inhibitorů HIV transkriptázy (nucleoside reverse transcriptase inhibitors – NRTI), které zasahují na samém začátku replikačního cyklu HIV. Mechanismus jejich účinku spočívá v blokádě reverzní transkripce virové RNA do provirové DNA: je-li do vznikajícího řetězce DNA na místo přirozeného nukleosidu začleněn jeho syntetický analog, nemůže reverzní transkripce pokračovat a replikační cyklus je zastaven. Tato skupina léků včetně zidovudinu stále tvoří základní součást (back-bone) většiny léčebných režimů. V roce 2001 přibyl k této skupině léků nukleotidový inhibitor reverzní transkriptázy tenofovir, který byl syntetizován profesorem A. Holým v Ústavu organické chemie a biochemie Akademie věd (5) (tab. 1).
Table 1. Přehled nukleosidových inhibitorů HIV reverzní transkriptázy 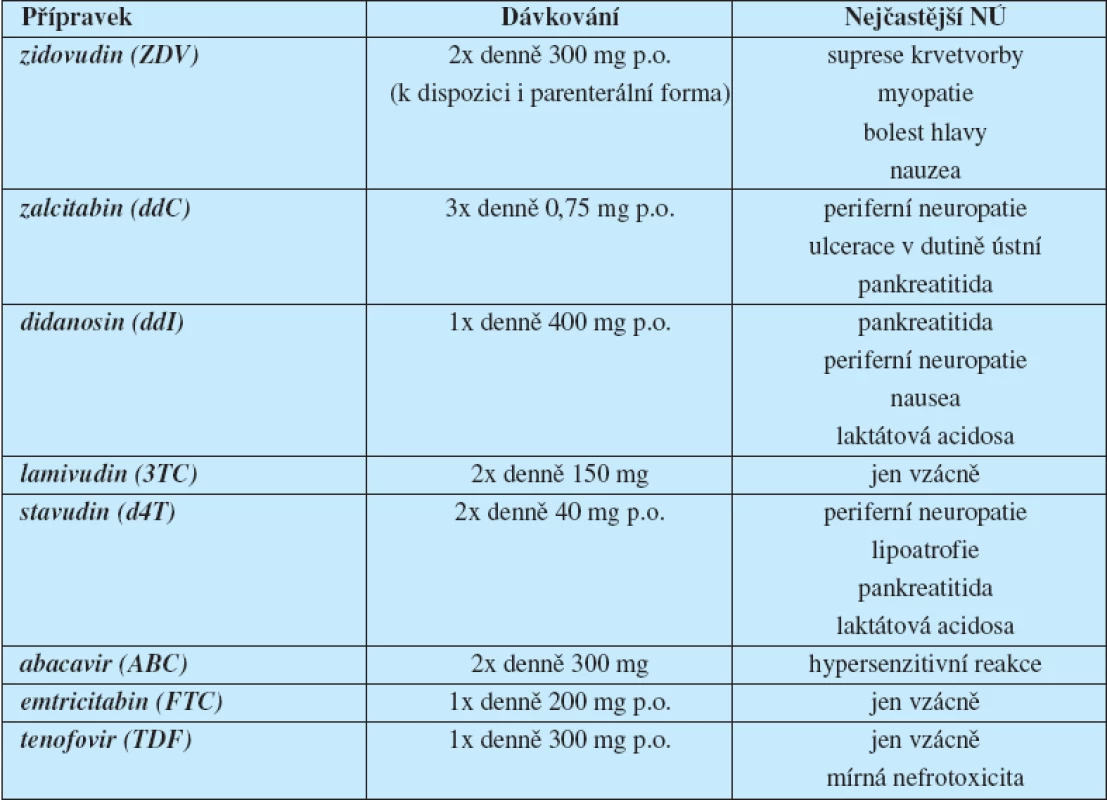
V polovině devadesátých let se arzenál antiretrovirových chemoterapeutik rozšířil nejprve o nenukleosidové inhibitory HIV-1 reverzní transkriptázy (NNRTI) a krátce poté o inhibitory HIV proteázy (PI) (6, 7). Léky ze skupiny NNRTI rovněž blokují reverzní transkripci HIV RNA do provirové DNA, mechanismus jejich účinku je ale zcela odlišný – vážou se přímo na enzym reverzní transkriptázu, konkrétně na tzv. alosterickou kapsu molekuly reverzní transkriptázy; výsledný komplex NNRTI s reverzní transkriptázou má jen omezenou afinitu k přirozeným nukleotidům, a tím dochází k účinné inhibici reverzní transkripce (tab. 2).
Table 2. Přehled nenukleosidových inhibitorů HIV reverzní transkriptázy 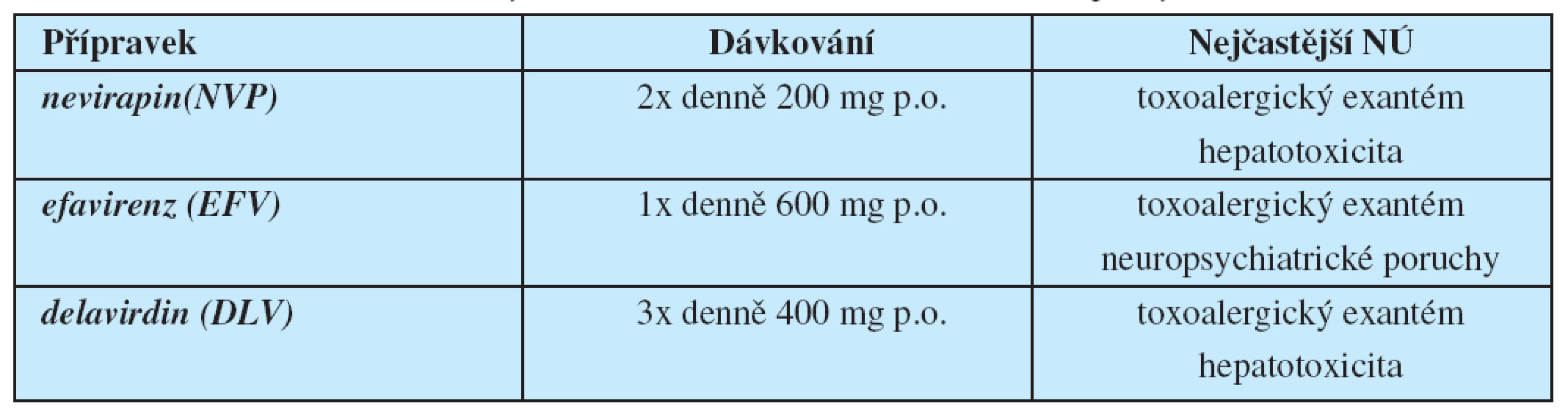
Inhibitory HIV proteázy účinkují narozdíl od předchozích skupin antiretrovirotik na samém konci replikačního cyklu HIV, kdy definitivní maturace nových virových partikulí je podmíněna rozštěpením polyproteinových řetězců Gag-pol pomocí HIV proteázy. Inhibitory HIV proteázy se kompetitivně vážou na toto aktivní místo tohoto enzymu a inhibují tak rozštěpení řetězců Gag-pol. Nezralé virové partikule, ve kterých nedošlo k rozštěpení těchto polyproteinových řetězců, pak nejsou schopné efektivní replikace v další hostitelské buňce.
Zavedení inhibitorů HIV proteázy do praxe v roce 1995 znamenalo dosud největší přínos pro terapii HIV infekce a vedlo k zásadnímu obratu v léčbě, který byl spojen s výrazným poklesem morbidity i mortality pacientů s tímto onemocněním (tab. 3 – str. 73).
Table 3. Přehled inhibitorů HIV proteázy 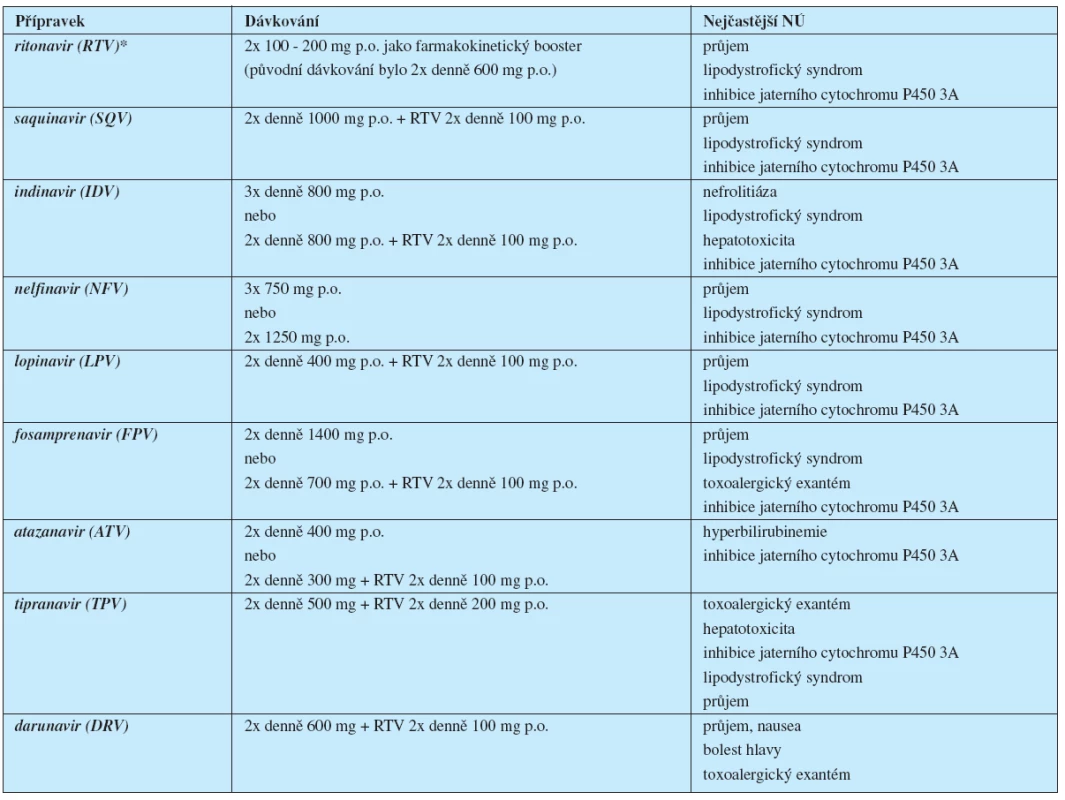
V roce 2003 byl do klinické praxe uveden první a dosud jediný lék ze skupiny tzv. inhibitorů fúze enfuvirtid. Tento léky se extracelulárně váže na virový glykoproteinu gp41, což vede k zastavení fúze mezi HIV a cílovou buňkou, a virová RNA do této buňky nemůže vstoupit. Enfuvirtid má peptidovou molekulu a musí být jako jediný antiretrovirový lék aplikován parenterálně (8).
V roce 2007 byly pro klinickou praxi uvolněny první zástupci dalších dvou skupin léků – jednak inhibitor koreceptoru CCR5 maraviroc, který blokuje proces přichycení HIV na cílové buňce a také první inhibitor HIV integrázy raltegravir, který blokuje proces integrace provirové DNA do genomu napadené buňky. Oba tyto přípravky nejsou v České republice dosud k dispozici, lze ale očekávat, že v průběhu roku 2008 jimi první pacienti léčeni budou.
V současné době je tak pro léčbu HIV infekce k dispozici celkem 24 přípravků ze šesti různých skupin; v užívání je i několik léků kombinovaných, které obsahují v jedné tabletě několik účinných složek a umožňují tak snížit počet užívaných tablet.
Základem léčby je v současné době podávání kombinací antiretrovirotik – obvykle tří přípravků ze dvou různých skupin, v rámci tzv. cART (combination antiretroviral therapy). Monoterapie nebo léčba kombinací dvou přípravků je vyhrazena prakticky pouze pro časově omezené podávání v rámci profylaxe vertikálního přenosu v graviditě nebo při postexpoziční profylaxi.
Cíle a indikace antiretrovirové terapie
Cílem antiretrovirové terapie je maximální dosažitelná rekonstituce imunitního systému, která zajistí prodloužení života a zlepšení nebo alespoň udržení jeho kvality (9, 10). Toho lze dosáhnout pomocí maximální suprese virové replikace vyjádřené poklesem plasmatické virové nálože HIV RNA. Z epidemiologického hlediska je rovněž významné, že antiretrovirová léčba přispívá k tlumení dalšího šíření HIV v populaci, protože léčené osoby jsou zpravidla méně infekční.
V současné době existují čtyři základní indikace zahájení antiretrovirové terapie:
- léčba chronické HIV infekce (obvykle klinická kategorie B),
- profylaxe vertikálního přenosu HIV infekce,
- postexpoziční profylaxe, a
- léčba akutní HIV infekce.
Chronická HIV infekce u symptomatických pacientů s vysokým rizikem progrese onemocnění do AIDS nebo smrti je nejčastější a nejvýznamnější indikací k zahájení terapie antiretrovirotiky. V tomto stádiu jsou léky podávány prakticky výhradně v režimu cART, kdy pacient obvykle užívá kombinaci tří přípravků ze dvou různých skupin, většinou 2 NRTI + 1 PI nebo 2 NRTI + 1 NNRTI (11).
Profylaxe vertikálního přenosu HIV infekce z matky na plod je druhou významnou indikací antiretrovirové léčby. Při optimálním využití všech současných možností farmakologické i nefarmakologické intervence se redukuje riziko přenosu infekce z matky na dítě v průběhu gravidity a porodu z hodnot kolem 20 % za přirozených podmínek na hodnoty kolem 2–3 %. Profylaktické podávání antiretrovirotik se u těhotné zahajuje ve 14. týdnu gravidity a často není podávána kompletní kombinace cART, ale je obvykle užívána pouze monoterapie zidovudinem nebo kombinace zidovudin + lamivudin. Novorozenec není kojen a po dobu 6 týdnů po porodu užívá zidovudin (12).
Postexpoziční profylaxe slouží k zábraně přenosu HIV infekce u exponovaných osob ve vysokém riziku, jako je perkutánní poranění kontaminovaným předmětem nebo pohlavní styk. Léky se podávají po dobu 4 týdnů a podle míry rizika přenosu infekce se volí buď kombinace dvou NRTI nebo při vysokém riziku kompletní cART. Postexpoziční profylaxi je třeba zahájit co nejdříve (maximálně do 72 hodin) a při včasném zahájení lze redukovat riziko infekce až o 90 % (13–16).
Akutní HIV infekce – indikační kriteria k zahájení antiretrovirové léčby v tomto stádiu onemocnění nejsou dosud jednoznačně stanovena, zdá se však, že léčba může, alespoň u některých pacientů, výrazně zpomalit pozdější progresi onemocnění. Akutní HIV infekce představuje klíčový moment přirozeného vývoje onemocnění, kdy léčbou navozená radikální suprese virové replikace a snížení virové nálože v plazmě zbrzdí diseminaci HIV v organismu a udrží reaktivitu HIV-specifických CD4+ T lymfocytů. Dostatečná funkční schopnost CD4+ T lymfocytů je podmínkou dlouhodobé přirozené suprese HIV, a tím i zpomalení progrese HIV infekce. Vždy by zřejmě měla být léčba zahájena u pacientům s těžkým a protrahovaným průběhem akutní infekce.
Rozhodneme-li se k léčbě, měla by tato být zahájena co nejdříve po potvrzení diagnózy, nejdéle však do půl roku po proběhlé akutní infekci. Léčba akutní HIV infekce je prováděna podle stejných zásad jako léčba chronické HIV infekce režimem cART. Iniciální léčba akutní HIV infekce má trvat 6 měsíců až 1 rok a pak se lze v průběhu asymptomatického stadia pokusit při velmi nízkých hladinách virové nálože (poãet kopií HIV RNA < 50/ml) a dostatečně vysokém počtu CD4+ T lymfocytÛ (> 500/∝l) o vysazení antiretrovirové terapie.
Mnoho pacientů pak může být bez této léčby za trvalého sledování klinického stavu a laboratorních hodnot po mnoho let, u jiných pacientů ovšem dojde po vysazení iniciální léčby opět k rychlému zhoršení jak laboratorních nálezů, tak klinického stavu a je nutné antiretrovirotika znovu nasadit (17, 18).
Monitorování průběhu terapie
V průběhu terapie je třeba provádět pravidelné sledování klinického stavu a řady laboratorních parametrů tak, aby bylo možno včas odhalit selhání terapie a aby bylo možno předcházet výskytu závažných nežádoucích účinků (NÚ) léčby.
Základními laboratorními markery hodnocení průběhu HIV infekce jsou počet CD4+ T lymfocytů a hodnota virové nálože, která je měřena pomocí polymerázové řetězové reakce a udávána jako počet kopií HIV RNA v l ml plazmy.
Analýzy výsledků z řady studií ukazují, že nejspolehlivější předpovědní hodnotu dlouhodobé virové suprese je rychlý iniciální pokles virové nálože v průběhu prvních 4 týdnů terapie, který má činit ≥ 1 log10 (90 %) a dosažení nedetekovatelných hodnot virové nálože (< 50 kopií/ml) po 16 týdnech. Vývoj hodnot CD4+ T lymfocytů je v optimální situaci zrcadlovým obrazem změn virové nálože – do 16 týdnů by měl nárůst počtu činit alespoň 50–60 buněk/μl a následný růst počtu CD4+ T lymfocytů kolem 50–100 buněk/μl za rok při trvalé optimální virové supresi (19).
Kromě sledování hodnot virové nálože apočtu CD4+T lymfocytů je třeba pravidelně monitorovat řadu dalších laboratorních parametrů; do standardní sestavy patří především kompletní krevní obraz, jaterní enzymy a bilirubin, glykémie, urea akreatinin, albumin a celková bílkovina, C-reaktivní protein, laktát, krevní lipidy. Klinické vyšetření má zahrnovat zjištění hmotnosti pacienta, celkové vyšetření těla se zaměřením na stav výživy a případnou lipodystrofii, vyšetření kůže, prohlédnutí dutiny ústní, kontrolu mízních uzlin, poslechové vyšetření srdce a plic včetně měření krevního tlaku, palpace jater a sleziny a orientační neurologické vyšetření. Vzhledem k nebezpečí tuberkulózy je nutné kontrolovat jedenkrát za rok RTG snímek plic.
UHIV pozitivních žen je vhodné provádět gynekologické kontroly zaměřené na onkologickou prevenci jedenkrát za půl roku, minimálně ale jednou za rok. Upacientů s hlubokým imunodeficitem je doporučeno provádět pravidelné oftalmologické kontroly včetně vyšetření očního pozadí. Nesmírně důležitou součástí komplexní péče oHIV pozitivní pacienty je také poskytování adekvátní psychické podpory ať již ošetřujícím lékařem, či specialistou psychologem nebo psychiatrem.
Nežádoucí účinky
Nežádoucí účinky antiretrovirové terapie jsou časté, četné a mnohdy velmi závažné atoxicita antiretrovirových prostředků je tak, jak již bylo uvedeno výše, spolu s rezistencí hlavním faktorem, který limituje úspěšnost této léčby. V prvém roce léčby postihují NÚ kolem poloviny všech pacientů a jsou také nejčastější příčinou změny nebo ukončení terapie v tomto období; navíc kolem 20 % všech HIV pozitivních pacientů léčbu cART ze strachu z NÚ vůbec odmítá, nebo z ní má značné obavy (20).
V době uvádění jednotlivých skupiny antiretrovirotik do praxe panovalo určité optimistické očekávání, že výskyt NÚ nebude při léčbě těmito přípravky vysoký, protože v lidském organismu se nevyskytují enzymy se substrátovou specificitou podobnou HIV reverzní transkriptáze a zvláště pak HIV proteáze. Tato očekávání se bohužel nenaplnila a záhy se ukázalo, že většina antiretrovirotik jsou léky s úzkou terapeutickou šíří, jejichž farmakodynamicky účinné dávky jsou na horní hranici tolerability pro lidský organismus. Alespoň mírné nežádoucí účinky do stupně toxicity 1–2, jako jsou gastrointestinální příznaky, anémie, neutropénie či elevace jaterních enzymů, mají prakticky všechna antiretrovirotika. I velmi mírné subjektivní nežádoucí účinky, jako jsou např. lehké gastrointestinální obtíže, však mohou významně snižovat adherenci k léčbě, a tím zásadním způsobem přispívat k rozvoji rezistence (21).
Závažné a potenciálně dokonce fatální NÚ mohou postihnout většinu orgánů a orgánových systému těla a jejich výskyt výrazně narůstá s délkou léčby a také s pokročilostí základního onemocnění. U řady léků již příčiny vzniku jejich NÚ známe a dokážeme jim úspěšně čelit, u mnoha jiných jsou však patogenetické mechanismy jejich vzniku nejasné a jediným způsobem, jak těmto NÚ předcházet, je jednak odpovědná volba složení léčebných režimů a jednak pečlivé sledování průběhu léčby (22).
Gastrointestinální poruchy jsou nejčastějšími NÚ antiretrovirové terapie a mohou se vyskytnout při podávání prakticky všech antiretrovirotik. Typickými projevy jsou nauzea a zvracení, bolesti břicha, flatulence, pálení žáhy, průjmy a ztráta chuti k jídlu.
Nauzea se nejčastěji vyskytuje u pacientů léčených zidovudinem, průjmy typicky u pacientů léčených PI. U většiny pacientů ustupují tyto NÚ obvykle během 4–6 týdnů po zahájení terapie, často pomůže i psychoterapeutický edukační pohovor a úprava diety. Přetrvávající obtíže lze podle charakteru příznaků mírnit symptomatickou léčbou např. metoclopramidem či při průjmech antimotiliky (19).
Hepatotoxicita je dalším velmi častým nežádoucím účinkem, který se může objevit při léčbě prakticky všemi antiretrovirovými prostředky. Obvykle se jedná pouze omírný vzestup laboratorních parametrů (ALT, AST, GMT, méně často bilirubinu), bez vážnějších klinických projevů jaterního poškození (23).
Nejzávažnější typ jaterního poškození se objevuje při léčbě nevirapinem. K rozvoji jaterního poškození dochází časně, obvykle již v prvních 6–12 týdnech léčby, a rychle může nastat progrese do jaterní nekrózy s exitem. Mechanismus vzniku tohoto NÚ není jasný, předpokládá se imunopatologický původ (24).
Při léčbě atazanavirem dochází pravidelně ke značnému vzestupu nekonjugovaného bilirubinu bez elevace transamináz; příčinou je zřejmě inhibice enzymu uridin 5‘-difosfo-glukuronosyltransferázy anásledný pokles konjugace bilirubinu. Tento NÚ je považován za „kosmetický“ bez zásadního vlivu na zdravotní stav pacientů, nicméně upřibližně 3–5 % pacientů dochází k rozvoji intenzivního ikteru, který pacienty přinejmenším značně společensky stigmatizuje (25).
Laktátová acidóza a jaterní steatóza – přítomnost zvýšených hladin laktátu je jedním z častých projevů mitochondriální toxicity vázané především na podávání některých NRTI. Mechanismus tohoto NÚ spočívá vinhibici mitochondriální γ-DNA polymerázu s následnou poruchou replikace mitochondrií a jejich funkcí (26). Většinou se jedná o klinicky asymptomatickou hyperlaktátémii (>2 mmol/l), asi u1 % těchto pacientů však může dojít rozvoji závažných, potenciálně fatálních komplikací. Klinické projevy nastupující laktátové acidózy jsou nespecifické a zahrnují zvýšenou únavu, myalgie, nevolnost, zvracení, vzedmutí a bolest břicha, průjem, dušnost a stav může přejít do jaterního a kardiopulmonálního selhání.
Při sonografickém vyšetření jater nebo v biopsii bývají patrné známky jaterní steatózy. U pacientů s projevy laktátové acidózy je třeba ihned přerušit podávání NRTI , závažnější stavy vyžadují léčbu na jednotce intenzivní péče (27).
Metabolický syndrom při antiretrovirové terapii – záhy po zavedení vysoce účinné antiretrovirové terapie sestávající z kombinace PI a NRTI do klinické praxe v polovině devadesátých let se objevily prvé zprávy o výskytu poruch metabolismu lipidů a glycidů provázejících tuto léčbu a postupně bylo stále zřejmější, že u těchto pacientů dochází k rozvoji souboru klinických a laboratorních příznaků, jako je lipodystrofický syndrom, hypertenze, dyslipoproteinémie a inzulínová rezistence, které nápadně připomínají tzv. metabolický syndrom (28, 29).
Poruchy rozložení tukové tkáně (lipodystrofický syndrom), vyskytující se při léčbě antiretrovirotiky, bývají velmi nápadné a podle charakteru morfologických změn je lze rozdělit do dvou forem s odlišnou etiologií, které se mohou objevovat izolovaně nebo společně. V určitých oblastech organismu se typicky objevuje akumulace tukové tkáně a naopak v jiných lokalizacích dochází k její atrofii. K aku-mulaci tuku dochází zvláště uvnitř dutiny břišní (Crix-belly, protease paunch), šíje (buffalo hump), prsou (gynekomastie) a také izolovaně v podkoží některých částí těla (periferní lipomatóza).
Při lipoatrofii dochází k úbytku podkožního tuku v oblastech tváří, končetin ahýždí. Lipodystrofické změny postihují podle složení a délky léčebných režimů 20–80 % pacientů léčených kombinací NRTI aPI a prvé známky jsou většinou pozorovány po 18 měsících terapie.
Zvýšené ukládání tuků je většinou spojeno s terapií PI, lipoatrofie je obvykle vázána na terapii thymidinovými NRTI příčinou je zřejmě deplece mitochondriální DNA (30).
Patogeneze poruch glycidového a lipidového metabolismu není dosud plně vysvětlena. Byla navržena řada hypotéz, žádná z nich však nevysvětluje kompletně všechny aspekty toho problému. V experimentech sledujících účinky PI na lidských buňkách i zvířecích modelech byla pozorována řada poruch, jako je inhibice diferenciace adipocytů, zvl. snížení aktivace a translokace sterol-regulačních proteinů SREBPs (sterol regulatory element-binding proteins), přímá inhibice inzulin-dependentního transportéru glukózy GLUT-4 (glucose transporter) v tukové a svalové tkáni a také přímá inhibice proteasomů zajišťujících degradaci apolipoproteinu B (31). Velká pozornost je v současné době věnována vlivu poruch metabolismu tuků a glycidů u pacientů léčených cART na rozvoj možných kardio - a cerebrovaskulárních komplikací a intenzivně je také diskutována otázka, zda riziko těchto komplikací nepřevyšuje prospěch z antiretrovirové terapie.
K bližšímu porozumění komplikovaného vztahu antiretrovirové terapie avzniku vaskulárních komplikací je třeba dalšího výzkumu, nicméně v současné době lze říci, je přínos terapie cART, zvláště PI, je jednoznačný a momentálně, alespoň pro značnou část pacientů, je léčba těmito přípravky nezastupitelná (32).
Anémie po zidovudinu byla prvním závažným NÚ antiretrovirové terapie, který byl v klinické praxi zaznamenán. Prakticky u všech pacientů na zidovudinem se záhy dostavuje mírná makrocytární anémie (MCV>98 fl), která obvykle zůstává stabilizovaná na mírném stupni. U některých pacientů však suprese červené řady pokračuje progresivně dále a mnohdy se již po 12 týdnech léčby může objevit hluboká anémie s hodnotami hemoglobinu pod 60 g/l. V těchto případech je třeba podávání zidovudinu ihned ukončit, dle stavu podat transfúzi, zajistit substituci kyseliny listové a vitamínu B12 a případně i léčbu erytropoetinem (33).
Neutropénie – při terapii NRTI či PI se může objevit neutropénie, která obvykle vyžaduje změnu terapie, v závažných případech je indikováno podání G-CSF (granulocyte colony stimulating factor).
Zvýšená krvácivost při léčbě PI je vzácným, ale potenciálně nebezpečným NÚ, který zvláště u hemofiliků může způsobit vážné komplikace, jako je např. nitrolební krvácení. Příčina je nejasná, při objevení se tohoto NÚ je obvykle třeba změnit terapii (19).
Poruchy metabolismu kostí projevující se poklesem mineralizace kostní tkáně (osteopénie) a avaskulární osteonekróza jsou další NÚ, které se při léčbě antiretrovirotiky, zvláště PI, vyskytují. Postižena je především oblast hlavice femuru a při rutinním vyšetřování magnetickou rezonancí jsou tyto poruchy nacházeny u1 až 4 % pacientů léčených cART.
Mechanismus vzniku poruch kostní tkáně zůstává dosud značně nejasný, je však zřejmé, že příčina je komplexní aže se i na rozvoji tohoto NÚ podílí řada dalších faktorů, jako je pohlaví, věk, abúzus alkoholu či nutriční deficity (34).
Zidovudinová myopatie postihuje kolem 3 % léčených pacientů a projevuje se myalgiemi a svalovou slabostí. Příčinou je zřejmě mitochondriální toxicita vedoucí k narušení energetického metabolismu svalového vlákna (35).
Kloubní poruchy postihující ramenní kloub (adhezívní kapsulitida či frozen shoulder) byly opakovaně zaznamenané u pacientů léčených indinavirem; úlevu přinese přerušení terapie a symptomatická léčba (36).
Toxoalergické kožní reakce jsou nejčastějším NÚ společným všem přípravkům ze skupiny NNRTI. Na počátku léčby objevují u15–20 % pacientů a jedná se obvykle o silně svědivý exantém, který většinou po 2–3 týdnech ustupuje buď spontánně, nebo po krátkodobém podání antihistaminik či kortikoidů. Ukončení léčby pro rozvoj závažné toxoalergické reakce (Stevens-Johnsonova syndromu) je nutné upřibližně 3 % pacientů (37).
Bolestivé lokální reakce po enfuvirtidu jsou nejčastějším NÚ tohoto přípravku. Silná bolestivost a zarudnutí v místě aplikace se objevuje až u 98 % pacientů léčených enfuvirtidem. Tyto lokální reakce obvykle vymizí do sedmi dnů, ovšem asi 3 % pacientů musí pro tento NÚ léčbu enfuvirtidem ukončit.
Mechanismus vzniku těchto lokálních reakcí není jasný, enfuvirtid je agonista leukocytárního receptoru pro N-formylpeptid apůsobí zřejmě jako atraktant pro neutrofily s následným rozvojem lokální zánětlivé reakce (38).
Ostatní dermatologické NÚ – při léčbě indinavirem se může vyskytnou řada NÚ dermatologického charakteru, jako jsou kožní hyperpigmentace, xerodemie, zarůstání nehtů či alopecie, které sice většinou nejsou závažného charakteru, negativně však ovlivňují kvalitu života; příčinou je pravděpodobně vliv indinaviru na metabolismu retinolu prostřednictvím zvýšené aktivity retinoldehydrogenázy (25).
Hypersenzitivní reakce po abacaviru je zvláštním typem idiosynkratické multisystémové zánětlivé reakce, která se objevuje po zahájení léčby tímto přípravkem u5–8 % pacientů a je vázána na přítomnost alely HLA-B5701. Příznaky jsou horečka, kožní vyrážka, gastrointestinální a respirační projevy, mohou být přítomné i projevy jaterního poškození. Hypersenzitivní reakce je potenciálně fatální komplikace s úmrtností kolem 0,03 % a při důvodném podezření na ni je nutné podávání abacaviru okamžitě definitivně ukončit (39).
Neurologické nežádoucí účinky antiretrovirové terapie mohou postihovat jak CNS tak i periferní nervový systém. Méně závažné projevy CNS toxicity, jako jsou bolesti hlavy, nespavost, zvýšená únava jsou časté NÚ objevující se zvláště na počátku terapie řadou přípravků, především zidovudinu. Mezi závažné neurologické NÚ patří především neuropsychiatrické NÚ při užívání efavirenzu atoxická periferní polyneuropatie.
Neuropsychiatrické nežádoucí účinky efavirenzu – tyto NÚ postihují až 50 % pacientů zahajujících léčbu efavirenzem a přibližně 2–5 % pacientů musí pro tyto NÚ užívání tohoto léku ukončit.
Mechanismu účinku efavirenzu na CNS spočívá zřejmě ve vlivu na některý z neurotransmiterových systémů. Nástup neuropsychiatrických NÚ je obvykle velmi rychlý a většina pacientů hlásí obtíže již během prvních dnů léčby. Typickými projevy jsou závratě, bolesti hlavy, zvýšená únava, poruchy koncentrace, zmatenost až stupor, amnézie, agitovanost, poruchy spánku zahrnující poruchy usínání či naopak somnolenci, mohou se dostavit i halucinace, pocity depersonalizace, katatonie, stavy úzkosti a deprese, manické stavy a dokonce suicidální tendence. Ve většině případů dochází po několika týdnech léčby k ústupu těchto NÚ a dlouhodobá perzistence obtíží je vzácná (40).
Toxická periferní polyneuropatie je NÚ typicky spojený s podáváním některých NRTI. Incidence je 10–30 % a příčinou je podobně jako u jiných NÚ této skupiny mitochondriální toxicita. Toxická periferní polyneuropatie se projevuje jako postupně se zhoršující symetrické parestézie a bolesti dolních, méně často i horních končetin. Účinná terapie tohoto typu periferní polyneuropatie není známá, jediný efekt má vysazení neurotoxické léčby. Bolesti obvykle pak ustupují během 6–8 týdnů, přibližně u 30 % pacientů však mohou také přetrvávat dlouhodobě (41).
Akutní neuromuskulární selhání – (HIV-associated neuromusculary weakness syndrome – HANWS) je vzácný, ale nebezpečný NÚ antiretrovirové terapie. Jde o velmi závažný stav s úmrtností kolem 20 %, který se rozvíjí akutně jako komplikace laktátové acidózy při léčbě NRTI, především stavudinem.
Přesný mechanismus vzniku není znám, předpokládá se, podobně jako u dalších NÚ této skupiny, mitochondriální toxicita a poruchy energetického metabolismu nervových a svalových buněk. Průběh je subakutní až fulminantní s rozvojem ascendentních proximálních paréz a akutní respirační insuficience. Léčba vyžaduje okamžité vysazení NRTI, úpravu hodnot vnitřního prostředí, v nejtěžších případech je nutná intenzivní péče s umělou ventilací (19).
Indinavirová nefrolitiáza je častý NÚ typicky vyskytující se při léčbě tímto přípravkem. Příčinou je rychlý pokles rozpustnosti indinaviru v moči při její alkalizaci. Léčení akutních obtíží spočívá především v zajištění zvýšené hydratace – vzestup na 3l tekutiny denně a krátkodobém podání analgetik či spasmolytik.
Nefrotoxicita tenofoviru je jediný závažnější NÚ tohoto jinak velmi dobře tolerovaného přípravku . Většinou se jedná pouze o lehký pokles clearence kreatininu nebo mírnou hypofosfatémii, ojediněle mohou být přítomné myalgie. U pacientů s normálními renálními parametry je výskyt tohoto NÚ extrémně vzácný, rizikovými faktory jsou preexistující renální onemocnění, užívání jiných nefrotoxických léků a nízká tělesná hmotnost (42).
Imunorestituční zánětlivý syndrom (IRIS - immune reconstitution inflammatory syndrome) je zvláštním typem NÚ antiretrovirové léčby, který není vázán na lékovou toxicitu. IRIS je prudká imunopatologická zánětlivá reakce, která se paradoxně objevuje v souvislosti s úspěšným zahájením terapie cART a vede ke zhoršení preexistujících či dokonce manifestaci latentních onemocnění, zvláště oportunních infekcí či nádorů a některých dalších onemocnění jako kožní infekce, apendicitidy a některých autoimunitních onemocnění.
IRIS postihuje přibližně třetinu pacientů příznivě odpovídajících na zahájení této léčby a mechanismus jejího vzniku není dosud zcela objasněn, příčinou je pravděpodobně robustní imunologická odpověď podmíněná prudkým zlepšením funkce celulární imunity, vedoucí klokální nebo systémové intenzivní zánětlivé reakci na preexistující latentní infekci. IRIS má většinou dobrou prognózu a při pokračování terapie cART obvykle dochází k odeznění projevů onemocnění, byly ale popsány i případy fatálního průběhu (43).
HIV rezistence
Rezistence je definována jako schopnost HIV replikovat se i za přítomnosti látky s inhibičním účinkem a je hlavní příčinou selhání antiretrovirové terapie. Ke vzniku rezistence dochází obvykle v průběhu terapie následkem selekčního tlaku nedostatečně vysokých hladin léku, rezistentním kmenem HIV se lze ovšem také nakazit v rámci primoinfekce – tato situace je pak označována jako tzv. primární rezistence.
Rezistence je fenotypová vlastnost HIV podmíněná změnami virového genomu, ke kterým dochází na samém počátku replikačního cyklu v průběhu reverzní transkripce. Rozvoj rezistence může být podmíněn jak vlivy ze strany pacienta (nízká adherence, poruchy farmakokinetiky), tak i viru HIV samotného, respektive jejich kombinací. Rychlost vzniku rezistentních kmenů HIV závisí na řadě faktorů – optimálně zvolená léčebná kombinace má za následek maximální supresi virové replikace, a tím pokles statistické pravděpodobnosti vzniku rezistentní mutanty; naopak nedostatečně účinný léčebný režim má za následek suboptimální inhibici replikace, a tím také rychlejší selekci rezistentních mutant viru.
Pro dlouhodobý úspěch virové suprese má klíčový význam schopnost pacienta udržet dostatečně vysokou adherenci kléčbě. Nedostatečná míra adherence je jedním z hlavních faktorů vzniku rezistence vůči všem skupinám antiretrovirotik. Ideální míra adherence je 100 % a již při poklesu adherence pod hodnoty 95 % prudce stoupá riziko evoluce rezistence a tím také selhání léčby (44).
Závěr
Zavedení antiretrovirové terapie do klinické praxe představuje dosud největší úspěch v boji proti onemocnění AIDS. Racionálně indikovaná a správně řízená antiretrovirové terapie přináší HIV pozitivním osobám významné prodloužení života při zajištění jeho uspokojivé kvality a také zásadním způsobem snižuje riziko vertikálního přenosu HIV infekce.
Dříve rychle smrtící choroba AIDS se tak stala onemocněním, které sice dosud neumíme definitivně vyléčit, dovedeme jej však, podobně jako řadu dalších chronických onemocnění, dlouhodobě úspěšně léčit.
Nezbytným předpokladem úspěchu antiretrovirové terapie je dobrá spolupráce pacienta s jeho lékařem. Tato spolupráce musí být založena zvláště na maximální adherenci k léčbě ze straně pacienta; lékař pak musí věnovat maximální pozornost bedlivému sledování klinických i laboratorních příznaků svědčících pro rozvoje rezistence či nežádoucích účinků, které představují hlavní úskalí této léčby.
Vývoj nových antiretrovirových léků, který patří k nejdynamičtěji se rozvíjejícím oblastem biomedicínského výzkumu, dále pokračuje a od nových antiretrovirotik je očekávána především vyšší účinnost při nižší toxicitě, vyšší odolnost vůči rozvoji HIV rezistence a také lepší farmakokinetické vlastnosti, které umožní zejména snížení počtu denních dávek léků, a tím zvýšení adherence k léčbě.
V brzké době budou do klinické praxe uvedeny jednak nové přípravky z již stávajících skupin, ale také léky zásadně nové, které budou působit na jiných etážích replikačního cyklu. Takovými slibnými skupinami antiretrovirotik jsou například inhibitory vazby (attachment) HIV na receptory CXCR4 aCD4, inhibitory maturace aněkteré další. Slibně se do budoucna jeví také možnosti imunomodulační terapie, především využití terapeutické vakcinace.
Velkým problémem nadále zůstává vysoká cena antiretrovirových léků, a to jak originálních přípravků, tak i generik. Z toho důvodu je v současné době antiretrovirová terapie dostupná převážně pacientům v průmyslově vyspělých státech. V rozvojových zemích nemá z ekonomických důvodů přístup k léčbě více než 75 % všech osob s HIV infekcí, kteří tuto terapii potřebují. Od vývoje nových antiretrovirotik jsou tak očekávány v neposlední řadě také přípravky levnější, aby mohla být zajištěna dostupnost antiretrovirové léčby do roku 2010 pro všechny pacienty, kteří to potřebují, v souladu spožadavkem Organizace spojených národů a Světové zdravotnická organizace v dokumentu Mezinárodní směrnice pro HIV/AIDS a lidská práva, k jehož splnění se zavázaly vlády většiny zemí světa (45).
MUDr.Ladislav Machala, Ph.D.
AIDS Centrum, Infekční klinika FN Bulovka
Budínova 2
18081 Praha 8
E-mail: ladimachala@centrum.cz
Sources
1. Mitsuya, H., Weinhold, K., Furman, P. et al. 3‘-Azido-3‘-deoxythymidine (BW A509U): an antiviral agent that inhibits the infectivity and cytopathic effect of human T-lymphotropic virus type III/lymphadenopathy-associated virus in vitro. Proc. Natl. Acad. Sci. USA 1985, 82, p. 7096-7100.
2. Brook. I. Approval of zidovudine (AZT) for acquired immunodeficiency syndrome. A challenge to the medical and pharmaceutical communities. JAMA 1987, 258, p. 1517.
3. Walensky, R., Paltiel, A., Losina, E. et al. The survival benefits of AIDS treatment in the United States. J. Infect. Dis. 2006, 194, p. 11-19.
4. WHO/UN AIDS: Progress in scaling up access to HIV treatment in low and middle-income countries, June 2006. Fact Sheet. Geneva 2006.
5. James, J. Tenofovir approved: broad indication. AIDS Treat. News 2001. (373), p. 2-3.
6. James, J. Saquinavir (Invirase): first protease inhibitor approved - reimbursement, information hotline numbers. AIDS Treat. News 1995 (237), p. 1-2.
7. Bowerson, J. Nevirapine approved by FDA. Food and Drug Administration. NIAID AIDS Agenda 1996, 10.
8. Robertson, D. US FDA approves new class of HIV therapeutics. Nat. Biotechnol. 2003, 21, p. 470-471.
9. Laurence, J. Immune restoration and HAART: new clinical and in vitro data. AIDS Read. 2002, 12, p. 421-422.
10. Lange, C., Lederman, M., Madero, J. et al. Impact of supression of viral replication by highly active antiretroviral therapy on immune functions and phenotype in chronic HIV-1 infection. J. Acquir. Immune. Defic. Syndr. 2002, 30, p. 33-40.
11. Bartlett, J., Gallant, J. Medical management of HIV infection. Baltimore: Johns Hopkins Medicine Health Publishing Business Group, 2004.
12. Recommendations for the Use of Antiretroviral Drugs in Pregnant HIV-1 Infected women for Maternal Health and Interventions to Reduce Perinatal HIV-1 Transmission in the United States. Dostupné na http://aidsinfo.nih.gov/guidelines, 2005.
13. Centers for Disease Control and Prevention. Antiretroviral postexposure prophylaxis after sexual, injection-drug use, or other nonoccupational exposure to HIV in the United States: recommendations from the U.S. Department of Health and Human Services. MMWR 2005, 54, (No. RR-2).
14. Health Protection Agency Centre for Infections & Collaborators: Occupational transmission of HIV. Summary of published Reports. March 2005 Edition. Dostupné na http://www.hpa.org.uk.
15. Almeda, J., Casabona, J., Simon, B. et al. Proposed recommendations for the management of HIV post-exposure prophylaxis after sexual, injecting drug or other exposures in Europe. Euro Surveill. 2004, 9, p. 35-40.
16. Puro, V., Cicalini, S., De Carli, G. et al. Post-exposure prophylaxis of HIV infection in healthcare workers: recommendations for the European setting. Eur. J. Epidemiol. 2004, 19, p. 577-584.
17. Blankson, J. Primary HIV-1 infection: to treat or not to treat? AIDS Read. 2005, 15, p. 245-251.
18. Centers for Disease Control and Prevention. Guidelines for using antiretroviral agents among HIV-1 infected adults and adolescents. MMWR Recommend Rep. 2002; 51(RR-7).
19. Bartlett, J., Gallant, J. Medical management of HIV Infection - 2005-2006 Edition. Baltimore: John Hopkins Medicine Health Publishing Business Group, 2005.
20. Mocroft, A., Phillips, A., Soriano, V. et al. Reasons for stopping antiretrovirals used in an initial highly active antiretroviral regimen: increased incidence of stopping due to toxicity or patient/physician choice in patients with hepatitis C coinfection. AIDS Res. Hum. Retroviruses 2005, 21, p. 743-752.
21. Schiller, D. Identification, management, and prevention of adverse effects associated with highly active antiretroviral therapy. Am. J. Health-Syst. Pharm. 2004, 61, p. 2507-2522.
22. Hofman, P., Nelson, A. The pathology induced by highly active antiretroviral therapy against human immunodeficiency virus: an update. Curr. Med. Chem. 2006, 13, p. 3121-3123.
23. Ogedegbe, A., Sulkowski, M. Antiretroviral-associated liver injury. Clin. Liver Dis. 2003, 7, p. 475-499.
24. Bourezane, Y., Salard, D., Hoen, B. et al. DRESS (drug rash with eosinophilia and systemic symptoms) syndrome associated with nevirapine therapy. Clin. Infect. Dis. 1998, 27, p. 1321-1322.
25. Hawkins, T. Appearence-related side effects of HIV-1 treatment. AIDS Patient Care STDS 2006, 20, p. 6-18.
26. Rustin, P. Mitochondrial dysfunction in HIV infection: an overview of pathogenesis. J. HIV Ther. 2001, 6, p. 4-12.
27. Simpson, D., Estanislao, L., Evans, S. et al. HIV-associated neuromuscular weakness syndrome. AIDS 2004, 18, p. 1403-1412.
28. Carr, A., Samaras, K., Burton, S. et al. A syndrome of peripheral lipodystrophy, hyperlipidaemia and insulin resistance in patients receiving HIV protease inhibitors. AIDS 1998, 12, F51-F58.
29. Snopková, S., Husa, P. Metabolický syndrom u onemocnění HIV/AIDS. Klin. mikrobiol. inf. lék. 2006, 12, s. 108-116.
30. Carr, A., Samaras, K., Thorisdottir, A. et al. Diagnosis, prediction, and natural course of HIV-1 protease-inhibitor-associated lipodystrophy, hyperlipidaemia, and diabetes mellitus: a cohort study. Lancet 1999, 353, p. 2093-2099.
31. Yan, Q., Hruz, P. Direct comparison of the acute in vivo effects of HIV protease inhibitors on peripheral glucose disposal. J. Acquir. Immune. Defic. Syndr. 2005, 40, p. 398-403.
32. d‘Arminio Monforte, A., Sabin, C., Phillips, A. et al. Cardio - and cerebrovascular events in HIV-infected persons. AIDS 2004, 18, p. 1811-1817.
33. Richman, D., Fischl, M., Grieco, M. et al. The toxicity of azidothymidine (AZT) in the treatment of patients with AIDS and AIDS-related complex. A double-blind, placebo-controlled trial. N. Engl. J. Med. 1987, 317, p. 192-197.
34. Mary-Krause, M., Billaud, E., Poizot-Martin, I. et al. Risk factors for osteonecrosis in HIV-infected patients: impact of treatment with combination antiretroviral therapy. AIDS 2006, 20, p. 1627-1635.
35. Walsh, K., Kave, K., Demaerschalk, B. et al. AZT myopathy and HIV-1 polymyositis: one disease or two? Can. J. Neurol. Sci. 2002, 29, p. 393-393.
36. De Ponti, A. Adhesive capsulitis of the shoulder in human immunodeficiency virus-positive patients during highly active antiretroviral therapy. J. Shoulder Elbow Surg. 2006, 15, p. 188-190.
37. de Maat, M., ter Heine, R., Mulder, J. et al. Incidence and risk factors for nevirapine-associated rash. Eur. J. Clin. Pharmacol. 2003, 59, p. 457-462.
38. Trottier, B., Walmsley, S., Reynes, J. et al. Safety of enfuvirtide in combination with an optimized background of antiretrovirals in treatment-experienced HIV-1-infected adults over 48 weeks. J. Acquir. Immune. Defic. Syndr. 2005, 40, p. 413-421.
39. Phillips, E., Wong, G., Kaul, R. et al. Clinical and immunogenetic correlates of abacavir hypersensitivity. AIDS 2005, 19, p. 979-981.
40. Gallego, L., Barreiro, P., del Rio, R. et al. Analyzing sleep abnormalities in HIV-infected patients treated with Efavirenz. Clin. Infect. Dis. 2004, 38, p. 430-432.
41. Brew, B. The peripheral nerve complications of human immunodeficiency virus (HIV) infection. Muscle Nerve 2003, 28, p. 542-552.
42. Gallant ,J., Parish, M., Keruly, J. et al. Changes in renal function associated with tenofovir disoproxil fumarate treatment, compared with nucleoside reverse-transcriptase inhibitor treatment. Clin. Infect. Dis. 2005, 40, p. 1194-1198.
43. Jevtovic, D., Salemovic, D., Ranin ,J. et al. The prevalence and risk of immune restoration disease in HIV-infected patients treated with highly active antiretroviral therapy. HIV Med. 2005, 6, p. 140-143.
44. Murphy, D., Marelich, W., Hoffman, D. et al. Predictors of antiretroviral resistance. AIDS Care 2004, 16, p. 471-484.
45. UNAIDS: International Guidelines on HIV/AIDS and Human Rights. Geneva, 2006.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2008 Issue 2-
All articles in this issue
- Transparentní zodpovědnost (accountability) v medicíně a zodpovědnost etických komisí
- Současné možnosti a problémy antiretrovirové terapie
- Etiopatogeneze autismu z pohledu buněčné a molekulární biologie
- Paměť a její poruchy
- Metalothionein a jeho vztah k protinádorové léčbě na bázi platinových komplexů
- Hodnocení dynamiky transportní funkce a remodelace levé srdeční síně po úspěšné endoskopické mikrovlnné epikardiální izolaci plicních žil. Pilotní studie.
- O lidech, kteří hromadí věci a zvířata
- Současné přístupy k očkování konjugovanou pneumokokovou vakcínou
- Akutní toxická hepatitida po bylinném přípravku
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Paměť a její poruchy
- Současné možnosti a problémy antiretrovirové terapie
- O lidech, kteří hromadí věci a zvířata
- Akutní toxická hepatitida po bylinném přípravku
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

