-
Medical journals
- Career
Primární extragonadální germinální nádory u mužů Analýza souboru z let 1994–2008
Authors: T. Büchler; M. Foldyna; J. Nepomucká; M. Kupec; Z. Donátová; P. Kubánková; E. Voršilková; D. Kordíková; J. Mendelová; J. Abrahámová
Authors‘ workplace: Fakultní Thomayerova nemocnice a 1. lékařská fakulta Univerzity Karlovy, Praha ; Primář: Prof. MUDr. Jitka Abrahámová, DrSc. ; Onkologické oddělení
Published in: Prakt. Lék. 2008; 88(10): 578-581
Category: Of different specialties
Overview
Pacienti s extragonadálními germinálními nádory mají nepříznivou prognózu pro relativní chemorezistenci těchto nádorů a často velmi pokročilé stádium s mnohočetnou orgánovou diseminací již v době diagnózy. Optimální terapie primárních extragonadálních nádorů zatím nebyla definována. V retrospektivní studii jsme analyzovali charakteristiku a výsledky terapie 19 mužů s primárním extragonadálním germinálním tumorem retroperitonea nebo mediastina. Medián celkového přežívání pacientů z našeho souboru je 25,9 měsíce. Celkem přežívá 7/19 pacientů (37 %). Dva ze sedmi přežívajících pacientů pokračují v terapii, pět (26 %) je bez příznaků aktivní malignity. Z našich výsledků vyplývá, že navzdory relativně nepříznivé prognóze, lze u pacientů s extragonadálními germinálními nádory dosáhnout trvalou remisi, a to i tehdy, když léčbou 1. linie není dosaženo kompletní remise.
Klíčová slova:
extragonadální, germinální, nádor, chemoterapie.Úvod
Primární extragonadální nádory jsou zřídkavě se vyskytující malignitou a tvoří asi 2 až 5 % všech germinálních nádorů u mužů. Nejčastěji vznikají v retroperitoneu, mediastinu nebo v pineální žláze. Pacienti s extragonadálními nádory mají podstatně horší prognózu než pacienti s testikulárními germinálními nádory. Podílí se na tom jak relativní chemorezistence těchto nádorů, tak pozdní diagnóza, často ve velmi pokročilém stádiu s mnohočetnou orgánovou diseminací. Pokud dojde k relapsu extragonadálního germinálního tumoru, záchranná chemoterapie je většinou neúčinná (1).
Příčiny a patogeneze extragonadálních germinálních nádorů nebyly objasněny. V současnosti je obecně přijímaná teorie, že tyto nádory vznikají ze pluripotentních zárodečných buněk, které se buď fyziologicky nachází v orgánech jako jsou játra, thymus či mozek, anebo zůstávají v strukturách střední čáry při poruše migrace kmenových buněk v embryonálním období (2). Je možné, že část extragonadálních nádorů vzniká v zárodečním epitelu gonád, ale po metastatickém rozšíření nádorových buněk do retroperitonea nebo mediastina dojde k zániku primárního testikulárního nádoru.
Histologie extragonadálních nádorů odpovídá germinálním nádorům varlat. Zatímco však asi 45 % testikulárních nádorů tvoří seminomy a 55 % neseminomové nádory, u extragonadálních nádorů je podíl seminomů jen přibližně 15 %.
Společnou vlastností testikulárních a extragonadálních neseminomů je sekrece nádorových markerů alfafetoprotein (AFP) a choriogonadotropin (HCG) a častá přítomnost izochromozomu i(12p) (3). Existuje asociace mezi mediastinálními neseminomovými nádory a Klinefelterovým syndromem či hematologickými malignitami (4). Pacienti s extragonadálními nádory mají relativně vysoký výskyt preinvazivních neoplastických změn zárodečného epitelu testes, tzv. intratubulární germinální neoplazie (5, 6).
Systém TNM neposkytuje návod na stanovení stádia extragonadálních germinálních nádorů a prognostické faktory pro extragonadální nádory se neshodují s parametry v systému IGCCC, který se používá pro germinální nádory varlat.
V naší studií jsme vyhledali a retrospektivně analyzovali muže s extragonadálními germinálními nádory diagnostikované a léčené na našem oddělení od roku 1994. Cílem bylo stanovit význam vybraných vstupních parametrů před léčbou, zhodnotit účinnost léčby a posoudit efektivitu zobrazovacích a biochemických vyšetření po léčbě.
Pacienti a metody
Pacienti
Pacienti s extragonadálními germinálními nádory mediastina nebo retroperitonea byli identifikováni pomocí údajů v přírůstkové knize a v elektronické klinické databázi. V zájmu homogenity souboru byli zařazení jen muži s primárně mediastinálním nebo retroperitoneálním germinálním tumorem. Všichni zařazení pacienti absolvovali cílené ultrazvukové vyšetření na testes, testikulární biopsií, nebo měli orchiektomií. Pacienti, kteří byli vstupně diagnostikováni s primárním extragonadálním nádorem, ale následná vyšetření prokázala jistý nebo pravděpodobný testikulární původ nádoru, byli ze souboru vyloučeni.
Terapie a sledování pacientů
Standardní léčbou první linie byla chemoterapie režimem na bázi cisplatina-etopsid-bleomycin (BEP). Při operabilním reziduálním nádoru byla provedena retroperitoneální nodální disekce (RPLND). Pokud byl nádor inoperabilní, byla při perzistenci podávána chemoterapie 2. linie, nejčastěji režimem vinorelbin-ifosfamid-cisplatina (VeIP), u pacientů v dobrém klinickém stavu a s nádorovou odpovědí na chemoterapii 1. linie byla do léčby zařazena vysokodávkovaná chemoterapie režimem karboplatina-etopsid-cyklofosfamid (CARBOPEC) a autologní transplantace kostní dřeně. Standardním režimem 3. line byla chemoterapie paclitaxel-gemcitabin (PAGE). U vybraných pacientů byla alternativou k resekci nádorového rezidua cílená radioterapie.
Onkomarkery AFP, HCG a laktátdehydrogenáza (LDH) byly hodnoceny před zahájením chemoterapie, před každým cyklem terapie, po ukončení plánované chemoterapeutické série a v případě dispenzarizace 2–4x ročně. Vyšetření CT bylo prováděno před zahájením chemoterapie, po ukončení každé chemoterapeutické série a 1–4x ročně během dispenzarizace, a při klinickém nebo biochemickém podezření na relaps. Vyšetření pozitronovou emisní tomografií (PET) jsme indikovali u pacientů s inoperabilním nádorovým reziduem, pokud se dosáhla negativizace markerů, a při podezření na relaps.
Hodnocení klinické odpovědi
Kompletní odpověď (CR) byla definována jako normalizace všech morfologických a biochemických změn, včetně výsledku vyšetření PET. Částečná odpověď (PR) byla definována jako více než 50% redukce součtu ploch nádorových mas v transverzálním průřezu. Osobitně byly hodnoceny podskupiny pacientů s PR podle CT a negativizací onkomarkerů (M-PR) a negativitou PET (PET-PR). Progrese (PD) byla diagnostikována v případě zvětšení ploch nádorových mas v transverzálním průřezu o 25 % nebo více, anebo objevení nového nádorového ložiska.
Celkové přežívání bylo hodnoceno do úmrtí, anebo do posledního kontaktu s pacientem. Přežívání pacientů bylo hodnoceno pomocí Kaplan-Meierovy metody, srovnání mezi podskupinami, definovány podle známých nebo předpokládaných rizikových faktorů, bylo provedeno metodou log-rank test. Pokud došlo k úmrtí při nepřítomnosti nádoru, data byla k datu úmrtí pro potřebu statistické analýzy censurována.
Graph 1. Kaplan-Meierův graf celkového přežívání pacientů s extragonadálním germinálním nádorem v našem souboru. 
Výsledky
Vstupní charakteristika pacientů
Nalezli jsme 19 pacientů s jednoznačnou diagnózou extragonadálního germinálního nádoru. Z nich 15 (79 %) mělo nádor neseminomového typu a 4 (21 %) nádor seminomového typu. U 6 pacientů (31 %) bylo primární ložisko v mediastinu a u 13 pacientů (69 %) v retroperitoneu.
Medián věku byl 36 let (rozsah 19–52 let). Systémové symptomy svědčící pro velký celkový objem tumoru (ztráta hmotnosti, horečky, chřipkové symptomy) byly přítomné u 7 pacientů. Žádný z pacientů neměl vstupně metastázy do CNS.
Další vstupní charakteristiky souboru jsou uvedené v tabulce 1 a 2.
Table 1. Základní charakteristiky pacientů s extragonadálním germinálním nádorem (n=19) 
Table 2. Vstupně přítomné symptomy pacientů s extragonadálními germinálními nádory 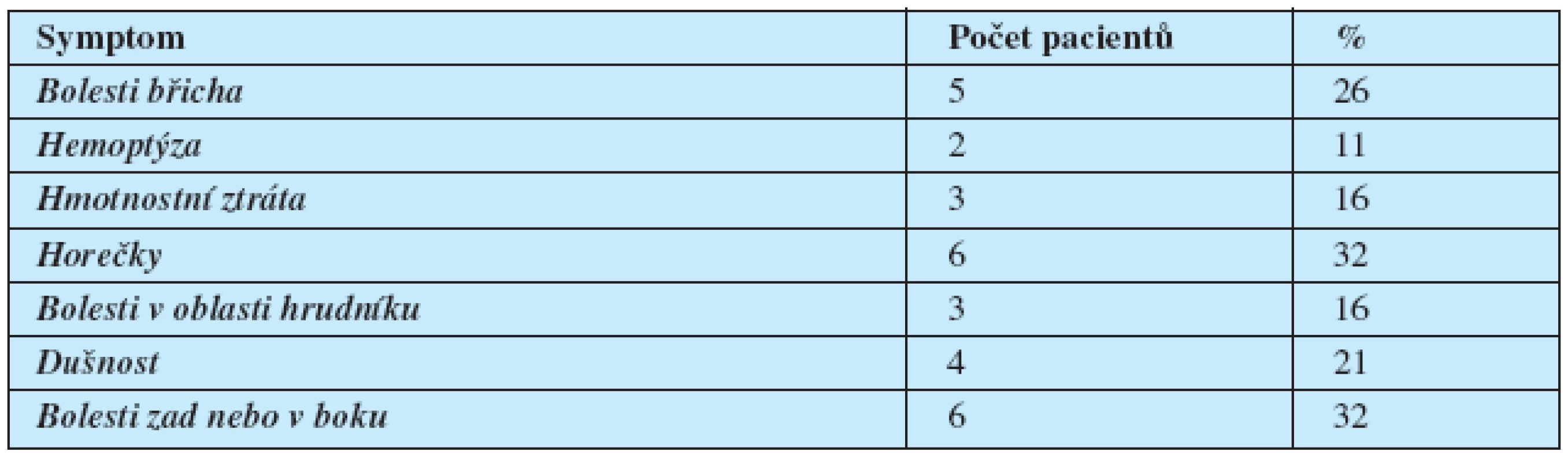
Výsledky léčby
Všichni pacienti absolvovali primární léčbu chemoterapií na bázi platinového cytostatika – 18 pacientů v režimu BEP a 1 pacient v režimu PVB. Čtyři z 18 pacientů léčených kombinací BEP dostali v rámci léčby první linie ještě jinou doplňkovou chemoterapií – 1x PAGE, 1x cisplatina-vinblastin-bleomycin (PVB), 1x vysokodávkovaný metotrexát, 1x vysokodávkovaná chemoterapie CARBOPEC.
Po chemoterapii 1. linie byl jen jeden pacient v kompletní remisi (později však dochází k relapsu), dva pacienti zemřeli na progresi v průběhu chemoterapie 1. linie, 16 pacientů dosáhlo parciální remisi (6 pacientů M-PR, z toho 3 pacienti měli také PET-PR, u 10 pacientů k úplné normalizaci onkomarkerů nedošlo).
U 14 pacientů byla podána chemoterapie 2. linie, důvodem pro její podání byla u 9 pacientů M + PR, u 2 pacientů inoperabilní reziduální nádorová masa při negativitě markerů (jeden pacient měl vstupně marker-negativní seminom, a druhý relativně nízkou vstupní hladinu markerů vzhledem k vstupnímu rozsahu nemoci, takže negativita markerů byla relativně málo výpovědná), u 1 pacienta progrese z CR, u jednoho pacienta progrese z M-PR a u 1 pacienta nález viabilního nádoru při RPLND.
Celkem byla RPLND provedena u 5 pacientů – u jednoho pacienta se seminomem pro reziduální retroperitoneální masu po chemoterapii (výsledek: nekróza) a u 4 pacientů s neseminomovým nádorem při PR po léčbě 2. linie (u všech byla prokázána viabilní malignita a následně byli léčení další chemoterapií). Celkem tři pacienti s nedostatečnou odpovědí na léčbu 1. linie s perzistující elevací onkomarkerů byli vyléčeni záchrannou chemoterapií a přežívají bez známek nádoru.
Table 3. Terapie 2. linie (n=14). 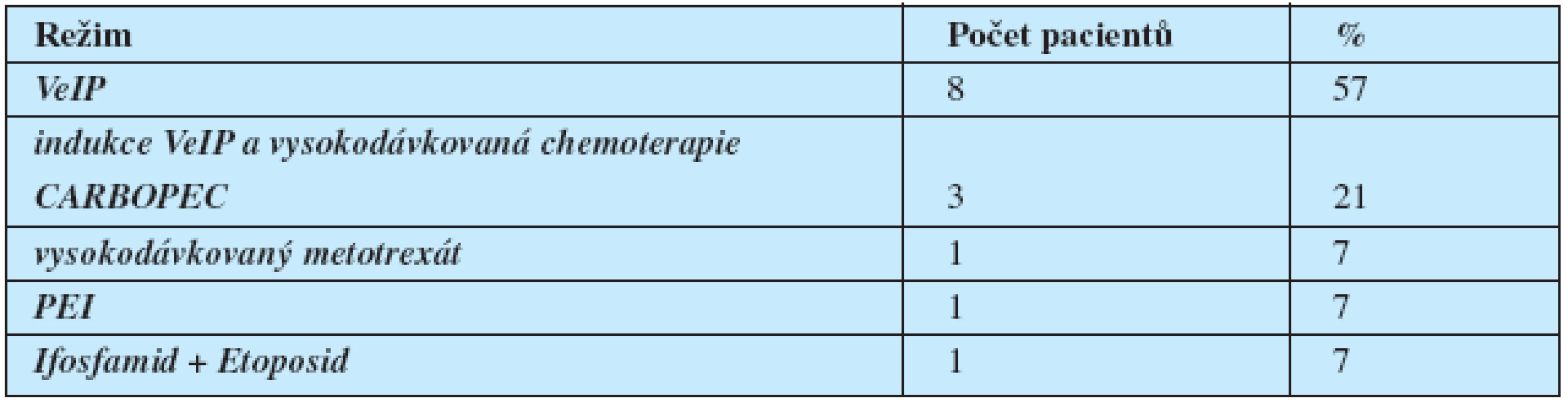
Hodnocení přežívání a prognostických faktorů
Střední doba sledování pro přežívající pacienty je v současnosti 38 měsíců (6–95 měsíců). Medián celkového přežívání pacientů z našeho souboru je 25,9 měsíce. Celkem přežívá 7/19 pacientů (37 %). Dva z osmi přežívajících pacientů pokračují v systémové terapii, pět (26 %) je bez příznaků aktivní malignity. V našem souboru jsme nezaznamenali výskyt sekundární malignity. Jeden pacient zemřel v kompletní remisi nádoru na pozdní následky krvácení do mozku. Nejdéle přežívající pacienti jsou v kompletní remisi více než 8 let po diagnóze.
Ve statistické analýze jsme hodnotili následující známé nebo předpokládané prognostické faktory:
- věk,
- přítomnost systémových symptomů,
- mediastinální versus retroperitoneální tumor,
- seminom versus neseminom,
- vstupní elevace LDH,
- S stádium,
- přítomnost metastáz do jater.
Kromě seminomové histologie (příznivá prognóza, p=0,02) ani jeden z těchto parametrů nepredikoval statisticky signifikantně výsledek léčby a přežívání. Důvodem pro negativní výsledky statistické analýzy je nejspíše relativně malý počet pacientů v souboru, odůvodněný velmi nízkou incidencí extragonadálního germinálního nádoru. Významně lepší přežívání dosáhli pacienti, u kterých se podařilo dosáhnout léčbou negativizace PET (51 versus 21 měsíců, p=0,016) a normalizaci onkomarkerů (40 versus 11 měsíců, p=0,006).
Diskuse
Naše studie charakterizuje skupinu 19 mužů s primárním mediastinálním nebo retroperitoneálním germinálním nádorem a hodnotí výsledky jejich léčby.
Primární extragonadální germinální nádory jsou vzácné a mnoho publikovaných studí analyzuje malé kohorty pacientů, které navíc někdy zahrnují i pacienty s pineálními nádory, kterých léčba je odlišná, a pediatrické pacienty.
Zatím největší retrospektivní studie byla publikovaná v roce 2002 a obsahovala 635 pacientů z 11 nemocnic, kteří byly léčeni v období od 1975 do 1996 (3). Tato studie prokázala výrazně lepší prognózu seminomových extragonadálních nádorů ve srovnání s neseminomy. Nejhorší prognózu měli pacienti s neseminomovými nádory mediastina. Pravděpodobnost přežití pacientů s retroperitoneálním neseminomovým nádorem byla horší, než přežívání metastatických testikulárních seminomů, ale lepší než prognóza mediastinálních nádorů.
Nezávislé prognostické parametry pro extragonadální germinální nádory se nekryjí s prognostickými faktory testikulárních nádorů podle klasifikace IGCCC (7). S horším přežíváním koreluje neseminomová histologie, mediastinální primární tumor, přítomnost metastáz do CNS, přítomnost metastáz do jater, přítomnost metastáz do kostí a elevace HCG (odrážející přítomnost choriokarcinomové složky) (3). Je zajímavé, že celkové přežívání pacientu s neseminomovými nádory v této studii bylo významně vyšší než v menších publikovaných sériích (8) i v našem souboru. Domníváme se, že příčinou je pokročilejší stádium nádorů v naší skupině pacientů, například 66 % našich pacientů s neseminomovou histologií mělo vstupně metastázy do plic (v studii Bokemeyera 37 %) a 33 % metastázy do jater (ve srovnání se 16 %).
Není známo, zda strategie léčby pro testikulární nádory jsou optimální i v léčbě nádorů extragonadálních, zejména neseminomů. Podle předběžných výsledků může vysokodávkovaná chemoterapie aplikovaná v 1. linií zvýšit procento dlouhodobě přežívajících pacientů (9). Vysokodávkovaná chemoterapie v 2. linii podle analýzy Evropské transplantační skupiny EBMT dosahuje remisí až u 43 % s retroperitoneálními germinálnímí nádory, ale pouze u 14 % pacientů s mediastinálními nádory (10).
U části našich pacientů bylo ke sledování odpovědi na léčbu využíváno vyšetření PET. Zdá se, že PET dokáže spolehlivě identifikovat viabilní nádor seminomového typu (11). U neseminomových germinálních nádorů se zatím úloha PET nepotvrdila a procento falešně pozitivních i falešně negativních výsledků je vysoké (12), když publikované studie nehodnotí dostatečný počet pacientů. Další možná aplikace PET je pro časnou detekci pacientů s rezistencí na podávanou chemoterapii (13). Většina publikovaných studií zkoumajících využití PET u germinálních nádorů byla limitována malým počtem pacientů a krátkou dobou sledování, a proto PET zatím nemá pevné místo v jejich diagnostice a sledování. Studie provedené za účelem časného zjištění relapsu, charakterizace reziduálních tumorů a hodnocení predikativního významu vyšetření PET po chemoterapii přinesly protichůdné výsledky (14). Naše analýza skupiny pacientů s extragonadálními germinálními nádory svědčí pro využitelnost metody PET pro predikci dlouhodobého přežívaní pacientů po systémové chemoterapii.
Z našich výsledků vyplývá, že navzdory relativně nepříznivé prognóze lze u pacientů s extragonadálními germinálními nádory dosáhnout trvalou remisi, a to i tehdy, když léčbou 1. linie není dosaženo kompletní remise. Zásadnější zlepšení léčebných výsledků u pacientů nově diagnostikovaných i s relapsem však může přinést jen mezinárodní spolupráce v rámci multicentrických studií.
MUDr. Tomáš Büchler, Ph.D.
Onkologické oddělení
Fakultní Thomayerova nemocnice
Vídeňská 800
140 59 Praha 4
E-mail: tomas.buchler@ftn.cz
Sources
1. Abrahámová, J. Extragonadální germinální nádory. In: Abrahámová J., Povýšil C., Dušek L. a kol. Nádory varlat. Praha: Grada 2008.
2. Oosterhuis, J.W., Stoop, H., Honecker, F., Looijenga, L.H. Why human extragonadal germ cell tumours occur in the midline of the body: old concepts, new perspectives. Int. J. Androl. 2007, 30, 4, p. 256-263.
3. Bokemeyer, C., Nichols, C.R., Droz, J.P. et al. Extragonadal germ cell tumors of the mediastinum and retroperitoneum: results from an international analysis. J. Clin. Oncol. 2002, 20, 7, p. 1864-1873.
4. Hartmann, J.T., Nichols, C.R., Droz, J.P. et al. Prognostic variables for response and outcome in patients with extragonadal germ-cell tumors. Ann. Oncol. 2002, 13, 7, p. 1017-1128.
5. Daugaard, G., Rørth, M., von der Maase, H., Skakkebaek, N.E. Management of extragonadal germ-cell tumors and the significance of bilateral testicular biopsies. Ann. Oncol. 1992, 3, 4, p. 283-289.
6. Buchler, T., Freeman, A., Harland, S. Contralateral intratubular germ cell neoplasia in a patient with testicular cancer. Nat. Clin. Pract. Urol 2008, 5, 5, p. 284-288.
7. International Germ Cell Cancer Collaborative Group. International Germ Cell Consensus Classification: a prognostic factor-based staging system for metastatic germ cell cancers. J. Clin. Oncol. 1997, 15, 2, p. 594-603.
8. Hsu, Y.J., Pai, L., Chen, Y.C. et al. Extragonadal germ cell tumors in Taiwan: an analysis of treatment results of 59 patients. Cancer 2002, 95, 4, p. 766-774.
9. Kumano, M., Miyake, H., Hara, I. et al. First-line high-dose chemotherapy combined with peripheral blood stem cell transplantation for patients with advanced extragonadal germ cell tumors. Int. J. Urol. 2007, 14, 4, p. 336-338.
10. De Giorgi, U., Demirer, T., Wandt, H. et al. Second-line high-dose chemotherapy in patients with mediastinal and retroperitoneal primary non-seminomatous germ cell tumors: the EBMT experience. Ann. Oncol. 2005, 16, 1, p.146-151.
11. De Santis, M., Pont, J. The role of positron emission tomography in germ cell cancer. World J. Urol. 2004, 22, 1, p. 41-46.
12. Karapetis, C.S., Strickland, A.H., Yip, D. et al. Use of fluorodeoxyglucose positron emission tomography scans in patients with advanced germ cell tumour following chemotherapy: single-centre experience with long-term follow up. Intern. Med. J. 2003, 33, 9-10, p. 427-435.
13. Bokemeyer, C., Kollmannsberger, C., Oechsle, K. et al. Early prediction of treatment response to high-dose salvage chemotherapy in patients with relapsed germ cell cancer using [(18)F]FDG PET. Br. J. Cancer 2002, 86, 4, p. 506-511.
14. Hain, S.F. Positron emission tomography in uro-oncology. Cancer Imaging 2005, 5, 1, p. 1-7.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2008 Issue 10-
All articles in this issue
- Mentalizace
- Základní obecná klasifikační schémata dětských zlomenin
- Primární extragonadální germinální nádory u mužů Analýza souboru z let 1994–2008
- Syndrom Guillain-Barré Specifika intenzivní péče, možnosti terapeutického využití plazmaferézy a naše zkušenosti
- Historie a současnost registrace vrozených vad v České republice
- Netypický tumor nosohltanu ve vyšším věku – angiofibrom nosohltanu?
- Komunitní pneumonie
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Syndrom Guillain-Barré Specifika intenzivní péče, možnosti terapeutického využití plazmaferézy a naše zkušenosti
- Základní obecná klasifikační schémata dětských zlomenin
- Mentalizace
- Netypický tumor nosohltanu ve vyšším věku – angiofibrom nosohltanu?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

