-
Medical journals
- Career
Vliv expozice anti-TNFα in utero na vývoj imunitního systému exponovaných dětí – kontrolovaná multicentrická studie
Authors: Ďuricová D. 1; Dvořáková E. 1; Hradský O. 2; Mitrová K. 1,2; Durilová M. 3; Koželuhová J. 4; Kohout P. 5; Zárubová K. 2; Bronský J. 2; Hradská N. 6; Bronská E. 7; Adamcová M. 7; Machková N. 1; Hrubá V. 1; Bortlík M. 1,8,9; Lukáš M. 1; Malíčková K. 1,10
Authors‘ workplace: Klinické a výzkumné centrum pro střevní záněty ISCARE I. V. F., a. s., Praha 1; Pediatrická klinika 2. LF UK a FN Motol, Praha 2; Klinika dětské chirurgie 2. LF UK a FN Motol, Praha 3; Gastroenterologické a hepatologické oddělení, I. interní klinika LF UK a FN v Plzni 4; Interní klinika 3. LF UK a Thomayerovy nemocnice, Praha6 Privátní ordinace PLDD, Litovel 5; Privátní ordinace PLDD, Praha 7; Interní klinika 1. LF UK a ÚVN, Praha 8; Farmakologický ústav 1. LF UK a VFN, Praha 9; Ústav lékařské biochemie a laboratorní diagnostiky, 1. LF UK a VFN, Praha 10
Published in: Gastroent Hepatol 2018; 72(6): 479-485
Category:
doi: https://doi.org/10.14735/amgh2018479Overview
Úvod:
Údaje o vlivu anti-TNFα terapie in utero na dlouhodobý vývoj exponovaných dětí jsou omezené. Cílem této studie bylo zhodnotit vliv expozice anti-TNFα terapie in utero na postnatální vývoj exponovaných dětí, především na vývoj jejich imunitního systému.
Metody:
Do studie byly zařazeny děti ve věku ≥ 12 měsíců, jejichž matky byly léčeny anti-TNFα terapií v těhotenství pro idiopatický střevní zánět (IBD – inflammatory bowel disease) ve třech centrech, v období 2007– 2016. Kontrolní skupinu tvořily neexponované děti ne-IBD matek, které absolvovaly plánovanou povinnou preventivní prohlídku u obvodního pediatra. Data o perinatálním období, infekčních komplikacích, užívání antibiotik a očkování byla získána pomocí strukturovaného dotazníku ošetřujícími pediatry dětí.
Výsledky:
Zařazeno bylo 72 exponovaných a 69 neexponovaných dětí (medián věku 35, resp. 50 měsíců). Mezi exponovanými dětmi a kontrolami nebyl pozorován signifikantní rozdíl ve výskytu infekčních komplikací v průběhu 1. roku života (23,9 vs. 17,4 %; p = 0,36) nebo v průběhu celé délky sledování (p = 0,32). Konkomitantní imunosupresivní terapie v těhotenství a hladiny anti-TNFα v pupečníkové krvi nebyly spojeny se zvýšeným rizikem infekcí v 1. roce života (p > 0,05). Více než 95 % exponovaných dětí mělo adekvátní sérologickou odpověď na očkování, kromě vakcíny proti H. influenzae a viru parotitidy. Obě vakcíny však vykazovaly nejnižší sérologickou odpověď i u kontrolní skupiny.
Závěr:
Léčba matek anti-TNFα v průběhu těhotenství z důvodu IBD se zdá být bezpečná s ohledem na vývoj imunitního systému exponovaných dětí.
Klíčová slova:
idiopatické střevní záněty – anti-TNFα – gravidita – infekce – vakcinace
Úvod
Idiopatické střevní záněty (IBD), Crohnova nemoc (CD – Crohn’s disease) a ulcerózní kolitida, jsou chronická zánětlivá imunitně podmíněná onemocnění trávicího traktu diagnostikovaná velmi často v mladém a reprodukčním věku [1]. Značná část žen s IBD, která otěhotní již v průběhu nemoci, tak bývá vystavena účinkům biologické terapie v průběhu gravidity. Informace o možných dopadech této léčby na vývoj plodu jsou proto zcela zásadní. Infliximab (IFX) i adalimumab (ADA) patří do skupiny IgG1 protilátek proti tumor nekrotizujícímu faktoru (TNF)α, které procházejí od konce 2. trimestru placentou aktivním transportem stejně jako ostatní mateřské IgG protilátky [2]. Výsledkem pak často bývají relativně vysoké hladiny léčiva v pupečníkové krvi nebo krvi novorozence, které mohou přetrvávat až po dobu 12 měsíců po narození [3]. Dosavadní studie již prokázaly příznivý bezpečnostní profil preparátů anti-TNFα jak na průběh těhotenství, tak i na vývoj plodu [2]. Nicméně dat týkajících se vlivu prenatální expozice anti-TNFα na dlouhodobý vývoj exponovaných dětí a jejich imunitní systém je stále málo a nepochybně je zapotřebí dalších prospektivních studií. Cílem této práce bylo zhodnotit vliv expozice anti-TNFα in utero na dlouhodobý vývoj exponovaných dětí. V naší práci jsme se zaměřili především na vývoj jejich imunitního systému s ohledem na infekční komplikace a reakce na očkování.
Metodika
Do studie byly zařazeny děti ve věku alespoň 12 měsíců, jejichž matky byly v těhotenství léčeny z důvodu IBD IFX nebo ADA ve třech centrech v ČR v období 2007– 2016. Podskupinu této studijní populace s kratší dobou následného sledování jsme prezentovali v předchozí práci v rámci nekontrolované studie [4]. Kontrolní skupina byla vytvořena ve spolupráci se třemi praktickými lékaři pro děti a dorost (PLDD) a sestávala z náhodně vybraných dětí zdravých ne-IBD matek, které absolvovaly pravidelné povinné preventivní prohlídky. V ČR jsou ze zákona povinné preventivní prohlídky v časném novorozeneckém a kojeneckém věku a dále pak v 3., 6., 12. a 18. měsíci. Další kontroly pak probíhají plánovaně od 3. roku věku ve 2letých intervalech až do dosažení 19 let. V rámci každé preventivní prohlídky se hodnotí předem stanovené parametry jako kojení, stav výživy, psychomotorický vývoj dítěte, infekce, užívání antibiotik a další abnormality. Kontrolní skupina dětí byla srovnatelná s exponovanou skupinou podle roku narození v poměru 1 : 1.
Sběr dat
Za účelem sběru dat byl vytvořen strukturovaný dotazník, který byl vyplněn ošetřujícím PLDD a matkou každého dítěte z exponované i neexponované kontrolní skupiny. Zaznamenány byly údaje týkající se perinatálního období (porodní hmotnost a délka, způsob porodu, komplikace a vrozené malformace), kojení, růstu, psychomotorického vývoje, očkování (odchylka od standardního očkovacího protokolu, nežádoucí reakce) a výskytu infekcí (typ infekce, věk v době infekce, antibiotická terapie, potřeba hospitalizace). Z infekcí byly hodnoceny pouze ty, které vyžadovaly antibiotickou terapii a/ nebo hospitalizaci. Dalším zdrojem získaných údajů byl zdravotní a očkovací průkaz pacienta obsahující záznamy o povinných preventivních prohlídkách a očkování. Do povinného očkovacího schématu v ČR patřilo v době studie očkování neživou hexavalentní vakcínou (hepatitida B, Haemophilus influenzae B (HiB), záškrt, tetanus, pertuse, inaktivované polio) s doporučeným dávkovacím schématem 3 + 1, tj. podáním 3 dávek během 1. roku věku s přeočkováním v období mezi 12. a 18. měsícem věku. Většině dětí byla v podobném očkovacím schématu aplikována také nepovinná neživá očkovací látka proti bakterii Streptococcus pneumoniae. Povinná živá vakcína (spalničky, příušnice, zarděnky) je podávána nejdříve v 15. měsíci života, na kterou navazuje druhá dávka s odstupem 6– 10 měsíců. Jedinou živou vakcínou podávanou v prvních týdnech po narození je v současné době vakcína proti rotavirům, která ale nepatří do povinného očkovacího schématu. Všechny matky léčené anti-TNFα v graviditě obdržely doporučení vyhnout se tomuto očkování v případě pozitivních nebo neznámých hladin anti-TNFα v krvi kojence. Do listopadu 2011 patřilo do povinného očkovacího schématu také očkování proti tuberkulóze očkovací látkou Bacillus Calmette-Guérin (BCG), která byla podávána během 1. týdne života. Údaje týkající se matek (typ IBD, typ a dávkování anti-TNFα, konkomitantní medikace) byly získány z lékařských záznamů pacientek.
Laboratorní analýza
Hladiny anti-TNFα v pupečníkové krvi byly měřeny v Klinickém a výzkumném centru ISCARE, kde se toto měření provádí rutinně již od roku 2010. K detekci hladin sledovaných léků byl použit test ELISA (Q-INFLIXI, Remicade a Q-ADA, Humira, Matriks Biotek, Ankara, Turecko). Koncentrace IFX a ADA byly vyjádřeny v μg/ ml, přičemž dolní limity pro detekci byly 0,3 ng/ ml pro IFX a 0,01 ng/ ml pro ADA. V podskupině exponovaných i neexponovaných dětí byl odebrán vzorek žilní krve k analýze vybraných parametrů buněčné a humorální imunity, vč. sérologické odpovědi na očkování (neživé vakcíny: tetanus, záškrt, HiB, S. pneumoniae a živé vakcíny: spalničky, příušnice a zarděnky). Sérologická odpověď na očkování byla hodnocena pouze v případě, že byly aplikovány alespoň tři dávky neživé vakcíny a obě dávky živé vakcíny. Protektivní titr protilátek byl posuzován podle stanoveného rozmezí dané laboratoře.
Statistická analýza
Kategorická data byla popsána jako absolutní počet a procento, zatímco kvantitativní údaje byly vyjádřeny jako medián a rozmezí nebo mezikvartilové rozmezí (IQR). Pro porovnání kategorických dat byl použit Chí-kvadrát test nebo Fisherův exaktní test, zatímco pro kvantitativní data byl použit Mann-Whitney test. Vliv expozice anti-TNFα na riziko infekce během prvního roku života byl analyzován modelem univariantní a multivariantní logistické regrese se stanovením poměru pravděpodobnosti (ORs) a 95% CI. Vzhledem k tomu, že délka sledování po porodu byla u exponované a kontrolní skupiny odlišná, infekce vyskytující se během celého sledovaného období byly vyjádřeny jako poměr celkového počtu infekcí k celkovému počtu měsíců sledování. K hodnocení vlivu expozice anti-TNFα na výskyt infekcí během celé doby sledování byl použit univariantní a multivariantní lineární regresní model s β-regresním koeficientem a 95% CI. Za statisticky signifikantní byly považovány hodnoty p < 0,05. Statistické analýzy byly provedeny pomocí SPSS Statistics for Windows (verze 17.0, SPSS Inc., Chicago) a R (verze 3.4.4, R Core Team).
Etická komise
Studie byla schválena etickou komisí Klinického a výzkumného centra pro střevní záněty ISCARE v Praze. Informovaný souhlas s účastí dítěte ve studii byl podepsán zákonným zástupcem dítěte.
Výsledky
Sledovaná skupina
Do studie bylo zařazeno 72 dětí exponovaných anti-TNFα in utero a 69 neexponovaných kontrol. Medián věku sledovaných dětí v době poslední kontroly byl 35,1 a 50,4 měsíců (p = 0,04). Ve srovnání s dětmi z kontrolní skupiny měly exponované děti nižší porodní hmotnost (3 120 vs. 3 400 g; p = 0,001), byly častěji narozené císařským řezem (66,7 vs. 15,9 %; p < 0,001) a kojené kratší dobu (5 vs. 11 měsíců; p = 0,001). Mezi skupinami nebyly zjištěny signifikantní rozdíly v pohlaví, frekvenci předčasných porodů, perinatálních komplikacích, vrozených malformacích nebo kouření matky během těhotenství (tab. 1).
Table 1. Charakteristiky anti-TNFα exponovaných dětí a neexponovaných kontrol.
Tab. 1. Characteristics of anti-TNFα exposed children and non-exposed controls.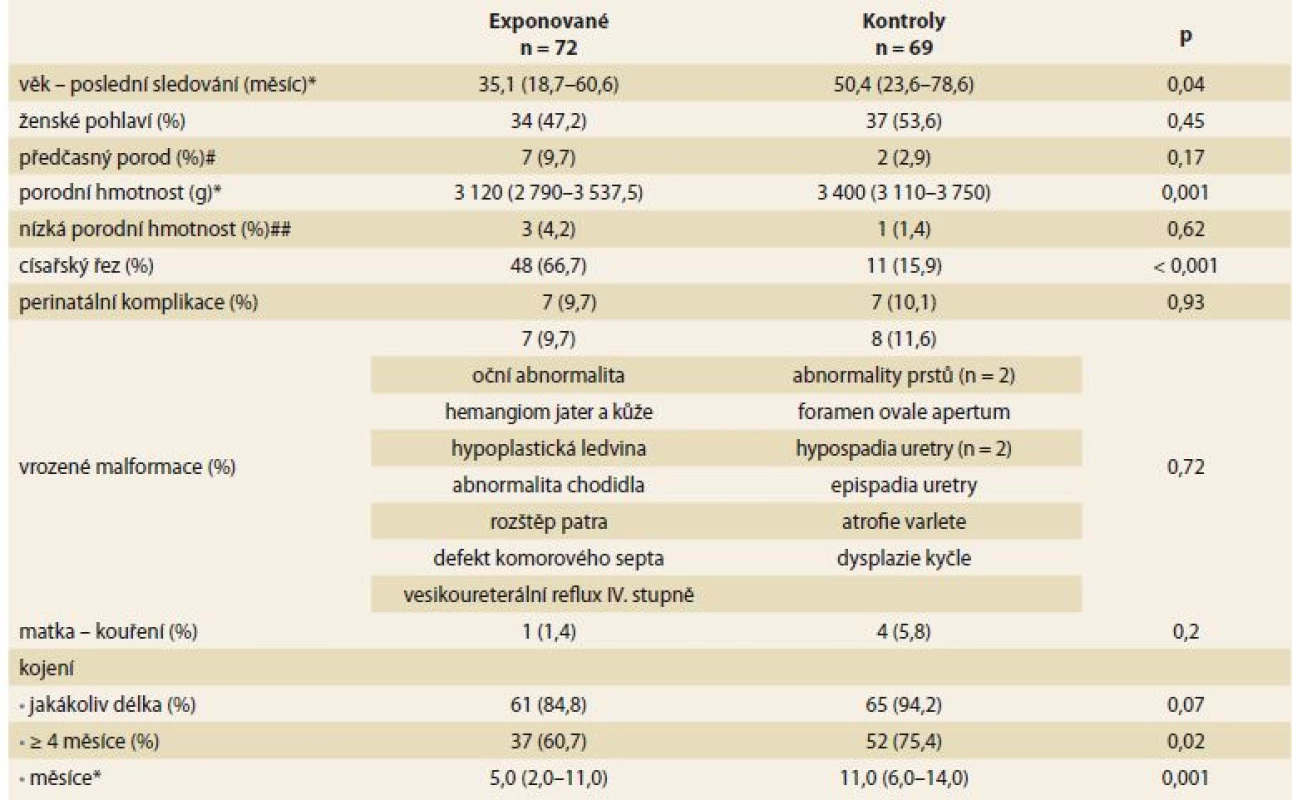
*medián (interkvartilové rozmezí), #předčasný porod: gestační týden < 37, ##nízká porodní hmotnost: hmotnost < 2 500 g; p < 0,05 – statisticky významný, n – počet, p – hladina významnosti Většina matek exponovaných dětí trpěla CD (52; 72,2 %). V průběhu gravidity bylo IFX léčeno 54 (75 %) žen, 27 (37,5 %) užívalo konkomitantní terapii thiopuriny a 7 (9,8 %) užívalo steroidy (5 systémové a 2 topické). Medián posledního gestačního týdne aplikace anti-TNFα byl týden 29 (rozsah 17– 39), v případě IFX týden 28 (rozsah 17– 37) a v případě ADA týden 30 (rozsah 24– 39). Hladiny anti-TNFα v pupečníkové krvi byly měřeny u 46 (63,9 %) dětí a jsou uvedeny v tab. 2.
Table 2. Hladiny infliximabu a adalimumabu v pupečníkové krvi exponovaných dětí. Tab. 2. Levels of infliximab and adalimumab in umbilical cord blood of exposed children. 
*medián (rozmezí), n – počet Infekční komplikace
Infekce během prvního roku života
V průběhu 1. roku věku prodělalo alespoň jednu infekci vyžadující antibiotickou léčbu a/ nebo hospitalizaci 17 (23,6 %) exponovaných dětí a 12 (17,4 %) kontrol (p = 0,36). Spektrum prodělaných infekcí bylo podobné u obou skupin, ve většině případů se jednalo o infekce dýchacích a močových cest (tab. 3). Jedno dítě z exponované skupiny prodělalo zánět středouší vyvolaný Pseudomonas aeruginosa jako pooperační komplikaci pro rozštěp patra. Nebyla zachycena žádná další atypická nebo oportunní infekce.
Table 3. Infekční komplikace v průběhu prvního roku života u anti-TNFα exponovaných dětí a neexponovaných kontrol. Tab. 3. Infectious complications during the fi rst year of life in anti-TNFαexposed children and non-exposed controls. 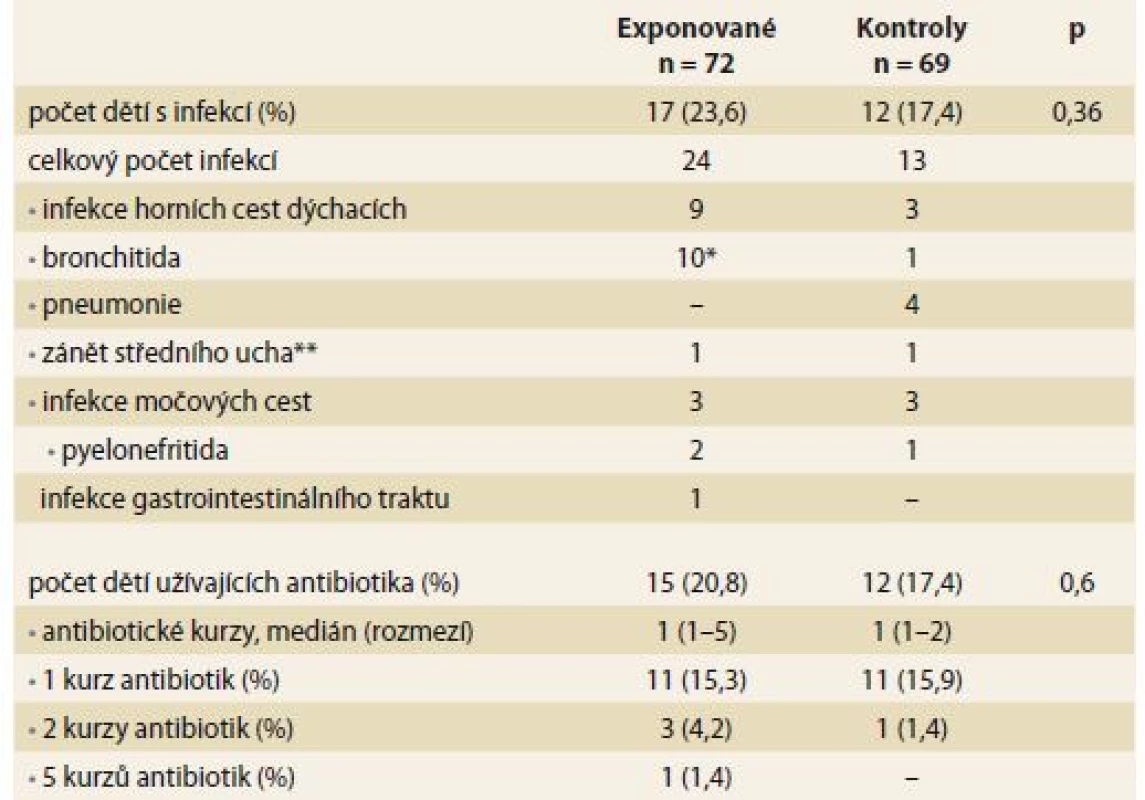
*5 infekcí u jednoho dítěte, **zánět středního ucha vyvolán Pseudomonas aeruginosa Jak univariantní, tak ani multivariantní regresní analýza neprokázala signifikantní vliv prenatální expozice anti-TNFα na výskyt infekčních komplikací v průběhu 1. roku života (tab. 4).
Table 4. Vliv expozice anti-TNFα in utero na výskyt infekčních komplikací u exponovaných dětí ve srovnání s neexponovanými kontrolami. Tab. 4. The effect of anti-TNFα in utero exposure on the incidence of infectious complications in exposed children as compared to non-exposed controls. 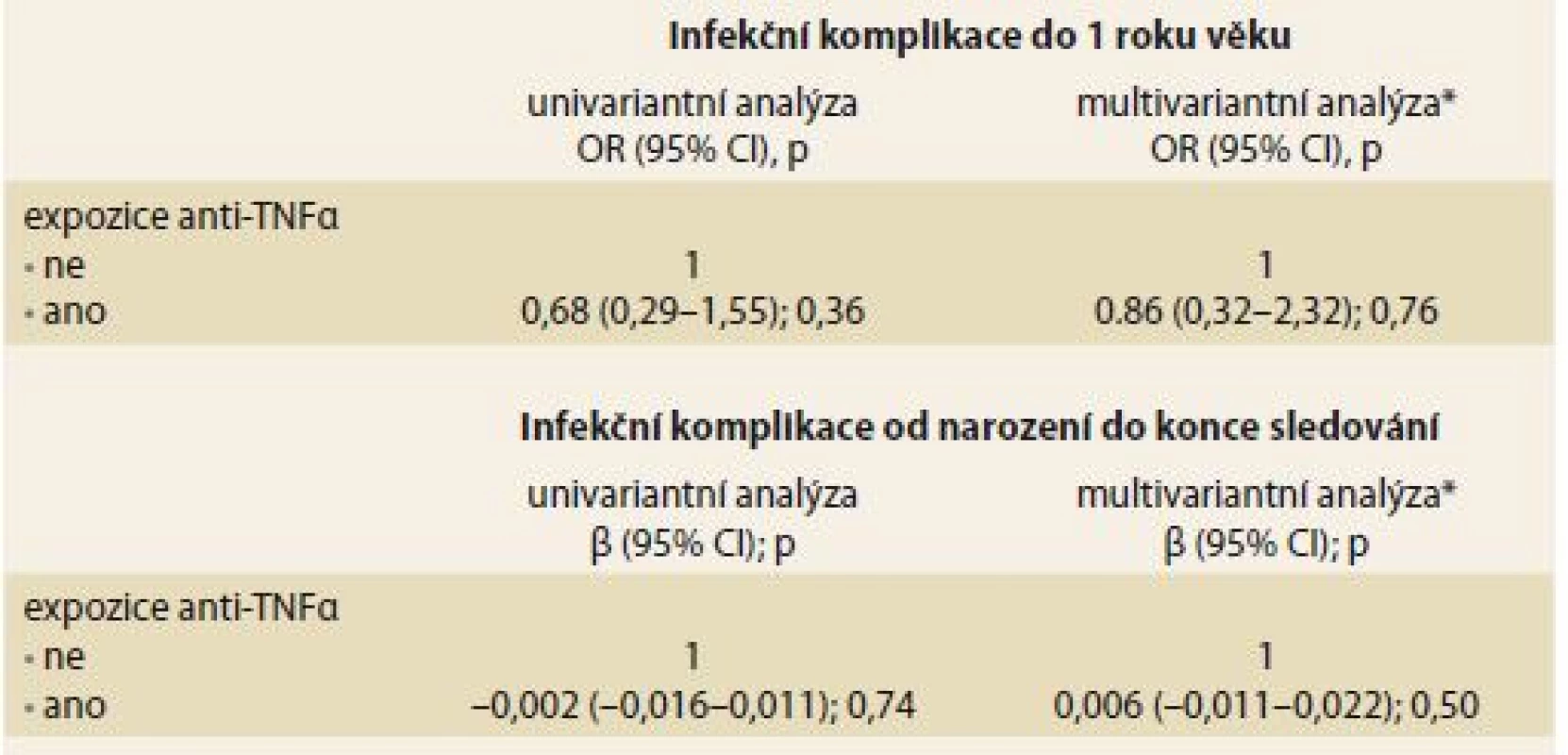
TNF – tumor necrosis factor, OR – odds ratio, CI – konfi denční interval, β-regresní koeficient *adjustováno na: předčasný porod (< 37 gestační týden), nízká porodní hmotnost (< 2 500 g), kojení, způsob vedení porodu a anamnéza alergie u dítěte V podskupině exponovaných dětí nebyl prokázán signifikantní vliv konkomitantní terapie thiopuriny v průběhu gravidity na riziko infekce během 1. roku života (thiopuriny NE vs. ANO: 20,5 vs. 29,6 %; p = 0,38). Dále nebyl pozorován významný rozdíl v hladinách anti-TNFα v pupečníkové krvi mezi dětmi s infekčními komplikacemi během 1. roku života a těmi bez nich (infekce NE vs. ANO: medián 5,0 vs. 3,4 μg / ml; p = 0,90).
Infekce v průběhu celého období sledování
Mezi exponovanými dětmi a kontrolní skupinou nebyl pozorován signifikantní rozdíl v mediánu poměru infekcí v období od narození do konce sledování (0,016 vs. 0,031; p = 0,32). Jedno dítě z exponované skupiny prodělalo zánět atlantoaxiálního kloubu po provedené adenotomii vyžadující antibiotickou terapii a hospitalizaci. K ostatním pozorovaným infekcím v obou skupinách patřily běžné dětské infekce, zejména infekce dýchacích cest. Expozice anti-TNFα in utero nebyla spojena s rizikem infekčních komplikací jak v univariantním, tak multivariantním regresním modelu (tab. 4).
Vakcinace
Očkování podle standardního očkovacího protokolu podstoupilo celkem 64 exponovaných dětí (88,9 %) a všechny děti z kontrolní skupiny. Důvody odchýlení od standardního vakcinačního protokolu byly: oddálení zahájení očkování na základě rozhodnutí ošetřujícího pediatra z důvodu biologické terapie matky (n = 3), odmítnutí očkování rodičem (n = 1), oddálené podání živé vakcíny z důvodu respiračních infekcí po prvním roce života (n = 3) a individuální vakcinační protokol z důvodu kongenitální hypoplastické ledviny a infekce dýchacích cest (n = 1).
Nežádoucí účinky po očkování byly hlášeny u 17 (23,9%) exponovaných dětí a u 8 (11,6 %) kontrol (p = 0,06). Většina vedlejších účinků zahrnovala krátkodobé zvýšení teploty nebo horečku, pouze u minima dětí byla pozorována lokální kožní reakce. Nebyly hlášeny žádné závažné nežádoucí účinky. V době, kdy ještě nebyly známy kontraindikace očkování živými vakcínami po expozici anti-TNFα, podstoupilo 15 dětí exponovaných IFX během prvního týdne věku také očkování BCG vakcínou. U 4 z nich došlo k rozvoji velké lokální kožní reakce, komplikované v jednom případě axilární lymfadenopatií. Nicméně k rozvoji lokální kožní reakce po BCG vakcinaci došlo také u 2 dětí z kontrolní skupiny. Žádné z dětí nevyžadovalo antituberkulózní terapii.
Sérologická odpověď na neživé a živé vakcíny byla hodnocena u 49 (68,1%) a 37 (51,4%) exponovaných dětí ve věku 34,0 a 38,7 měsíce (medián). Postvakcinační titry protilátek byly měřeny u > 95 % dětí v případě všech testovaných vakcín s výjimkou HiB a příušnic, u kterých dosáhlo odpovídající sérologickou odpověď pouze 65,3 a 75,7 % dětí (tab. 5). U 16 (23,2 %) dětí z kontrolní skupiny byly měřeny titry postvakcinačních protilátek u neživých i živých vakcín ve věku 80,4 měsíců (medián). Odpovídající sérologická odpověď byla zaznamenána u > 95 % dětí v případě všech živých vakcín, s výjimkou příušnic (81,3 %). Avšak titry ochranných protilátek v případě všech neživých vakcín byly měřeny u < 90 % kontrol, přičemž v případě vakcíny proti HiB byla adekvátní sérologická odpověď pouze u 12,5 % dětí. U všech neživých vakcín, s výjimkou záškrtu, došlo k signifikantně slabší imunitní odpovědi u dětí z kontrolní skupiny ve srovnání s exponovanými dětmi (tab. 5).
Table 5. Protektivní titr protilátek po očkování u dětí exponovaných anti-TNFα in utero a neexponovaných kontrol. Tab. 5. Protective antibody titer for vaccination in children exposed to anti-TNFα in utero and non-exposed controls. 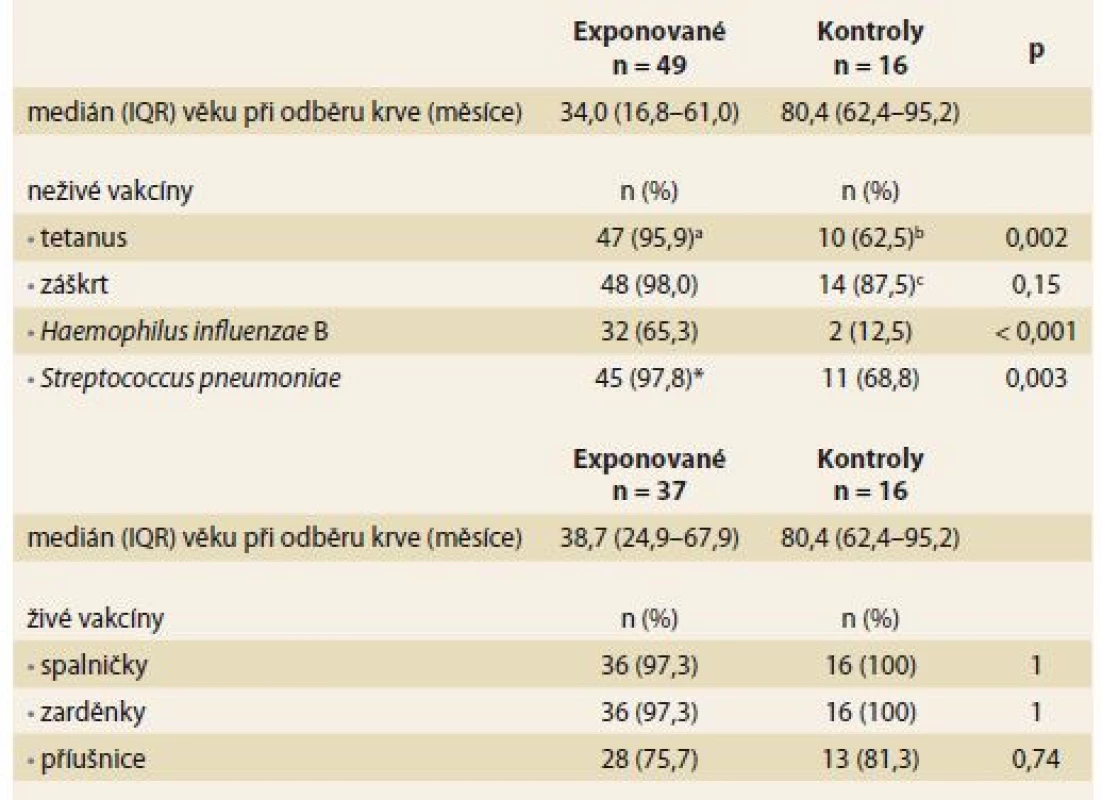
IQR – mezikvartilové rozmezí, n – počet
* jenom 46 dětí bylo očkováno proti Streptococcus pneumoniae
* obě děti s nedostatečným titrem protilátek byly před aplikací booster vakcíny proti tetanu a záškrtu, plánovanou ve věku 5–6 let
* dvě děti s nedostatečným titrem protilátek byly před aplikací booster vakcíny proti tetanu a záškrtu, plánovanou ve věku 5–6 let
* jedno dítě s nedostatečným titrem protilátek bylo před aplikací booster vakcíny proti tetanu a záškrtu, plánovanou ve věku 5–6 letDiskuze
Cílem této studie bylo zhodnocení vlivu expozice anti-TNFα in utero na postnatální vývoj exponovaných dětí. Mezi sledovanými skupinami exponovaných dětí a dětí narozených zdravým ne-IBD matkám nebyl pozorován významný rozdíl v podílu infekčních komplikací vzniklých jak během 1. roku života, tak i v průběhu celého sledovaného období. Stejně tak nebyl prokázán signifikantní vliv konkomitantní imunosupresivní terapie nebo hladin anti-TNFα v pupečníkové krvi na riziko vzniku infekce během 1. roku života. Přibližně u 10 % exponovaných dětí byly zaznamenány určité odchylky od standardního očkování. Adekvátní sérologická odpověď na očkování byla zachycena u více než 95 % exponovaných dětí, s výjimkou vakcín proti HiB a příušnicím, které však vykazovaly nejnižší protilátkovou odpověď i v kontrolní skupině dětí.
Největší obavy spojené s expozicí anti-TNFα in utero se týkají především vlivu na vývoj imunitního systému exponovaných dětí. V rámci této studie jsme nenalezli signifikantní rozdíl v podílu dětí s infekčními komplikacemi vyžadujícími antibiotika a/ nebo hospitalizaci při srovnání exponované a kontrolní skupiny, a to jak během 1. roku života, tak během celého sledovaného období. Tyto nálezy jsou v souladu s výsledky dvou předchozích studií, které neprokázaly zvýšené riziko infekce po prenatální expozici anti-TNFα ve srovnání s neexponovanými kojenci [5,6]. Překvapivé byly spíše výsledky nizozemské studie, ve které vykazovaly exponované děti ve srovnání s neexponovanými dětmi ne-IBD matek (kontrolami) signifikantně nižší riziko infekcí vyžadujících antibiotika (24,5 vs. 39,9 %; p = 0,02) [5]. Autoři však předpokládali, že tyto nálezy mohly být důsledkem systematického poradenství žen s IBD v jejich centru, kde byli rodiče upozorněni na potenciálně zvýšené riziko infekcí u dětí s hladinami anti-TNFα v pupečníkové krvi nad 3 μg/ ml. Přestože rodičům našich dětí nebylo poskytnuto žádné zvláštní poradenství nebo doporučení týkající se infekčních komplikací, míra exponovaných dětí vyžadujících antibiotika byla podobná jako ta u exponovaných dětí z nizozemské studie [5].
Názory na užívání konkomitantní imunosupresivní terapie u těhotných pacientek s IBD a její vliv na riziko infekcí u jejich dětí jsou stále kontroverzní. Přestože dvě multicentrické studie uváděly zvýšený výskyt infekcí u dětí vystavených in utero kombinované imunosupresivní terapii, jedna nizozemská studie tato tvrzení nepotvrdila [3,5,7]. Naše studie neprokázala signifikantní rozdíl ve výskytu infekcí v 1. roce života u dětí vystavených monoterapii anti-TNFα a kombinované imunosupresivní terapii, což je v souladu s výsledky studie z Nizozemí. Nicméně je třeba zdůraznit, že první dvě výše zmiňované práce ve svém hodnocení zahrnovaly i virové infekce nevyžadující antibiotickou terapii, naproti tomu naše a nizozemská studie se zaměřily pouze na infekce vyžadující léčbu antibiotiky a/ nebo hospitalizaci [3,5,7].
V naší kohortě nebyla pozorována žádná spojitost mezi hladinami anti-TNFα v pupečníkové krvi a rizikem infekce vzniklé během 1. roku života. Některé předchozí studie přinesly podobně povzbudivé výsledky [3,8,9].
Přibližně u 10 % exponovaných dětí došlo k určitým odchylkám od standardního vakcinačního protokolu, přičemž u poloviny z nich se tak stalo na základě individuálního rozhodnutí pediatra nebo rodiče bez jakéhokoli klinického relevantního podkladu. Podobná zjištění přinesla také nedávno publikovaná evropská multicentrická studie, jejíž autoři zaznamenali ve skupině dětí exponovaných anti-TNFα významně vyšší počet dětí, které nepodstoupily standardní očkovací protokol ve srovnání s dětmi z kontrolní skupiny (6 vs. 1,3 %; p < 0,01) [6]. Nežádoucí účinky očkování, i když nebyly závažné, byly u exponovaných dětí popsány téměř 2× častěji než v kontrolní skupině. Zatím není zcela jasné, jestli by mohl být tento rozdíl důsledkem samotné expozice anti-TNFα nebo je spíše důsledkem zvýšeného sledování exponovaných dětí matkami i pediatry.
Adekvátní sérologická odpověď na očkování (měřená ve věku téměř 3 let, medián) byla zachycena u > 95 % exponovaných dětí, s výjimkou vakcín proti HiB (neživá) a příušnicím (živá). Podobná situace v případě živých vakcín byla zachycena i v kontrolní skupině, s vyšší mírou nedostatečné imunitní odpovědi na vakcínu proti příušnicím. Nicméně ve srovnání s exponovanými dětmi jsme v kontrolní skupině zachytili signifikantně nižší titry protektivních protilátek proti třem neživým vakcínám (HiB, pneumokok, tetanus). Vakcíny proti HiB a pneumokoku jsou aplikovány pouze v prvních 18 měsících života, bez podání další tzv. booster dávky v pozdějším věku (vzhledem k nižšímu riziku invazivních infekcí způsobených těmito patogeny po 5. roce života). Tato skutečnost by vysvětlovala vyšší míru nedostatečné sérologické odpovědi u dětí z kontrolní skupiny, které byly vyšetřované ve vyšším věku než exponované děti (medián 80 vs. 34 měsíců). Na druhou stranu německá multicentrická studie hodnotící imunologickou perzistenci hexavalentní vakcíny, která byla podávána zdravým dětem ve stejném režimu jak tomu bylo u naší kohorty, prokázala perzistenci protilátek proti HiB u > 95 % dětí ve věku 4– 6 let a 7– 9 let [10]. Odpovídající titry protilátek proti tetanu byly naměřeny u 74,7 % dětí ve věku 4– 5 let a u > 95 % dětí ve věku 7– 9 let (po podání boosterové dávky ve věku 5– 6 let) [10]. Je třeba poznamenat, že německá studie měla nastaveny mnohem nižší „cut-off“ hodnoty séroprotekce pro obě vakcíny ve srovnání s hodnotami používanými naší laboratoří. Pokud bychom ale použili stejné hodnoty „cut-off“ jako ve zmiňované německé studii, adekvátní odpověď na vakcínu proti HiB by mělo 98 % exponovaných dětí a 81,3 % kontrol a 93,3 % kontrol by mělo také adekvátní sérologickou odpověď na vakcínu proti tetanu (údaje nejsou uvedeny). Navíc v recentní studii PIANO, jediné studii hodnotící sérologickou odpověď na vakcínu proti HiB a vakcínu proti tetanu u dětí exponovaných anti-TNFα (≥ 7 měsíců věku), byla adekvátní protilátková odpověď přítomná pouze v 71, resp. 80 % [11]. Zajímavé je, že nízká míra imunitní odpovědi na obě vakcíny byla nalezena také u dětí IBD matek, které ale nebyly v těhotenství léčeny anti-TNFα (50, resp. 75 %). Nicméně přesný věk v době měření protilátek a ani použité hodnoty „cut-off“ nebyly v této studii uvedeny [11].
Závěr
Závěrem lze shrnout, že děti vystavené působení anti-TNFα in utero z důvodu IBD matky měly ve srovnání s neexponovanými dětmi ne-IBD matek podobné riziko vzniku infekcí v mediánu sledování téměř 3 let. Hladiny anti-TNFα v pupečníkové krvi ani konkomitantní imunosupresivní terapie během gravidity neovlivňovaly riziko vzniku infekcí u exponovaných dětí. Prenatální expozice anti-TNFα neměla negativní vliv na sérologickou odpověď na očkování. Nicméně nepochybně budou zapotřebí další studie zaměřené na sledování dlouhodobých dopadů prenatální expozice anti-TNFα, především však práce věnované novým biologickým přípravkům s odlišným mechanizmem účinku.
Doručeno: 22. 11. 2018
Přijato: 28. 11. 2018
MU Dr. Katarína Mitrová, Ph.D.
Oddělení dětské gastroenterologie
Pediatrická klinika 2. LF UK a FN Motol
V Úvalu 84, 150 06 Praha 5
Sources
1. Burisch J, Munkholm P. The epidemiology of inflammatory bowel disease. Scand J Gastroenterol 2015; 50(8): 942– 951. doi: 10.3109/ 00365521.2015.1014407.
2. van der Woude CJ, Ardizzone S, Bengtson MBet al. The second European evidenced-based consensus on reproduction and pregnancy in inflammatory bowel disease. J Crohns Colitis 2015; 9(2): 107– 124. doi: 10.1093/ ecco-jcc/ jju006.
3. Julsgaard M, Christensen LA, Gibson PR et al. Concentrations of adalimumab and infliximab in mothers and newborns, and effects on infection. Gastroenterol 2016; 151(1): 110– 119. doi: 10.1053/ j.gastro.2016.04.002.
4. Bortlik M, Duricova D, Machkova N et al. Impact of anti-tumor necrosis factor alpha antibodies administered to pregnant women with inflammatory bowel disease on long-term outcome of exposed children. Inflamm Bowel Dis 2014; 20(3): 495– 501. doi: 10.1097/ 01.MIB.0000440984.86659.4f.
5. de Lima A, Zelinkova Z, van der Ent C et al. Tailored anti-TNF therapy during pregnancy in patients with IBD: maternal and fetal safety. Gut 2016; 65(8): 1261– 1268. doi: 10.1136/ gutjnl-2015-309321.
6. Chaparro M, Verreth A, Lobaton T et al. Long-term safety of in utero exposure to anti-tnfα drugs for the treatment of inflammatory bowel disease: results from the multicenter European TEDDY Study. Am J Gastroenterol 2018; 113(3): 396– 403. doi: 10.1038/ ajg.2017.501.
7. Mahadevan U, Martin CF, Sandler RS et al. PIANO: A 1000 patient prospective registry of pregnancy outcomes in women with IBD exposed to immunomodulators and biologic thera-py (Abstract 865). Gastroenterol 2012; 142 (5 Suppl 1): S149.
8. Kanis SL, de Lima-Karagiannis, van der Ent C et al. Anti-TNF levels in cord blood at birth are associated with anti-TNF type. J Crohns Colitis 2018; 12(8): 939– 947. doi: 10.1093/ ecco-jcc/ jjy058.
9. Mahadevan U, Martin CF, Kane SV et al. Do infant serum levels of biologic agents at birth correlate with risk of adverse outcomes? Results from the PIANO Registry. Gastroenterol 2016; 150 (4 Suppl 1): S91– S92.
10. Zinke M, Disselhoff J, Gartner B et al. Immunological persistence in 4– 6 and 7– 9 year olds previously vaccinated in infancy with hexavalent DTPa-HBV-IPV/ Hib. Hum Vaccin 2010; 6(2): 189– 193.
11. Beaulieu DB, Ananthakrishnan AN, Martin C et al. Use of biologic therapy by pregnant women with inflammatory bowel disease does not affect infant response to vaccines. Clin Gastroenterol Hepatol 2018; 16(1): 99– 105. doi: 10.1016/ j.cgh.2017.08.041.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2018 Issue 6-
All articles in this issue
- Detská gastroenterológia a hepatológia
- Obezitologie a bariatricko-metabolická chirurgie
- Ultrasonografické hodnotenie steatózy pečene u obéznych pediatrických pacientov
- Vliv expozice anti-TNFα in utero na vývoj imunitního systému exponovaných dětí – kontrolovaná multicentrická studie
- Wilsonova choroba v dětském věku – dvě kazuistiky
- Parciální jejunální diverze – technické aspekty a počáteční zkušenosti
- Novinky ve farmakoterapii obezity
- Psychologické aspekty chirurgické léčby obezity
- Hepatopatie jako první projev systémové AL amyloidózy
- Meckelův divertikl jako příčina náhlé příhody břišní
- Intrapankreaticky uložená akcesorní slezina jako raritní solidní léze pankreatu
- Krvácení jako komplikace chronické pankreatitidy
- Správná praxe při oplachu endoskopů
- Endoskopická léčba rektálního syndromu při lipomu rekta technikou „loop and let go“
- Výběr z mezinárodních časopisů
- Široká problematika žlučových kyselin a jejich účinků pohledem XXV. Bile Acid Meeting: Bile Acids in Health and Disease 2018
- Správná odpověď na kvíz
- Poděkování recenzentům
- První biosimilární adalimumab – SB5
- Hepatitida B u osob infikovaných virem lidské imunodeficience v Porto-Novo – prevalence a související faktory
-
Novel developments in endoscopy of the proximal GIT
Oliver Pech (Germany) – Gastro Update Europe 2018, Prague
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Meckelův divertikl jako příčina náhlé příhody břišní
- Hepatopatie jako první projev systémové AL amyloidózy
- Wilsonova choroba v dětském věku – dvě kazuistiky
- Endoskopická léčba rektálního syndromu při lipomu rekta technikou „loop and let go“
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

