-
Medical journals
- Career
Krvácení jako komplikace chronické pankreatitidy
Authors: Kancnýř J.; Kovala P.; Kremer M.
Authors‘ workplace: Interna, Městská nemocnice Ostrava, p. o.
Published in: Gastroent Hepatol 2018; 72(6): 527-530
Category:
doi: https://doi.org/10.14735/amgh2018527Overview
Krvácení, provázející chronickou pankreatitidu, je neobvyklou komplikací, která však v závislosti na intenzitě a lokalizaci může vážně ohrozit život pacienta. Důležitou roli hraje včasné stanovení diagnózy s lokalizací zdroje. Při ošetření krvácení se volí nejvhodnější metoda dle aktuálního hemodynamického stavu pacienta a technické proveditelnosti. Kazuistika popisuje případ pacienta s letitou anamnézou chronické pankreatitidy, komplikované pseudocystou v oblasti hlavy pankreatu, který přichází do nemocnice s náhle vzniklými bolestmi břicha. Během vyšetření je zjištěn nárůst objemu pseudocysty s útlakem extrahepatálních žlučových cest. Zároveň vzniklo podezření na krvácení do jejího lumen. Po objektivizaci leaku kontrastní látky do dutiny pseudocysty pomocí CT vyšetření byla indikována angiografie, při které se podařilo detekovat a ošetřit poškozenou arterii za použití coilingu. Následně byla provedena endoskopická retrográdní cholangiopankreatikografie se zavedením stentu do d. choledochus. Během aplikace kontrastní látky do žlučových cest došlo i k plnění dutiny pseudocysty. Tento nález umožnil úspěšnou transpapilární drenáž pseudocysty pomocí monopigtailu. Během dalšího sledování došlo k úplné regresi pseudocysty se spontánním odchodem monopigtailu.
Klíčová slova:
chronická pankreatitida – pankreatická pseudocysta – krvácení – angiografie
Úvod
Tvorba pseudocyst je běžnou komplikací chronické pankreatitidy. Krvácení ve spojitosti s chronickou pankreatitidou se vyskytuje u pacientů bez pankreatické pseudocysty s incidencí 6– 17 % a v případě přítomné pankreatické pseudocysty 6– 31 % [1,2]. Může se jednat o život ohrožující komplikaci s mortalitou více než 40 % [2,3]. Patofyziologicky se v rozvoji krvácení uplatňuje enzymatické působení obsahu pseudocysty na okolní struktury s narušením integrity cév, vlastní stěny pseudocysty, biliárního systému nebo stěny přilehlé části trávicí trubice. Druhým mechanizmem bývá útlak nebo trombóza v. lienalis, v. mesenterica superior nebo v. portae s rozvojem portální hypertenze a následným varikózním krvácením nebo rupturou sleziny. Ke krvácení dochází do vývodného systému pankreatu, biliárního systému, lumen trávicí trubice, peritoneální dutiny nebo retroperitoneálního prostoru. Ke krvácení do prostoru pseudocysty dochází buď při kompletní ruptuře cévní stěny se zakrvácením do existující dutiny, nebo při narušení a oslabení části cévní stěny s jejím následným vyklenutím v podobě pseudoaneurysmatu. Incidence pankreatického pseudoaneurysmatu se uvádí v 10– 21 % u pacientů s chronickou pankreatitidou a v 10– 31 % u pacientů s pankreatickou pseudocystou [4]. Z cévních struktur dochází nejčastěji ke krvácení z v. lienalis (30– 50 %), a. gastroduodenalis (17 %), a. pancreaticoduodenalis (11– 16 %), vzácněji také z a. mesenterica superior a truncus coeliacus [1,5].
Kazuistika
Pacient, 58 let, s letitou anamnézou chronické kalcifikující pankreatitidy toxonutritivní etiologie s cystickým útvarem velikosti 26 mm v oblasti hlavy pankreatu, přichází na interní oddělení pro stupňující se bolesti břicha v oblasti epigastria a pravého podžebří a opakované zvracení trávicích šťáv. Přes palpační bolestivost v epigastriu a pravém podžebří neměl nález na břiše charakter peritoneálního dráždění. Vyšetření per rectum bylo negativní. Pacient byl normotenzní, bez tachykardie a bez dušnosti. V laboratorních výsledcích dominovala elevace sérové amylázy (8,23 µkat/ l) a lipázy (12,07 µkat/ l), elevace jaterních testů cholestatického charakteru (celkový bilirubin 62 µmol/ l, alaninaminotransferáza (ALT) 0,26 μkat/ l, aspartátaminotransferáza (AST) 0,3 μkat/ l, alkalická fosfatáza (ALP – alkaline phosphatase) 4,7 μkat/ l, gama-glutamyltransferáza (GGT) 6,6 μkat/ l, C-reaktivní protein (CRP) 102 mg/ l a lehká normocytární anémie bez leukocytózy (hemoglobin 110 g/ l, leukocyty 9,4 × 109/ l). Transabdominální sonografie prokázala progresi velikosti cystické léze v hlavě slinivky na 40 mm. Pacientovi byla podána antibiotika, spasmoanalgetika, inhibitory protonové pumpy a infuze krystaloidů. Přes zavedená opatření došlo k vzestupu CRP (136 mg/ l) a cholestázy (celkový bilirubin 157 µmol/ l, ALT 0,62 µkat/ l, AST 0,96 µkat/ l, ALP 11,7 µkat/ l, GGT 29,4 µkat/ l). Bylo provedeno endosonografické vyšetření, limitované pro přístroj (Olympus GF-UE 160) neprůchodnou stenózou v oblasti bulbu duodena, tvořenou extramurálním tlakem. V hlavě slinivky bylo zobrazeno homogenní, hypoechogenní ložisko s dopplerometricky detekovatelnými turbulentními proudy, odpovídající svou lokalizací dříve popisované pseudocystě. Akutně provedené CT vyšetření břicha prokázalo sytící se ložisko hlavy pankreatu, s maximem sycení ve venózní fázi, ale bez jednoznačného průkazu zdroje krvácení (obr. 1). Dále se zobrazila dilatace intrahepatálních i extrahepatálních žlučových cest a hydrops žlučníku. Během provedených vyšetření nedochází k rozvoji hemodynamické nestability či progresi anémie. Po vzájemné domluvě s cévním chirurgem a intervenčním angiologem byl pacient přeložen na cévní oddělení k provedení angiografie. Ta prokazuje leak kontrastní látky z větve a. mesenterica superior do dutiny pseudocysty (obr. 2) v hlavě pankreatu. Erodované místo tepny bylo okludováno aplikací dvou coilů (obr. 3). Pacient byl po výkonu ve stabilizovaném stavu přeložen zpět na interní oddělení. Kontrolní endosonografické vyšetření prokazuje nehomogenní náplň pseudocysty, nyní již bez detekce toků. Nález odpovídá obsahu koagul po zastaveném krvácení. Pro přetrvávající cholestázu byla provedena endoskopická retrográdní cholangiopankreatikografie se zavedením stentu do d. choledochus. Během vyšetření dochází k průniku aplikované kontrastní látky i do dutiny pseudocysty (obr. 4), a tím k průkazu její komunikace s vývodným systémem. Pseudocysta byla transpapilárně drénována zavedením monopigtailu (obr. 5). Při následující laboratorní kontrole dochází k normalizaci jaterních testů i CRP. Pacient byl následně bez subjektivních obtíží předán do ambulantního sledování. Během dalšího roku byla sonograficky prokázána úplná regrese pseudocysty hlavy pankreatu se spontánním odchodem monopigtailu. Při laboratorních kontrolách nedošlo k recidivě cholestázy a pacient byl po celou dobu sledování asymptomatický.
Image 1. CT vyšetření – pankreatická pseudocysta s maximálním sycením ve venózní fázi. Fig. 1. CT scan – pancreatic pseudocyst with maximum enhancement in the venous phase. 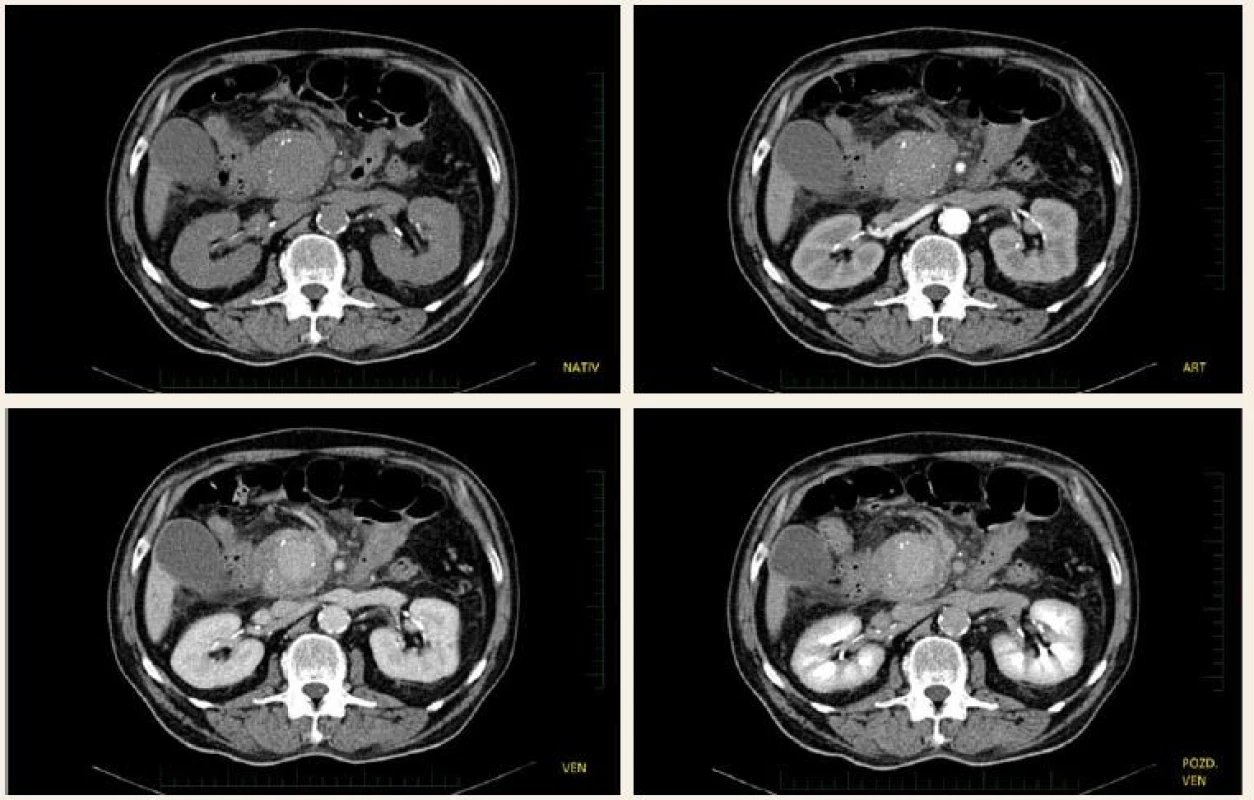
Image 2. Angiografie – únik kontrastní látky do dutiny pankreatické pseudocysty. Fig. 2. Angiography – leakage of contrast medium into the pancreatic pseudocyst cavity. 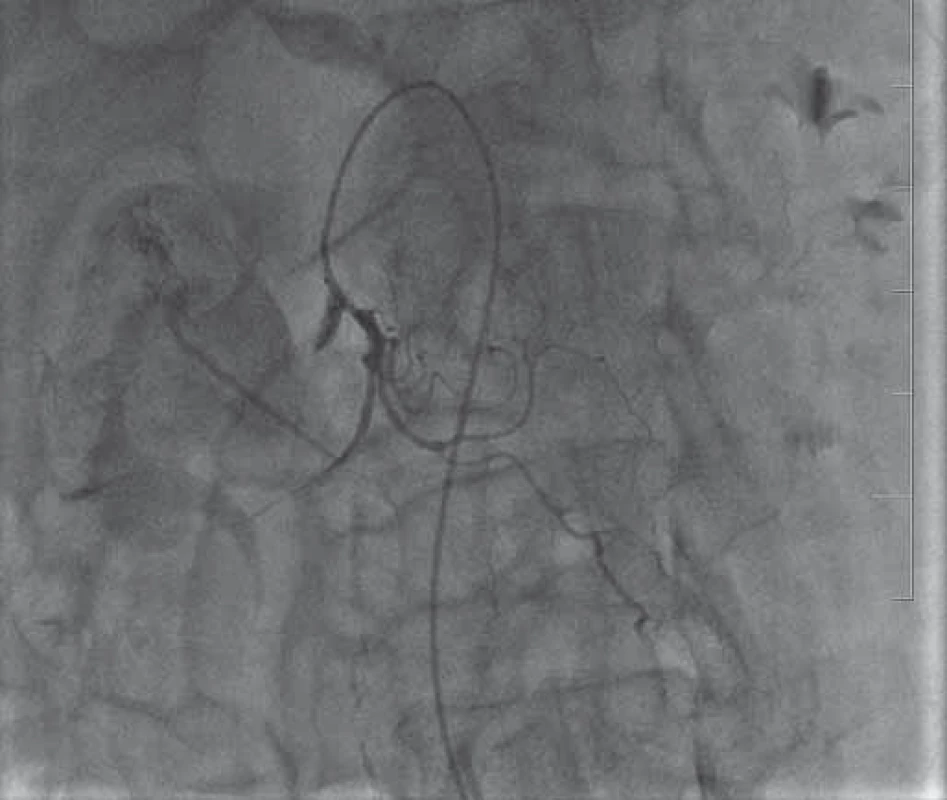
Image 3. Angiografie – dva coily zavedené do poškozené tepny. Fig. 3. Angiography – two coils inserted into the affected artery. 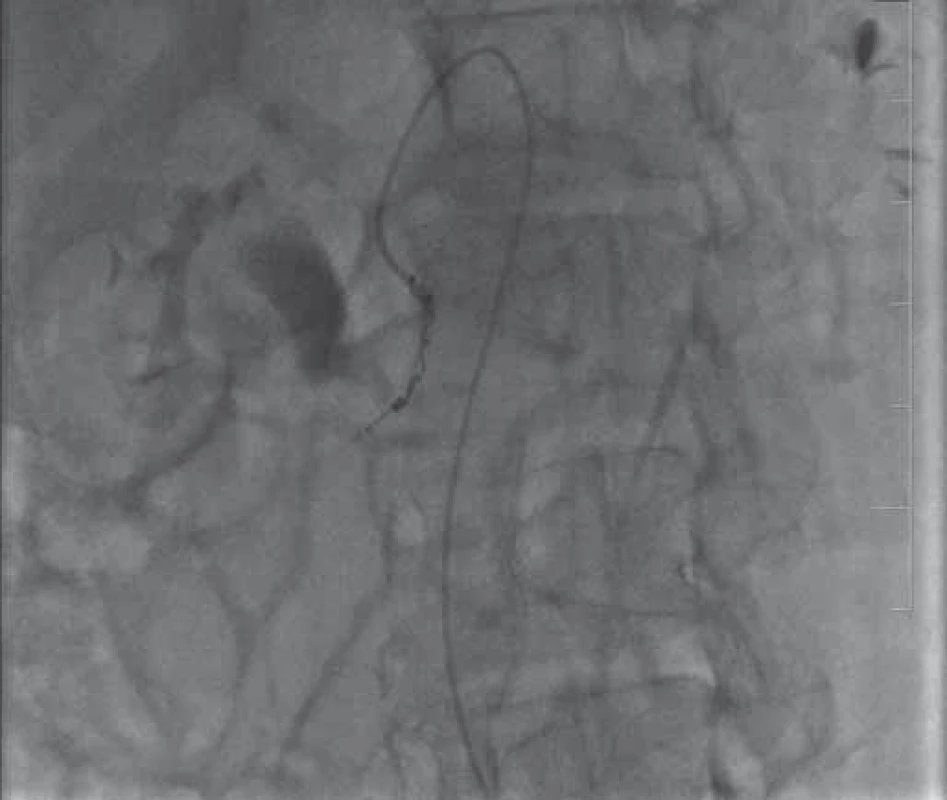
Image 4. ERCP – aplikace kontrastní látky do žlučových cest s plněním dutiny pseudocysty. Fig. 4. ERCP – application of contrast medium into the biliary tract with filling of the pseudocyst cavity. 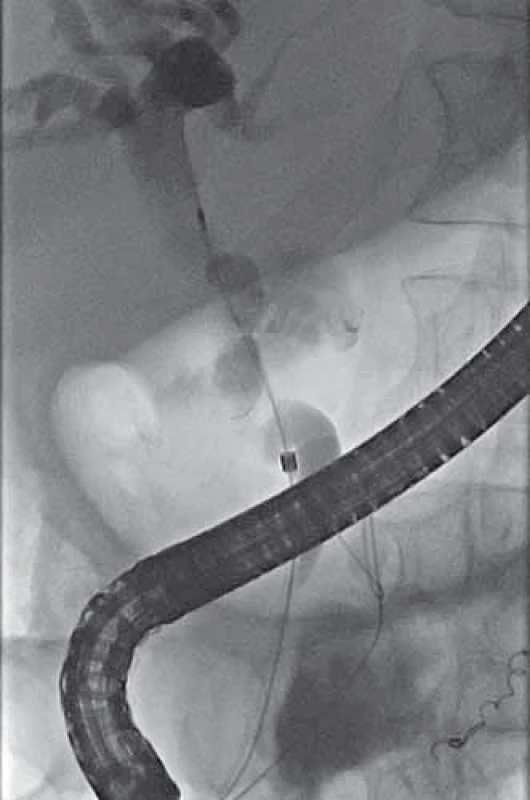
Image 5. ERCP – traspapilárně zavedený stent do d. choledochus a mono pigtail do dutiny pseudocysty. Fig. 5. ERCP – transpapillary stent placement into common bile duct and mono pigtail stent placement into the pseudocyst cavity. 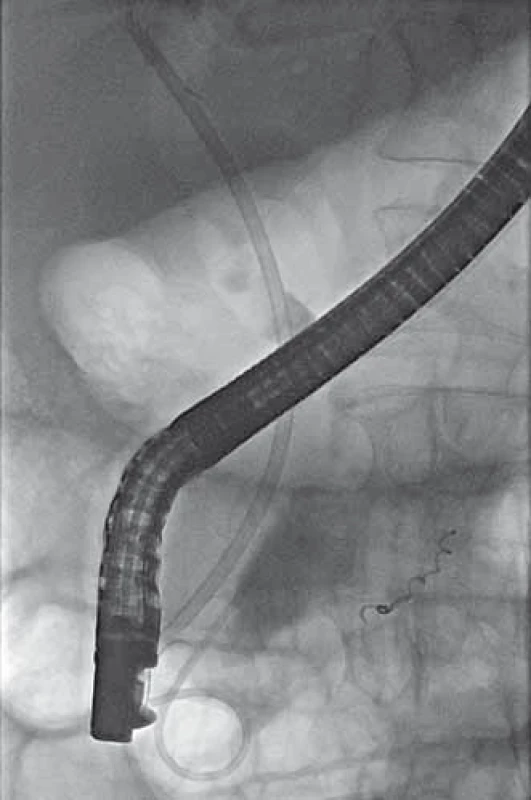
Diskuze
V léčbě krvácivých komplikací chronické pankreatitidy je klíčová včasná diagnostika. Opírá se o anamnestická data, klinické vyšetření, laboratorní testy, zobrazovací vyšetření a v neposlední řadě také o endoskopické a endosonografické vyšetření zažívacího traktu [6]. Anamnéza a klinické vyšetření pacienta nemusí být specifické pro krvácení. Klinicky se pseudoaneurysma a. gastroduodenalis nejčastěji manifestuje krvácením do zažívacího traktu při ruptuře do trávicí trubice (52 %), dále pak bolestí břicha (46 %) nebo se může jednat o asymptomatický náhodný nález při zobrazovacím vyšetření prováděném pro jinou indikaci (7,5 %) [7]. Palpačně může být v oblasti epigastria zjištěna bolestivá, pulzující rezistence. Pro masivnější či protrahované krevní ztráty je typický rozvinutý anemický syndrom s oběhovou nestabilitou. Přímé krvácení do trávicí trubice, provázené hematemézou, melénou či enteroragií, nemusí být přítomno. Objevuje se v případech narušení stěny trávicí trubice pseudocystou, při krvácení z varixů nebo krvácení do biliárního či pankreatického systému. V laboratoři pátráme po poklesu v krevním obraze, leukocytóze, poruchách koagulace, zvýšení hladiny pankreatických enzymů a zánětlivých markerů. Ke klíčovým vyšetřením umožňujícím diagnózu a lokalizaci krvácení patří zobrazovací vyšetření. Transabdominální sonografie umožňuje detekci pseudocyst pankreatu, vč. jejich velikosti, šířky stěny a topografického vztahu k okolním cévám. Umožňuje také zobrazení patologie v oblasti sleziny a v neposlední řadě také zjištění přítomnosti volné tekutiny v dutině břišní. V případě dopplerometrického vyšetření také umožňuje diagnostikovat trombotické uzávěry v oblasti lienální žíly a vzácněji i lokalizaci krvácení. Přesnější informace lze získat užitím endosonografie, také s možností dopplerometrického vyšetření. Topograficky komplexnější informace může nabídnout CT vyšetření s aplikací kontrastní látky. Oproti ultrazvukovému vyšetření nabízí podrobnější informace o samotné pseudocystě, včetně charakteru jejího obsahu, okolních strukturách a jejich vzájemném vztahu s pseudocystou. Také dokáže s vyšší senzitivitou detekovat místo krvácení. Endoskopické metody se uplatňují zejména při manifestaci krvácení z trávicí trubice. Lokalizaci krvácení umožňuje také scintigrafie s využitím erytrocytů značených techneciem (99mTc). Nejpřesnější údaje o zdroji krvácení, až na úroveň drobných viscerálních větví, nabízí angiografie, která zároveň umožňuje následnou intervenci. Při volbě metody k zástavě krvácení je rozhodující lokalizace krvácení a hemodynamická stabilita pacienta. U stabilních pacientů je metodou volby selektivní angiografie s embolizací, u které se uvádí úspěšnost zástavy krvácení 79–100 %, ale riziko rekurence je 17– 37 % [4,8,9]. V literatuře jsou popsány i případy kombinace metod angiografických a endoskopických, kdy zdroj krvácení byl napřed detekován intervenčním radiologem, ale pro nepříznivé anatomické poměry v cévním řečišti nebylo možné zavedení katetru do požadované pozice. K samotné zástavě krvácení byl proto použit N-butyl-2-cyanoacryl aplikovaný endoskopicky [10]. Endoskopie hraje klíčovou roli v terapii varikózního krvácení s možností efektivní hemostázy ligací, sklerotizací a aplikací tkáňových lepidel [11]. Chirurgická léčba je vyhrazena pro pacienty hemodynamicky nestabilní a pro případy selhání léčby endovaskulární. Zahrnuje resekci pseudocysty, parciální pankreatektomii, splenektomii, ligaci cévy a drenáž pseudocysty. Pacienti řešení chirurgickou intervencí pro krvácení do pankreatické pseudocysty tvoří nejrizikovější skupinu, z čehož vyplývá i vysoká perioperační mortalita, pohybující se mezi 70 a 90 % [12].
Závěr
Diagnostika krvácení vyvolaného chronickou pankreatitidou může být obtížná, obzvláště v případech s nespecifickou klinickou manifestací a absencí výraznější anemizace. Pečlivě provedená vstupní vyšetření však mohou podpořit podezření na krvácení zahrnuté v diferenciální rozvaze a posunout pacienta dále ke specifičtějším metodám diagnostiky. Terapeutický postup se volí na základě hemodynamické stability. Pro nestabilní pacienty je vyhrazeno chirurgické řešení, v opačném případě se přistupuje k endovaskulárním metodám. Endoskopické ošetření krvácení je možné ve specifických případech, jako je zejména varikózní krvácení.
Obrazová dokumentace průběhu angiografie byla použita s laskavým svolením prim. MU Dr. D. Kučery, Ph.D., MBA, Vaskulární centrum Vítkovické nemocnice a. s., Ostrava.
Doručeno: 23. 3. 2018
Přijato: 3. 7. 2018
MU Dr. Jan Kancnýř
Interna, Městská nemocnice Ostrava, p. o.
Nemocniční 898/ 20A
728 80 Ostrava – Moravská Ostrava
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Sources
1. Bouassida M, Benali M, Charrada H et al. Gastrointestinal bleeding due to an erosion of the superior mesenteric artery: an exceptional fatal complication of pancreatic pseudocyst. Pan Afr Med J 2012; 12 : 62.
2. Houska A, Závada F, Lacman J et al. Neobvyklá komplikace chronické pankreatitidy. Gastroent Hepatol 2011; 65(3): 154– 156.
3. Garcea G, Krebs M, Lloyd T et al. Haemorrhage from pancreatic pseudocysts presenting as upper gastrointestinal haemorrhage. Asian J Surg 2004; 27(2): 137– 140. doi: 10.1016/ S1015-9584(09)60328-6.
4. Ammori BJ, Madan M, Alexander DJ. Haemorrhagic complications of pancreatitis: presentation, diagnosis and management. Ann R Coll Surg Engl 1998; 80(5): 316– 325.
5. Novacic K, Vidjak V, Suknaic S et al. Embolization of a large pancreatic pseudoaneurysm converted from pseudocyst (hemorrhagic pseudocyst). JOP 2008; 9(3): 317– 321.
6. Novotný I, Boudný J, Kala Z. Hemosuccus pancreaticus jako komplikace akutní exacerbace chronické pankreatitidy. Česk Slov Gastroenterol Hepatol 2004; 58(1): 16– 20.
7. Zarin M, Ali S, Majid A et al. Gastroduodenal artery aneurysm – post traumatic pancreatic pseudocyst drainage – an interesting case. Int J Surg Case Rep 2018; 42 : 82– 84. doi: 10.1016/ j.ijscr.2017.11.049.
8. Yu P, Gong J. Hemosuccus pancreaticus: A mini-review. Ann Med Surg 2018; 28 : 45– 48. doi: 10.1016/ j.amsu.2018.03.002.
9. Peynircioğlu B, Karaosmanoğlu AD, Idilman IS et al. Intrapancreatic pseudoaneurysm causing massive gastrointestinal hemorrhage and chronic pancreatitis. Turk J Gastroenterol 2015; 26(3): 270– 273. doi: 10.5152/ tjg.2015.6548.
10. Rana SS, Singhal M, Sharma A et al. Success-ful hemostasis of arterial bleeding in chronic pseudocyst by direct endoscopic injection of N-butyl-2-cyanoacrylate in the pseudoaneurysm. Gastrointest Endosc 2015; 81(4): 1046– 1047. doi: 10.1016/ j.gie.2014.09.057.
11. Fejfar T, Vaňásek T, Brůha R et al. Léčba krvácení v důsledku portální hypertenze při jaterní cirhóze – aktualizace doporučených postupů ČHS ČLS JEP. Gastroent Hepatol 2017; 71(2): 105–116. doi:10.14735/amgh2017105.
12. Szpakowicz J, Szpakowitz P, Urbanik A et al. Splenic artery pseudoaneurysm rupture into a pancreatic pseudocyst with its subsequent perforation as the cause of a massive intra-abdominal bleeding – case report. Pol Przegl Chir 2016; 88(6): 350– 355. doi: 10.1515/ pjs-2016-0075.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2018 Issue 6-
All articles in this issue
- Detská gastroenterológia a hepatológia
- Obezitologie a bariatricko-metabolická chirurgie
- Ultrasonografické hodnotenie steatózy pečene u obéznych pediatrických pacientov
- Vliv expozice anti-TNFα in utero na vývoj imunitního systému exponovaných dětí – kontrolovaná multicentrická studie
- Wilsonova choroba v dětském věku – dvě kazuistiky
- Parciální jejunální diverze – technické aspekty a počáteční zkušenosti
- Novinky ve farmakoterapii obezity
- Psychologické aspekty chirurgické léčby obezity
- Hepatopatie jako první projev systémové AL amyloidózy
- Meckelův divertikl jako příčina náhlé příhody břišní
- Intrapankreaticky uložená akcesorní slezina jako raritní solidní léze pankreatu
- Krvácení jako komplikace chronické pankreatitidy
- Správná praxe při oplachu endoskopů
- Endoskopická léčba rektálního syndromu při lipomu rekta technikou „loop and let go“
- Výběr z mezinárodních časopisů
- Široká problematika žlučových kyselin a jejich účinků pohledem XXV. Bile Acid Meeting: Bile Acids in Health and Disease 2018
- Správná odpověď na kvíz
- Poděkování recenzentům
- První biosimilární adalimumab – SB5
- Hepatitida B u osob infikovaných virem lidské imunodeficience v Porto-Novo – prevalence a související faktory
-
Novel developments in endoscopy of the proximal GIT
Oliver Pech (Germany) – Gastro Update Europe 2018, Prague
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Meckelův divertikl jako příčina náhlé příhody břišní
- Hepatopatie jako první projev systémové AL amyloidózy
- Wilsonova choroba v dětském věku – dvě kazuistiky
- Endoskopická léčba rektálního syndromu při lipomu rekta technikou „loop and let go“
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

